تعریف
بنزن(سیکلوهگزاترین - 1،3،5) - یک ماده آلی، ساده ترین نماینده تعدادی از هیدروکربن های معطر.
فرمول - C 6 H 6 (فرمول ساختاری - شکل 1). وزن مولکولی - 78، 11.
برنج. 1. فرمول های ساختاری و فضایی بنزن.
هر شش اتم کربن موجود در مولکول بنزن در حالت هیبریدی sp 2 هستند. هر اتم کربن با دو اتم کربن دیگر و یک اتم هیدروژن که در همان صفحه قرار دارد، 3 σ پیوند تشکیل می دهد. شش اتم کربن یک شش ضلعی منظم (σ-اسکلت مولکول بنزن) را تشکیل می دهند. هر اتم کربن یک اوربیتال p هیبرید نشده دارد که حاوی یک الکترون است. شش الکترون p یک ابر الکترونی واحد (سیستم معطر) را تشکیل می دهند که به صورت دایره ای در داخل یک چرخه شش عضوی به تصویر کشیده می شود. رادیکال هیدروکربنی مشتق شده از بنزن C 6 H 5 - - فنیل (Ph-) نامیده می شود.
خواص شیمیایی بنزن
بنزن با واکنش های جایگزینی مشخص می شود که طبق مکانیسم الکتروفیلیک انجام می شود:
- هالوژناسیون (بنزن در حضور کاتالیزورها با کلر و برم برهم کنش می کند - AlCl3، FeCl3، AlBr3 بی آب)
C 6 H 6 + Cl 2 \u003d C 6 H 5 -Cl + HCl.
- نیتراسیون (بنزن به راحتی با یک مخلوط نیترات کننده واکنش می دهد - مخلوطی از اسیدهای نیتریک و سولفوریک غلیظ)

- آلکیلاسیون با آلکن ها
C 6 H 6 + CH 2 \u003d CH-CH 3 → C 6 H 5 -CH (CH 3) 2;
واکنش های افزودن به بنزن منجر به تخریب سیستم معطر می شود و فقط در شرایط سخت ادامه می یابد:
- هیدروژناسیون (با گرم شدن واکنش ادامه می یابد، کاتالیزور پلاتین است)

- افزودن کلر (در اثر اشعه ماوراء بنفش با تشکیل یک محصول جامد رخ می دهد - هگزا کلرو سیکلوهگزان (هگزاکلران) - C 6 H 6 Cl 6)

مانند هر ترکیب آلی، بنزن با تشکیل دی اکسید کربن و آب به عنوان محصولات واکنش وارد یک واکنش احتراق می شود (با شعله دودی می سوزد):
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O.
خواص فیزیکی بنزن
بنزن مایعی بی رنگ است، اما بوی تند خاصی دارد. یک مخلوط آزئوتروپیک با آب تشکیل می دهد، به خوبی با اترها، بنزین و حلال های آلی مختلف مخلوط می شود. نقطه جوش - 80.1 درجه سانتیگراد، نقطه ذوب - 5.5 درجه سانتیگراد. سمی، سرطان زا (یعنی به توسعه سرطان کمک می کند).
تهیه و استفاده از بنزن
روشهای اصلی بدست آوردن بنزن:
- چرخه زدایی از هگزان (کاتالیزورها - Pt, Cr3O2)
CH 3 - (CH 2) 4 -CH 3 → C 6 H 6 + 4H 2;
- هیدروژن زدایی سیکلوهگزان (واکنش هنگام گرم شدن ادامه می یابد، کاتالیزور پلاتین است)
C 6 H 12 → C 6 H 6 + 4H 2;
تریمریزاسیون استیلن (با حرارت دادن به 600 درجه سانتیگراد واکنش ادامه می یابد، کاتالیزور کربن فعال است)
3HC≡CH → C 6 H 6 .
بنزن به عنوان ماده خام برای تولید همولوگ ها (اتیل بنزن، کومن)، سیکلوهگزان، نیتروبنزن، کلروبنزن و سایر مواد عمل می کند. قبلاً از بنزن به عنوان افزودنی برای بنزین برای افزایش عدد اکتان آن استفاده می شد، اما اکنون به دلیل سمیت بالای آن، محتوای بنزن در سوخت به شدت تنظیم شده است. گاهی اوقات از بنزن به عنوان حلال استفاده می شود.
نمونه هایی از حل مسئله
مثال 1
| ورزش | معادلاتی را بنویسید که با آنها می توانید تبدیل های زیر را انجام دهید: CH 4 → C 2 H 2 → C 6 H 6 → C 6 H 5 Cl. |
| راه حل | برای بدست آوردن استیلن از متان از واکنش زیر استفاده می شود: 2CH 4 → C 2 H 2 + 3H 2 (t = 1400C). به دست آوردن بنزن از استیلن با واکنش تریمریزاسیون استیلن امکان پذیر است که هنگام گرم شدن (t = 600C) و در حضور کربن فعال رخ می دهد: 3C 2 H 2 → C 6 H 6 . واکنش کلرزنی بنزن برای به دست آوردن کلروبنزن به عنوان یک محصول در حضور کلرید آهن (III) انجام می شود: C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl. |
مثال 2
| ورزش | به 39 گرم بنزن در حضور کلرید آهن (III) 1 مول آب برم اضافه شد. چه مقدار ماده و چند گرم از چه محصولاتی حاصل شد؟ |
| راه حل | اجازه دهید معادله واکنش بنزن برماسیون در حضور کلرید آهن (III) را بنویسیم: C 6 H 6 + Br 2 → C 6 H 5 Br + HBr. محصولات واکنش برموبنزن و هیدروژن برومید هستند. جرم مولی بنزن با استفاده از جدول عناصر شیمیایی D.I. مندلیف - 78 گرم در مول. مقدار ماده بنزن را به دست آورید: n(C 6 H 6 ) = m ( C 6 H 6 ) / M ( C 6 H 6 ). n(C 6 H 6) = 39/78 = 0.5 مول. با توجه به شرایط مشکل، بنزن با 1 مول برم واکنش داد. در نتیجه، بنزن با کمبود مواجه است و محاسبات بعدی برای بنزن انجام خواهد شد. طبق معادله واکنش n (C 6 H 6): n (C 6 H 5 Br) : n (HBr) \u003d 1: 1: 1، بنابراین n (C 6 H 6) \u003d n (C 6 H 5 Br) \u003d: n(HBr) = 0.5 مول. سپس، جرم برموبنزن و هیدروژن برومید برابر خواهد بود: m(C6H5Br) = n(C6H5Br)×M(C6H5Br); m(HBr) = n(HBr)×M(HBr). جرم مولی برموبنزن و برمید هیدروژن با استفاده از جدول عناصر شیمیایی D.I. مندلیف - به ترتیب 157 و 81 گرم در مول. m(C6H5Br) = 0.5×157 = 78.5 گرم؛ m(HBr) = 0.5 x 81 = 40.5 گرم. |
| پاسخ | محصولات واکنش برموبنزن و هیدروژن برومید هستند. جرم برموبنزن و هیدروژن برومید به ترتیب 78.5 و 40.5 گرم است. |
   |
|
| نظام نام | بنزن |
| اختصارات | PhH |
| نام های سنتی | سشوار (Laurent, 1837) فنیل هیدروژن، بنزن |
| شیمی. فرمول | C₆H6 |
| دولت | مایع |
| جرم مولی | 78.11 گرم در مول |
| تراکم | 0.8786 گرم بر سانتی متر مکعب |
| ویسکوزیته دینامیکی | 0.0652 Pa s |
| انرژی یونیزاسیون | 0.01 ± 9.24 eV |
| T. ذوب شود. | 5.5 درجه |
| تی کیپ. | 80.1 درجه |
| T. rev. | -11 درجه |
| T. svsp. | 562 درجه |
| و غیره. انفجار | 0.1 ± 1.2 درصد حجمی |
| فشار بخار | 75 ± 1 میلی متر جیوه |
| حلالیت در آب | 0.073 گرم در 100 میلی لیتر |
| GOST | GOST 5955-75 |
| Reg. شماره CAS | 71-43-2 |
| PubChem | 241 |
| Reg. شماره EINECS | 200-753-7 |
| لبخند می زند | C1=CC=CC=C1 |
| InChI | |
| RTECS | CY1400000 |
| چبی | 16716 |
| ChemSpider | 236 |
| سمیت | سمی، دارای خواص سرطان زا و مخدر است |
| کلمه سیگنال | خطرناک! |
| داده ها برای شرایط استاندارد (25 درجه، 100 کیلو پاسکال) داده شده است، مگر اینکه خلاف آن ذکر شده باشد. | |
خواص شیمیایی
واکنش های جایگزینی مشخصه بنزن است - بنزن با آلکن ها، کلروآلکان ها، هالوژن ها، اسیدهای نیتریک و سولفوریک واکنش می دهد. واکنش های برش حلقه بنزن در شرایط سخت (دما، فشار) انجام می شود.
- برهمکنش با آلکن ها (آلکیلاسیون)، در نتیجه واکنش، همولوگ های بنزن تشکیل می شود، به عنوان مثال، اتیل بنزن و کومن:
- برهمکنش با کلر و برم در حضور کاتالیزور برای تشکیل کلروبنزن (واکنش جایگزینی الکتروفیلیک):
- در غیاب کاتالیزور، هنگام گرم شدن یا روشن شدن، یک واکنش افزودن رادیکال با تشکیل مخلوطی از ایزومرهای هگزا کلرو سیکلوهگزان رخ می دهد.
- هنگامی که بنزن با برم در محلول اولئوم واکنش می دهد، هگزابروموبنزن تشکیل می شود:
- برهمکنش با مشتقات هالوژن آلکان ها (آلکیلاسیون بنزن، واکنش فریدل کرافت) برای تشکیل آلکیل بنزن ها:

- واکنش آیلاسیون فریدل کرافت انیدریدهای بنزن، هالیدهای کربوکسیلیک اسید منجر به تشکیل کتون های معطر معطر و چرب می شود:

6 6 + 6 5 COCl → AlCl 3 6 5 COC 6 5 + HCl
در واکنش اول و دوم، استوفنون (متیل فنیل کتون) تشکیل می شود، جایگزینی کلرید آلومینیوم با کلرید آنتیموان اجازه می دهد تا دمای واکنش به 25 درجه سانتیگراد کاهش یابد. در واکنش سوم، بنزوفنون (دی فنیل کتون) تشکیل می شود.
- واکنش فرمیلاسیون - برهمکنش بنزن با مخلوطی از CO و HCl، در فشار بالا انجام می شود و تحت عمل یک کاتالیزور، محصول واکنش بنزآلدئید است:
- واکنش های سولفوناسیون و نیتراسیون (جایگزینی الکتروفیلی):
- احیای بنزن با هیدروژن (هیدروژناسیون کاتالیزوری):
واکنش های اکسیداسیون
بنزن، به دلیل ساختارش، در برابر اکسیداسیون بسیار مقاوم است، به عنوان مثال، محلول پرمنگنات پتاسیم بر آن تأثیر نمی گذارد. با این حال، اکسیداسیون به انیدرید مالئیک را می توان با استفاده از کاتالیزور اکسید وانادیم انجام داد:

- واکنش ازونولیز همچنین، بنزن تحت اوزنولیز قرار می گیرد، اما این فرآیند کندتر از هیدروکربن های غیر اشباع است:

نتیجه واکنش تشکیل دی آلدهید - گلیوکسال (1،2-اتاندیال) است.
- واکنش احتراق احتراق بنزن حالت محدود کننده اکسیداسیون است. بنزن بسیار قابل اشتعال است و در هوا با شعله بسیار دودی می سوزد:
ساختار
از نظر ترکیب، بنزن به هیدروکربن های غیر اشباع (سری همولوگ) تعلق دارد n 2n−6)، اما بر خلاف هیدروکربنهای سری اتیلن، 2 4، خواص ذاتی هیدروکربنهای غیراشباع را نشان میدهد (آنها با واکنشهای اضافه مشخص میشوند)، فقط در شرایط سخت، اما بنزن بیشتر مستعد واکنشهای جایگزینی است. این "رفتار" بنزن با ساختار خاص آن توضیح داده می شود: حضور اتم ها در همان صفحه و وجود ابر 6π-الکترونی مزدوج در ساختار. ایده مدرن ماهیت الکترونیکی پیوندها در بنزن مبتنی بر فرضیه لینوس پاولینگ است، که پیشنهاد کرد مولکول بنزن را به صورت شش ضلعی با دایره ای محاط شده به تصویر بکشد، در نتیجه بر عدم وجود پیوندهای دوگانه ثابت و وجود یک ابر تک الکترونی که تمام شش اتم کربن چرخه را می پوشاند.
در ادبیات تخصصی و عامه، اصطلاح حلقه بنزن، به عنوان یک قاعده، به ساختار کربن بنزن بدون در نظر گرفتن سایر اتم ها و گروه های مرتبط با اتم های کربن اشاره دارد. حلقه بنزن بخشی از بسیاری از ترکیبات مختلف است.
تولید
تا به امروز چندین روش اساساً متفاوت برای تولید بنزن وجود دارد.

کاربرد

حمل و نقل بنزن از طریق راه آهن در واگن های تخصصی انجام می شود
بخش قابل توجهی از بنزن حاصل برای سنتز محصولات دیگر استفاده می شود:
- حدود 50 درصد از بنزن به اتیل بنزن تبدیل می شود (آلکیلاسیون بنزن با اتیلن).
- حدود 25 درصد از بنزن به کومن تبدیل می شود (آلکیلاسیون بنزن با پروپیلن).
- تقریباً 10-15 درصد بنزن به سیکلوهگزان هیدروژنه می شود.
- حدود 10 درصد از بنزن صرف تولید نیتروبنزن می شود.
- 2-3 درصد از بنزن به آلکیل بنزن های خطی تبدیل می شود.
- تقریباً 1 درصد از بنزن برای سنتز کلروبنزن استفاده می شود.
در مقادیر بسیار کمتر، از بنزن برای سنتز برخی از ترکیبات دیگر استفاده می شود. گهگاه و در موارد شدید به دلیل سمیت زیاد از بنزن به عنوان حلال استفاده می شود.
علاوه بر این، بنزن بخشی از بنزین است. در دهههای 1920 و 1930، بنزن ru de به بنزین مستقیم اضافه شد تا امتیاز اکتان آن افزایش یابد، اما در دهه 1940 چنین ترکیبهایی نمیتوانستند با بنزینهای با اکتان بالا رقابت کنند. با توجه به سمیت بالا، محتوای بنزن در سوخت توسط استانداردهای مدرن به معرفی تا 1٪ محدود شده است.
عمل بیولوژیکی و سم شناسی
بنزن یکی از رایج ترین بیگانه بیگانه های انسانی است.
بنزن بسیار سمی است. حداقل دوز کشنده برای تجویز خوراکی 15 میلی لیتر، متوسط 50-70 میلی لیتر است. با استنشاق کوتاه بخار بنزن، مسمومیت فوری رخ نمی دهد، بنابراین، تا همین اواخر، روش کار با بنزن به ویژه تنظیم نشده بود. بنزن در مقادیر زیاد باعث حالت تهوع و سرگیجه می شود و در برخی موارد شدید مسمومیت می تواند کشنده باشد. اولین علامت مسمومیت با بنزن اغلب سرخوشی است. بخار بنزن می تواند به پوست دست نخورده نفوذ کند. بنزن مایع برای پوست کاملاً تحریک کننده است. اگر بدن انسان در معرض قرار گرفتن طولانی مدت در معرض بنزن در مقادیر کم قرار گیرد، عواقب آن نیز می تواند بسیار جدی باشد.
بنزن یک سرطان زا قوی است. مطالعات ارتباط بنزن را با بیماری هایی مانند کم خونی آپلاستیک، لوسمی حاد (میلوئید، لنفوبلاستیک)، لوسمی میلوئید مزمن، سندرم میلودیسپلاستیک و بیماری های مغز استخوان نشان می دهد.
مکانیسم تبدیل و اثر جهش زایی بنزن
انواع مختلفی از مکانیسم تبدیل بنزن در بدن انسان وجود دارد. در نوع اول، مولکول بنزن توسط سیستم اکسیداسیون میکروزومی با مشارکت سیتوکروم P450 هیدروکسیله می شود. طبق مکانیسم، بنزن ابتدا به یک اپوکسید بسیار واکنشپذیر اکسید میشود که بیشتر به فنل تبدیل میشود. علاوه بر این، رادیکالهای آزاد (نوعهای اکسیژن فعال) به دلیل فعالسازی بالای P450 بر اساس واکنش تولید میشوند:
مکانیسم مولکولی جهش زایی بنزن
بنزن است پروموتاژن، فقط پس از تبدیل زیستی خاصیت جهش زایی به دست می آورد ، در نتیجه ترکیبات بسیار واکنش پذیر تشکیل می شوند. یکی از اینها اپوکسید بنزن است. به دلیل تنش زاویه ای زیاد چرخه اپوکسی، پیوندهای -C-O-C- می شکند و مولکول به الکتروفیل تبدیل می شود، به راحتی با مراکز نوکلئوفیل بازهای نیتروژنی مولکول های اسید نوکلئیک به ویژه DNA واکنش می دهد.
مکانیسم برهمکنش چرخه اپوکسی با مراکز هسته دوست - گروه های آمینه بازهای نیتروژنی (واکنش آریلاسیون) به عنوان یک واکنش جایگزینی هسته دوست ادامه می یابد. 2 . در نتیجه، ترکیبات افزایشی DNA متصل به کووالانسی نسبتاً قوی تشکیل می شود، اغلب چنین مشتقاتی در گوانین مشاهده می شود (از آنجایی که مولکول گوانین دارای حداکثر تعداد مراکز نوکلئوفیل است)، به عنوان مثال، N7-phenylguanine. ترکیب های افزایشی DNA حاصل می تواند منجر به تغییر در ساختار مادری DNA شود و در نتیجه روند رونویسی و همانندسازی صحیح را مختل کند. منشا جهش های ژنتیکی چیست؟ تجمع اپوکسید در سلولهای کبدی (سلولهای کبد) منجر به عواقب غیرقابل برگشتی میشود: افزایش آریلاسیون DNA و در عین حال افزایش بیان (بیان بیش از حد) پروتئینهای جهش یافته که محصولات یک جهش ژنتیکی هستند. مهار آپوپتوز؛ تبدیل سلولی و حتی مرگ. بنزن علاوه بر سمیت ژنتیکی و جهش زایی مشخص، دارای سمیت میلوتوکسیک قوی و فعالیت سرطان زایی نیز می باشد، به ویژه این اثر در سلول های بافت میلوئیدی آشکار می شود (سلول های این بافت به چنین اثرات بیگانه بیوتیک ها بسیار حساس هستند).
بنزن و سوء مصرف مواد
بنزن اثر گیج کننده ای روی فرد دارد و می تواند منجر به اعتیاد به مواد مخدر شود.
مسمومیت حاد
در غلظت های بسیار بالا - از دست دادن تقریباً آنی هوشیاری و مرگ در عرض چند دقیقه. رنگ صورت سیانوتیک است، غشاهای مخاطی اغلب قرمز گیلاسی است. در غلظت های پایین تر - تحریک، مشابه الکل، سپس خواب آلودگی، ضعف عمومی، سرگیجه، حالت تهوع، استفراغ، سردرد، از دست دادن هوشیاری. انقباضات عضلانی نیز مشاهده می شود که می تواند به تشنج تونیک تبدیل شود. مردمک ها اغلب گشاد شده و به نور پاسخ نمی دهند. تنفس ابتدا تند می شود، سپس کند می شود. دمای بدن به شدت کاهش می یابد. نبض تند، پر کردن کوچک. فشار خون کاهش یافته است. مواردی از آریتمی های شدید قلبی گزارش شده است.
پس از مسمومیت شدید که مستقیماً منجر به مرگ نمی شود، گاهی اوقات اختلالات درازمدت سلامتی مشاهده می شود: پلوریت، آب مروارید دستگاه تنفسی فوقانی، بیماری های قرنیه و شبکیه، آسیب کبدی، اختلالات قلبی و غیره. یک مورد وازوموتور روان رنجوری همراه با تورم صورت و اندام ها، اختلالات حساسیت و تشنج اندکی پس از مسمومیت حاد با بخار بنزن. گاهی اوقات مرگ مدتی پس از مسمومیت رخ می دهد.
مسمومیت مزمن
در موارد شدید عبارتند از: سردرد، خستگی مفرط، تنگی نفس، سرگیجه، ضعف، عصبی بودن، خواب آلودگی یا بی خوابی، سوء هاضمه، حالت تهوع، گاهی استفراغ، بی اشتهایی، افزایش ادرار، قاعدگی، خونریزی مداوم از مخاط دهان به ویژه لثه، اغلب ایجاد می شود، و بینی، برای ساعت ها و حتی روزها باقی می ماند. گاهی اوقات خونریزی مداوم پس از کشیدن دندان رخ می دهد. خونریزی های کوچک متعدد (خونریزی) در پوست. وجود خون در مدفوع، خونریزی رحم، خونریزی شبکیه. معمولاً این خونریزی و اغلب تب همراه (دمای تا 40 درجه و بالاتر) است که مسموم را به بیمارستان می آورد. در چنین مواردی، پیش آگهی همیشه جدی است. علت مرگ گاهی اوقات عفونت های ثانویه است: مواردی از التهاب گانگرونی پریوستوم و نکروز فک، التهاب زخمی شدید لثه ها، سپسیس عمومی با اندومتریت سپتیک وجود دارد.
گاهی اوقات، با مسمومیت شدید، علائم بیماری های عصبی ایجاد می شود: افزایش رفلکس های تاندون، کلونوس دو طرفه، علامت بابینسکی مثبت، اختلال حساسیت عمیق، اختلالات شبه تبتیک همراه با پارستزی، آتاکسی، پاراپلژی و اختلالات حرکتی (علائم آسیب به رگ ستون های خلفی نخاع و دستگاه هرمی).
معمولی ترین تغییرات در خون. تعداد گلبول های قرمز معمولاً به شدت کاهش می یابد و به 1-2 میلیون و کمتر می رسد. محتوای هموگلوبین نیز به شدت کاهش می یابد، گاهی اوقات تا 10٪. شاخص رنگ در برخی موارد کم، گاهی نزدیک به نرمال و گاهی زیاد است (مخصوصاً با کم خونی شدید). آنیزوسیتوز و پویکیلوسیتوز، سوراخ بازوفیل و ظهور گلبول های قرمز هسته ای، افزایش تعداد رتیکولوسیت ها و حجم گلبول های قرمز مشاهده می شود. کاهش شدید تعداد لکوسیت ها معمولی تر است. گاهی اوقات در ابتدا لکوسیتوز، به سرعت با لکوپنی، تسریع ESR جایگزین می شود. تغییرات در خون به طور همزمان ایجاد نمی شود. بیشتر اوقات، سیستم لکوپویتیک زودتر تحت تأثیر قرار می گیرد، ترومبوسیتوپنی دیرتر ایجاد می شود. شکست عملکرد erythroblastic اغلب حتی دیرتر رخ می دهد. در آینده، یک تصویر مشخص از مسمومیت شدید ممکن است ایجاد شود - کم خونی آپلاستیک.
اثرات مسمومیت ممکن است ماهها و سالها پس از قطع کار با بنزن باقی بماند و حتی پیشرفت کند.
کمک های اولیه برای مسمومیت و درمان
در صورت مسمومیت حاد با بنزن (بخار بنزن)، قربانی ابتدا باید به هوای تازه منتقل شود، در صورت ایست تنفسی، تنفس مصنوعی به حالت عادی انجام می شود، از اکسیژن و لوبلین به عنوان محرک تنفسی استفاده می شود. استفاده از آدرنالین به عنوان مسکن اکیدا ممنوع است! در صورت بروز استفراغ، محلول گلوکز 40% داخل وریدی، در صورت اختلالات گردش خون - تزریق محلول کافئین. اگر مسمومیت به صورت خوراکی رخ داد و بنزن وارد معده شد، لازم است آن را با روغن گیاهی بشویید (بنزن به خوبی جذب می شود)، این روش باید با احتیاط انجام شود، زیرا آسپیراسیون امکان پذیر است. با مسمومیت خفیف، به بیمار استراحت نشان داده می شود. در حالتهای هیجانزده، داروهای آرامبخش مورد نیاز است. در صورت کم خونی، تزریق خون، ویتامین B12، اسید فولیک انجام می شود، در صورت لکوپنی - ویتامین B6، پنتوکسیل. در صورت کاهش ایمنی (وضعیت نقص ایمنی) - محرک های ایمنی.
اثر بنزن بر روی غشاهای زیستی
غشاهای بیولوژیکی ساختارهای فوق مولکولی هستند - یک لایه لیپیدی دوگانه که در آن یکپارچه شده (جاسازی شده) یا روی سطح مولکول های پروتئین ها، پلی ساکاریدها متصل می شوند. لیپیدهایی که غشاهای زیستی را تشکیل می دهند، طبیعتاً ترکیبات آمفی دوست (آموفیلیک) هستند، یعنی به دلیل وجود گروه های قطبی در آنها، به اصطلاح، قادر به حل شدن در مواد قطبی و غیر قطبی هستند. "سر"(کربوکسیل -COOH، هیدروکسیل -OH، گروه های آمینه -NH 2 و دیگران) و غیر قطبی به اصطلاح. "دم"(رادیکال های هیدروکربنی - آلکیل ها، آریل ها، ساختارهای چند حلقه ای مانند کلستان و غیره).
بنزن یک حل کننده موثر غشاهای بیولوژیکی است، به سرعت گروه های غیر قطبی (به اصطلاح هیدروکربن) را حل می کند. "دم") لیپیدها، عمدتاً کلسترول، که بخشی از غشاها است. فرآیند انحلال توسط غلظت بنزن محدود می شود، هر چه بیشتر باشد، این فرآیند سریعتر پیش می رود. در فرآیند انحلال، انرژی آزاد می شود و به معنای واقعی کلمه لایه چربی مضاعف (دولایه لیپیدی) را می شکند، که منجر به تخریب کامل (تخریب ساختار) غشاء و متعاقب آن آپوپتوز سلولی می شود (در حین تخریب غشاهای زیستی، گیرنده های غشایی فعال می شوند (مانند به عنوان: CD95، TNFR1، DR3، DR4، و دیگران) که آپوپتوز سلولی را فعال می کنند).
عمل بر روی پوست
با تماس مکرر دست ها با بنزن، خشکی پوست، ترک، خارش، قرمزی (معمولاً بین انگشتان)، تورم و تاول های ارزن مانند مشاهده می شود. گاهی اوقات به دلیل ضایعات پوستی، کارگران مجبور به ترک شغل می شوند.
حداکثر غلظت مجاز 5 میلی گرم بر متر مکعب است.
ایمنی
کار با بنزن خطر مسمومیت و مشکلات جدی سلامتی را به همراه دارد. بنزن یک مایع بسیار فرار (فرار 320 میلی گرم در لیتر در دمای 20 درجه سانتیگراد) با درجه اشتعال بالا است، بنابراین هنگام کار با آن، رعایت نکات ایمنی برای کار با مایعات قابل اشتعال ضروری است. بخارات بنزن بسیار خطرناک هستند، زیرا می توانند مخلوط های انفجاری با هوا ایجاد کنند. در حال حاضر استفاده از بنزن به عنوان یک حلال آلی به دلیل سمیت و اثرات سرطان زای بخارات آن و اثرات منفی آن بر روی پوست به شدت محدود شده است. کار با بنزن در آزمایشگاه ها نیز محدودیت آن را فراهم می کند (به شدت تنظیم شده است). استفاده از بنزن در آزمایشها فقط در حجمهای کوچک (بیش از 50 میلیلیتر) توصیه میشود، کار باید منحصراً با دستکشهای فلورروبر انجام شود (لاتکس در هنگام قرار گرفتن در معرض بنزن حل میشود و متورم میشود).
- در نزدیکی منابع گرما، شعله های آتش باز، عوامل اکسید کننده قوی، مواد غذایی و غیره ذخیره کنید.
- ظروف حاوی بنزن را باز بگذارید، دود،
- استفاده از ظروف بنزن برای استفاده در مواد غذایی، شستن دست ها، ظروف،
- کار در یک اتاق بسته و تهویه ضعیف با دمای هوا بیش از 30 درجه سانتیگراد،
- استفاده از حجم زیادی از یک ماده به عنوان حلال،
- بدون تجهیزات محافظ برای پوست دست، چشم و اندام های تنفسی کار کنید.
بوم شناسی
بنزن یک ماده ناایمن برای محیط زیست است، یک ماده سمی با منشاء انسانی. منابع اصلی بنزن وارد شده به محیط زیست با فاضلاب یا انتشارات هوا، صنایع پتروشیمی و کک، تولید سوخت و حمل و نقل است. از مخازن، بنزن به راحتی تبخیر می شود، می تواند از خاک به گیاهان تبدیل شود، که تهدیدی جدی برای اکوسیستم است.
بنزن دارای خاصیت تجمع است، به دلیل چربی دوستی که دارد، می تواند در سلول های بافت چربی حیوانات رسوب کرده و در نتیجه آنها را مسموم کند.
مشخصات فیزیکی
بنزن و نزدیکترین همولوگهای آن مایعاتی بی رنگ با بوی خاص هستند. هیدروکربن های معطر سبک تر از آب هستند و در آن حل نمی شوند، با این حال، آنها به راحتی در حلال های آلی - الکل، اتر، استون حل می شوند.
بنزن و همولوگ های آن خود حلال های خوبی برای بسیاری از مواد آلی هستند. همه عرصه ها به دلیل محتوای کربن بالای مولکول هایشان با شعله دودی می سوزند.
خواص فیزیکی برخی از آرن ها در جدول ارائه شده است.
جدول. خواص فیزیکی برخی از میدان ها
|
نام |
فرمول |
t°.pl., |
bp., |
|
بنزن |
C 6 H 6 |
5,5 |
80,1 |
|
تولوئن (متیل بنزن) |
C 6 H 5 CH 3 |
95,0 |
110,6 |
|
اتیل بنزن |
C 6 H 5 C 2 H 5 |
95,0 |
136,2 |
|
زایلن (دی متیل بنزن) |
C 6 H 4 (CH 3) 2 |
||
|
ارتو- |
25,18 |
144,41 |
|
|
متا |
47,87 |
139,10 |
|
|
جفت- |
13,26 |
138,35 |
|
|
پروپیل بنزن |
C 6 H 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
کومن (ایزوپروپیل بنزن) |
C 6 H 5 CH(CH 3) 2 |
96,0 |
152,39 |
|
استایرن (وینیل بنزن) |
C 6 H 5 CH \u003d CH 2 |
30,6 |
145,2 |
بنزن - کم جوش ( تیکیپ= 80.1 درجه سانتی گراد)، مایع بی رنگ، نامحلول در آب
توجه! بنزن - سم، روی کلیه ها تأثیر می گذارد، فرمول خون را تغییر می دهد (با قرار گرفتن در معرض طولانی مدت)، می تواند ساختار کروموزوم ها را مختل کند.
بیشتر هیدروکربن های معطر تهدید کننده حیات و سمی هستند.
به دست آوردن آرن ها (بنزن و همولوگ های آن)
در آزمایشگاه
1. ادغام نمک های اسید بنزوئیک با مواد قلیایی جامد
C 6 H 5 -COONa + NaOH t → C 6 H 6 + Na 2 CO 3
بنزوات سدیم
2. واکنش Wurtz-Fitting: (در اینجا G هالوژن است)
از 6اچ 5 -G+2Na + آر-G →سی 6 اچ 5 - آر + 2 Naجی
از جانب 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
در صنعت
- جداسازی شده از نفت و زغال سنگ با تقطیر جزئی، رفرمینگ.
- از قطران زغال سنگ و گاز کوره کک
1. هیدروسایکل زدایی آلکان هابا بیش از 6 اتم کربن:
C 6 H 14 تی , کت→ C 6 H 6 + 4H 2
2. تریمریزاسیون استیلن(فقط برای بنزن) – آر. زلینسکی:
3С 2 H2 600 درجهسی، عمل کنید زغال سنگ→ C 6 H 6
3. هیدروژن زداییسیکلوهگزان و همولوگ های آن:
نیکلای دیمیتریویچ زلینسکی، آکادمیسین شوروی، ثابت کرد که بنزن از سیکلوهگزان (هیدروژن زدایی سیکلوآلکان ها) تشکیل می شود.
C 6 H 12 تی، گربه→ C 6 H 6 + 3H 2

C 6 H 11 -CH 3 تی , کت→ C 6 H 5 -CH 3 + 3H 2
متیل سیکلوهگزان تولوئن
4. آلکیلاسیون بنزن(به دست آوردن همولوگ بنزن) – r Friedel-Crafts.
C 6 H 6 + C 2 H 5 -Cl t، AlCl3→C 6 H 5 -C 2 H 5 + HCl
کلرواتان اتیل بنزن

خواص شیمیایی آرن ها
من. واکنش های اکسیداسیون
1. احتراق (شعله دودی):
2C 6 H 6 + 15O 2 تی→ 12CO 2 + 6H 2 O + Q
2. بنزن در شرایط عادی آب برم و محلول آبی پرمنگنات پتاسیم را بی رنگ نمی کند.
3. همولوگ های بنزن توسط پرمنگنات پتاسیم اکسید می شوند (پرمنگنات پتاسیم را تغییر رنگ می دهند):
الف) در یک محیط اسیدی به اسید بنزوئیک
تحت تأثیر پرمنگنات پتاسیم و سایر اکسیدان های قوی بر روی همولوگ های بنزن، زنجیره های جانبی اکسید می شوند. مهم نیست که زنجیره جایگزین چقدر پیچیده باشد، به استثنای اتم کربن که به یک گروه کربوکسیل اکسید می شود، از بین می رود.
همولوگ های بنزن با یک زنجیره جانبی اسید بنزوئیک می دهند:
همولوگ های حاوی دو زنجیره جانبی اسیدهای دی بازیک می دهند:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 + 28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 + 14H 2 O
ساده شده :
C 6 H 5 -CH 3 + 3O KMnO4→ C 6 H 5 COOH + H 2 O
ب) خنثی و کمی قلیایی به نمک های اسید بنزوئیک
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K OH + 2MnO 2 + H 2 O
II. واکنش های افزودنی (سخت تر از آلکن ها)
1. هالوژناسیون
C 6 H 6 + 3Cl 2 ساعت ν → C 6 H 6 Cl 6 (هگزا کلرو سیکلوهگزان - هگزاکلران)
2. هیدروژناسیون
C 6 H 6 + 3H 2 تی , Ptیانی→ C 6 H 12 (سیکلوهگزان)
3. پلیمریزاسیون
III. واکنش های جایگزینی - مکانیسم یونی (سبک تر از آلکان ها)
1. هالوژناسیون -
آ ) بنزن
C 6 H 6 + Cl 2 AlCl 3 → C 6 H 5 -Cl + HCl (کلروبنزن)
C 6 H 6 + 6Cl 2 t، AlCl3→C 6 Cl 6 + 6HCl( هگزا کلروبنزن)
C 6 H 6 + Br 2 t، FeCl3→ C 6 H 5 -Br + HBr( بروموبنزن)
ب) همولوگ های بنزن در اثر تابش یا حرارت دادن
از نظر خواص شیمیایی، رادیکال های آلکیل مشابه آلکان ها هستند. اتم های هیدروژن در آنها با مکانیسم رادیکال آزاد با هالوژن ها جایگزین می شوند. بنابراین، در غیاب کاتالیزور، گرمایش یا تابش اشعه ماوراء بنفش منجر به واکنش جایگزینی رادیکال در زنجیره جانبی می شود. تأثیر حلقه بنزن بر جایگزین های آلکیل منجر به این واقعیت می شود که اتم هیدروژن همیشه در اتم کربنی که مستقیماً به حلقه بنزن متصل است (اتم a-کربن) جایگزین می شود.
1) C 6 H 5 -CH 3 + Cl 2 ساعت ν → C 6 H 5 -CH 2 -Cl + HCl
ج) همولوگ های بنزن در حضور کاتالیزور
C 6 H 5 -CH 3 + Cl 2 AlCl 3 → (مخلوط اورتا، جفت مشتقات) +HCl
2. نیتراسیون (با اسید نیتریک)
C 6 H 6 + HO-NO 2 t، H2SO4→ C 6 H 5 -NO 2 + H 2 O
نیتروبنزن - بو بادام!
C 6 H 5 -CH 3 + 3HO-NO 2 t، H2SO4→ از جانب H 3 -C 6 H 2 (NO 2) 3 + 3H 2 O2،4،6-ترینیتروتولوئن (تول، تروتیل)
استفاده از بنزن و همولوگ های آن
بنزن C 6 H 6 یک حلال خوب است. بنزن به عنوان یک افزودنی باعث بهبود کیفیت سوخت موتور می شود. به عنوان ماده خام برای تولید بسیاری از ترکیبات آلی معطر - نیتروبنزن C 6 H 5 NO 2 (حلال، آنیلین از آن به دست می آید)، کلروبنزن C 6 H 5 Cl، فنل C 6 H 5 OH، استایرن و غیره استفاده می شود.
تولوئن C 6 H 5 - CH 3 - حلالی است که در ساخت رنگها، داروها و مواد منفجره (تروتیل (تول)، یا 2،4،6-ترینیتروتولوئن TNT استفاده می شود.
زایلن C 6 H 4 (CH 3) 2 . زایلن فنی مخلوطی از سه ایزومر ( ارتو-, متا- و جفتزایلن ها) - به عنوان حلال و محصول اولیه برای سنتز بسیاری از ترکیبات آلی استفاده می شود.
ایزوپروپیل بنزن C 6 H 5 - CH (CH 3) 2 برای به دست آوردن فنل و استون عمل می کند.
مشتقات کلر بنزنبرای حفاظت از گیاهان استفاده می شود. بنابراین، محصول جایگزینی اتم های H در بنزن با اتم های کلر، هگزاکلروبنزن C 6 Cl 6 - یک قارچ کش است. از آن برای ضماد دانه خشک گندم و چاودار در برابر لکه های سخت استفاده می شود. محصول افزودن کلر به بنزن هگزاکلروسیکلو هگزان (هگزاکلران) C 6 H 6 Cl 6 - یک حشره کش است. از آن برای کنترل حشرات مضر استفاده می شود. این مواد به آفت کش ها - ابزارهای شیمیایی برای مبارزه با میکروارگانیسم ها، گیاهان و حیوانات اشاره دارد.
استایرن C 6 H 5 - CH \u003d CH 2 به راحتی پلیمریزه می شود و پلی استایرن را تشکیل می دهد و با لاستیک های بوتادین - استایرن-بوتادین کوپلیمریزه می شود.
تجربیات ویدیویی
PRTSVSH (F) FGBOU VPO
اداره "ایمنی آتش نشانی"
تست
در رشته "نظریه احتراق و انفجار"
کار شماره 1
مقادیر نظری خاص و حجم هوای مورد نیاز برای احتراق کامل بخار بنزن را تعیین کنید. شرایطی که هوا در آن قرار دارد با دمای Tv و فشار Pv و بخار بنزن - دما Tg و فشار Pg مشخص می شود. نتایج محاسبات را در واحدهای زیر بیان کنید: ; ;;;
داده های اولیه (N - شماره گروه، n - تعداد با توجه به لیست دانش آموزان:
TV=300+(-1) N *2*N-(-1) n *0.2*n= 277.6 K
Pv \u003d؟ 10 3 \u003d 95900 Pa.
Тg=300?(?1) N?2?N?(?1) n?0.2?n= 321.6 K;
Pr \u003d? 10 3 \u003d 79400 Pa.
С6Н6+7.5О2+7.5?3.76N2=6CO2+3pO+7.5?3.76N2+Qp (1)،
که در آن Qp گرمای یک واکنش شیمیایی است. از این معادله می توان ضرایب استوکیومتری بنزن و اکسیژن مولکولی را تعیین کرد: Vg = 1، V0 = 7.5
2. مقدار نظری خاص هوا - تعداد کیلو مول هوا که برای احتراق کامل یک کیلو مول بنزن لازم است با فرمول محاسبه می شود:
که در آن 4.76 مقدار هوایی است که حاوی یک واحد اکسیژن است، \u003d نسبت ضرایب استوکیومتری اکسیژن مولکولی (Vo) و بنزن (Vg) است.
با جایگزینی (d) مقادیر Vo و Vg، به دست می آوریم:
3. حجم هوای مورد نیاز برای احتراق کامل یک کیلو مول بنزن به شرح زیر تعیین می شود:
حجم یک کیلومول هوا در دما و فشار Pv در تلویزیون کجاست. مقدار با استفاده از فرمول محاسبه می شود
که در آن 22.4 حجم مولی گاز در شرایط عادی است، Po = 101325 Pa فشار نرمال است، تا = 273 K دمای طبیعی است.
با جایگزینی Tv, To, Pv, Po در (5) بدست می آوریم
حجم هوای نظری خاص با فرمول (4) محاسبه می شود:
4. حجم هوای مورد نیاز برای احتراق کامل یک واحد حجم سوخت گازی به شرح زیر تعیین می شود:
حجم یک کیلومول سوخت - بخار بنزن در دمای Tg و فشار Pg کجاست. با توجه به اینکه
و با جایگزینی (8) و (5) به (7)، عبارت زیر را برای حجم هوای نظری خاص بدست می آوریم:
ما مقدار این پارامتر فرآیند احتراق را محاسبه می کنیم:
حجم هوای مورد نیاز برای احتراق کامل یک کیلوگرم بنزن به صورت زیر تعیین می شود:
که در آن - جرم مولی سوخت جرم یک کیلو مول بنزن است که بر حسب کیلوگرم بیان می شود. جرم مولی بنزن از نظر عددی برابر با وزن مولکولی آن با فرمول زیر است:
Ac?nc + An?nn، UiAi?ni (11)
که در آن Ac و An وزن اتمی کربن و هیدروژن هستند، nc و nn تعداد اتم های کربن در مولکول بنزن هستند. با جایگزینی مقادیر Ac = 12، nc = 6، An = 1، nn = 6، دریافت می کنیم:
حجم نظری خاص هوا را با جایگزین کردن مقادیر n در فرمول (10) و در آن مییابیم:
نتیجه محاسبه:
کار شماره 2
اگر ضریب هوای اضافی c، دمای Tp و فشار Pp محصولات احتراق، دمای Tg و فشار Pg بخار بنزن مشخص باشد، مقدار، حجم و ترکیب نظری خاص محصولات احتراق بنزن را تعیین کنید. نتایج محاسبات را به صورت کسر مولی (در درصد) و در واحدهای زیر بیان کنید: ; ;;
اطلاعات اولیه:
c=1.5+(?1) N?0.1?N?(?1) n?0.01?n = 0.2;
Rp \u003d؟ 10 3 \u003d 68400 Pa.
Tp=1600?(?1) N?20?N?(?1) n?2?n = 1816 K;
Тg=273?(?1) N?2?N+(?1) n?0.2?n = 295.4 K;
Rg \u003d? 10 3 \u003d 111600 Pa;
محلول (N=11، n=2).
1. معادله استوکیومتری واکنش احتراق بنزن در هوا را می نویسیم:
C 6 H 6 +7.5O 2 +7.5؟ 3.76N 2 \u003d 6CO 2 + 3H 2 O + 7.5؟ 3.76N 2 + Qp، (1)
که در آن Qp گرمای یک واکنش شیمیایی است. از این معادله، ضرایب استوکیومتری زیر را تعیین می کنیم:
V CO2 \u003d 6، V pO \u003d 3، V C6H6 \u003d 1، V O2 \u003d 7.5، V N2 \u003d 7.5؟ 3.76
2. مقدار تخمینی محصولات احتراق یک کیلو مول سوخت را تعیین کنید:
با جایگزینی (2) مقادیر ضرایب استوکیومتری محصولات احتراق و سوخت، به دست می آوریم:
3. مقدار نظری خاص هوا - تعداد کیلو مول هوای لازم برای احتراق کامل یک کیلو مول سوخت، با استفاده از فرمول تعیین می کنیم:
جایی که 4.76 مقدار هوایی است که حاوی یک واحد اکسیژن است،
نسبت ضرایب استوکیومتری اکسیژن مولکولی و بنزن.
با جایگزینی در (4) مقادیر V O2 = 7.5 و V C6H6 = 1، به دست می آوریم:
4. مقدار هوای اضافی که روی 1 کیلومتر مول سوخت می افتد با عبارت:
هوای احتراق بخار بنزن
در این عبارت مقادیر را جایگزین کنید
37,7(0,2-1)=30,16(7)
5. مقدار کل محصولات احتراق در واحد مقدار ماده سوختی با مجموع تعیین می شود:
پس از جایگزینی مقادیر به دست می آید:
6. کسرهای مول محصولات احتراق به صورت درصد به شرح زیر تعیین می شود:
در فرمول (9) برای کسرهای مولی نیتروژن و اکسیژن در محصولات احتراق، 0.79 و 0.21 کسرهای مول این مواد در هوا هستند که مازاد آن منجر به افزایش نسبت نیتروژن و ظاهر شدن اکسیژن می شود. در محصولات احتراق
7. برای تعیین حجم و محصولات احتراق خاص، لازم است حجم مولی آنها - حجم یک کیلو مول گاز در شرایطی که محصولات در آن قرار دارند محاسبه شود:
که در آن 22.4 حجم یک کیلومول گاز در شرایط عادی است، T 0 \u003d 273K - دمای معمولی، Po \u003d 101325 Pa - فشار نرمال.
با جایگزینی (10) مقادیر Po, To به دست می آوریم:
حجم فرآورده هایی که در حین احتراق یک کیلوگرم سوخت به استثنای هوای اضافی تشکیل می شود به صورت زیر محاسبه می شود:
که در آن - جرم مولی سوخت جرم یک کیلو مول بنزن است که بر حسب کیلوگرم بیان می شود. جرم مولی بنزن با فرمول زیر بدست می آید:
که در آن Ac و An وزن اتمی کربن (12) و هیدروژن (1)، nc و n n تعداد اتم های کربن (6) و هیدروژن (6) در مولکول های بنزن (C 6 H 6) هستند.
با جایگزینی مقادیر، و در (12) به دست می آوریم
حجم هوای اضافی به ازای هر کیلوگرم سوخت به صورت زیر تعیین می شود:
حجم یک کیلو مول هوای اضافی که بخشی از محصولات احتراق است، کجاست. از آنجایی که دما و فشار هوای اضافی با دما و فشار محصولات احتراق مطابقت دارد، پس \u003d \u003d 220.7.
با جایگزینی این مقدار، و همچنین در (14)، به دست می آوریم:
برای محاسبه حجم ویژه محصولات حاصل از احتراق کامل سوخت، فرض می کنیم که بخار بنزن دارای دمای Tg در فشار است:
حجم یک کیلو مول بخار بنزن در دمای Tg و فشار Pg کجاست. حجم مولی سوخت با فرمول محاسبه می شود:
با جایگزینی مقدار به دست آمده و چنین مقادیری در (17)، به دست می آوریم:
حجم اضافی هوا در هر متر مکعب بخار بنزن به صورت زیر تعیین می شود:
جایگزینی در (20) مقادیر \u003d 30.16 ، \u003d و
نتیجه زیر را می دهد:
مجموع حجم ویژه محصولات احتراق، با در نظر گرفتن هوای اضافی، با مجموع تعیین می شود
نتیجه محاسبه:
X CO2 \u003d%؛ X H2O \u003d 4.4%؛ X N2 =%; X O2 \u003d 11.7٪
اسناد مشابه
محاسبه ضریب احتراق نیتروبنزن C6H5NO2 و دی سولفید کربن CS2. معادله واکنش احتراق پروپیل استات در هوا. محاسبه حجم هوا و محصولات احتراق در حین احتراق گاز قابل احتراق. تعیین نقطه اشتعال تولوئن بر اساس فرمول V. Blinov.
تست، اضافه شده در 1396/04/08
محاسبه حجم هوا و فرآورده های احتراق تشکیل شده در طی احتراق یک ماده. معادله واکنش احتراق اتیلن گلیکول در هوا. احتراق مخلوطی از گازهای قابل احتراق. محاسبه دمای احتراق آدیاباتیک برای یک مخلوط استوکیومتری. احتراق پروپانول
تست، اضافه شده در 10/17/2012
نوع احتراق و پارامترهای اصلی آن. تبدیل شیمیایی سوخت و اکسیدان به محصولات احتراق. معادلات تعادل مواد و حرارتی واکنش احتراق. تأثیر ضریب هوای اضافی بر ترکیب محصولات احتراق و دمای احتراق.
تست، اضافه شده در 1392/01/17
تعیین حجم هوای مورد نیاز برای احتراق کامل یک واحد جرم یک ماده قابل احتراق. ترکیب محصولات احتراق یک واحد جرم یک ماده قابل احتراق. محدودیت های انتشار شعله مخلوط گاز، بخار، گرد و غبار و هوا. فشار تجزیه انفجاری
مقاله ترم، اضافه شده 12/23/2013
توسعه اقدامات برای جلوگیری از وقوع آتش سوزی و انفجار، ارزیابی شرایط توسعه و سرکوب آنها. مفهوم نرخ فرسودگی شغلی، روش تعریف آن. روش تدوین معادله واکنش احتراق. محاسبه حجم هوای مورد نیاز برای احتراق.
مقاله ترم، اضافه شده 07/10/2014
تعیین ترکیب محصولات حاصل از احتراق کامل گاز. محاسبه دمای احتراق آدیاباتیک مخلوط گاز در حجم ثابت و فشار ثابت. ثابت های واکنش جنبشی خود اشتعالی گاز طبیعی. محدودیت اشتعال مخلوط گاز.
مقاله ترم، اضافه شده در 2014/02/19
مشخصات روش های صنعتی برای آلکیلاسیون بنزن با پروپیلن اصول آلکیلاسیون بنزن با الفین ها در فناوری شیمیایی مشکلات طراحی تاسیسات تکنولوژیکی برای آلکیلاسیون بنزن. شرح فناوری فرآیند تولید.
پایان نامه، اضافه شده در 11/15/2010
احتراق یک فرآیند اکسیداسیون قدرتمند است. انواع احتراق: دود شدن و سوزاندن با شعله. انفجار به عنوان یک مورد خاص از احتراق. خواص الکتریکی شعله تنوع محصولات احتراق در نتیجه احتراق ناقص سوخت. فیلتر کردن دود از طریق آب
کار علمی، اضافه شده در 2009/07/29
تعیین حجم هوای مورد نیاز برای احتراق کامل مقدار معینی پروپان. محاسبه تغییر آنتالپی، آنتروپی و انرژی گیبس با استفاده از پیامدهای قانون هس. تعیین معادل جرم مولی عامل اکسید کننده و عامل کاهنده.
تست، اضافه شده در 2012/02/08
روش های تعیین میزان مصرف روغن جاذب، غلظت بنزن در روغن جاذب خروجی از جاذب. محاسبه قطر و ارتفاع جاذب بسته بندی شده. تعیین سطح گرمایش مورد نیاز در مکعب ستون و میزان مصرف بخار حرارتی.
اولین گروه از واکنش ها، واکنش های جانشینی هستند. گفتیم که آرن ها در ساختار مولکولی پیوندهای متعددی ندارند، بلکه دارای یک سیستم مزدوج از شش الکترون هستند که بسیار پایدار است و به حلقه بنزن استحکام بیشتری می بخشد. بنابراین در واکنش های شیمیایی اول از همه جانشینی اتم های هیدروژن اتفاق می افتد و نه تخریب حلقه بنزن.
ما قبلاً هنگام صحبت در مورد آلکان ها با واکنش های جانشینی روبرو شده ایم ، اما برای آنها این واکنش ها طبق یک مکانیسم رادیکال انجام می شود ، در حالی که آرن ها با مکانیسم یونی واکنش های جایگزینی مشخص می شوند.
اولینخواص شیمیایی - هالوژناسیون. جایگزینی اتم هیدروژن به جای اتم هالوژن - کلر یا برم.
واکنش زمانی که گرم می شود و همیشه با مشارکت یک کاتالیزور ادامه می یابد. در مورد کلر، می تواند کلرید آلومینیوم یا کلرید آهن سه باشد. کاتالیزور مولکول هالوژن را قطبی می کند و در نتیجه پیوند هترولیتیک شکسته می شود و یون ها به دست می آیند.
یون کلرید با بار مثبت با بنزن واکنش می دهد.
اگر واکنش با برم رخ دهد، تری برومید آهن یا برومید آلومینیوم به عنوان کاتالیزور عمل می کند.

توجه به این نکته مهم است که واکنش با برم مولکولی و نه با آب برم رخ می دهد. بنزن با آب برم واکنش نمی دهد.
هالوژنه شدن همولوگ های بنزن ویژگی های خاص خود را دارد. در مولکول تولوئن، گروه متیل جایگزینی را در حلقه تسهیل می کند، واکنش پذیری افزایش می یابد و واکنش در شرایط ملایم تر، یعنی در دمای اتاق ادامه می یابد.

توجه به این نکته ضروری است که جایگزینی همیشه در موقعیت های ارتو و پارا اتفاق می افتد، بنابراین مخلوطی از ایزومرها به دست می آید.
دومینخاصیت - نیتراسیون بنزن، ورود یک گروه نیترو به حلقه بنزن.

یک مایع زرد رنگ سنگین با بوی بادام تلخ - نیتروبنزن تشکیل می شود، بنابراین واکنش می تواند برای بنزن کیفی باشد. برای نیتراسیون، از مخلوط نیترات کننده اسیدهای نیتریک و سولفوریک غلیظ استفاده می شود. واکنش با حرارت دادن انجام می شود.
یادآوری می کنم که برای نیتراسیون آلکان ها در واکنش کونوالوف، از اسید نیتریک رقیق بدون افزودن اسید سولفوریک استفاده شد.
در نیتراسیون تولوئن، و همچنین در هالوژناسیون، مخلوطی از ارتو- و پارا ایزومرها تشکیل می شود.

سومخاصیت - آلکیلاسیون بنزن با هالوآلکان ها.

این واکنش اجازه می دهد تا یک رادیکال هیدروکربنی وارد حلقه بنزن شود و می تواند روشی برای به دست آوردن همولوگ های بنزن در نظر گرفته شود. کلرید آلومینیوم به عنوان یک کاتالیزور استفاده می شود که باعث تجزیه مولکول هالوآلکان به یون می شود. همچنین نیاز به گرمایش دارد.
چهارمخاصیت - آلکیلاسیون بنزن با آلکن ها.

از این طریق می توان به عنوان مثال کومن یا اتیل بنزن به دست آورد. کاتالیزور کلرید آلومینیوم است.
2. واکنش های افزودن به بنزن
گروه دوم واکنش ها، واکنش های افزایشی هستند. گفتیم که این واکنش ها مشخصه نیستند، اما در شرایط نسبتاً سخت با تخریب ابر پی الکترونی و تشکیل پیوندهای شش سیگما امکان پذیر است.
پنجمویژگی در لیست کلی - هیدروژناسیون، افزودن هیدروژن.

دما، فشار، کاتالیزور نیکل یا پلاتین. تولوئن قادر است به همین روش واکنش نشان دهد.
ششمخاصیت - کلرزنی. لطفا توجه داشته باشید که ما به طور خاص در مورد تعامل با کلر صحبت می کنیم، زیرا برم وارد این واکنش نمی شود.
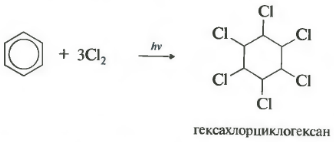
واکنش تحت تابش سخت فرابنفش ادامه می یابد. هگزاکلروسیکلو هگزان، نام دیگر هگزاکلران، تشکیل شده است، یک جامد.
مهم است که به یاد داشته باشید که برای بنزن ممکن نیستواکنش های افزودن هالیدهای هیدروژن (هیدروهالوژناسیون) و افزودن آب (هیدراتاسیون).
3. جایگزینی در زنجیره جانبی همولوگ های بنزن
گروه سوم واکنش ها فقط به همولوگ های بنزن مربوط می شود - این یک جایگزینی در زنجیره جانبی است.
هفتمیک ویژگی در لیست کلی هالوژناسیون در اتم کربن آلفا در زنجیره جانبی است.

این واکنش زمانی رخ می دهد که حرارت داده شود یا تحت تابش قرار گیرد، و همیشه فقط در کربن آلفا. با ادامه هالوژناسیون، اتم دوم هالوژن به موقعیت آلفا باز می گردد.
4. اکسیداسیون همولوگ های بنزن
گروه چهارم از واکنش ها اکسیداسیون است.
حلقه بنزن خیلی قوی است، بنابراین بنزن است اکسید نمی شودپرمنگنات پتاسیم - محلول آن را تغییر رنگ نمی دهد. این بسیار مهم است که به خاطر بسپارید.
از طرف دیگر، همولوگ های بنزن با یک محلول اسیدی از پرمنگنات پتاسیم هنگام گرم شدن اکسید می شوند. و این هشتمین خاصیت شیمیایی است.

معلوم می شود اسید بنزوئیک. تغییر رنگ محلول مشاهده می شود. در این حالت، مهم نیست که زنجیره کربنی جانشین چقدر طولانی باشد، همیشه بعد از اولین اتم کربن می شکند و اتم آلفا با تشکیل اسید بنزوئیک به یک گروه کربوکسیل اکسید می شود. بقیه مولکول به اسید مربوطه یا اگر فقط یک اتم کربن باشد به دی اکسید کربن اکسید می شود.
اگر همولوگ بنزن بیش از یک جایگزین هیدروکربنی روی حلقه معطر داشته باشد، اکسیداسیون طبق قوانین مشابه اتفاق می افتد - کربن در موقعیت آلفا اکسید می شود.

در این مثال یک اسید آروماتیک دوبازیک به دست می آید که به آن اسید فتالیک می گویند.
به طور خاص، من اکسیداسیون کومن، ایزوپروپیل بنزن، با اکسیژن اتمسفر در حضور اسید سولفوریک را یادداشت می کنم.

این روش به اصطلاح کیومن برای تولید فنل است. به عنوان یک قاعده، باید با این واکنش در مسائل مربوط به تولید فنل برخورد کرد. این روش صنعتی است.
نهمخاصیت - احتراق، اکسیداسیون کامل با اکسیژن. بنزن و همولوگ های آن به دی اکسید کربن و آب می سوزند.
اجازه دهید معادله احتراق بنزن را به صورت کلی بنویسیم.
طبق قانون بقای جرم، در سمت چپ باید به تعداد اتم های سمت راست اتم وجود داشته باشد. زیرا بالاخره در واکنشهای شیمیایی، اتمها به جایی نمیروند، اما ترتیب پیوندهای بین آنها به سادگی تغییر میکند. بنابراین به تعداد اتم های کربن در یک مولکول آرن، مولکول دی اکسید کربن وجود خواهد داشت، زیرا مولکول حاوی یک اتم کربن است. این n مولکول CO 2 است. نصف مولکول های آب به اندازه اتم های هیدروژن وجود خواهد داشت، یعنی (2n-6) / 2، که به معنای n-3 است.
تعداد اتم های اکسیژن در سمت چپ و راست یکسان است. در سمت راست، 2n از دی اکسید کربن وجود دارد، زیرا در هر مولکول دو اتم اکسیژن، به اضافه n-3 از آب، در مجموع 3n-3 وجود دارد. در سمت چپ، همان تعداد اتم اکسیژن وجود دارد - 3n-3، به این معنی که نصف تعداد مولکول ها وجود دارد، زیرا مولکول حاوی دو اتم است. یعنی (3n-3)/2 مولکول اکسیژن.
بنابراین، ما معادله احتراق همولوگ های بنزن را به شکل کلی جمع آوری کرده ایم.
