730. Por que a água é usada para resfriar alguns mecanismos?
A água tem uma alta capacidade de calor específico, o que contribui para uma boa remoção de calor do mecanismo.
731. Em que caso se deve gastar mais energia: para aquecer um litro de água a 1°C ou para aquecer cem gramas de água a 1°C?
Para aquecer um litro de água, pois quanto maior a massa, mais energia precisa ser gasta.
732. Cuproníquel e garfos de prata da mesma massa foram mergulhados em água quente. Eles recebem a mesma quantidade de calor da água?
Um garfo de cuproníquel receberá mais calor, porque o calor específico do cuproníquel é maior que o da prata.
733. Um pedaço de chumbo e um pedaço de ferro fundido da mesma massa foram atingidos três vezes com uma marreta. Qual parte ficou mais quente?
O chumbo esquenta mais porque sua capacidade específica de calor é menor que o ferro fundido, e menos energia é necessária para aquecer o chumbo.
734. Um frasco contém água, o outro contém querosene da mesma massa e temperatura. Um cubo de ferro igualmente aquecido foi jogado em cada frasco. O que aquecerá a uma temperatura mais alta - água ou querosene?
Querosene.
735. Por que as oscilações de temperatura são menos acentuadas no inverno e no verão nas cidades litorâneas do que nas cidades do interior?
A água aquece e esfria mais lentamente do que o ar. No inverno, esfria e movimenta as massas de ar quente sobre a terra, tornando o clima do litoral mais quente.
736. O calor específico do alumínio é 920 J/kg °C. O que isto significa?
Isso significa que são necessários 920 J para aquecer 1 kg de alumínio em 1 °C.
737. Barras de alumínio e cobre com a mesma massa de 1 kg são resfriadas em 1 °C. Quanto mudará a energia interna de cada bloco? Qual barra mudará mais e quanto?
738. Que quantidade de calor é necessária para aquecer um quilograma de tarugo de ferro em 45 °C?

739. Quanto calor é necessário para aquecer 0,25 kg de água de 30°C para 50°C?

740. Como a energia interna de dois litros de água varia quando aquecida a 5°C?

741. Quanto calor é necessário para aquecer 5 g de água de 20 °C para 30 °C?
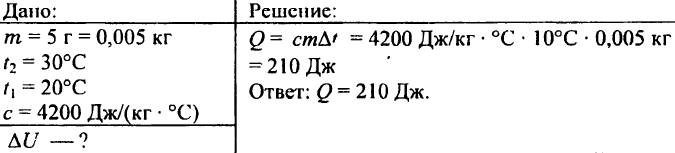
742. Que quantidade de calor é necessária para aquecer uma bola de alumínio de 0,03 kg em 72 °C?

743. Calcule a quantidade de calor necessária para aquecer 15 kg de cobre em 80 °C.
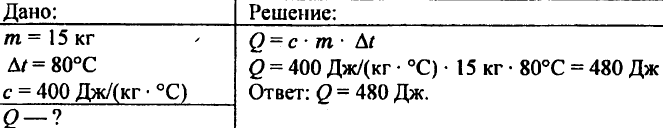
744. Calcule a quantidade de calor necessária para aquecer 5 kg de cobre de 10 °C a 200 °C.

745. Que quantidade de calor é necessária para aquecer 0,2 kg de água de 15 °C para 20 °C?

746. A água pesando 0,3 kg esfriou 20 °C. Em quanto a energia interna da água é reduzida?

747. Quanto calor é necessário para aquecer 0,4 kg de água a uma temperatura de 20 °C até uma temperatura de 30 °C?

748. Quanto calor é gasto para aquecer 2,5 kg de água em 20 °C?
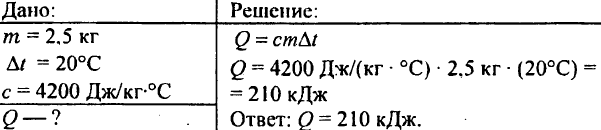
749. Quanto calor foi liberado quando 250 g de água resfriaram de 90 °C para 40 °C?
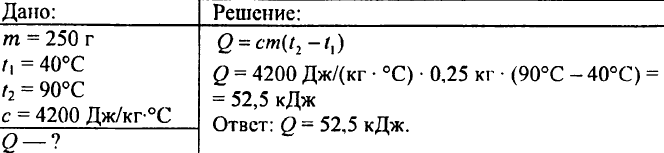
750. Que quantidade de calor é necessária para aquecer 0,015 litro de água em 1 °C?

751. Calcule a quantidade de calor necessária para aquecer uma lagoa com um volume de 300 m3 em 10 °C?
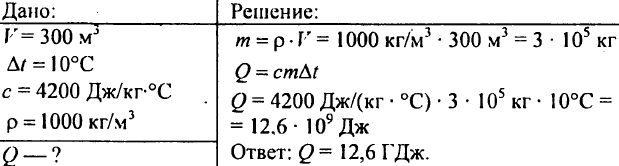
752. Quanto calor deve ser fornecido a 1 kg de água para elevar sua temperatura de 30°C para 40°C?

753. A água com um volume de 10 litros arrefeceu de uma temperatura de 100 °C para uma temperatura de 40 °C. Quanto calor é liberado neste caso?

754. Calcule a quantidade de calor necessária para aquecer 1 m3 de areia em 60 °C.

755. Volume de ar 60 m3, capacidade térmica específica 1000 J/kg °C, densidade do ar 1,29 kg/m3. Quanto calor é necessário para aumentá-la para 22°C?

756. A água foi aquecida a 10 ° C, gastando 4,20 103 J de calor. Determine a quantidade de água.
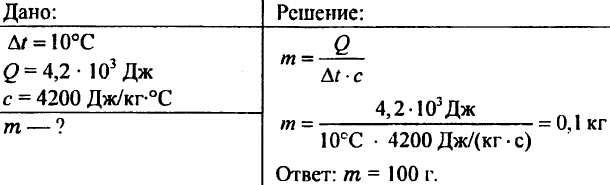
757. A água pesando 0,5 kg relatou 20,95 kJ de calor. Qual seria a temperatura da água se a temperatura inicial da água fosse 20°C?

758. 8 kg de água a 10 °C são despejados em uma panela de cobre pesando 2,5 kg. Quanto calor é necessário para ferver a água em uma panela?

759. Um litro de água a uma temperatura de 15°C é despejado em uma concha de cobre de 300 g.Quanto calor é necessário para aquecer a água na panela em 85°C?

760. Um pedaço de granito aquecido pesando 3 kg é colocado na água. O granito transfere 12,6 kJ de calor para a água, resfriando 10 °C. Qual é o calor específico da pedra?

761. Água quente a 50°C foi adicionada a 5 kg de água a 12°C, obtendo-se uma mistura com temperatura de 30°C. Quanta água foi adicionada?

762. Água a 20°C foi adicionada a 3 litros de água a 60°C para obter água a 40°C. Quanta água foi adicionada?

763. Qual será a temperatura da mistura se 600 g de água a 80 °C forem misturados com 200 g de água a 20 °C?

764. Um litro de água a 90°C foi derramado em água a 10°C, e a temperatura da água tornou-se 60°C. Quanta água fria havia lá?

765. Determine quanta água quente aquecida a 60°C deve ser despejada em um recipiente se o recipiente já contém 20 litros de água fria a uma temperatura de 15°C; a temperatura da mistura deve ser de 40 °C.

766. Determine quanto calor é necessário para aquecer 425 g de água em 20 °C.

767. Quantos graus 5 kg de água aquecerão se a água receber 167,2 kJ?

768. Quanto calor é necessário para aquecer m gramas de água de uma temperatura t1 até uma temperatura t2?
769. 2 kg de água são despejados em um calorímetro a uma temperatura de 15 °C. A que temperatura a água do calorímetro aquecerá se um peso de latão de 500 g aquecido a 100 °C for abaixado para dentro dela? O calor específico do latão é de 0,37 kJ/(kg °C).
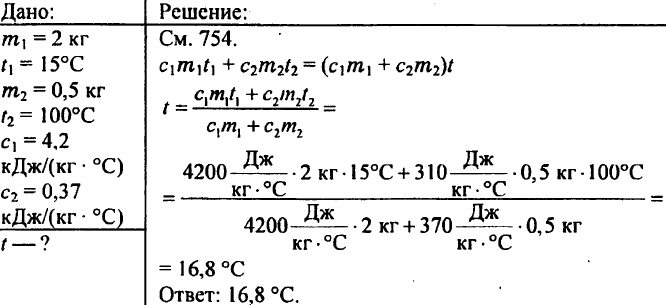
770. São peças de cobre, estanho e alumínio do mesmo volume. Qual dessas peças tem a maior e qual a menor capacidade térmica?

771. 450 g de água, cuja temperatura é de 20 °C, foram despejados no calorímetro. Quando 200 g de limalha de ferro aquecida a 100°C foram imersos nesta água, a temperatura da água tornou-se 24°C. Determine o calor específico da serragem.

772. Um calorímetro de cobre pesando 100 g contém 738 g de água, cuja temperatura é de 15 °C. 200 g de cobre foram reduzidos a este calorímetro a uma temperatura de 100 °C, após o que a temperatura do calorímetro subiu para 17 °C. Qual é o calor específico do cobre?

773. Uma esfera de aço pesando 10 g é retirada do forno e mergulhada em água a uma temperatura de 10 °C. A temperatura da água subiu para 25°C. Qual era a temperatura da bola no forno se a massa de água é de 50 g? O calor específico do aço é de 0,5 kJ/(kg °C).

777. 50 g de água a 19 °C são despejados em água pesando 150 g a uma temperatura de 35 °C. Qual a temperatura da mistura?

778. Água pesando 5 kg a 90 °C foi despejada em uma chaleira de ferro fundido pesando 2 kg a uma temperatura de 10 °C. Qual era a temperatura da água?

779. Um cinzel de aço pesando 2 kg foi aquecido a uma temperatura de 800 °C e depois baixado para um recipiente contendo 15 litros de água a uma temperatura de 10 °C. A que temperatura a água no recipiente será aquecida?

(Indicação. Para resolver este problema, é necessário criar uma equação na qual a temperatura desejada da água no vaso após o abaixamento do cortador é tomada como incógnita.)
780. Qual será a temperatura da água se você misturar 0,02 kg de água a 15 °C, 0,03 kg de água a 25 °C e 0,01 kg de água a 60 °C?
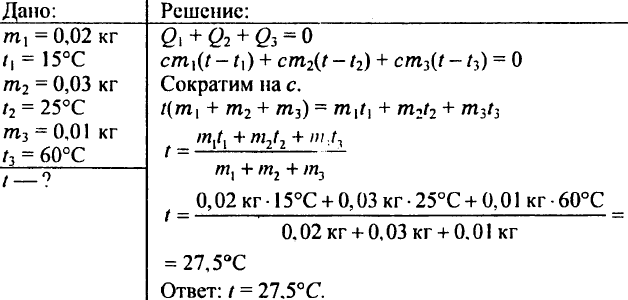
781. Aquecer uma classe bem ventilada requer uma quantidade de calor de 4,19 MJ por hora. A água entra nos radiadores de aquecimento a 80°C e sai a 72°C. Quanta água deve ser fornecida aos radiadores a cada hora?

782. Chumbo pesando 0,1 kg a uma temperatura de 100 °C foi imerso em um calorímetro de alumínio pesando 0,04 kg contendo 0,24 kg de água a uma temperatura de 15 °C. Em seguida, estabeleceu-se a temperatura de 16 °C no calorímetro. Qual é o calor específico do chumbo?

O que esquenta mais rápido no fogão - uma chaleira ou um balde d'água? A resposta é óbvia - uma chaleira. Então a segunda pergunta é por quê?
A resposta não é menos óbvia - porque a massa de água na chaleira é menor. Excelente. E agora você mesmo pode fazer a experiência física mais real em casa. Para fazer isso, você precisará de duas panelas pequenas idênticas, uma quantidade igual de água e óleo vegetal, por exemplo, meio litro cada e um fogão. Coloque panelas de óleo e água no mesmo fogo. E agora é só observar o que vai esquentar mais rápido. Se houver termômetro para líquidos, pode usar, se não tiver, é só experimentar a temperatura de vez em quando com o dedo, só cuidado para não se queimar. De qualquer forma, você logo verá que o óleo esquenta significativamente mais rápido que a água. E mais uma pergunta, que também pode ser implementada na forma de experiência. O que ferve mais rápido - água morna ou fria? Tudo é óbvio novamente - o quente será o primeiro a terminar. Por que todas essas perguntas e experimentos estranhos? A fim de determinar a quantidade física chamada "a quantidade de calor".
Quantidade de calor
A quantidade de calor é a energia que o corpo perde ou ganha durante a transferência de calor. Isso fica claro pelo nome. Ao resfriar, o corpo perde uma certa quantidade de calor e, quando aquecido, absorve. E as respostas às nossas perguntas nos mostraram de que depende a quantidade de calor? Primeiro, quanto maior a massa do corpo, maior a quantidade de calor que deve ser gasta para alterar sua temperatura em um grau. Em segundo lugar, a quantidade de calor necessária para aquecer um corpo depende da substância que o compõe, ou seja, do tipo de substância. E em terceiro lugar, a diferença na temperatura corporal antes e depois da transferência de calor também é importante para nossos cálculos. Com base no exposto, podemos determine a quantidade de calor pela fórmula:
Q=cm(t_2-t_1) ,
onde Q é a quantidade de calor,
m - peso corporal,
(t_2-t_1) - a diferença entre as temperaturas corporal inicial e final,
c - o calor específico da substância é encontrado nas tabelas relevantes.
Usando esta fórmula, você pode calcular a quantidade de calor necessária para aquecer qualquer corpo ou que esse corpo liberará quando esfria.
A quantidade de calor é medida em joules (1 J), como qualquer outra forma de energia. No entanto, esse valor foi introduzido não faz muito tempo e as pessoas começaram a medir a quantidade de calor muito antes. E eles usaram uma unidade muito usada em nosso tempo - uma caloria (1 cal). 1 caloria é a quantidade de calor necessária para elevar a temperatura de 1 grama de água em 1 grau Celsius. Guiados por esses dados, os amantes da contagem de calorias dos alimentos que ingerem podem, a título de curiosidade, calcular quantos litros de água podem ser fervidos com a energia que consomem com os alimentos durante o dia.
A mudança na energia interna ao realizar trabalho é caracterizada pela quantidade de trabalho, ou seja, O trabalho é uma medida da variação da energia interna em um determinado processo. A mudança na energia interna de um corpo durante a transferência de calor é caracterizada por uma quantidade chamada quantidade de calor.
é a variação da energia interna do corpo no processo de transferência de calor sem a realização de trabalho. A quantidade de calor é indicada pela letra Q .
O trabalho, a energia interna e a quantidade de calor são medidos nas mesmas unidades - joules ( J), como qualquer outra forma de energia.
Nas medições térmicas, uma unidade especial de energia, a caloria ( fezes), igual a a quantidade de calor necessária para elevar a temperatura de 1 grama de água em 1 grau Celsius (mais precisamente, de 19,5 a 20,5 ° C). Esta unidade, em particular, é atualmente utilizada no cálculo do consumo de calor (energia térmica) em prédios de apartamentos. Empiricamente, o equivalente mecânico do calor foi estabelecido - a razão entre calorias e joules: 1 cal = 4,2 J.

Quando um corpo transfere uma certa quantidade de calor sem realizar trabalho, sua energia interna aumenta, se um corpo libera uma certa quantidade de calor, então sua energia interna diminui.
Se você derramar 100 g de água em dois recipientes idênticos e 400 g em outro na mesma temperatura e colocá-los nos mesmos queimadores, a água do primeiro recipiente ferverá mais cedo. Assim, quanto maior a massa do corpo, maior a quantidade de calor que ele precisa para se aquecer. O mesmo vale para o resfriamento.

A quantidade de calor necessária para aquecer um corpo também depende do tipo de substância da qual esse corpo é feito. Essa dependência da quantidade de calor necessária para aquecer o corpo do tipo de substância é caracterizada por uma quantidade física chamada capacidade de calor específico substâncias.
- esta é uma quantidade física igual à quantidade de calor que deve ser relatada a 1 kg de uma substância para aquecê-la em 1 ° C (ou 1 K). A mesma quantidade de calor é liberada por 1 kg de uma substância quando resfriada a 1 °C.
O calor específico é indicado pela letra Com. A unidade de calor específico é 1 J/kg °C ou 1 J/kg °K.
Os valores da capacidade de calor específico das substâncias são determinados experimentalmente. Os líquidos têm uma capacidade de calor específico maior do que os metais; A água tem a maior capacidade de calor específico, o ouro tem uma capacidade de calor específico muito pequena.
Como a quantidade de calor é igual à variação da energia interna do corpo, podemos dizer que a capacidade específica de calor mostra o quanto a energia interna varia 1 kg substância quando sua temperatura muda 1°C. Em particular, a energia interna de 1 kg de chumbo, quando aquecido a 1 °C, aumenta em 140 J e, quando resfriado, diminui em 140 J.
Q necessária para aquecer a massa corporal m temperatura t 1 °С até a temperatura t 2 °С, é igual ao produto da capacidade calorífica específica da substância, massa corporal e a diferença entre as temperaturas final e inicial, ou seja,Q \u003d c ∙ m (t 2 - t 1)
De acordo com a mesma fórmula, também é calculada a quantidade de calor que o corpo libera quando resfriado. Somente neste caso a temperatura final deve ser subtraída da temperatura inicial, ou seja, Subtraia a temperatura menor da temperatura maior.

Esta é uma sinopse sobre o tema. "Quantidade de calor. Calor específico". Escolha os próximos passos:
- Ir para o próximo resumo:
« Física - 10º ano"
Em que processos ocorre a transformação agregada da matéria?
Como o estado da matéria pode ser mudado?
Você pode alterar a energia interna de qualquer corpo realizando trabalho, aquecendo ou, inversamente, resfriando-o.
Assim, ao forjar um metal, o trabalho é realizado e ele é aquecido, enquanto ao mesmo tempo o metal pode ser aquecido em uma chama ardente.
Além disso, se o pistão for fixo (Fig. 13.5), o volume do gás não varia quando aquecido e nenhum trabalho é realizado. Mas a temperatura do gás e, portanto, sua energia interna, aumenta.
A energia interna pode aumentar e diminuir, então a quantidade de calor pode ser positiva ou negativa.
O processo de transferência de energia de um corpo para outro sem realizar trabalho é chamado troca de calor.
A medida quantitativa da mudança na energia interna durante a transferência de calor é chamada quantidade de calor.
Imagem molecular da transferência de calor.
Durante a troca de calor na fronteira entre os corpos, moléculas de movimento lento de um corpo frio interagem com moléculas de movimento rápido de um corpo quente. Como resultado, as energias cinéticas das moléculas são equalizadas e as velocidades das moléculas de um corpo frio aumentam, enquanto as de um corpo quente diminuem.
Durante a troca de calor, não há conversão de energia de uma forma para outra; parte da energia interna de um corpo mais quente é transferida para um corpo menos aquecido.
A quantidade de calor e capacidade de calor.
Você já sabe que para aquecer um corpo de massa m da temperatura t 1 até a temperatura t 2, é necessário transferir para ele a quantidade de calor:
Q \u003d cm (t 2 - t 1) \u003d cm Δt. (13.5)
Quando o corpo esfria, sua temperatura final t 2 acaba sendo menor que a temperatura inicial t 1 e a quantidade de calor liberada pelo corpo é negativa.
O coeficiente c na fórmula (13.5) é chamado capacidade de calor específico substâncias.
Calor específico- este é um valor numericamente igual à quantidade de calor que uma substância com massa de 1 kg recebe ou emite quando sua temperatura muda em 1 K.
A capacidade específica de calor dos gases depende do processo pelo qual o calor é transferido. Se você aquecer um gás a pressão constante, ele se expandirá e realizará trabalho. Para aquecer um gás em 1 °C a pressão constante, ele precisa transferir mais calor do que aquecê-lo a volume constante, quando o gás apenas aquecerá.
Líquidos e sólidos se expandem ligeiramente quando aquecidos. Suas capacidades de calor específico a volume constante e pressão constante diferem pouco.
Calor específico de vaporização.
Para converter um líquido em vapor durante o processo de ebulição, é necessário transferir uma certa quantidade de calor para ele. A temperatura de um líquido não muda quando ele ferve. A transformação de líquido em vapor a uma temperatura constante não leva a um aumento na energia cinética das moléculas, mas é acompanhada por um aumento na energia potencial de sua interação. Afinal, a distância média entre as moléculas de um gás é muito maior do que entre as moléculas de um líquido.
O valor numericamente igual à quantidade de calor necessária para converter um líquido de 1 kg em vapor a uma temperatura constante é chamado calor específico de vaporização.
O processo de evaporação do líquido ocorre a qualquer temperatura, enquanto as moléculas mais rápidas saem do líquido e ele esfria durante a evaporação. O calor específico de vaporização é igual ao calor específico de vaporização.
Este valor é indicado pela letra r e é expresso em joules por quilograma (J/kg).
O calor específico de vaporização da água é muito alto: r H20 = 2,256 10 6 J/kg a uma temperatura de 100 °C. Em outros líquidos, como álcool, éter, mercúrio, querosene, o calor específico de vaporização é 3 a 10 vezes menor que o da água.
Para converter um líquido de massa m em vapor, é necessária uma quantidade de calor igual a:
Q p \u003d rm. (13.6)
Quando o vapor condensa, a mesma quantidade de calor é liberada:
Q k \u003d -rm. (13.7)
Calor específico de fusão.
Quando um corpo cristalino funde, todo o calor fornecido a ele vai aumentar a energia potencial de interação das moléculas. A energia cinética das moléculas não muda, pois a fusão ocorre a uma temperatura constante.
O valor numericamente igual à quantidade de calor necessária para transformar uma substância cristalina pesando 1 kg no ponto de fusão em um líquido é chamado calor específico de fusão e são indicados pela letra λ.
Durante a cristalização de uma substância com massa de 1 kg, exatamente a mesma quantidade de calor é liberada e absorvida durante a fusão.
O calor específico de fusão do gelo é bastante alto: 3,34 10 5 J/kg.
“Se o gelo não tivesse um alto calor de fusão, então na primavera toda a massa de gelo teria que derreter em alguns minutos ou segundos, já que o calor é continuamente transferido do ar para o gelo. As consequências disso seriam terríveis; pois mesmo sob a situação atual, grandes inundações e grandes torrentes de água surgem do derretimento de grandes massas de gelo ou neve. R. Black, século XVIII
Para fundir um corpo cristalino de massa m, é necessária uma quantidade de calor igual a:
Qpl \u003d λm. (13.8)
A quantidade de calor liberada durante a cristalização do corpo é igual a:
Q cr = -λm (13,9)
Equação de equilíbrio térmico.
Considere a troca de calor dentro de um sistema que consiste em vários corpos com temperaturas inicialmente diferentes, por exemplo, a troca de calor entre a água em um recipiente e uma bola de ferro quente mergulhada na água. De acordo com a lei da conservação de energia, a quantidade de calor liberada por um corpo é numericamente igual à quantidade de calor recebida por outro.
A quantidade dada de calor é considerada negativa, a quantidade de calor recebida é considerada positiva. Portanto, a quantidade total de calor Q1 + Q2 = 0.
Se a troca de calor ocorre entre vários corpos em um sistema isolado, então
Q 1 + Q 2 + Q 3 + ... = 0. (13.10)
A equação (13.10) é chamada equação de balanço de calor.
Aqui Q 1 Q 2 , Q 3 - a quantidade de calor recebida ou cedida pelos corpos. Essas quantidades de calor são expressas pela fórmula (13.5) ou fórmulas (13.6) - (13.9), se várias transformações de fase da substância ocorrerem no processo de transferência de calor (fusão, cristalização, vaporização, condensação).
Você pode alterar a energia interna do gás no cilindro não apenas realizando trabalho, mas também aquecendo o gás (Fig. 43). Se o pistão estiver fixo, o volume do gás não mudará, mas a temperatura e, portanto, a energia interna aumentarão.
O processo de transferência de energia de um corpo para outro sem realizar trabalho é chamado de transferência de calor ou transferência de calor.
A energia transferida para o corpo como resultado da transferência de calor é chamada de quantidade de calor. A quantidade de calor também é chamada de energia que o corpo libera no processo de transferência de calor.
Imagem molecular da transferência de calor. Durante a troca de calor na fronteira entre os corpos, moléculas de movimento lento de um corpo frio interagem com moléculas de movimento mais rápido de um corpo quente. Como resultado, as energias cinéticas
as moléculas se alinham e as velocidades das moléculas de um corpo frio aumentam e as de um corpo quente diminuem.
Durante a troca de calor, não há conversão de energia de uma forma para outra: parte da energia interna de um corpo quente é transferida para um corpo frio.
A quantidade de calor e capacidade de calor. Do curso de física da classe VII, sabe-se que para aquecer um corpo com massa de temperatura em temperatura, é necessário informá-lo da quantidade de calor
![]()
Quando o corpo esfria, sua temperatura final é menor que a inicial e a quantidade de calor liberada pelo corpo é negativa.
O coeficiente c na fórmula (4.5) é chamado de capacidade calorífica específica. A capacidade de calor específico é a quantidade de calor que 1 kg de uma substância recebe ou cede quando sua temperatura muda de 1 K -
A capacidade térmica específica é expressa em joules por quilograma vezes kelvin. Corpos diferentes requerem uma quantidade desigual de energia para aumentar a temperatura em I K. Assim, o calor específico da água e do cobre
A capacidade de calor específico depende não apenas das propriedades da substância, mas também do processo no qual ocorre a transferência de calor.Se você aquecer um gás a pressão constante, ele se expandirá e realizará trabalho. Para aquecer um gás em 1 °C a pressão constante, ele precisará transferir mais calor do que aquecê-lo a volume constante.
Líquidos e sólidos se expandem ligeiramente quando aquecidos, e suas capacidades de calor específico a volume e pressão constantes diferem pouco.
Calor específico de vaporização. Para converter um líquido em vapor, uma certa quantidade de calor deve ser transferida para ele. A temperatura do líquido não muda durante esta transformação. A transformação de líquido em vapor a uma temperatura constante não leva a um aumento da energia cinética das moléculas, mas é acompanhada por um aumento de sua energia potencial. Afinal, a distância média entre as moléculas do gás é muitas vezes maior do que entre as moléculas do líquido. Além disso, um aumento de volume durante a transição de uma substância do estado líquido para o gasoso exige que seja realizado trabalho contra as forças da pressão externa.
A quantidade de calor necessária para transformar 1 kg de líquido em vapor a uma temperatura constante é chamada
calor específico de vaporização. Este valor é indicado por uma letra e expresso em joules por quilograma.
O calor específico de vaporização da água é muito alto: a uma temperatura de 100°C. Para outros líquidos (álcool, éter, mercúrio, querosene, etc.), o calor específico de vaporização é 3 a 10 vezes menor.
Para converter uma massa líquida em vapor requer uma quantidade de calor igual a:
Quando o vapor condensa, a mesma quantidade de calor é liberada:
Calor específico de fusão. Quando um corpo cristalino funde, todo o calor fornecido a ele aumenta a energia potencial das moléculas. A energia cinética das moléculas não muda, pois a fusão ocorre a uma temperatura constante.
A quantidade de calor A necessária para converter 1 kg de uma substância cristalina no ponto de fusão em um líquido da mesma temperatura é chamada de calor específico de fusão.
Durante a cristalização de 1 kg de uma substância, exatamente a mesma quantidade de calor é liberada. O calor específico de fusão do gelo é bastante alto:
Para fundir um corpo cristalino com uma massa, é necessária uma quantidade de calor igual a:
A quantidade de calor liberada durante a cristalização do corpo é igual a:
1. Como se chama a quantidade de calor? 2. O que determina o calor específico das substâncias? 3. O que é chamado de calor específico de vaporização? 4. O que é chamado de calor específico de fusão? 5. Em que casos a quantidade de calor transferido é negativa?
