Antoine Laurent LAVOISIER () () Untersuchte Sauerstoff und schuf die Sauerstoff-Verbrennungstheorie, die die Phlogiston-Theorie ersetzte. Er studierte Sauerstoff und schuf die Sauerstoff-Verbrennungstheorie, die die Phlogiston-Theorie ersetzte.

Sauerstoff ist das häufigste Element auf der Erde In der Luft 21 % (nach Volumen), In der Luft 21 % (nach Volumen), in der Erdkruste 49 % (nach Masse), in der Erdkruste 49 % (nach Masse), in der Hydrosphäre 89 % (nach Masse), in der Hydrosphäre 89 % (nach Masse), in lebenden Organismen bis zu 65 % nach Masse. in lebenden Organismen bis zu 65 % der Masse.

Physikalische Eigenschaften Aggregatzustand - Gas unter Normalbedingungen. Bei sehr tiefen Temperaturen (-183°C) geht es in einen flüssigen Aggregatzustand über (blaue Flüssigkeit), bei noch tieferen Temperaturen (-219°C) wird es fest (blaue Schneekristalle). Aggregatzustand - Gas unter Normalbedingungen. Bei sehr tiefen Temperaturen (-183°C) geht es in einen flüssigen Aggregatzustand über (blaue Flüssigkeit), bei noch tieferen Temperaturen (-219°C) wird es fest (blaue Schneekristalle). Farbe - farblos. Farbe - farblos. Geruch - geruchlos. Geruch - geruchlos. Löslichkeit in Wasser - schlecht löslich. Löslichkeit in Wasser - schlecht löslich. Schwerer als Luft (M Luft = 29 g / Mol und M O 2 = 32 g / Mol. Schwerer als Luft (M Luft = 29 g / Mol und M O 2 = 32 g / Mol).

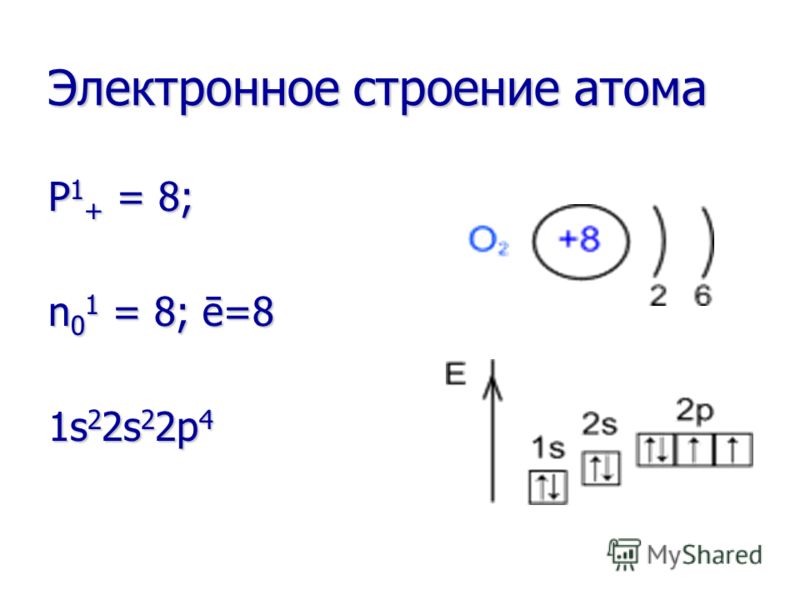
Chemische Eigenschaften Sauerstoff ist ein sehr starkes Oxidationsmittel! Es oxidiert viele Stoffe bereits bei Raumtemperatur (langsame Oxidation) und noch mehr, wenn der Stoff erhitzt oder verbrannt wird (schnelle Oxidation). Sauerstoff ist ein sehr starkes Oxidationsmittel! Es oxidiert viele Stoffe bereits bei Raumtemperatur (langsame Oxidation) und noch mehr, wenn der Stoff erhitzt oder verbrannt wird (schnelle Oxidation). Bei Reaktionen mit allen Elementen (außer Fluor) ist Sauerstoff immer ein Oxidationsmittel. Bei Reaktionen mit allen Elementen (außer Fluor) ist Sauerstoff immer ein Oxidationsmittel.

Reaktionen mit Metallen Als Ergebnis der Reaktion entsteht ein Oxid dieses Metalls. Beispielsweise wird Aluminium durch Sauerstoff gemäß der Gleichung oxidiert: Als Ergebnis der Reaktion entsteht ein Oxid dieses Metalls. Beispielsweise wird Aluminium durch Sauerstoff gemäß der Gleichung oxidiert: t° 4Al + 3O 2 2Al 2 O 3 t° 4Al + 3O 2 2Al 2 O 3 Ein weiteres Beispiel. Beim Absenken eines glühenden Eisendrahts in eine Sauerstoffflasche brennt der Draht aus und sprüht an den Seiten Funkenbündel - heiße Partikel aus Eisenzunder Fe 3 O 4: t ° 3Fe + 2O 2 Fe 3 O 4 t ° 3Fe + 2O 2 Fe 3 O 4


Weitere Beispiele für Reaktionen mit Nichtmetallen Verbrennung von Schwefel in Sauerstoff zu Schwefeldioxid SO 2: t ° S + O 2 SO 2 t ° S + O 2 SO 2 Verbrennung von Kohle in Sauerstoff zu Kohlendioxid: Verbrennung von Kohle in Sauerstoff zu Kohlendioxid: t° C + O 2 CO 2 t° C + O 2 CO 2
Reaktionen mit einigen komplexen Substanzen In diesem Fall werden Oxide der Elemente gebildet, aus denen das Molekül einer komplexen Substanz besteht. In diesem Fall werden Oxide der Elemente gebildet, aus denen das Molekül einer komplexen Substanz besteht. Zum Beispiel beim Verbrennen von Kupfer (II) -Sulfid Zum Beispiel beim Verbrennen von Kupfer (II) -Sulfid t ° 2CuS + 3O 2 · 2CuO + 2SO 2 · t ° 2CuS + 3O 2 · 2CuO + 2SO 2 werden zwei Oxide gebildet Kupfer (II) oxid und Schwefeloxid (IV). Es werden zwei Oxide gebildet, Kupfer(II)-oxid und Schwefel(IV)-oxid. Beim Rösten von Sulfiden entsteht immer Schwefeloxid, bei dem die Schwefelwertigkeit IV ist. Beim Rösten von Sulfiden entsteht immer Schwefeloxid, bei dem die Schwefelwertigkeit IV ist. Ein weiteres Beispiel ist die Verbrennung von Methan CH 4. Da dieses Molekül aus Atomen der Elemente Kohlenstoff C und Wasserstoff H besteht, bedeutet dies, dass zwei Oxide gebildet werden: Kohlenmonoxid (IV) CO 2 und Wasserstoffoxid, dh Wasser - H 2 O: t °CH 4 + 2O 2 CO 2 + 2H 2 O t ° CH 4 + 2O 2 CO 2 + 2H 2 O

Die chemische Wechselwirkung eines Stoffes mit Sauerstoff wird als Oxidationsreaktion bezeichnet. Oxidationsreaktionen unter Freisetzung von Wärme und Licht werden als Verbrennungsreaktionen bezeichnet. Verbrennungsreaktionen von Stoffen sind Beispiele für schnelle Oxidation, aber Fäulnis, Rost usw. dies sind Beispiele für langsame Oxidation von Stoffen mit Sauerstoff Verbrennungsreaktionen von Stoffen sind Beispiele für schnelle Oxidation, aber Fäulnis, Rost usw. dies sind Beispiele für die langsame Oxidation von Stoffen durch Sauerstoff

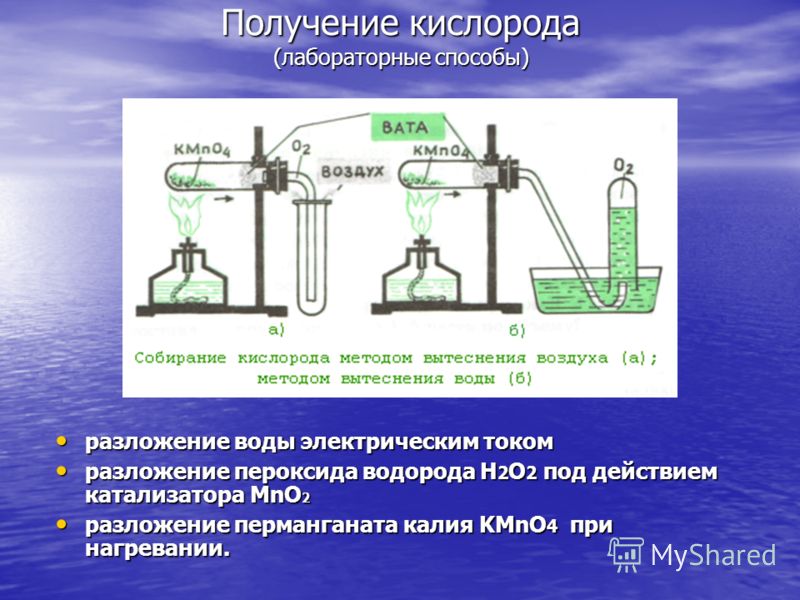
Sauerstoffproduktion (Labormethoden) Wasserzersetzung durch elektrischen Strom Wasserzersetzung durch elektrischen Strom Zersetzung von Wasserstoffperoxid H 2 O 2 unter Einwirkung von MnO 2 -Katalysator Zersetzung von Wasserstoffperoxid H 2 O 2 unter Einwirkung von MnO 2 -Katalysator Zersetzung von Kaliumpermanganat KMnO 4 beim Erhitzen. Zersetzung von Kaliumpermanganat KMnO 4 beim Erhitzen.
Gewinnung von Sauerstoff (industrielles Verfahren) In der Industrie wird zur Gewinnung von reinem Sauerstoff die Flüssigluftdestillation verwendet, die auf unterschiedlichen Siedetemperaturen der Luftbestandteile basiert. Die Luft wird auf etwa -200°C abgekühlt und dann langsam erwärmt. Bei einer Temperatur von -183°C entweicht Sauerstoff aus der flüssigen Luft, die restlichen Bestandteile der bei dieser Temperatur verflüssigten Luft verbleiben im flüssigen Aggregatzustand. In der Industrie wird zur Gewinnung von reinem Sauerstoff die Flüssigluftdestillation eingesetzt, basierend auf unterschiedlichen Siedetemperaturen der Luftbestandteile. Die Luft wird auf etwa -200°C abgekühlt und dann langsam erwärmt. Bei einer Temperatur von -183°C entweicht Sauerstoff aus der flüssigen Luft, die restlichen Bestandteile der verflüssigten Luft verbleiben bei dieser Temperatur im flüssigen Aggregatzustand.

Einsatz von Sauerstoff im Bauwesen und Maschinenbau im Bauwesen und Maschinenbau - zum Autogenschweißen und -schneiden von Metallen - zum Autogenschweißen und -schneiden von Metallen - zum Spritzen und Auftragen von Metallen bei der Erdölförderung bei der Erdölförderung - beim Einpressen in die Formation zur Erhöhung der Verdrängungsenergie in der Hütten- und Bergbauindustrie in der Hütten- und Bergbauindustrie - bei der konvektiven Stahlerzeugung, Sauerstoffstrahlen in Hochöfen, Gewinnung von Gold und Erzen, Herstellung von Ferrolegierungen, Verhüttung von Nickel, Zink, Blei , Zirkonium und andere NE-Metalle - bei konvektiver Stahlerzeugung, Sauerstoffstrahlen in Hochöfen, Gewinnung von Gold und Erzen, Herstellung von Ferrolegierungen, Verhüttung von Nickel, Zink, Blei, Zirkonium und anderen NE-Metallen - mit direkter Reduktion von Eisen - mit direkter Eisenreduktion - mit Feuerreinigung in der Gießereiproduktion - mit Feuerreinigung in der Gießereiproduktion - mit Feuerbohren x Rassen

Die Verwendung von Sauerstoff in der Medizin in der Medizin - in Sauerstoffkammern - in Sauerstoffkammern - beim Befüllen von Sauerstoffmasken, Kissen usw. - beim Befüllen von Sauerstoffmasken, Kissen etc. - auf Stationen mit besonderem Mikroklima - auf Stationen mit besonderem Mikroklima - zur Herstellung von Sauerstoff-Cocktails - zur Herstellung von Sauerstoff-Cocktails - bei der Kultivierung von Mikroorganismen - bei der Kultivierung von Mikroorganismen in der Ökologie in der Ökologie - in der Trinkreinigung Wasser - bei der Reinigung von Trinkwasser - beim Recycling von Metallen - beim Recycling von Metallen - beim Einblasen von Abwasser mit Sauerstoff - beim Einblasen von Abwasser mit Sauerstoff - beim Neutralisieren von chemisch aktiven Abfällen in Kläranlagen in Verbrennungsanlagen - beim Neutralisieren von chemisch aktiven Abfällen in Kläranlagen in Verbrennungsöfen

Die Verwendung von Sauerstoff in der chemischen Industrie in der chemischen Industrie - bei der Herstellung von Acetylen, Zellulose, Methylalkohol, Ammoniak, Salpeter- und Schwefelsäure - bei der Herstellung von Acetylen, Zellulose, Methylalkohol, Ammoniak, Salpeter- und Schwefelsäure - in der katalytischen Umwandlung von Erdgas (bei der Herstellung von synthetischem Ammoniak) - bei der katalytischen Umwandlung von Erdgas (bei der Herstellung von synthetischem Ammoniak) - bei der Hochtemperatur-Umwandlung von Methan - bei der Hochtemperatur-Umwandlung von Methan in der Energiewirtschaft in der Energiewirtschaft - bei der Vergasung fester Brennstoffe - bei der Vergasung fester Brennstoffe - zur Luftanreicherung für Haushalts- und Industriekessel - zur Luftanreicherung für Haushalts- und Industriekessel - zur Verdichtung von Wasser-Kohle-Gemisch - zur Verdichtung von Wasser- Kohlenmischung

Die Verwendung von Sauerstoff in militärischer Ausrüstung in militärischer Ausrüstung - in Druckkammern - in Druckkammern - für den Betrieb von Dieselmotoren unter Wasser - für den Betrieb von Dieselmotoren unter Wasser - als Brennstoffoxidationsmittel für Raketentriebwerke - als Brennstoffoxidationsmittel z Raketentriebwerke in der Landwirtschaft in der Landwirtschaft - zur Anreicherung der aquatischen Umwelt mit Sauerstoff beim Fischfang - zur Anreicherung der aquatischen Umwelt mit Sauerstoff beim Fischfang - bei der Herstellung von Sauerstoffcocktails - bei der Herstellung von Sauerstoffcocktails - zur Gewichtszunahme von Tieren - zur Gewichtszunahme von Tieren

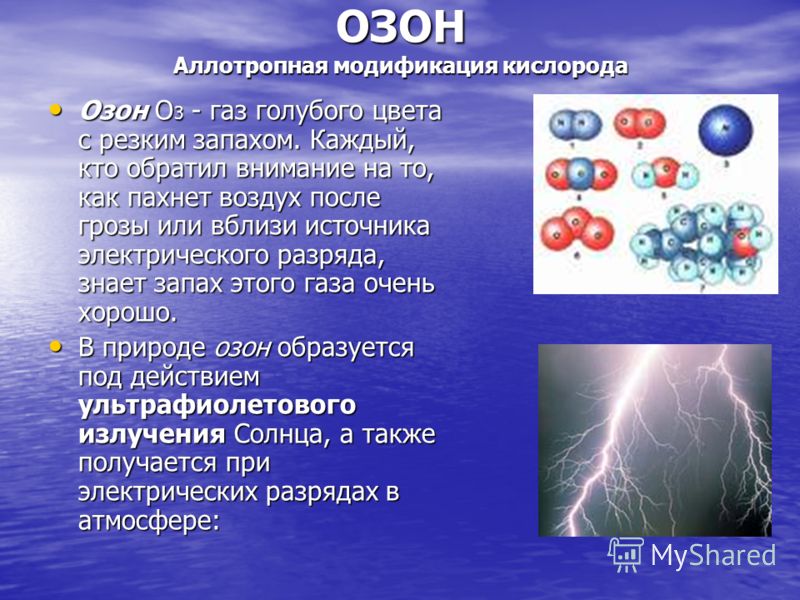
OZON Allotrope Modifikation von Sauerstoff Ozon O 3 ist ein blaues Gas mit stechendem Geruch. Wer schon einmal darauf geachtet hat, wie die Luft nach einem Gewitter oder in der Nähe einer elektrischen Entladungsquelle riecht, kennt den Geruch dieses Gases sehr gut. Ozon O 3 ist ein blaues Gas mit stechendem Geruch. Wer schon einmal darauf geachtet hat, wie die Luft nach einem Gewitter oder in der Nähe einer elektrischen Entladungsquelle riecht, kennt den Geruch dieses Gases sehr gut. In der Natur entsteht Ozon durch die Einwirkung von ultravioletter Strahlung der Sonne und wird auch durch elektrische Entladungen in der Atmosphäre erzeugt:
Ozon ist ein sehr starkes Oxidationsmittel, daher wird es zur Desinfektion von Trinkwasser eingesetzt. Bei Kontakt mit den meisten oxidierbaren Stoffen kommt es zu einer Explosion. Ozon entsteht in der Erdatmosphäre in 25 km Höhe unter dem Einfluss von Sonnenstrahlung, es absorbiert gefährliche Sonnenstrahlung. Doch im nur etwa 30 Meter dicken Ozon-„Schirm“ der Erde tauchen hin und wieder „Löcher“ auf. Immer mehr ozonschädliche Gase wie Stickstoffmonoxid NO oder solche Stoffe, die zum Befüllen von Kühlaggregaten und Aerosoldosen verwendet werden, gelangen in die Luft. Auch das teilweise Verschwinden der Ozonschicht über der Erde bedroht alle Lebewesen mit dem Tod ... Doch im nur etwa 30 Meter dicken Ozon-"Schirm" der Erde tauchen hin und wieder "Löcher" auf. Immer mehr ozonschädliche Gase wie Stickstoffmonoxid NO oder solche Stoffe, die zum Befüllen von Kühlaggregaten und Aerosoldosen verwendet werden, gelangen in die Luft. Auch das teilweise Verschwinden der Ozonschicht über der Erde bedroht alle Lebewesen mit dem Tod...


