Antoine Laurent LAVOISIER () () Investigou o oxigênio e criou a teoria da combustão do oxigênio, que substituiu a teoria do flogisto. Ele estudou o oxigênio e criou a teoria da combustão do oxigênio, que substituiu a teoria do flogisto.

O oxigênio é o elemento mais comum na Terra No ar 21% (em volume), No ar 21% (em volume), na crosta terrestre 49% (em massa), na crosta terrestre 49% (em massa), na hidrosfera 89% (em massa), na hidrosfera 89% (em massa), em organismos vivos até 65% em massa. em organismos vivos até 65% da massa.

Propriedades físicas Estado agregado - gás em condições normais. Em temperaturas muito baixas (-183°C) torna-se um estado líquido de agregação (líquido azul), e em temperaturas ainda mais baixas (-219°C) torna-se sólido (cristais de neve azuis). Estado agregado - gás em condições normais. Em temperaturas muito baixas (-183°C) torna-se um estado líquido de agregação (líquido azul), e em temperaturas ainda mais baixas (-219°C) torna-se sólido (cristais de neve azuis). Cor - incolor. Cor - incolor. Cheiro - inodoro. Cheiro - inodoro. Solubilidade em água - pouco solúvel. Solubilidade em água - pouco solúvel. Mais pesado que o ar (M ar = 29 g/mol, e M O 2 = 32 g/mol. Mais pesado que o ar (M ar = 29 g/mol, e M O 2 = 32 g/mol.

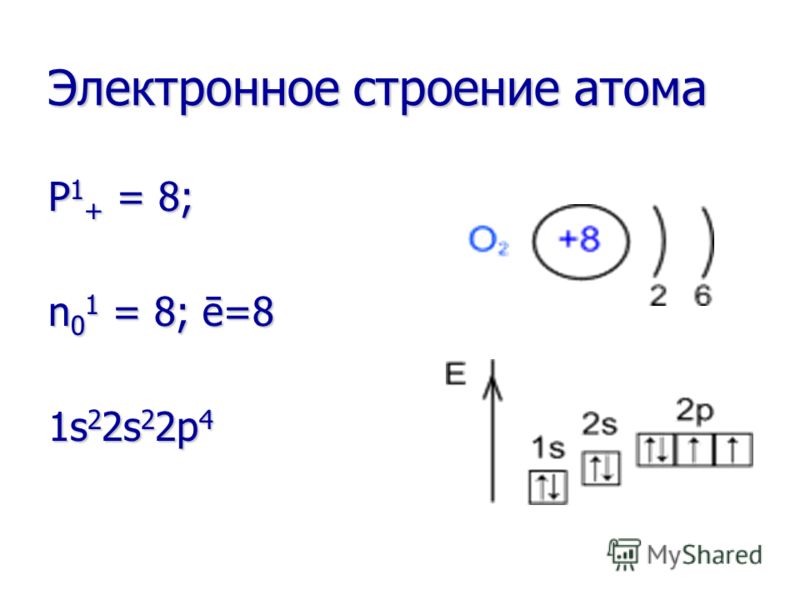
Propriedades químicas O oxigênio é um agente oxidante muito forte! Oxida muitas substâncias já à temperatura ambiente (oxidação lenta) e ainda mais quando a substância é aquecida ou queimada (oxidação rápida). O oxigênio é um agente oxidante muito forte! Oxida muitas substâncias já à temperatura ambiente (oxidação lenta) e ainda mais quando a substância é aquecida ou queimada (oxidação rápida). Em reações com todos os elementos (exceto flúor), o oxigênio é sempre um agente oxidante. Em reações com todos os elementos (exceto flúor), o oxigênio é sempre um agente oxidante.

Reações com metais Como resultado da reação, um óxido desse metal é formado. Por exemplo, o alumínio é oxidado pelo oxigênio de acordo com a equação: Como resultado da reação, um óxido desse metal é formado. Por exemplo, o alumínio é oxidado pelo oxigênio de acordo com a equação: t° 4Al + 3O 2 2Al 2 O 3 t° 4Al + 3O 2 2Al 2 O 3 Outro exemplo. Ao abaixar um fio de ferro em brasa em uma garrafa de oxigênio, o fio queima, pulverizando para os lados feixes de faíscas - partículas quentes de escala de ferro Fe 3 O 4: t ° 3Fe + 2O 2 Fe 3 O 4 t ° 3Fe + 2O 2 Fe 3 O 4


Outros exemplos de reações com não-metais Combustão de enxofre em oxigênio para formar dióxido de enxofre SO 2: t ° S + O 2 SO 2 t ° S + O 2 SO 2 Combustão de carvão em oxigênio para formar dióxido de carbono: Combustão de carvão em oxigênio para formar dióxido de carbono: t° C + O 2 CO 2 t° C + O 2 CO 2
Reações com algumas substâncias complexas Neste caso, formam-se óxidos dos elementos que compõem a molécula de uma substância complexa. Nesse caso, são formados óxidos dos elementos que compõem a molécula de uma substância complexa. Por exemplo, ao queimar sulfeto de cobre (II) Por exemplo, ao queimar sulfeto de cobre (II) t ° 2CuS + 3O 2 2CuO + 2SO 2 t ° 2CuS + 3O 2 2CuO + 2SO 2, dois óxidos são formados óxido de cobre (II) e óxido de enxofre (IV). dois óxidos são formados, óxido de cobre(II) e óxido de enxofre(IV). Durante a torrefação de sulfetos, sempre se forma óxido de enxofre, no qual a valência do enxofre é IV. Durante a torrefação de sulfetos, sempre se forma óxido de enxofre, no qual a valência do enxofre é IV. Outro exemplo é a combustão do metano CH 4. Como essa molécula é composta por átomos dos elementos carbono C e hidrogênio H, significa que dois óxidos são formados monóxido de carbono (IV) CO 2 e óxido de hidrogênio, ou seja, água - H 2 O: t ° CH 4 + 2O 2 CO 2 + 2H 2 O t ° CH 4 + 2O 2 CO 2 + 2H 2 O

A interação química de uma substância com o oxigênio é chamada de reação de oxidação. As reações de oxidação acompanhadas pela liberação de calor e luz são chamadas de reações de combustão. As reações de combustão de substâncias são exemplos de oxidação rápida, mas apodrecendo, enferrujando, etc. estes são exemplos de oxidação lenta de substâncias com oxigênio. Reações de combustão de substâncias são exemplos de oxidação rápida, mas apodrecendo, enferrujando, etc. estes são exemplos da oxidação lenta de substâncias pelo oxigênio

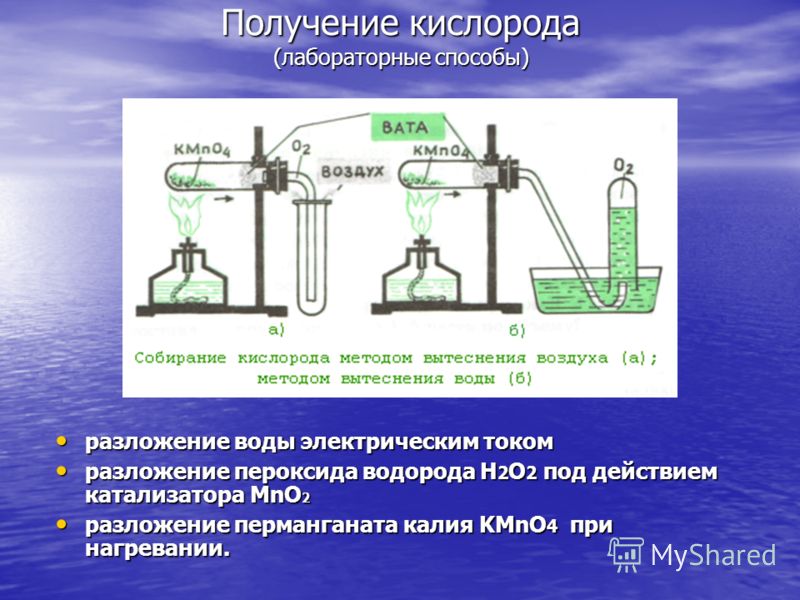
Produção de oxigênio (métodos de laboratório) decomposição da água por corrente elétrica decomposição da água por corrente elétrica decomposição de peróxido de hidrogênio H 2 O 2 sob ação de MnO 2 catalisador decomposição de peróxido de hidrogênio H 2 O 2 sob ação de MnO 2 catalisador decomposição de permanganato de potássio KMnO 4 quando aquecido. decomposição do permanganato de potássio KMnO 4 quando aquecido.
Obtenção de oxigênio (método industrial) Na indústria, para obter oxigênio puro, utiliza-se a destilação do ar líquido, com base nas diferentes temperaturas de ebulição dos componentes do ar. O ar é resfriado a cerca de -200°C e então aquecido lentamente. Quando a temperatura atinge -183°C, o oxigênio escapa do ar líquido, os componentes restantes do ar liquefeito a esta temperatura permanecem em estado líquido de agregação. Na indústria, para obter oxigênio puro, utiliza-se a destilação de ar líquido, com base em diferentes temperaturas de ebulição dos componentes do ar. O ar é resfriado a cerca de -200°C e então aquecido lentamente. Quando a temperatura atinge -183°C, o oxigênio escapa do ar líquido, os componentes restantes do ar liquefeito a esta temperatura permanecem em estado líquido de agregação.

O uso de oxigênio na construção e engenharia mecânica na construção e engenharia mecânica - para soldagem a gás oxi-acetileno e corte a gás de metais - para soldagem a gás oxi-acetileno e corte a gás de metais - para pulverização e revestimento de metais na produção de petróleo na produção de petróleo - quando injetado na formação para aumentar a energia de deslocamento na metalurgia e indústria de mineração na indústria de metalurgia e mineração - na produção de aço convectivo, sopro de oxigênio em altos-fornos, extração de ouro e minérios, produção de ferroligas, fundição de níquel, zinco, chumbo , zircônio e outros metais não ferrosos - na produção de aço convectivo, sopro de oxigênio em altos-fornos, extração de ouro e minérios, produção de ferroligas, fundição de níquel, zinco, chumbo, zircônio e outros metais não ferrosos - com redução direta de ferro - com redução direta de ferro - com limpeza a fogo na produção de fundição - com limpeza a fogo na produção de fundição - com furação a fogo x raças

O uso de oxigênio na medicina na medicina - em câmaras oxibáricas - em câmaras oxibáricas - ao preencher máscaras de oxigênio, travesseiros, etc. - ao encher máscaras de oxigênio, travesseiros, etc. - em enfermarias com microclima especial - em enfermarias com microclima especial - para a produção de coquetéis de oxigênio - para a produção de coquetéis de oxigênio - no cultivo de microrganismos - no cultivo de microrganismos em ecologia em ecologia - na purificação da bebida água - na purificação de água potável - na reciclagem de metais - ao reciclar metais - ao soprar águas residuais com oxigênio - ao soprar águas residuais com oxigênio - ao neutralizar resíduos quimicamente ativos em estações de tratamento em incineradores - ao neutralizar resíduos quimicamente ativos em estações de tratamento em incineradores

O uso de oxigênio na indústria química na indústria química - na produção de acetileno, celulose, álcool metílico, amônia, ácido nítrico e sulfúrico - na produção de acetileno, celulose, álcool metílico, amônia, ácido nítrico e sulfúrico - em a conversão catalítica de gás natural (na produção de amônia sintética) - na conversão catalítica de gás natural (na produção de amônia sintética) - na conversão de alta temperatura de metano - na conversão de alta temperatura de metano no indústria de energia na indústria de energia - na gaseificação de combustíveis sólidos - na gaseificação de combustíveis sólidos - para enriquecimento de ar para caldeiras domésticas e industriais - para enriquecimento de ar para caldeiras domésticas e industriais - para compressão de mistura água-carvão - para compressão de água- mistura de carvão

A utilização de oxigénio em equipamento militar em equipamento militar - em câmaras de pressão - em câmaras de pressão - para o funcionamento de motores diesel debaixo de água - para o funcionamento de motores diesel debaixo de água - como oxidante de combustível para motores de foguete - como oxidante de combustível para motores de foguete na agricultura na agricultura - para enriquecer o ambiente aquático com oxigênio na pesca - para enriquecer o ambiente aquático com oxigênio na pesca - na fabricação de coquetéis de oxigênio - na fabricação de coquetéis de oxigênio - para ganho de peso animal - para ganho de peso animal

OZÔNIO Modificação alotrópica do oxigênio O ozônio O 3 é um gás azul com odor pungente. Quem prestou atenção ao cheiro do ar após uma tempestade ou próximo a uma fonte de descarga elétrica conhece muito bem o cheiro desse gás. O ozônio O 3 é um gás azul com odor pungente. Quem prestou atenção ao cheiro do ar após uma tempestade ou próximo a uma fonte de descarga elétrica conhece muito bem o cheiro desse gás. Na natureza, o ozônio é formado pela ação da radiação ultravioleta do Sol, e também é produzido por descargas elétricas na atmosfera:
O ozônio é um agente oxidante muito forte, por isso é usado na desinfecção da água potável. Em contato com a maioria das substâncias oxidáveis, ocorre uma explosão. O ozônio é formado na atmosfera da Terra a uma altura de 25 km sob a influência da radiação solar, absorve a radiação perigosa do Sol. No entanto, no "guarda-chuva" de ozônio da Terra, com apenas cerca de 30 metros de espessura, "buracos" aparecem de vez em quando. Cada vez mais gases "prejudiciais" ao ozônio, como o monóxido de nitrogênio NO ou aquelas substâncias que são usadas para encher unidades de refrigeração e latas de aerossol, estão entrando no ar. Mesmo o desaparecimento parcial da camada de ozônio acima da Terra ameaça todos os seres vivos com a morte ... No entanto, no "guarda-chuva" de ozônio da Terra, apenas cerca de 30 metros de espessura, "buracos" aparecem de vez em quando. Cada vez mais gases "prejudiciais" ao ozônio, como o monóxido de nitrogênio NO ou aquelas substâncias que são usadas para encher unidades de refrigeração e latas de aerossol, estão entrando no ar. Mesmo o desaparecimento parcial da camada de ozônio acima da Terra ameaça todos os seres vivos com a morte...


