730. Warum wird Wasser verwendet, um einige Mechanismen zu kühlen?
Wasser hat eine hohe spezifische Wärmekapazität, was zu einer guten Wärmeabfuhr aus dem Mechanismus beiträgt.
731. In welchem Fall sollte mehr Energie aufgewendet werden: um einen Liter Wasser um 1 °C zu erhitzen oder um hundert Gramm Wasser um 1 °C zu erhitzen?
Um einen Liter Wasser zu erhitzen, muss mehr Energie aufgewendet werden, je größer die Masse ist.
732. Kupfernickel- und Silbergabeln der gleichen Masse wurden in heißes Wasser getaucht. Erhalten sie die gleiche Wärmemenge aus Wasser?
Eine Kupfernickelgabel erhält mehr Wärme, da die spezifische Wärme von Kupfernickel größer ist als die von Silber.
733. Ein Stück Blei und ein Stück Gusseisen gleicher Masse wurden dreimal mit einem Vorschlaghammer geschlagen. Welcher Teil wurde heißer?
Blei erwärmt sich stärker, da seine spezifische Wärmekapazität geringer als bei Gusseisen ist und weniger Energie benötigt wird, um das Blei zu erhitzen.
734. Der eine Kolben enthält Wasser, der andere Kerosin von gleicher Masse und Temperatur. In jeden Kolben wurde ein gleich erhitzter Eisenwürfel geworfen. Was erwärmt sich auf eine höhere Temperatur - Wasser oder Kerosin?
Kerosin.
735. Warum sind die Temperaturschwankungen im Winter und Sommer in Städten an der Meeresküste weniger stark als in Städten im Landesinneren?
Wasser erwärmt sich und kühlt langsamer ab als Luft. Im Winter kühlt es ab und bewegt warme Luftmassen an Land, wodurch das Klima an der Küste wärmer wird.
736. Die spezifische Wärmekapazität von Aluminium beträgt 920 J/kg °C. Was bedeutet das?
Das bedeutet, dass 920 J benötigt werden, um 1 kg Aluminium um 1 °C zu erwärmen.
737. Aluminium- und Kupferbarren der gleichen Masse von 1 kg werden um 1 °C gekühlt. Wie stark ändert sich die innere Energie jedes Blocks? Welche Bar ändert sich mehr und um wie viel?
738. Welche Wärmemenge ist nötig, um einen Kilogramm Eisenknüppel auf 45 °C zu erhitzen?

739. Wie viel Wärme ist erforderlich, um 0,25 kg Wasser von 30 °C auf 50 °C zu erhitzen?

740. Wie ändert sich die innere Energie von zwei Litern Wasser bei Erwärmung um 5 °C?

741. Wie viel Wärme wird benötigt, um 5 g Wasser von 20 °C auf 30 °C zu erhitzen?
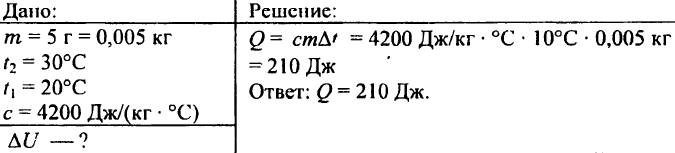
742. Welche Wärmemenge ist nötig, um eine 0,03 kg schwere Aluminiumkugel auf 72 °C zu erhitzen?

743. Berechnen Sie die Wärmemenge, die benötigt wird, um 15 kg Kupfer um 80 °C zu erhitzen.
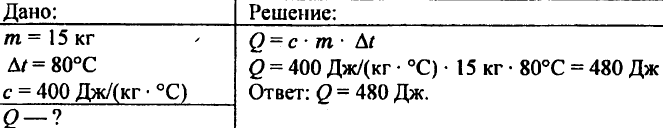
744. Berechnen Sie die Wärmemenge, die benötigt wird, um 5 kg Kupfer von 10 °C auf 200 °C zu erhitzen.

745. Welche Wärmemenge ist erforderlich, um 0,2 kg Wasser von 15 °C auf 20 °C zu erwärmen?

746. Wasser mit einem Gewicht von 0,3 kg ist um 20 °C abgekühlt. Um wie viel wird die innere Energie des Wassers reduziert?

747. Wie viel Wärme wird benötigt, um 0,4 kg Wasser mit einer Temperatur von 20 °C auf eine Temperatur von 30 °C zu erwärmen?

748. Wie viel Wärme wird aufgewendet, um 2,5 kg Wasser um 20 °C zu erwärmen?
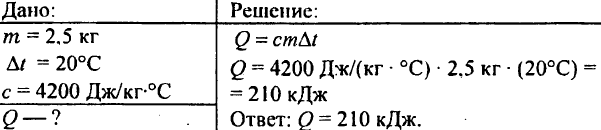
749. Wie viel Wärme wurde freigesetzt, als 250 g Wasser von 90 °C auf 40 °C abkühlten?
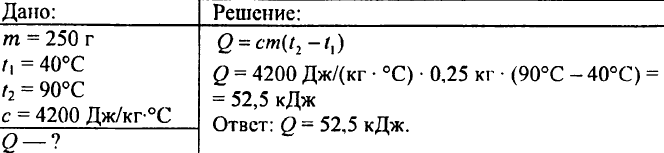
750. Welche Wärmemenge ist erforderlich, um 0,015 Liter Wasser um 1 °C zu erwärmen?

751. Wie viel Wärme muss berechnet werden, um einen Teich mit einem Volumen von 300 m3 um 10 °C zu erwärmen?
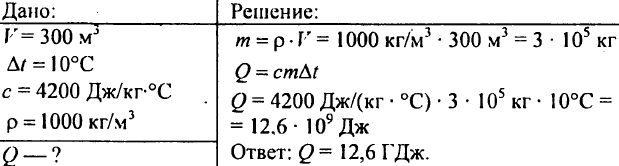
752. Wie viel Wärme muss 1 kg Wasser zugeführt werden, um seine Temperatur von 30°C auf 40°C zu erhöhen?

753. Wasser mit einem Volumen von 10 Litern hat sich von einer Temperatur von 100 °C auf eine Temperatur von 40 °C abgekühlt. Wie viel Wärme wird dabei freigesetzt?

754. Berechnen Sie die Wärmemenge, die benötigt wird, um 1 m3 Sand um 60 °C zu erwärmen.

755. Luftvolumen 60 m3, spezifische Wärmekapazität 1000 J/kg °C, Luftdichte 1,29 kg/m3. Wie viel Wärme wird benötigt, um sie auf 22 °C zu erwärmen?

756. Wasser wurde um 10 ° C erhitzt, wobei 4,20 103 J Wärme verbraucht wurden. Bestimmen Sie die Wassermenge.
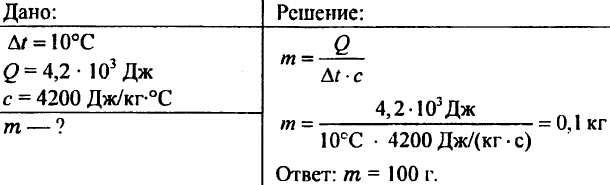
757. Wasser mit einem Gewicht von 0,5 kg meldete 20,95 kJ Wärme. Wie hoch war die Wassertemperatur, wenn die Anfangstemperatur des Wassers 20 °C betrug?

758. 8 kg Wasser von 10 °C werden in einen Kupfertopf mit einem Gewicht von 2,5 kg gegossen. Wie viel Hitze braucht man, um das Wasser in einem Topf zum Kochen zu bringen?

759. Ein Liter Wasser mit einer Temperatur von 15 °C wird in eine Kupferkelle mit einem Gewicht von 300 g gegossen.Wie viel Wärme wird benötigt, um das Wasser in der Kelle auf 85 °C zu erhitzen?

760. Ein Stück erhitzter Granit mit einem Gewicht von 3 kg wird in Wasser gelegt. Granit überträgt 12,6 kJ Wärme auf Wasser und kühlt um 10 °C ab. Wie groß ist die spezifische Wärmekapazität des Steins?

761. Heißes Wasser bei 50°C wurde zu 5 kg Wasser bei 12°C gegeben, wodurch eine Mischung mit einer Temperatur von 30°C erhalten wurde. Wie viel Wasser wurde hinzugefügt?

762. Wasser bei 20°C wurde zu 3 Liter Wasser bei 60°C gegeben, um Wasser bei 40°C zu erhalten. Wie viel Wasser wurde hinzugefügt?

763. Welche Temperatur hat die Mischung, wenn 600 g Wasser von 80 °C mit 200 g Wasser von 20 °C gemischt werden?

764. Ein Liter Wasser bei 90°C wurde in Wasser bei 10°C gegossen, und die Temperatur des Wassers wurde 60°C. Wie viel kaltes Wasser war da?

765. Bestimmen Sie, wie viel auf 60°C erhitztes heißes Wasser in ein Gefäß gefüllt werden soll, wenn das Gefäß bereits 20 Liter kaltes Wasser mit einer Temperatur von 15°C enthält; die Temperatur der Mischung sollte 40 °C betragen.

766. Bestimmen Sie, wie viel Wärme benötigt wird, um 425 g Wasser um 20 °C zu erwärmen.

767. Um wie viel Grad erwärmen sich 5 kg Wasser, wenn das Wasser 167,2 kJ erhält?

768. Wie viel Wärme ist erforderlich, um m Gramm Wasser von einer Temperatur t1 auf eine Temperatur t2 zu erhitzen?
769. 2 kg Wasser werden bei einer Temperatur von 15 °C in ein Kalorimeter gegossen. Auf welche Temperatur erwärmt sich das Wasser des Kalorimeters, wenn ein auf 100 °C erhitztes Messinggewicht von 500 g hineingelassen wird? Die spezifische Wärmekapazität von Messing beträgt 0,37 kJ/(kg °C).
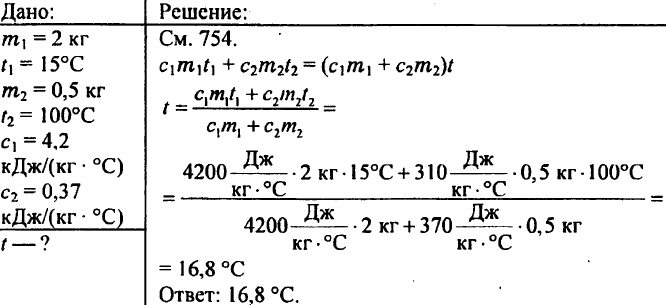
770. Es gibt Kupfer-, Zinn- und Aluminiumstücke von gleichem Volumen. Welches dieser Stücke hat die größte und welches die kleinste Wärmekapazität?

771. 450 g Wasser, dessen Temperatur 20°C beträgt, wurden in das Kalorimeter gegossen. Als 200 g auf 100°C erhitzte Eisenspäne in dieses Wasser eingetaucht wurden, wurde die Temperatur des Wassers 24°C. Bestimmen Sie die spezifische Wärmekapazität von Sägemehl.

772. Ein 100 g schweres Kupferkalorimeter fasst 738 g Wasser, dessen Temperatur 15 °C beträgt. 200 g Kupfer wurden in dieses Kalorimeter bei einer Temperatur von 100°C abgesenkt, wonach die Temperatur des Kalorimeters auf 17°C anstieg. Wie groß ist die spezifische Wärmekapazität von Kupfer?

773. Eine 10 g schwere Stahlkugel wird aus dem Ofen genommen und in 10 °C warmes Wasser getaucht. Die Wassertemperatur stieg auf 25°C. Welche Temperatur hatte die Kugel im Ofen, wenn die Wassermasse 50 g beträgt? Die spezifische Wärmekapazität von Stahl beträgt 0,5 kJ/(kg °C).

777. 50 g Wasser von 19 °C werden in 150 g schweres Wasser mit einer Temperatur von 35 °C gegossen. Welche Temperatur hat die Mischung?

778. Wasser mit einem Gewicht von 5 kg bei 90 °C wurde in einen gusseisernen Kessel mit einem Gewicht von 2 kg bei einer Temperatur von 10 °C gegossen. Welche Temperatur hatte das Wasser?

779. Ein 2 kg schwerer Stahlmeißel wurde auf eine Temperatur von 800 °C erhitzt und dann in ein Gefäß mit 15 Liter Wasser von 10 °C abgesenkt. Auf welche Temperatur wird das Wasser im Gefäß erhitzt?

(Hinweis. Um dieses Problem zu lösen, muss eine Gleichung erstellt werden, in der die gewünschte Temperatur des Wassers im Behälter nach dem Absenken des Schneidwerkzeugs als Unbekannte angenommen wird.)
780. Welche Temperatur bekommt Wasser, wenn man 0,02 kg Wasser von 15 °C, 0,03 kg Wasser von 25 °C und 0,01 kg Wasser von 60 °C mischt?
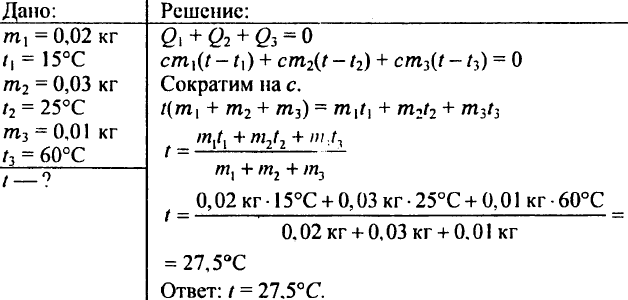
781. Das Heizen einer gut belüfteten Klasse erfordert eine Wärmemenge von 4,19 MJ pro Stunde. Wasser tritt mit 80 °C in die Heizkörper ein und mit 72 °C wieder aus. Wie viel Wasser soll den Heizkörpern stündlich zugeführt werden?

782. Blei mit einem Gewicht von 0,1 kg bei einer Temperatur von 100 °C wurde in ein Kalorimeter aus Aluminium mit einem Gewicht von 0,04 kg getaucht, das 0,24 kg Wasser mit einer Temperatur von 15 °C enthielt. Danach wurde im Kalorimeter die Temperatur von 16 °C eingestellt. Wie groß ist die spezifische Wärmekapazität von Blei?

Was wird auf dem Herd schneller heiß – ein Wasserkocher oder ein Eimer Wasser? Die Antwort liegt auf der Hand – ein Wasserkocher. Dann ist die zweite Frage warum?
Die Antwort ist nicht weniger offensichtlich - weil die Wassermasse im Wasserkocher geringer ist. Bußgeld. Und jetzt können Sie die realste körperliche Erfahrung selbst zu Hause machen. Dazu benötigen Sie zwei identische kleine Töpfe, eine gleiche Menge Wasser und Pflanzenöl, beispielsweise jeweils einen halben Liter, und einen Herd. Stellen Sie Töpfe mit Öl und Wasser auf dasselbe Feuer. Und jetzt nur zusehen, was sich schneller aufheizt. Wenn es ein Thermometer für Flüssigkeiten gibt, kannst du es verwenden, wenn nicht, kannst du die Temperatur einfach ab und zu mit dem Finger ausprobieren, pass nur auf, dass du dich nicht verbrennst. Auf jeden Fall werden Sie schnell feststellen, dass sich das Öl deutlich schneller erwärmt als Wasser. Und noch eine Frage, die sich auch in Erfahrungsform umsetzen lässt. Was kocht schneller - warmes oder kaltes Wasser? Alles ist wieder klar - der Warme kommt als Erster ins Ziel. Warum all diese seltsamen Fragen und Experimente? Um die physikalische Größe zu bestimmen, die als "Wärmemenge" bezeichnet wird.
Wärmemenge
Die Wärmemenge ist die Energie, die der Körper bei der Wärmeübertragung verliert oder gewinnt. Das geht aus dem Namen hervor. Beim Abkühlen verliert der Körper eine gewisse Menge an Wärme, und beim Erhitzen nimmt er auf. Und die Antworten auf unsere Fragen haben es uns gezeigt Wovon hängt die Wärmemenge ab? Erstens, je größer die Masse des Körpers ist, desto größer ist die Wärmemenge, die aufgewendet werden muss, um seine Temperatur um ein Grad zu ändern. Zweitens hängt die zur Erwärmung eines Körpers erforderliche Wärmemenge von der Substanz ab, aus der er besteht, dh von der Art der Substanz. Und drittens ist für unsere Berechnungen auch der Unterschied der Körpertemperatur vor und nach der Wärmeübertragung wichtig. Auf der Grundlage des Vorstehenden können wir Bestimmen Sie die Wärmemenge nach der Formel:
Q=cm(t_2-t_1) ,
wobei Q die Wärmemenge ist,
m - Körpergewicht,
(t_2-t_1) - die Differenz zwischen der anfänglichen und der endgültigen Körpertemperatur,
c - spezifische Wärmekapazität des Stoffes, ist den entsprechenden Tabellen zu entnehmen.
Mit dieser Formel können Sie die Wärmemenge berechnen, die erforderlich ist, um einen Körper zu erwärmen, oder die dieser Körper beim Abkühlen freisetzt.
Die Wärmemenge wird wie jede andere Energieform in Joule (1 J) gemessen. Dieser Wert wurde jedoch vor nicht allzu langer Zeit eingeführt, und die Menschen begannen viel früher, die Wärmemenge zu messen. Und sie verwendeten eine Einheit, die in unserer Zeit weit verbreitet ist - eine Kalorie (1 cal). 1 Kalorie ist die Wärmemenge, die benötigt wird, um 1 Gramm Wasser um 1 Grad Celsius zu erwärmen. Anhand dieser Daten können Liebhaber des Kalorienzählens in der Nahrung interessehalber berechnen, wie viele Liter Wasser mit der Energie, die sie tagsüber mit der Nahrung verbrauchen, gekocht werden können.
Die Veränderung der inneren Energie durch Arbeit wird durch die Arbeitsmenge charakterisiert, d.h. Arbeit ist ein Maß für die Änderung der inneren Energie in einem bestimmten Prozess. Die Änderung der inneren Energie eines Körpers bei der Wärmeübertragung wird durch eine Größe gekennzeichnet, die als Wärmemenge bezeichnet wird.
ist die Änderung der inneren Energie des Körpers bei der Wärmeübertragung ohne Arbeit. Die Wärmemenge wird mit dem Buchstaben bezeichnet Q .
Arbeit, innere Energie und Wärmemenge werden in denselben Einheiten gemessen - Joule ( J), wie jede andere Energieform.
Bei thermischen Messungen wird eine spezielle Energieeinheit, die Kalorie ( Kot), gleicht die Wärmemenge, die benötigt wird, um 1 Gramm Wasser um 1 Grad Celsius zu erwärmen (genauer gesagt von 19,5 bis 20,5 ° C). Insbesondere diese Einheit wird derzeit zur Berechnung des Wärmeverbrauchs (thermischer Energie) in Mehrfamilienhäusern verwendet. Empirisch wurde das mechanische Äquivalent von Wärme ermittelt - das Verhältnis zwischen Kalorien und Joule: 1 cal = 4,2 J.

Wenn ein Körper eine bestimmte Wärmemenge überträgt, ohne Arbeit zu verrichten, nimmt seine innere Energie zu, wenn ein Körper eine bestimmte Wärmemenge abgibt, dann nimmt seine innere Energie ab.
Wenn Sie 100 g Wasser in zwei identische Gefäße und 400 g in ein anderes Gefäß mit der gleichen Temperatur gießen und auf die gleichen Brenner stellen, kocht das Wasser im ersten Gefäß früher. Je größer also die Masse des Körpers ist, desto mehr Wärme muss er aufheizen. Gleiches gilt für die Kühlung.

Die Wärmemenge, die benötigt wird, um einen Körper zu erhitzen, hängt auch von der Art des Stoffes ab, aus dem dieser Körper besteht. Diese Abhängigkeit der zur Erwärmung des Körpers notwendigen Wärmemenge von der Stoffart wird durch eine physikalische Größe bezeichnet spezifische Wärmekapazität Substanzen.
- Dies ist eine physikalische Größe, die der Wärmemenge entspricht, die 1 kg eines Stoffes zugeführt werden muss, um ihn um 1 ° C (oder 1 K) zu erwärmen. Die gleiche Wärmemenge gibt 1 kg eines Stoffes ab, wenn er um 1 °C abgekühlt wird.
Die spezifische Wärmekapazität wird mit dem Buchstaben bezeichnet mit. Die Einheit der spezifischen Wärmekapazität ist 1 J/kg °C oder 1 J/kg °K.
Die Werte der spezifischen Wärmekapazität von Stoffen werden experimentell ermittelt. Flüssigkeiten haben eine höhere spezifische Wärmekapazität als Metalle; Wasser hat die höchste spezifische Wärmekapazität, Gold hat eine sehr kleine spezifische Wärmekapazität.
Da die Wärmemenge gleich der Änderung der inneren Energie des Körpers ist, können wir sagen, dass die spezifische Wärmekapazität zeigt, wie stark sich die innere Energie ändert 1 kg Substanz, wenn sich ihre Temperatur ändert 1 °C. Insbesondere nimmt die innere Energie von 1 kg Blei bei Erwärmung um 1 °C um 140 J zu und bei Abkühlung um 140 J ab.
Q erforderlich, um die Körpermasse zu erwärmen m Temperatur t 1 °С bis auf Temperatur t 2 °С, ist gleich dem Produkt aus spezifischer Wärmekapazität des Stoffes, Körpermasse und der Differenz zwischen End- und Anfangstemperatur, d.h.Q \u003d c ∙ m (t 2 - t 1)
Nach der gleichen Formel wird auch die Wärmemenge berechnet, die der Körper beim Abkühlen abgibt. Nur in diesem Fall sollte die Endtemperatur von der Anfangstemperatur abgezogen werden, d.h. Subtrahiere die kleinere Temperatur von der größeren Temperatur.

Dies ist eine Zusammenfassung zum Thema. „Wärmemenge. Spezifische Wärme". Wählen Sie die nächsten Schritte:
- Zum nächsten Abstract gehen:
« Physik - Klasse 10 "
Bei welchen Prozessen findet eine Aggregatumwandlung von Materie statt?
Wie kann der Aggregatzustand verändert werden?
Sie können die innere Energie eines jeden Körpers verändern, indem Sie Arbeit verrichten, ihn erhitzen oder umgekehrt kühlen.
Beim Schmieden eines Metalls wird also Arbeit verrichtet und erhitzt, während gleichzeitig das Metall über einer brennenden Flamme erhitzt werden kann.
Auch wenn der Kolben fixiert ist (Abb. 13.5), ändert sich das Gasvolumen beim Erhitzen nicht und es wird keine Arbeit verrichtet. Aber die Temperatur des Gases und damit seine innere Energie steigt.
Die innere Energie kann zunehmen und abnehmen, sodass die Wärmemenge positiv oder negativ sein kann.
Der Vorgang, Energie von einem Körper auf einen anderen zu übertragen, ohne Arbeit zu leisten, wird als Energie bezeichnet Wärmeaustausch.
Als quantitatives Maß wird die Änderung der inneren Energie bei der Wärmeübertragung bezeichnet Menge an Wärme.
Molekulares Bild der Wärmeübertragung.
Beim Wärmeaustausch an der Grenze zwischen Körpern treten langsam bewegte Moleküle eines kalten Körpers in Wechselwirkung mit schnell bewegten Molekülen eines heißen Körpers. Dadurch gleichen sich die kinetischen Energien der Moleküle an und die Geschwindigkeiten der Moleküle eines kalten Körpers nehmen zu, während die eines heißen Körpers abnehmen.
Beim Wärmeaustausch findet keine Energieumwandlung von einer Form in eine andere statt, ein Teil der inneren Energie eines heißeren Körpers wird auf einen weniger erhitzten Körper übertragen.
Wärmemenge und Wärmekapazität.
Sie wissen bereits, dass, um einen Körper mit der Masse m von der Temperatur t 1 auf die Temperatur t 2 zu erwärmen, die Wärmemenge auf ihn übertragen werden muss:
Q \u003d cm (t 2 - t 1) \u003d cm Δt. (13.5)
Wenn der Körper abkühlt, stellt sich heraus, dass seine Endtemperatur t 2 kleiner als die Anfangstemperatur t 1 ist und die vom Körper abgegebene Wärmemenge negativ ist.
Der Koeffizient c in Formel (13.5) wird aufgerufen spezifische Wärmekapazität Substanzen.
Spezifische Wärme- Dies ist ein numerischer Wert, der der Wärmemenge entspricht, die ein Stoff mit einer Masse von 1 kg aufnimmt oder abgibt, wenn sich seine Temperatur um 1 K ändert.
Die spezifische Wärmekapazität von Gasen hängt von dem Prozess ab, durch den Wärme übertragen wird. Wenn Sie ein Gas bei konstantem Druck erhitzen, dehnt es sich aus und verrichtet Arbeit. Um ein Gas bei konstantem Druck um 1 °C zu erwärmen, muss mehr Wärme übertragen werden als bei konstantem Volumen, wenn sich das Gas nur erwärmt.
Flüssigkeiten und Feststoffe dehnen sich bei Erwärmung leicht aus. Ihre spezifischen Wärmekapazitäten bei konstantem Volumen und konstantem Druck unterscheiden sich kaum.
Spezifische Verdampfungswärme.
Um eine Flüssigkeit während des Siedevorgangs in Dampf umzuwandeln, muss ihr eine bestimmte Wärmemenge zugeführt werden. Die Temperatur einer Flüssigkeit ändert sich beim Sieden nicht. Die Umwandlung von Flüssigkeit in Dampf bei konstanter Temperatur führt nicht zu einer Erhöhung der kinetischen Energie von Molekülen, sondern geht mit einer Erhöhung der potentiellen Energie ihrer Wechselwirkung einher. Schließlich ist der durchschnittliche Abstand zwischen Gasmolekülen viel größer als zwischen Flüssigkeitsmolekülen.
Der Wert, der numerisch gleich der Wärmemenge ist, die erforderlich ist, um 1 kg Flüssigkeit bei konstanter Temperatur in Dampf umzuwandeln, wird genannt spezifische Verdampfungswärme.
Der Prozess der Flüssigkeitsverdampfung findet bei jeder Temperatur statt, während die schnellsten Moleküle die Flüssigkeit verlassen und sie während der Verdampfung abkühlt. Die spezifische Verdampfungswärme ist gleich der spezifischen Verdampfungswärme.
Dieser Wert wird mit dem Buchstaben r bezeichnet und in Joule pro Kilogramm (J / kg) ausgedrückt.
Die spezifische Verdampfungswärme von Wasser ist sehr hoch: r H20 = 2,256 · 10 6 J/kg bei einer Temperatur von 100 °C. In anderen Flüssigkeiten wie Alkohol, Äther, Quecksilber, Kerosin ist die spezifische Verdampfungswärme 3-10 Mal geringer als die von Wasser.
Um eine Flüssigkeit der Masse m in Dampf umzuwandeln, ist eine Wärmemenge erforderlich, die gleich ist:
Q p \u003d rm. (13.6)
Beim Kondensieren von Dampf wird die gleiche Wärmemenge freigesetzt:
Q k \u003d -rm. (13.7)
Spezifische Schmelzwärme.
Wenn ein kristalliner Körper schmilzt, erhöht die gesamte ihm zugeführte Wärme die potenzielle Energie der Wechselwirkung von Molekülen. Die kinetische Energie der Moleküle ändert sich nicht, da das Schmelzen bei konstanter Temperatur erfolgt.
Der Wert, der numerisch gleich der Wärmemenge ist, die erforderlich ist, um eine kristalline Substanz mit einem Gewicht von 1 kg bei einem Schmelzpunkt in eine Flüssigkeit umzuwandeln, wird genannt spezifische Schmelzwärme und werden mit dem Buchstaben λ bezeichnet.
Bei der Kristallisation eines Stoffes mit einer Masse von 1 kg wird genau so viel Wärme freigesetzt wie beim Schmelzen aufgenommen wird.
Die spezifische Schmelzwärme von Eis ist ziemlich hoch: 3,34 10 5 J/kg.
„Hätte Eis keine hohe Schmelzwärme, müsste im Frühjahr die gesamte Eismasse in wenigen Minuten oder Sekunden schmelzen, da aus der Luft ständig Wärme auf das Eis übertragen wird. Die Folgen davon wären schlimm; denn selbst in der gegenwärtigen Lage entstehen große Überschwemmungen und große Wasserströme durch das Schmelzen großer Eis- oder Schneemassen.“ R. Schwarz, 18. Jahrhundert
Um einen kristallinen Körper der Masse m zu schmelzen, ist eine Wärmemenge erforderlich, die gleich ist:
Qpl \u003d λm. (13.8)
Die bei der Kristallisation des Körpers freigesetzte Wärmemenge ist gleich:
Qcr = -λm (13.9)
Wärmebilanzgleichung.
Betrachten Sie den Wärmeaustausch in einem System, das aus mehreren Körpern besteht, die anfänglich unterschiedliche Temperaturen haben, z. B. den Wärmeaustausch zwischen Wasser in einem Gefäß und einer heißen Eisenkugel, die in Wasser getaucht wird. Nach dem Energieerhaltungssatz ist die von einem Körper abgegebene Wärmemenge numerisch gleich der von einem anderen aufgenommenen Wärmemenge.
Die abgegebene Wärmemenge wird als negativ betrachtet, die empfangene Wärmemenge als positiv. Daher ist die Gesamtwärmemenge Q1 + Q2 = 0.
Wenn in einem isolierten System Wärmeaustausch zwischen mehreren Körpern stattfindet, dann
Q 1 + Q 2 + Q 3 + ... = 0. (13.10)
Gleichung (13.10) wird aufgerufen Wärmebilanzgleichung.
Hier Q 1 Q 2 , Q 3 - die von den Körpern aufgenommene oder abgegebene Wärmemenge. Diese Wärmemengen werden durch Formel (13.5) bzw. Formeln (13.6) - (13.9) ausgedrückt, wenn beim Prozess der Wärmeübertragung (Schmelzen, Kristallisieren, Verdampfen, Kondensieren) verschiedene Phasenumwandlungen des Stoffes auftreten.
Sie können die innere Energie des Gases in der Flasche nicht nur durch Arbeit, sondern auch durch Erhitzen des Gases verändern (Abb. 43). Wenn der Kolben fixiert ist, ändert sich das Volumen des Gases nicht, aber die Temperatur und damit die innere Energie nehmen zu.
Der Vorgang, Energie von einem Körper auf einen anderen zu übertragen, ohne Arbeit zu verrichten, wird als Wärmeübertragung oder Wärmeübertragung bezeichnet.
Die durch Wärmeübertragung auf den Körper übertragene Energie wird als Wärmemenge bezeichnet. Die Wärmemenge wird auch als Energie bezeichnet, die der Körper bei der Wärmeübertragung abgibt.
Molekulares Bild der Wärmeübertragung. Beim Wärmeaustausch an der Grenze zwischen Körpern treten die sich langsam bewegenden Moleküle eines kalten Körpers in Wechselwirkung mit den sich schneller bewegenden Molekülen eines heißen Körpers. Dadurch werden die kinetischen Energien
Moleküle richten sich aus und die Geschwindigkeiten der Moleküle eines kalten Körpers nehmen zu und die eines heißen ab.
Beim Wärmeaustausch findet keine Energieumwandlung von einer Form in eine andere statt: Ein Teil der inneren Energie eines heißen Körpers wird auf einen kalten Körper übertragen.
Wärmemenge und Wärmekapazität. Aus dem Physikkurs VII ist bekannt, dass man, um einen Körper mit einer Masse von Temperatur zu Temperatur zu erwärmen, die Wärmemenge mitteilen muss
![]()
Wenn der Körper abkühlt, ist seine Endtemperatur niedriger als die Anfangstemperatur und die vom Körper abgegebene Wärmemenge ist negativ.
Der Koeffizient c in Formel (4.5) wird als spezifische Wärmekapazität bezeichnet. Spezifische Wärmekapazität ist die Wärmemenge, die 1 kg eines Stoffes aufnimmt oder abgibt, wenn sich seine Temperatur um 1 K ändert -
Die spezifische Wärmekapazität wird in Joule pro Kilogramm mal Kelvin ausgedrückt. Unterschiedliche Körper benötigen ungleich viel Energie, um die Temperatur um I K zu erhöhen. Also die spezifische Wärmekapazität von Wasser und Kupfer
Die spezifische Wärmekapazität hängt nicht nur von den Eigenschaften des Stoffes ab, sondern auch vom Prozess der Wärmeübertragung: Erwärmt man ein Gas bei konstantem Druck, dehnt es sich aus und verrichtet Arbeit. Um ein Gas bei konstantem Druck um 1 °C zu erwärmen, muss mehr Wärme übertragen werden als bei konstantem Volumen.
Flüssigkeiten und Festkörper dehnen sich bei Erwärmung leicht aus und ihre spezifischen Wärmekapazitäten bei konstantem Volumen und konstantem Druck unterscheiden sich kaum.
Spezifische Verdampfungswärme. Um eine Flüssigkeit in Dampf umzuwandeln, muss ihr eine bestimmte Wärmemenge zugeführt werden. Die Temperatur der Flüssigkeit ändert sich bei dieser Umwandlung nicht. Die Umwandlung einer Flüssigkeit in Dampf bei konstanter Temperatur führt nicht zu einer Erhöhung der kinetischen Energie der Moleküle, sondern geht mit einer Erhöhung ihrer potentiellen Energie einher. Schließlich ist der durchschnittliche Abstand zwischen Gasmolekülen um ein Vielfaches größer als zwischen Flüssigkeitsmolekülen. Außerdem erfordert eine Volumenvergrößerung beim Übergang eines Stoffes vom flüssigen in den gasförmigen Zustand, dass Arbeit gegen äußere Druckkräfte verrichtet wird.
Die Wärmemenge, die erforderlich ist, um 1 kg Flüssigkeit bei konstanter Temperatur in Dampf umzuwandeln, wird als bezeichnet
spezifische Verdampfungswärme. Dieser Wert wird durch einen Buchstaben gekennzeichnet und in Joule pro Kilogramm ausgedrückt.
Die spezifische Verdampfungswärme von Wasser ist sehr hoch: bei einer Temperatur von 100°C. Bei anderen Flüssigkeiten (Alkohol, Äther, Quecksilber, Kerosin usw.) ist die spezifische Verdampfungswärme 3-10 mal geringer.
Um eine flüssige Masse in Dampf umzuwandeln, ist eine Wärmemenge erforderlich, die gleich ist:
Beim Kondensieren von Dampf wird die gleiche Wärmemenge freigesetzt:
Spezifische Schmelzwärme. Wenn ein kristalliner Körper schmilzt, wird die gesamte ihm zugeführte Wärme verwendet, um die potenzielle Energie der Moleküle zu erhöhen. Die kinetische Energie der Moleküle ändert sich nicht, da das Schmelzen bei konstanter Temperatur erfolgt.
Die Wärmemenge A, die erforderlich ist, um 1 kg eines kristallinen Stoffes beim Schmelzpunkt in eine Flüssigkeit gleicher Temperatur zu überführen, wird als spezifische Schmelzwärme bezeichnet.
Bei der Kristallisation von 1 kg eines Stoffes wird genau so viel Wärme freigesetzt. Die spezifische Schmelzwärme von Eis ist ziemlich hoch:
Um einen kristallinen Körper mit einer Masse zu schmelzen, ist eine Wärmemenge erforderlich, die gleich ist:
Die bei der Kristallisation des Körpers freigesetzte Wärmemenge ist gleich:
1. Wie nennt man die Wärmemenge? 2. Was bestimmt die spezifische Wärmekapazität von Stoffen? 3. Was heißt spezifische Verdampfungswärme? 4. Was heißt spezifische Schmelzwärme? 5. In welchen Fällen ist die übertragene Wärmemenge negativ?
