Antoine Laurent LAVOISIER () () გამოიკვლია ჟანგბადი და შექმნა წვის ჟანგბადის თეორია, რომელმაც შეცვალა ფლოგისტონის თეორია. მან შეისწავლა ჟანგბადი და შექმნა წვის ჟანგბადის თეორია, რომელმაც შეცვალა ფლოგისტონის თეორია.

ჟანგბადი დედამიწაზე ყველაზე გავრცელებული ელემენტია ჰაერში 21% (მოცულობით), ჰაერში 21% (მოცულობით), დედამიწის ქერქში 49% (მასით), დედამიწის ქერქში 49% (მასით), ჰიდროსფეროში 89% (მასით), ჰიდროსფეროში 89% (მასით), ცოცხალ ორგანიზმებში 65%-მდე მასის მიხედვით. ცოცხალ ორგანიზმებში მასის 65%-მდე.

ფიზიკური თვისებები აგრეგატული მდგომარეობა - გაზი ნორმალურ პირობებში. ძალიან დაბალ ტემპერატურაზე (-183°C) ის გადაიქცევა აგრეგაციის თხევად მდგომარეობაში (ლურჯი სითხე), ხოლო კიდევ უფრო დაბალ ტემპერატურაზე (-219°C) ხდება მყარი (ცისფერი თოვლის კრისტალები). აგრეგატული მდგომარეობა - გაზი ნორმალურ პირობებში. ძალიან დაბალ ტემპერატურაზე (-183°C) ის გადაიქცევა აგრეგაციის თხევად მდგომარეობაში (ლურჯი სითხე), ხოლო კიდევ უფრო დაბალ ტემპერატურაზე (-219°C) ხდება მყარი (ცისფერი თოვლის კრისტალები). ფერი - უფერო. ფერი - უფერო. სუნი - უსუნო. სუნი - უსუნო. წყალში ხსნადობა - ცუდად ხსნადი. წყალში ხსნადობა - ცუდად ხსნადი. ჰაერზე მძიმე (M ჰაერი = 29 გ/მოლ, და M O 2 = 32 გ/მოლ. ჰაერზე მძიმე (M ჰაერი = 29 გ/მოლ და M O 2 = 32 გ/მოლ.

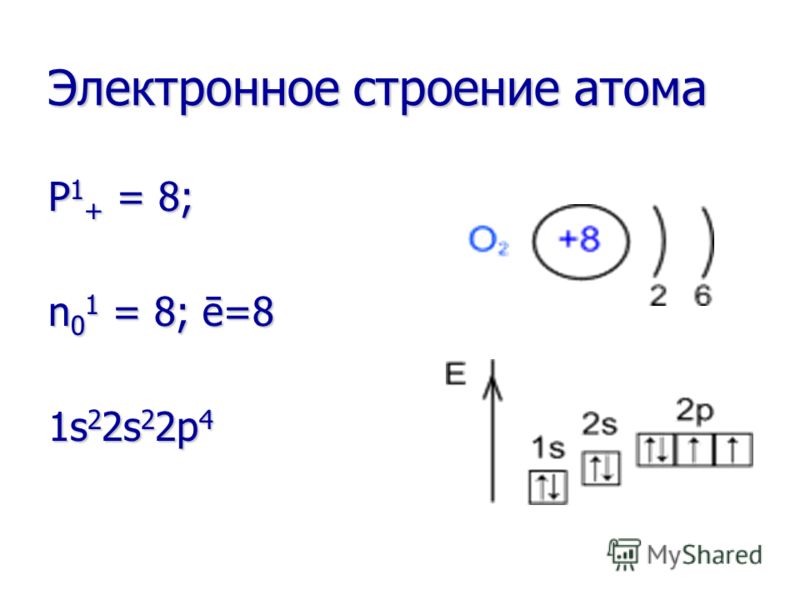
ქიმიური თვისებები ჟანგბადი არის ძალიან ძლიერი ჟანგვის აგენტი! ის აჟანგებს ბევრ ნივთიერებას უკვე ოთახის ტემპერატურაზე (ნელი დაჟანგვა) და მით უმეტეს, როდესაც ნივთიერება თბება ან იწვება (სწრაფი დაჟანგვა). ჟანგბადი არის ძალიან ძლიერი ჟანგვის აგენტი! ის აჟანგებს ბევრ ნივთიერებას უკვე ოთახის ტემპერატურაზე (ნელი დაჟანგვა) და მით უმეტეს, როდესაც ნივთიერება თბება ან იწვება (სწრაფი დაჟანგვა). ყველა ელემენტთან (გარდა ფტორისა) რეაქციაში ჟანგბადი ყოველთვის ჟანგვის აგენტია. ყველა ელემენტთან (გარდა ფტორისა) რეაქციაში ჟანგბადი ყოველთვის ჟანგვის აგენტია.

რეაქციები მეტალებთან რეაქციის შედეგად წარმოიქმნება ამ ლითონის ოქსიდი. მაგალითად, ალუმინი იჟანგება ჟანგბადით განტოლების მიხედვით: რეაქციის შედეგად წარმოიქმნება ამ ლითონის ოქსიდი. მაგალითად, ალუმინი იჟანგება ჟანგბადით განტოლების მიხედვით: t° 4Al + 3O 2 2Al 2 O 3 t° 4Al + 3O 2 2Al 2 O 3 კიდევ ერთი მაგალითი. წითელი ცხელი რკინის მავთულის ჟანგბადის ბოთლში ჩაშვებისას, მავთული იწვება, გვერდებზე ასხურებს ნაპერწკლების თაიგულებს - რკინის მასშტაბის ცხელი ნაწილაკები Fe 3 O 4: t ° 3Fe + 2O 2 Fe 3 O 4 t ° 3Fe + 2O 2 Fe 3 O 4


არალითონებთან რეაქციების სხვა მაგალითები. ჟანგბადი ნახშირორჟანგის შესაქმნელად: t° C + O 2 CO 2 t° C + O 2 CO 2
რეაქციები ზოგიერთ რთულ ნივთიერებასთან ამ შემთხვევაში წარმოიქმნება რთული ნივთიერების მოლეკულის შემადგენელი ელემენტების ოქსიდები. ამ შემთხვევაში წარმოიქმნება ელემენტების ოქსიდები, რომლებიც ქმნიან რთული ნივთიერების მოლეკულას. მაგალითად, სპილენძის (II) სულფიდის სროლისას, მაგალითად, სპილენძის (II) სულფიდის სროლისას t ° 2CuS + 3O 2 2CuO + 2SO 2 t ° 2CuS + 3O 2 2CuO + 2SO 2 წარმოიქმნება სპილენძის ორი ოქსიდი ( II) ოქსიდი და გოგირდის ოქსიდი (IV). წარმოიქმნება ორი ოქსიდი, სპილენძის (II) ოქსიდი და გოგირდის (IV) ოქსიდი. სულფიდების გამოწვის დროს ყოველთვის წარმოიქმნება გოგირდის ოქსიდი, რომელშიც გოგირდის ვალენტობა არის IV. სულფიდების გამოწვის დროს ყოველთვის წარმოიქმნება გოგირდის ოქსიდი, რომელშიც გოგირდის ვალენტობა არის IV. კიდევ ერთი მაგალითია მეთანის CH 4 წვა. ვინაიდან ეს მოლეკულა შედგება ნახშირბადის C და წყალბადის H ელემენტების ატომებისგან, ეს ნიშნავს, რომ ორი ოქსიდი წარმოიქმნება ნახშირბადის მონოქსიდი (IV) CO 2 და წყალბადის ოქსიდი, ანუ წყალი - H 2. O: t ° CH 4 + 2O 2 CO 2 + 2H 2 O t ° CH 4 + 2O 2 CO 2 + 2H 2 O

ნივთიერების ქიმიურ ურთიერთქმედებას ჟანგბადთან ეწოდება დაჟანგვის რეაქცია. ჟანგვის რეაქციებს, რომელსაც თან ახლავს სითბოს და სინათლის გამოყოფა, წვის რეაქციები ეწოდება. ნივთიერებების წვის რეაქციები არის სწრაფი დაჟანგვის მაგალითები, მაგრამ ლპობა, ჟანგი და ა.შ. ეს არის ჟანგბადით ნივთიერებების ნელი დაჟანგვის მაგალითები. ნივთიერებების წვის რეაქციები არის სწრაფი დაჟანგვის მაგალითები, მაგრამ ლპობა, ჟანგი და ა.შ. ეს არის ჟანგბადით ნივთიერებების ნელი დაჟანგვის მაგალითები

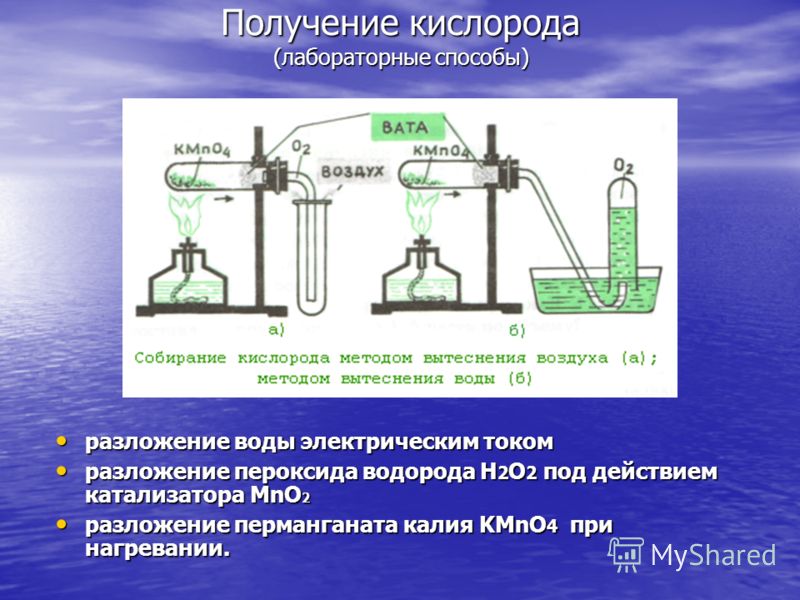
ჟანგბადის წარმოება (ლაბორატორიული მეთოდები) წყლის დაშლა ელექტრული დენით წყლის დაშლა ელექტრული დენით წყალბადის ზეჟანგის H 2 O 2 დაშლა MnO 2 კატალიზატორის დაშლა წყალბადის ზეჟანგი H 2 O 2 MnO 2 კატალიზატორის დაშლა კალიუმის პერმანგანატის მოქმედებით KMnO 4 გაცხელებისას. კალიუმის პერმანგანატის KMnO 4 დაშლა გაცხელებისას.
ჟანგბადის მიღება (ინდუსტრიული მეთოდი) მრეწველობაში სუფთა ჟანგბადის მისაღებად გამოიყენება თხევადი ჰაერის დისტილაცია, ჰაერის კომპონენტების სხვადასხვა დუღილის ტემპერატურის მიხედვით. ჰაერი გაცივდება დაახლოებით -200°C-მდე და შემდეგ ნელა თბება. როდესაც ტემპერატურა -183°C-ს მიაღწევს, ჟანგბადი გამოდის თხევადი ჰაერიდან, ამ ტემპერატურაზე თხევადი ჰაერის დარჩენილი კომპონენტები რჩება აგრეგაციის თხევად მდგომარეობაში. მრეწველობაში სუფთა ჟანგბადის მისაღებად გამოიყენება თხევადი ჰაერის დისტილაცია ჰაერის კომპონენტების სხვადასხვა დუღილის წერტილებზე დაყრდნობით. ჰაერი გაცივდება დაახლოებით -200°C-მდე და შემდეგ ნელა თბება. როდესაც ტემპერატურა -183°C-ს მიაღწევს, ჟანგბადი გამოდის თხევადი ჰაერიდან, ამ ტემპერატურაზე თხევადი ჰაერის დარჩენილი კომპონენტები რჩება აგრეგაციის თხევად მდგომარეობაში.

ჟანგბადის გამოყენება მშენებლობაში და მანქანათმშენებლობაში მშენებლობაში და მანქანათმშენებლობაში - ჟანგბად-აცეტილენის გაზით შედუღებისთვის და ლითონების გაზით ჭრისთვის - ჟანგბად-აცეტილენის გაზით შედუღებისთვის და ლითონების გაზით ჭრისთვის - ლითონების შესხურებისა და ზედაპირის დასაფენად ნავთობის წარმოებაში ნავთობის წარმოებაში - წარმონაქმნების შეყვანისას გადაადგილების ენერგიის გაზრდის მიზნით მეტალურგიაში და სამთო მრეწველობაში მეტალურგიაში და სამთო მრეწველობაში - კონვექციური ფოლადის წარმოებაში, ჟანგბადის აფეთქება აფეთქების ღუმელებში, ოქროსა და მადნების მოპოვება, ფეროშენადნობების წარმოება, ნიკელის, თუთიის, ტყვიის დნობა. ცირკონიუმი და სხვა ფერადი ლითონები - კონვექციური ფოლადის წარმოებაში, ჟანგბადის აფეთქება აფეთქების ღუმელებში, ოქროსა და მადნების მოპოვება, ფეროშენადნობების წარმოება, ნიკელის, თუთიის, ტყვიის, ცირკონიუმის და სხვა ფერადი ლითონების დნობა - პირდაპირი შემცირებით. რკინა - რკინის პირდაპირი შემცირებით - სამსხმელო წარმოებაში ცეცხლის გაწმენდით - სამსხმელო წარმოებაში ცეცხლის გაწმენდით - ცეცხლის ბურღვით x ჯიშები

ჟანგბადის გამოყენება მედიცინაში მედიცინაში - ოქსიბარულ კამერებში - ოქსიბარულ კამერებში - ჟანგბადის ნიღბების, ბალიშების და ა.შ. - ჟანგბადის ნიღბების, ბალიშების და ა.შ. - სპეციალური მიკროკლიმატის პალატებში - სპეციალური მიკროკლიმატის პალატებში - ჟანგბადის კოქტეილების წარმოებისთვის - ჟანგბადის კოქტეილების წარმოებისთვის - მიკროორგანიზმების გაშენებისას - მიკროორგანიზმების კულტივირებაში ეკოლოგიაში ეკოლოგიაში - სასმელის გაწმენდაში წყალი - სასმელი წყლის გაწმენდისას - ლითონების გადამუშავებისას - ლითონების გადამუშავებისას - ჩამდინარე წყლების ჟანგბადით აფეთქებისას - ჩამდინარე წყლების ჟანგბადით აფეთქებისას - ქიმიურად აქტიური ნარჩენების ნეიტრალიზაციისას გამწმენდ ნაგებობებში ინსინერატორებში - ქიმიურად აქტიური ნარჩენების განეიტრალებისას გამწმენდ ნაგებობებში ინსინერატორებში

ჟანგბადის გამოყენება ქიმიურ მრეწველობაში ქიმიურ მრეწველობაში - აცეტილენის, ცელულოზის, მეთილის სპირტის, ამიაკის, აზოტის და გოგირდმჟავას წარმოებაში - აცეტილენის, ცელულოზის, მეთილის სპირტის, ამიაკის, აზოტის და გოგირდმჟავას წარმოებაში - ბუნებრივი აირის კატალიზური გარდაქმნა (სინთეზური ამიაკის წარმოებაში) - ბუნებრივი აირის კატალიზური გადაქცევაში (სინთეზური ამიაკის წარმოებაში) - მეთანის მაღალტემპერატურულ გარდაქმნაში - მეთანის მაღალტემპერატურულ გარდაქმნაში ენერგეტიკული მრეწველობა ენერგეტიკულ ინდუსტრიაში - მყარი საწვავის გაზიფიკაციაში - მყარი საწვავის გაზიფიკაციაში - საყოფაცხოვრებო და სამრეწველო ქვაბებისთვის ჰაერის გამდიდრებისთვის - საყოფაცხოვრებო და სამრეწველო ქვაბებისთვის ჰაერის გამდიდრებისთვის - წყალი-ნახშირის ნარევი შეკუმშვისთვის - წყლის შეკუმშვისთვის - ნახშირის ნარევი

ჟანგბადის გამოყენება სამხედრო აღჭურვილობაში სამხედრო აღჭურვილობაში - წნევის კამერებში - წნევის კამერებში - დიზელის ძრავების წყლის ქვეშ მუშაობისთვის - დიზელის ძრავების წყლის ქვეშ მუშაობისთვის - როგორც საწვავის ოქსიდიზატორი სარაკეტო ძრავებისთვის - როგორც საწვავის ოქსიდიზატორი სარაკეტო ძრავები სოფლის მეურნეობაში სოფლის მეურნეობაში - წყლის გარემოს ჟანგბადით გასამდიდრებლად თევზაობაში - წყლის გარემოს ჟანგბადით გასამდიდრებლად თევზაობაში - ჟანგბადის კოქტეილების წარმოებაში - ჟანგბადის კოქტეილების წარმოებაში - ცხოველთა წონის მომატებისთვის - ცხოველის წონის მომატებისთვის

ოზონი ჟანგბადის ალოტროპული მოდიფიკაცია ოზონი O 3 არის ლურჯი გაზი მკვეთრი სუნით. ვინც ყურადღებას ამახვილებს იმაზე, თუ როგორ ასდის ჰაერი ჭექა-ქუხილის შემდეგ ან ელექტრული გამონადენის წყაროსთან ახლოს, კარგად იცის ამ გაზის სუნი. ოზონი O 3 არის ლურჯი გაზი მკვეთრი სუნით. ვინც ყურადღებას ამახვილებს იმაზე, თუ როგორ ასდის ჰაერი ჭექა-ქუხილის შემდეგ ან ელექტრული გამონადენის წყაროსთან ახლოს, კარგად იცის ამ გაზის სუნი. ბუნებაში, ოზონი წარმოიქმნება მზის ულტრაიისფერი გამოსხივების მოქმედებით და ასევე წარმოიქმნება ატმოსფეროში ელექტრული გამონადენით:
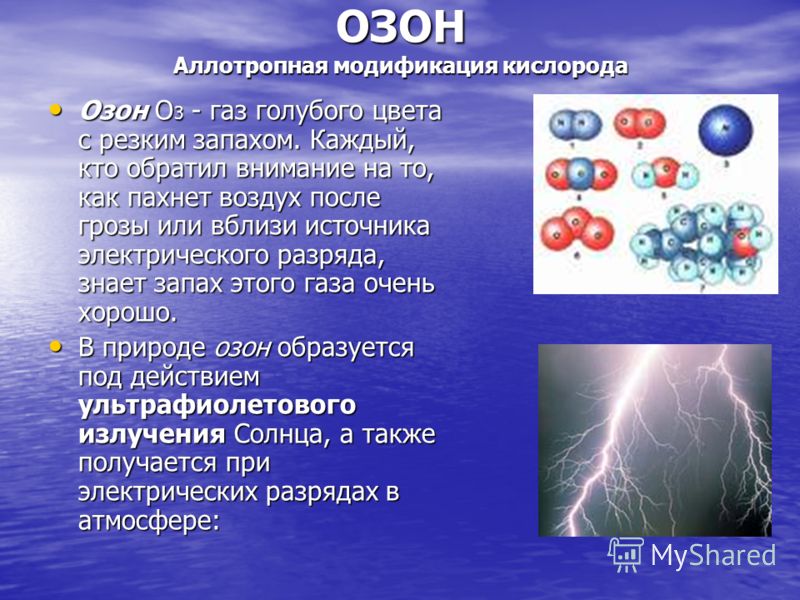
ოზონი არის ძალიან ძლიერი ჟანგვის აგენტი, ამიტომ გამოიყენება სასმელი წყლის დეზინფექციაში. უმეტეს ჟანგვის ნივთიერებებთან კონტაქტისას ხდება აფეთქება. ოზონი წარმოიქმნება დედამიწის ატმოსფეროში 25 კმ სიმაღლეზე მზის რადიაციის გავლენის ქვეშ, ის შთანთქავს მზის საშიშ გამოსხივებას. თუმცა, დედამიწის ოზონის „ქოლგაში“ სულ რაღაც 30 მეტრის სისქის „ხვრელები“ ჩნდება ხოლმე. სულ უფრო და უფრო მეტი აირები „მავნე“ ოზონისთვის, როგორიცაა აზოტის მონოქსიდი NO ან ის ნივთიერებები, რომლებიც გამოიყენება სამაცივრო დანადგარებისა და აეროზოლური ქილების შესავსებად, ჰაერში ხვდება. დედამიწის ზემოთ ოზონის შრის ნაწილობრივი გაქრობაც კი ყველა ცოცხალ არსებას სიკვდილით ემუქრება... თუმცა, დედამიწის ოზონის „ქოლგაში“ სულ რაღაც 30 მეტრის სისქის „ხვრელები“ ჩნდება ხოლმე. სულ უფრო და უფრო მეტი აირები „მავნე“ ოზონისთვის, როგორიცაა აზოტის მონოქსიდი NO ან ის ნივთიერებები, რომლებიც გამოიყენება სამაცივრო დანადგარებისა და აეროზოლური ქილების შესავსებად, ჰაერში ხვდება. დედამიწის ზემოთ ოზონის შრის ნაწილობრივი გაქრობაც კი ყველა ცოცხალ არსებას სიკვდილით ემუქრება...


