Antoine Laurent LAVOISIER () () A investigat oxigenul și a creat teoria oxigenului a arderii, care a înlocuit teoria flogistului. A studiat oxigenul și a creat teoria arderii oxigenului, care a înlocuit teoria flogistului.

Oxigenul este cel mai comun element de pe Pământ În aer 21% (în volum), în aer 21% (în volum), în scoarța terestră 49% (în masă), în scoarța terestră 49% (în masă), în hidrosferă 89% (din masă), în hidrosferă 89% (din masă), în organismele vii până la 65% din masă. în organismele vii până la 65% din masă.

Proprietăți fizice Stare agregată - gaz în condiții normale. La temperaturi foarte scăzute (-183°C) se transformă într-o stare lichidă de agregare (lichid albastru), iar la temperaturi și mai scăzute (-219°C) devine solidă (cristale albastre de zăpadă). Stare agregată - gaz în condiții normale. La temperaturi foarte scăzute (-183°C) se transformă într-o stare lichidă de agregare (lichid albastru), iar la temperaturi și mai scăzute (-219°C) devine solidă (cristale albastre de zăpadă). Culoare - incolor. Culoare - incolor. Miros - inodor. Miros - inodor. Solubilitate în apă - slab solubil. Solubilitate în apă - slab solubil. Mai greu decât aerul (M aer = 29 g / mol și M O 2 = 32 g / mol. Mai greu decât aerul (M aer = 29 g / mol și M O 2 = 32 g / mol.

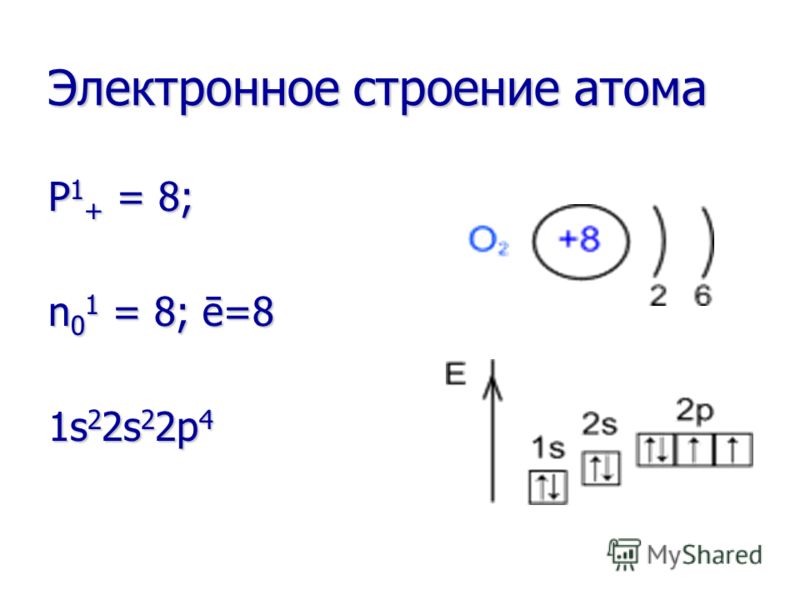
Proprietăți chimice Oxigenul este un agent oxidant foarte puternic! Oxidează multe substanțe deja la temperatura camerei (oxidare lentă) și cu atât mai mult atunci când substanța este încălzită sau arsă (oxidare rapidă). Oxigenul este un agent oxidant foarte puternic! Oxidează multe substanțe deja la temperatura camerei (oxidare lentă) și cu atât mai mult atunci când substanța este încălzită sau arsă (oxidare rapidă). În reacțiile cu toate elementele (cu excepția fluorului), oxigenul este întotdeauna un agent oxidant. În reacțiile cu toate elementele (cu excepția fluorului), oxigenul este întotdeauna un agent oxidant.

Reacții cu metalele În urma reacției se formează un oxid al acestui metal. De exemplu, aluminiul este oxidat de oxigen conform ecuației: Ca rezultat al reacției, se formează un oxid al acestui metal. De exemplu, aluminiul este oxidat de oxigen conform ecuației: t° 4Al + 3O 2 2Al 2 O 3 t° 4Al + 3O 2 2Al 2 O 3 Un alt exemplu. Când coborâți un fir de fier încins într-o sticlă de oxigen, firul se arde, pulverizând în lateral snopi de scântei - particule fierbinți de sol de fier Fe 3 O 4: t ° 3Fe + 2O 2 Fe 3 O 4 t ° 3Fe + 2O 2 Fe 3 O 4


Alte exemple de reacții cu nemetale Arderea sulfului în oxigen pentru a forma dioxid de sulf SO 2: t ° S + O 2 SO 2 t ° S + O 2 SO 2 Arderea cărbunelui în oxigen pentru a forma dioxid de carbon: Arderea cărbunelui în oxigen pentru a forma dioxid de carbon: t° C + O 2 CO 2 t° C + O 2 CO 2
Reacții cu unele substanțe complexe În acest caz se formează oxizi ai elementelor care alcătuiesc molecula unei substanțe complexe. În acest caz, se formează oxizi ai elementelor care alcătuiesc molecula unei substanțe complexe. De exemplu, în timpul arderii sulfurei de cupru (II) De exemplu, în timpul arderii sulfurei de cupru (II) t ° 2CuS + 3O 2 2CuO + 2SO 2 t ° 2CuS + 3O 2 2CuO + 2SO 2 se formează doi oxizi de cupru ( II) oxid și oxid de sulf ( IV). se formează doi oxizi, oxid de cupru (II) și oxid de sulf (IV). În timpul prăjirii sulfurilor, se formează întotdeauna oxid de sulf, în care valența sulfului este IV. În timpul prăjirii sulfurilor, se formează întotdeauna oxid de sulf, în care valența sulfului este IV. Un alt exemplu este arderea metanului CH 4. Deoarece această moleculă este formată din atomi ai elementelor carbon C și hidrogen H, înseamnă că se formează doi oxizi monoxid de carbon (IV) CO 2 și oxid de hidrogen, adică apă - H 2 O: t ° CH 4 + 2O 2 CO 2 + 2H 2 O t ° CH 4 + 2O 2 CO 2 + 2H 2 O

Interacțiunea chimică a unei substanțe cu oxigenul se numește reacție de oxidare. Reacțiile de oxidare însoțite de eliberarea de căldură și lumină se numesc reacții de ardere. Reacțiile de ardere ale substanțelor sunt exemple de oxidare rapidă, dar putrezire, ruginire etc. acestea sunt exemple de oxidare lentă a substanțelor cu oxigen.Reacțiile de ardere ale substanțelor sunt exemple de oxidare rapidă, dar putrezire, ruginire etc. acestea sunt exemple de oxidare lentă a substanțelor de către oxigen

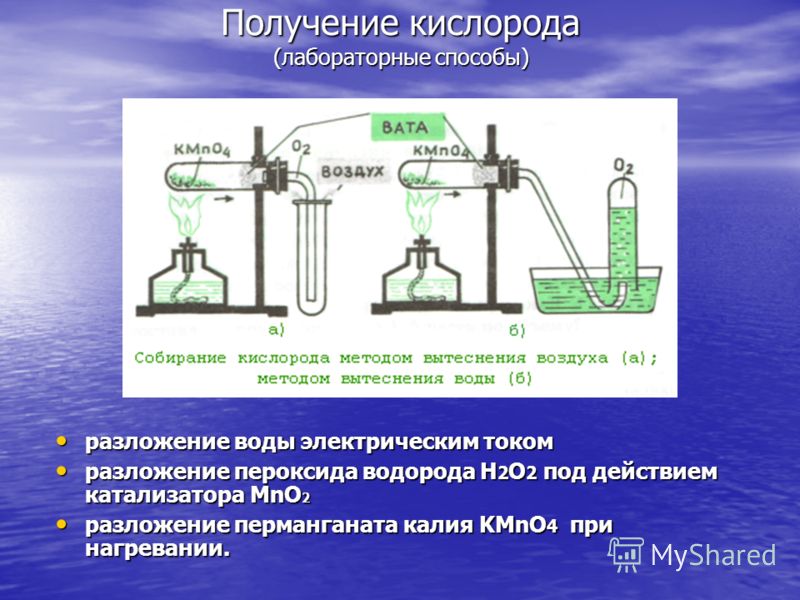
Producția de oxigen (metode de laborator) descompunerea apei prin curent electric descompunerea apei prin curent electric descompunerea peroxidului de hidrogen H 2 O 2 sub acțiunea catalizatorului MnO 2 descompunerea peroxidului de hidrogen H 2 O 2 sub acțiunea catalizatorului MnO 2 descompunerea permanganatului de potasiu KMnO 4 când este încălzit. descompunerea permanganatului de potasiu KMnO 4 la încălzire.
Obținerea oxigenului (metoda industrială) În industrie, pentru obținerea oxigenului pur se folosește distilarea aerului lichid, pe baza diferitelor temperaturi de fierbere ale componentelor aerului. Aerul este răcit la aproximativ -200°C și apoi încălzit încet. Când temperatura ajunge la -183°C, oxigenul iese din aerul lichid, componentele rămase ale aerului lichefiat la această temperatură rămân în stare lichidă de agregare. În industrie, pentru a obține oxigen pur, se folosește distilarea aerului lichid, pe baza diferitelor puncte de fierbere ale componentelor aerului. Aerul este răcit la aproximativ -200°C și apoi încălzit încet. Când temperatura ajunge la -183°C, oxigenul iese din aerul lichid, componentele rămase ale aerului lichefiat la această temperatură rămân în stare lichidă de agregare.

Utilizarea oxigenului în construcții și inginerie mecanică în construcții și inginerie mecanică - pentru sudarea cu gaz oxiacetilenă și tăierea cu gaz a metalelor - pentru sudarea cu gaz oxiacetilenă și tăierea cu gaz a metalelor - pentru pulverizarea și suprafața metalelor în producția de petrol în producția de petrol - atunci când este injectat în formațiune pentru a crește energia de deplasare în metalurgie și industria minieră în metalurgie și industria minieră - în producția de oțel convectiv, explozie de oxigen în furnal, extracția aurului și minereurilor, producția de feroaliaje, topirea nichelului, zincului, plumbului , zirconiu și alte metale neferoase - în producția de oțel convectiv, explozie de oxigen în furnalele înalte, extracția aurului și minereurilor, producția de feroaliaje, topirea nichelului, zincului, plumbului, zirconiului și a altor metale neferoase - cu reducerea directă a fier - cu reducerea directă a fierului - cu curățare la foc în producția de turnătorie - cu curățare la foc în producția de turnătorie - cu foraj la foc x rase

Utilizarea oxigenului în medicină în medicină - în camere oxibarice - în camere oxibarice - la umplerea măștilor de oxigen, pernelor etc. - la umplerea măștilor de oxigen, pernelor etc. - în saloane cu microclimat special - în saloane cu microclimat special - pentru producerea de cocktailuri de oxigen - pentru producerea de cocktailuri de oxigen - în cultivarea microorganismelor - în cultivarea microorganismelor în ecologie în ecologie - în purificarea băuturilor apă - la purificarea apei potabile - la reciclarea metalelor - la reciclarea metalelor - la suflarea apelor uzate cu oxigen - la suflarea apelor uzate cu oxigen - la neutralizarea deșeurilor active chimic în stațiile de epurare în incineratoare - la neutralizarea deșeurilor active chimic în stațiile de epurare în incineratoare

Utilizarea oxigenului în industria chimică în industria chimică - în producția de acetilenă, celuloză, alcool metilic, amoniac, acid azotic și sulfuric - în producția de acetilenă, celuloză, alcool metilic, amoniac, acid azotic și sulfuric - în conversia catalitică a gazelor naturale (în producția de amoniac sintetic) - în conversia catalitică a gazului natural (în producția de amoniac sintetic) - în conversia la temperatură înaltă a metanului - în conversia la temperatură înaltă a metanului în industria energetică în industria energetică - în gazeificarea combustibililor solizi - în gazeificarea combustibililor solizi - pentru îmbogățirea aerului pentru cazane casnice și industriale - pentru îmbogățirea aerului pentru cazane menajere și industriale - pentru comprimarea amestecului apă-cărbune - pentru comprimarea apei - amestec de cărbune

Utilizarea oxigenului în echipamentele militare în echipamentele militare - în camere de presiune - în camere de presiune - pentru funcționarea sub apă a motoarelor diesel - pentru funcționarea sub apă a motoarelor diesel - ca oxidant de combustibil pentru motoarele de rachetă - ca oxidant de combustibil pentru motoare rachete în agricultură în agricultură - pentru îmbogățirea mediului acvatic cu oxigen în pescuit - pentru îmbogățirea mediului acvatic cu oxigen în pescuit - la fabricarea cocktail-urilor cu oxigen - la fabricarea cocktail-urilor cu oxigen - pentru creșterea în greutate a animalelor - pentru creșterea în greutate a animalelor

OZON Modificarea alotropică a oxigenului Ozonul O 3 este un gaz albastru cu miros înțepător. Oricine a fost atent la felul în care mirosul aerului după o furtună sau în apropierea unei surse de descărcare electrică cunoaște foarte bine mirosul acestui gaz. Ozonul O 3 este un gaz albastru cu miros înțepător. Oricine a fost atent la felul în care mirosul aerului după o furtună sau în apropierea unei surse de descărcare electrică cunoaște foarte bine mirosul acestui gaz. În natură, ozonul se formează prin acțiunea radiațiilor ultraviolete de la Soare și este, de asemenea, produs de descărcări electrice din atmosferă:
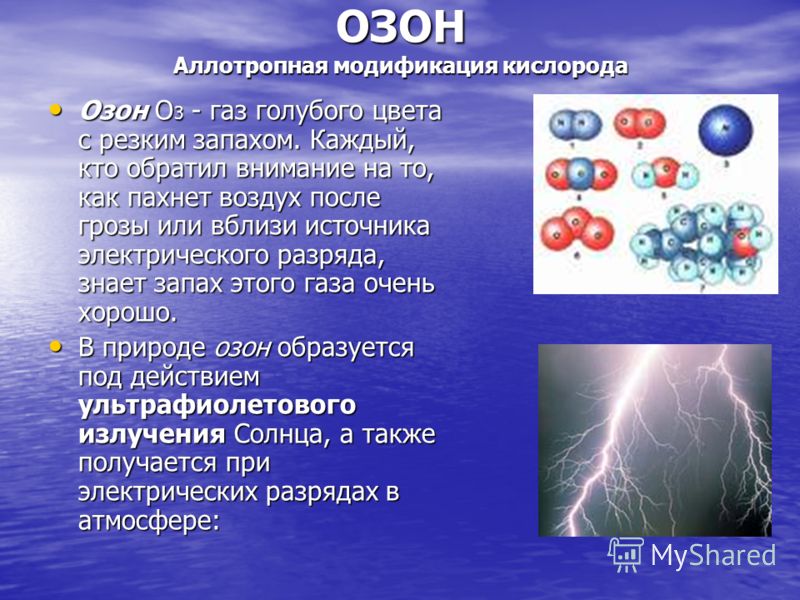
Ozonul este un agent oxidant foarte puternic, de aceea este folosit la dezinfectarea apei potabile. La contactul cu majoritatea substantelor oxidabile, are loc o explozie. Ozonul se formează în atmosfera Pământului la o înălțime de 25 km sub influența radiației solare, absoarbe radiațiile periculoase de la Soare. Cu toate acestea, în „umbrela” de ozon a Pământului, de doar aproximativ 30 de metri grosime, apar din când în când „găuri”. Din ce în ce mai multe gaze „dăunătoare” pentru ozon, precum monoxidul de azot NO sau acele substanțe care sunt folosite pentru umplerea unităților frigorifice și a cutiilor de aerosoli, ajung în aer. Chiar și dispariția parțială a stratului de ozon de deasupra Pământului amenință toate viețuitoarele cu moartea... Cu toate acestea, în „umbrela” de ozon a Pământului, de doar aproximativ 30 de metri grosime, apar din când în când „găuri”. Din ce în ce mai multe gaze „dăunătoare” pentru ozon, precum monoxidul de azot NO sau acele substanțe care sunt folosite pentru umplerea unităților frigorifice și a cutiilor de aerosoli, ajung în aer. Chiar și dispariția parțială a stratului de ozon de deasupra Pământului amenință toate ființele vii cu moartea...


