Antoine Laurent LAVOISIER () () Skúmal kyslík a vytvoril kyslíkovú teóriu spaľovania, ktorá nahradila flogistónovú teóriu. Študoval kyslík a vytvoril kyslíkovú teóriu spaľovania, ktorá nahradila flogistónovú teóriu.

Kyslík je najbežnejším prvkom na Zemi Vo vzduchu 21 % (objemovo), Vo vzduchu 21 % (objemovo), v zemskej kôre 49 % (hmotn.), v zemskej kôre 49 % (hmotn.), v hydrosfére 89% (hmotn.), v hydrosfére 89% (hmotn.), v živých organizmoch až 65% hmot. v živých organizmoch až 65% hmoty.

Fyzikálne vlastnosti Agregátny stav - plyn za normálnych podmienok. Pri veľmi nízkych teplotách (-183°C) prechádza do kvapalného stavu agregácie (modrá kvapalina) a pri ešte nižších teplotách (-219°C) sa stáva tuhým (modré snehové kryštály). Agregátny stav - plyn za normálnych podmienok. Pri veľmi nízkych teplotách (-183°C) prechádza do kvapalného stavu agregácie (modrá kvapalina) a pri ešte nižších teplotách (-219°C) sa stáva tuhým (modré snehové kryštály). Farba - bezfarebná. Farba - bezfarebná. Vôňa - bez zápachu. Vôňa - bez zápachu. Rozpustnosť vo vode - zle rozpustný. Rozpustnosť vo vode - zle rozpustný. Ťažšie ako vzduch (M vzduchu = 29 g/mol a M02 = 32 g/mol. Ťažšie ako vzduch (M vzduchu = 29 g/mol a M02 = 32 g/mol.

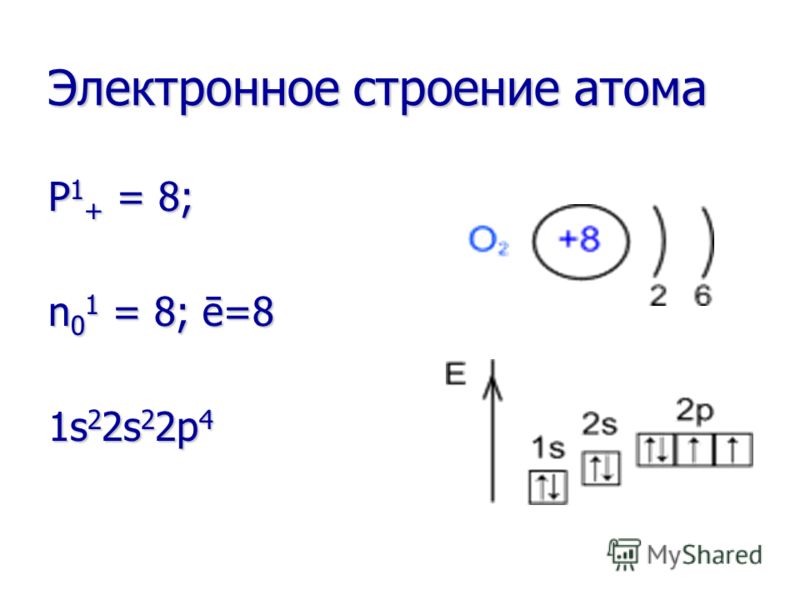
Chemické vlastnosti Kyslík je veľmi silné oxidačné činidlo! Oxiduje veľa látok už pri izbovej teplote (pomalá oxidácia) a ešte viac pri zahrievaní alebo spaľovaní látky (rýchla oxidácia). Kyslík je veľmi silné oxidačné činidlo! Oxiduje veľa látok už pri izbovej teplote (pomalá oxidácia) a ešte viac pri zahrievaní alebo spaľovaní látky (rýchla oxidácia). Pri reakciách so všetkými prvkami (okrem fluóru) je kyslík vždy oxidačným činidlom. Pri reakciách so všetkými prvkami (okrem fluóru) je kyslík vždy oxidačným činidlom.

Reakcie s kovmi Výsledkom reakcie je vznik oxidu tohto kovu. Napríklad hliník sa oxiduje kyslíkom podľa rovnice: V dôsledku reakcie vzniká oxid tohto kovu. Napríklad hliník sa oxiduje kyslíkom podľa rovnice: t° 4Al + 3O 2 2Al 2 O 3 t° 4Al + 3O 2 2Al 2 O 3 Ďalší príklad. Pri spúšťaní rozžeraveného železného drôtu do fľaše s kyslíkom drôt vyhorí a do strán vystreľujú snopy iskier - horúce častice železného kameňa Fe 3 O 4: t ° 3Fe + 2O 2 Fe 3 O 4 t ° 3Fe + 2O 2 Fe 3 O 4


Ďalšie príklady reakcií s nekovmi Spaľovanie síry v kyslíku za vzniku oxidu siričitého SO 2: t ° S + O 2 SO 2 t ° S + O 2 SO 2 Spaľovanie uhlia v kyslíku za vzniku oxidu uhličitého: Spaľovanie uhlia v kyslík za vzniku oxidu uhličitého: t° C + O 2 CO 2 t° C + O 2 CO 2
Reakcie s niektorými komplexnými látkami V tomto prípade vznikajú oxidy prvkov, ktoré tvoria molekulu komplexnej látky. V tomto prípade sa vytvárajú oxidy prvkov, ktoré tvoria molekulu komplexnej látky. Napríklad pri spaľovaní sulfidu meďnatého Napríklad pri spaľovaní sulfidu meďnatého t ° 2CuS + 3O 2 2CuO + 2SO 2 t ° 2CuS + 3O 2 2CuO + 2SO 2 vznikajú dva oxidy oxid meďnatý (II). a oxid sírový (IV). vznikajú dva oxidy, oxid meďnatý a oxid sírový. Pri pražení sulfidov vždy vzniká oxid sírový, v ktorom je valencia síry IV. Pri pražení sulfidov vždy vzniká oxid sírový, v ktorom je valencia síry IV. Ďalším príkladom je spaľovanie metánu CH 4. Keďže táto molekula pozostáva z atómov prvkov uhlíka C a vodíka H, znamená to, že vznikajú dva oxidy oxid uhoľnatý (IV) CO 2 a oxid vodíka, teda voda - H 2 O: t ° CH4 + 202 CO2 + 2H20 t ° CH4 + 202 CO2 + 2H20

Chemická interakcia látky s kyslíkom sa nazýva oxidačná reakcia. Oxidačné reakcie sprevádzané uvoľňovaním tepla a svetla sa nazývajú spaľovacie reakcie. Spaľovacie reakcie látok sú príkladmi rýchlej oxidácie, ale hniloby, hrdzavenia atď. to sú príklady pomalej oxidácie látok kyslíkom.spaľové reakcie látok sú príklady rýchlej oxidácie, ale hnitia, hrdzavenia a pod. toto sú príklady pomalej oxidácie látok kyslíkom

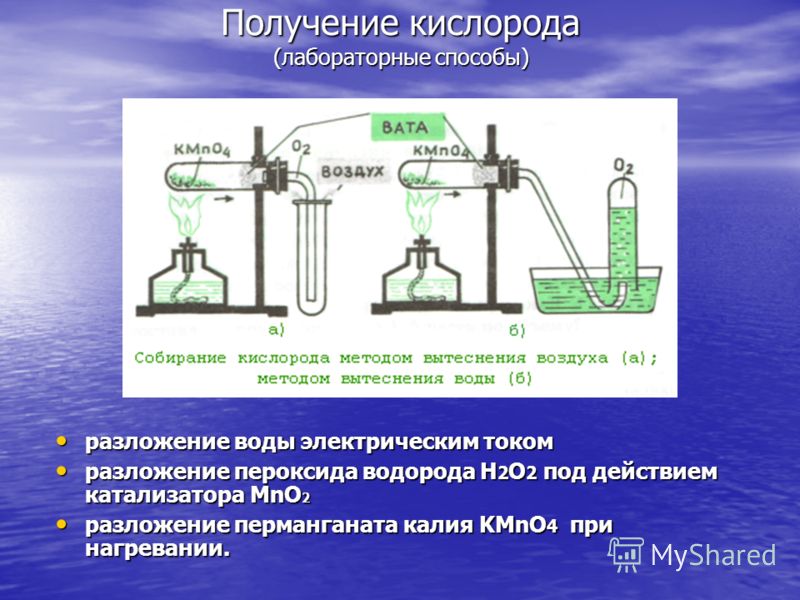
Výroba kyslíka (laboratórne metódy) rozklad vody elektrickým prúdom rozklad vody elektrickým prúdom rozklad peroxidu vodíka H 2 O 2 pôsobením MnO 2 katalyzátor rozklad peroxidu vodíka H 2 O 2 pôsobením MnO 2 katalyzátor rozklad manganistanu draselného KMnO 4 pri zahriatí. rozklad manganistanu draselného KMnO 4 pri zahrievaní.
Získavanie kyslíka (priemyselná metóda) V priemysle sa na získanie čistého kyslíka používa destilácia kvapalného vzduchu na základe rôznych teplôt varu zložiek vzduchu. Vzduch sa ochladí asi na -200 °C a potom sa pomaly zahrieva. Pri dosiahnutí teploty -183°C z kvapalného vzduchu uniká kyslík, zvyšné zložky skvapalneného vzduchu pri tejto teplote zostávajú v kvapalnom stave agregácie. V priemysle sa na získanie čistého kyslíka používa destilácia kvapalného vzduchu na základe rôznych teplôt varu zložiek vzduchu. Vzduch sa ochladí asi na -200 °C a potom sa pomaly zahrieva. Pri dosiahnutí teploty -183°C z kvapalného vzduchu uniká kyslík, zvyšné zložky skvapalneného vzduchu pri tejto teplote zostávajú v kvapalnom stave agregácie.

Využitie kyslíka v stavebníctve a strojárstve v stavebníctve a strojárstve - na zváranie kyslíkom a acetylénom a rezanie kovov - na zváranie kyslíkom a acetylénom a rezanie kovov - na striekanie a naváranie kovov pri výrobe ropy pri výrobe ropy - pri vstrekovaní do súvrstvia na zvýšenie vytesňovacej energie v hutníctve a ťažobnom priemysle v hutníctve a ťažobnom priemysle - pri konvekčnej výrobe ocele, fúkaní kyslíkom vo vysokých peciach, ťažbe zlata a rúd, výrobe ferozliatin, tavení niklu, zinku, olova , zirkónium a iné neželezné kovy - pri konvekčnej výrobe ocele, tryskanie kyslíkom vo vysokých peciach, ťažba zlata a rúd, výroba ferozliatin, tavenie niklu, zinku, olova, zirkónu a iných neželezných kovov - s priamou redukciou železo - s priamou redukciou železa - s čistením ohňom v zlievarenskej výrobe - s čistením ohňom v zlievárenskej výrobe - s vŕtaním ohňom x plemien

Využitie kyslíka v medicíne v medicíne - v oxybarických komorách - v oxybarických komorách - pri plnení kyslíkových masiek, vankúšov atď. - pri plnení kyslíkových masiek, vankúšov a pod. - na oddeleniach so špeciálnou mikroklímou - na oddeleniach so špeciálnou mikroklímou - na výrobu kyslíkových kokteilov - na výrobu kyslíkových kokteilov - pri kultivácii mikroorganizmov - pri kultivácii mikroorganizmov v ekológii v ekológii - pri čistení pitia voda - pri čistení pitnej vody - pri recyklácii kovov - pri recyklácii kovov - pri prefukovaní odpadových vôd kyslíkom - pri prefukovaní odpadových vôd kyslíkom - pri neutralizácii chemicky aktívnych odpadov v čistiarňach v spaľovniach - pri neutralizácii chemicky aktívnych odpadov v čistiarňach v spaľovniach

Využitie kyslíka v chemickom priemysle v chemickom priemysle - pri výrobe acetylénu, celulózy, metylalkoholu, amoniaku, kyseliny dusičnej a sírovej - pri výrobe acetylénu, celulózy, metylalkoholu, amoniaku, kyseliny dusičnej a sírovej - v r. katalytická premena zemného plynu (pri výrobe syntetického amoniaku) - pri katalytickej premene zemného plynu (pri výrobe syntetického amoniaku) - pri vysokoteplotnej premene metánu - pri vysokoteplotnej premene metánu v energetika v energetike - pri splyňovaní tuhých palív - pri splyňovaní tuhých palív - na obohacovanie vzduchu pre domáce a priemyselné kotolne - na obohacovanie vzduchu pre domáce a priemyselné kotolne - na stláčanie zmesi voda-uhlie - na stláčanie vody- uhoľná zmes

Využitie kyslíka vo vojenskej technike vo vojenskej technike - v tlakových komorách - v tlakových komorách - na prevádzku dieselových motorov pod vodou - na prevádzku dieselových motorov pod vodou - ako okysličovadlo paliva pre raketové motory - ako okysličovadlo paliva pre raketové motory v poľnohospodárstve v poľnohospodárstve - na obohacovanie vodného prostredia kyslíkom pri rybolove - na obohacovanie vodného prostredia kyslíkom pri rybolove - pri výrobe kyslíkových kokteilov - pri výrobe kyslíkových kokteilov - na priberanie zvierat - na priberanie zvierat

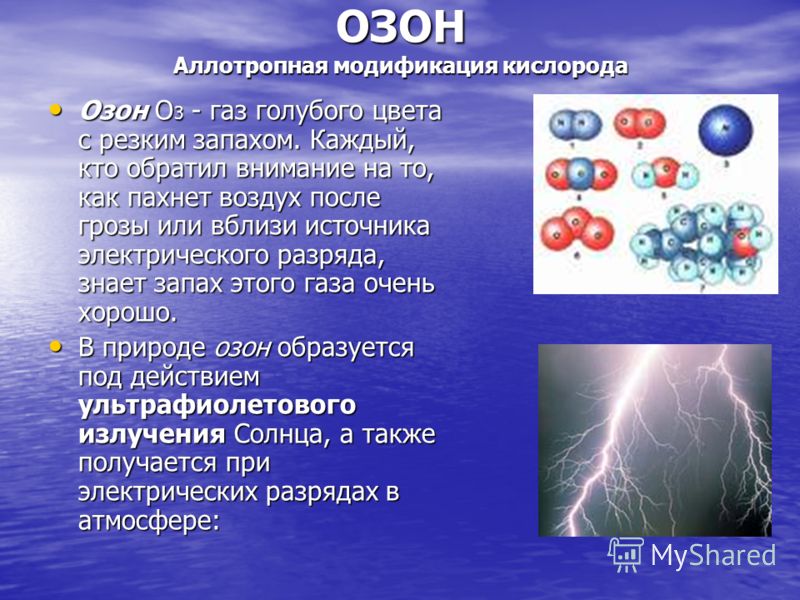
OZÓN Alotropická modifikácia kyslíka Ozón O 3 je modrý plyn s prenikavým zápachom. Každý, kto venoval pozornosť tomu, ako vonia vzduch po búrke alebo v blízkosti zdroja elektrického výboja, veľmi dobre pozná vôňu tohto plynu. Ozón O 3 je modrý plyn so štipľavým zápachom. Každý, kto venoval pozornosť tomu, ako vonia vzduch po búrke alebo v blízkosti zdroja elektrického výboja, veľmi dobre pozná vôňu tohto plynu. V prírode sa ozón tvorí pôsobením ultrafialového žiarenia zo Slnka a vzniká aj elektrickými výbojmi v atmosfére:
Ozón je veľmi silné oxidačné činidlo, preto sa používa pri dezinfekcii pitnej vody. Pri kontakte s väčšinou oxidovateľných látok dochádza k výbuchu. Ozón vzniká v zemskej atmosfére vo výške 25 km pod vplyvom slnečného žiarenia, pohlcuje nebezpečné žiarenie zo slnka. V ozónovom „dáždniku“ Zeme, hrubom len asi 30 metrov, sa však každú chvíľu objavia „diery“. Do ovzdušia sa dostáva čoraz viac plynov „škodlivých“ ozónu, ako je oxid dusnatý NO alebo tie látky, ktoré sa používajú na plnenie chladiacich jednotiek a aerosólových plechoviek. Aj čiastočné vymiznutie ozónovej vrstvy nad Zemou ohrozuje smrťou všetko živé... V ozónovom „dáždniku“ Zeme, hrubom len asi 30 metrov, sa však každú chvíľu objavia „diery“. Do ovzdušia sa dostáva čoraz viac plynov „škodlivých“ ozónu, ako je oxid dusnatý NO alebo tie látky, ktoré sa používajú na plnenie chladiacich jednotiek a aerosólových plechoviek. Aj čiastočné zmiznutie ozónovej vrstvy nad Zemou ohrozuje všetko živé...


