730. Miksi vettä käytetään joidenkin mekanismien jäähdyttämiseen?
Vedellä on korkea ominaislämpökapasiteetti, mikä edistää hyvää lämmönpoistoa mekanismista.
731. Missä tapauksessa energiaa pitäisi kuluttaa enemmän: yhden litran vettä lämmittämiseen 1 °C:lla vai sadan gramman lämmittämiseen 1 °C:lla?
Litra vettä lämmittää, koska mitä suurempi massa, sitä enemmän energiaa on kulutettava.
732. Kuumaan veteen upotettiin kupronikkeliä ja samaa massaa olevaa hopeahaarukkaa. Saavatko he saman määrän lämpöä vedestä?
Kupronikkelihaarukka saa enemmän lämpöä, koska kupronikkelin ominaislämpö on suurempi kuin hopean.
733. Samamassaiseen lyijynpalaan ja valurautapalaan lyötiin kolme kertaa vasaralla. Kumpi osa kuumeni?
Lyijy kuumenee enemmän, koska sen ominaislämpökapasiteetti on pienempi kuin valuraudalla ja lyijyn lämmittämiseen tarvitaan vähemmän energiaa.
734. Toisessa pullossa on vettä, toisessa kerosiinia, jonka massa ja lämpötila on sama. Jokaiseen pulloon heitettiin yhtä kuumennettu rautakuutio. Mikä lämpenee korkeampaan lämpötilaan - vesi vai kerosiini?
Kerosiini.
735. Miksi merenrantakaupungeissa lämpötilanvaihtelut ovat vähemmän jyrkkiä talvella ja kesällä kuin sisämaassa sijaitsevissa kaupungeissa?
Vesi lämpenee ja jäähtyy hitaammin kuin ilma. Talvella se jäähtyy ja siirtää lämpimiä ilmamassoja maalle, mikä tekee rannikon ilmastosta lämpimämmän.
736. Alumiinin ominaislämpökapasiteetti on 920 J/kg °C. Mitä tämä tarkoittaa?
Tämä tarkoittaa, että 1 kg alumiinia lämmittää 1 °C:lla 920 J.
737. Alumiini- ja kuparitankoja, joiden massa on sama 1 kg, jäähdytetään 1 °C:lla. Kuinka paljon kunkin lohkon sisäinen energia muuttuu? Kumpi palkki muuttuu enemmän ja kuinka paljon?
738. Kuinka paljon lämpöä tarvitaan kilogramman rautaaihion lämmittämiseen 45 °C:lla?

739. Kuinka paljon lämpöä tarvitaan lämmittämään 0,25 kg vettä 30 °C:sta 50 °C:seen?

740. Miten kahden litran vettä sisäinen energia muuttuu, kun sitä kuumennetaan 5 °C:lla?

741. Kuinka paljon lämpöä tarvitaan lämmittämään 5 g vettä 20 °C:sta 30 °C:seen?
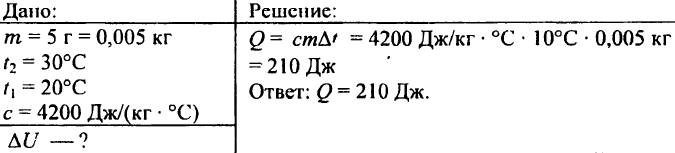
742. Kuinka paljon lämpöä tarvitaan 0,03 kg painavan alumiinipallon lämmittämiseen 72 °C:lla?

743. Laske lämpömäärä, joka tarvitaan lämmittämään 15 kg kuparia 80 °C:lla.
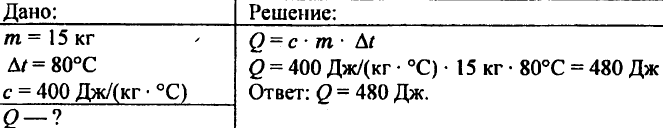
744. Laske lämpömäärä, joka tarvitaan lämmittämään 5 kg kuparia 10 °C:sta 200 °C:seen.

745. Kuinka paljon lämpöä tarvitaan lämmittämään 0,2 kg vettä 15 °C:sta 20 °C:seen?

746. 0,3 kg painava vesi on jäähtynyt 20 °C. Kuinka paljon veden sisäinen energia vähenee?

747. Kuinka paljon lämpöä tarvitaan lämmittämään 0,4 kg vettä lämpötilassa 20 °C 30 °C:n lämpötilaan?

748. Kuinka paljon lämpöä kuluu lämmittämällä 2,5 kg vettä 20 °C:lla?
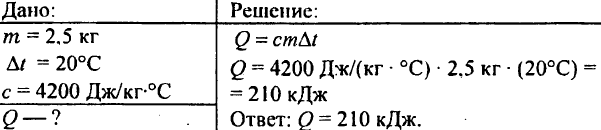
749. Kuinka paljon lämpöä vapautui, kun 250 g vettä jäähtyi 90 °C:sta 40 °C:seen?
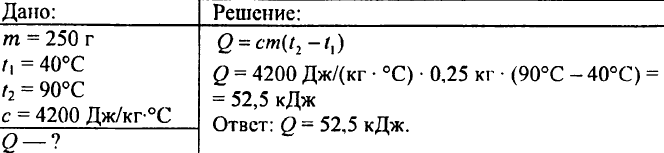
750. Kuinka paljon lämpöä tarvitaan lämmittämään 0,015 litraa vettä 1 °C:lla?

751. Laske lämpömäärä, joka tarvitaan 300 m3 10 °C:n lammen lämmittämiseen?
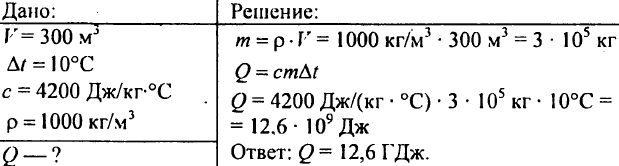
752. Kuinka paljon lämpöä on annettava 1 kg:aan vettä, jotta sen lämpötila nousee 30°C:sta 40°C:seen?

753. Vesi, jonka tilavuus on 10 litraa, on jäähtynyt 100 °C:n lämpötilasta 40 °C:een. Kuinka paljon lämpöä vapautuu tässä tapauksessa?

754. Laske lämpömäärä, joka tarvitaan lämmittämään 1 m3 hiekkaa 60 °C:lla.

755. Ilmatilavuus 60 m3, ominaislämpökapasiteetti 1000 J/kg °C, ilman tiheys 1,29 kg/m3. Kuinka paljon lämpöä tarvitaan nostamaan lämpötila 22 °C:seen?

756. Vesi kuumennettiin 10 °C:een kuluttaen 4,20 103 J lämpöä. Määritä veden määrä.
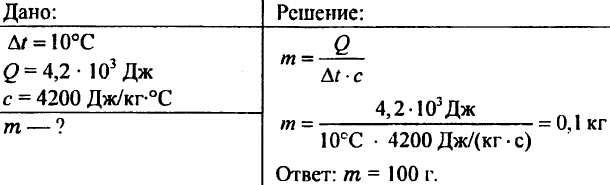
757. 0,5 kg painava vesi ilmoitti 20,95 kJ lämpöä. Mikä oli veden lämpötila, jos veden alkulämpötila oli 20°C?

758. 8 kg 10 °C:n vettä kaadetaan 2,5 kg painavaan kuparikattilaan. Kuinka paljon lämpöä tarvitaan kiehumaan vesi kattilassa?

759. 300 g painavaan kuparikauhaan kaadetaan litra 15 °C vettä, kuinka paljon lämpöä tarvitaan kauhassa olevan veden lämmittämiseen 85 °C:lla?

760. 3 kg painava pala kuumennettua graniittia laitetaan veteen. Graniitti siirtää 12,6 kJ lämpöä veteen jäähdyttäen 10 °C. Mikä on kiven ominaislämpökapasiteetti?

761. Kuuma vesi 50 °C:ssa lisättiin 5 kg:aan vettä 12 °C:ssa, jolloin saatiin seos, jonka lämpötila oli 30 °C. Kuinka paljon vettä lisättiin?

762. Vettä 20 °C:ssa lisättiin 3 litraan vettä 60 °C:ssa 40 °C:n veden saamiseksi. Kuinka paljon vettä lisättiin?

763. Mikä on seoksen lämpötila, jos 600 g 80 °C:n vettä sekoitetaan 200 g:aan 20 °C:n vettä?

764. Litra 90 °C:n vettä kaadettiin 10 °C:seen veteen, ja veden lämpötilaksi tuli 60 °C. Paljonko siellä oli kylmää vettä?

765. Määritä, kuinka paljon 60 °C:seen lämmitettyä kuumaa vettä astiaan tulee kaataa, jos astiassa on jo 20 litraa kylmää vettä, jonka lämpötila on 15 °C; seoksen lämpötilan tulee olla 40 °C.

766. Määritä, kuinka paljon lämpöä tarvitaan 425 g:n veden lämmittämiseen 20 °C:lla.

767. Kuinka monta astetta 5 kg vettä lämpenee, jos vesi saa 167,2 kJ?

768. Kuinka paljon lämpöä tarvitaan m gramman veden lämmittämiseen lämpötilassa t1 lämpötilaan t2?
769. Kalorimetriin kaadetaan 2 kg vettä, jonka lämpötila on 15 °C. Mihin lämpötilaan kalorimetrin vesi lämpenee, jos siihen lasketaan 500 g:n messinkipaino 100 °C:een kuumennettuna? Messingin ominaislämpökapasiteetti on 0,37 kJ/(kg °C).
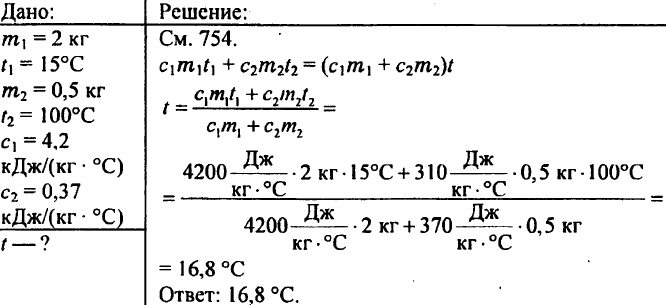
770. Kupari-, tina- ja alumiinikappaleita on samankokoisia. Millä näistä kappaleista on suurin ja millä pienin lämpökapasiteetti?

771. Kalorimetriin kaadettiin 450 g vettä, jonka lämpötila on 20 °C. Kun tähän veteen upotettiin 200 g 100°C:een kuumennettuja rautaviilaa, veden lämpötilaksi tuli 24°C. Määritä sahanpurun ominaislämpökapasiteetti.

772. 100 g painavaan kuparikalorimetriin mahtuu 738 g vettä, jonka lämpötila on 15 °C. Tähän kalorimetriin laskettiin 200 g kuparia 100 °C:n lämpötilassa, minkä jälkeen kalorimetrin lämpötila nousi 17 °C:seen. Mikä on kuparin ominaislämpökapasiteetti?

773. Uunista otetaan 10 g painava teräskuula ja lasketaan veteen 10 °C:n lämpötilassa. Veden lämpötila nousi 25 asteeseen. Mikä oli pallon lämpötila uunissa, jos veden massa on 50 g? Teräksen ominaislämpökapasiteetti on 0,5 kJ/(kg °C).

777. 50 g 19 °C:n vettä kaadetaan 150 g painavaan veteen, jonka lämpötila on 35 °C. Mikä on seoksen lämpötila?

778. Vesi, joka painoi 5 kg 90 °C:ssa, kaadettiin valurautakattilaan, joka painoi 2 kg, lämpötilassa 10 °C. Mikä oli veden lämpötila?

779. Terästaltta, joka painoi 2 kg, kuumennettiin 800 °C:n lämpötilaan ja laskettiin sitten astiaan, jossa oli 15 litraa vettä 10 °C:n lämpötilassa. Mihin lämpötilaan astiassa oleva vesi lämmitetään?

(Osoitus. Tämän ongelman ratkaisemiseksi on tarpeen luoda yhtälö, jossa astiassa olevan veden haluttu lämpötila leikkurin laskemisen jälkeen otetaan tuntemattomaksi.)
780. Minkä lämpötilan vesi saa, jos sekoitat 0,02 kg vettä 15 °C:ssa, 0,03 kg vettä 25 °C:ssa ja 0,01 kg vettä 60 °C:ssa?
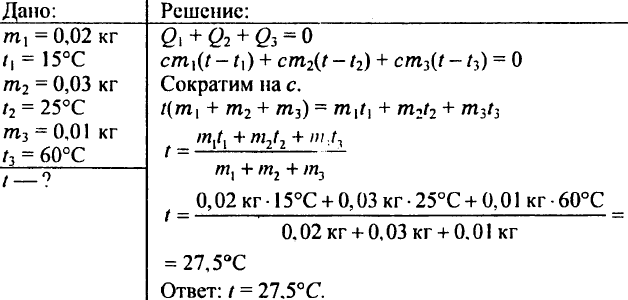
781. Hyvin tuuletetun luokan lämmittämiseen tarvitaan lämpöä 4,19 MJ tunnissa. Vesi tulee lämpöpattereihin 80 °C:ssa ja poistuu 72 °C:ssa. Kuinka paljon vettä tulisi syöttää lämpöpatteriin joka tunti?

782. Lyijyä, joka painoi 0,1 kg 100 °C:n lämpötilassa, upotettiin 0,04 kg painavaan alumiinikalorimetriin, joka sisälsi 0,24 kg vettä 15 °C:n lämpötilassa. Sen jälkeen kalorimetriin asetettiin lämpötila 16 °C. Mikä on lyijyn ominaislämpökapasiteetti?

Mikä lämpenee nopeammin liedellä - vedenkeitin vai ämpäri vettä? Vastaus on ilmeinen - vedenkeitin. Sitten toinen kysymys on miksi?
Vastaus ei ole yhtä ilmeinen - koska veden massa kattilassa on pienempi. Hieno. Ja nyt voit tehdä todellisimman fyysisen kokemuksen itse kotona. Tätä varten tarvitset kaksi identtistä pientä kattilaa, yhtä paljon vettä ja kasviöljyä, esimerkiksi puoli litraa kumpaakin, ja liesi. Laita kattilat öljyä ja vettä samalle tulelle. Ja nyt vain katsokaa, mikä lämpenee nopeammin. Jos nesteille on lämpömittari, voit käyttää sitä, jos ei, voit kokeilla lämpötilaa välillä sormella, varo, ettet polta itseäsi. Joka tapauksessa näet pian, että öljy lämpenee huomattavasti nopeammin kuin vesi. Ja vielä yksi kysymys, joka voidaan myös toteuttaa kokemuksen muodossa. Kumpi kiehuu nopeammin - lämmin vesi vai kylmä? Kaikki on taas selvää - lämmin tulee ensimmäisenä maaliin. Miksi kaikki nämä omituiset kysymykset ja kokeilut? Fyysisen suuren määrittämiseksi, jota kutsutaan "lämmön määräksi".
Lämmön määrä
Lämmön määrä on energiaa, jonka keho menettää tai kerää lämmönsiirron aikana. Tämä selviää nimestä. Jäähtyessään keho menettää tietyn määrän lämpöä, ja kuumennettaessa se imee itseensä. Ja vastaukset kysymyksiimme osoittivat meille mistä lämmön määrä riippuu? Ensinnäkin, mitä suurempi kehon massa on, sitä suurempi määrä lämpöä on kulutettava muuttaakseen sen lämpötilaa yhdellä asteella. Toiseksi kehon lämmittämiseen tarvittava lämmön määrä riippuu aineesta, josta se koostuu, eli aineen tyypistä. Ja kolmanneksi, ruumiinlämpötilan ero ennen ja jälkeen lämmönsiirron on myös tärkeä laskelmillemme. Edellisen perusteella voimme määritä lämmön määrä kaavalla:
Q=cm(t_2-t_1) ,
missä Q on lämmön määrä,
m - ruumiinpaino,
(t_2-t_1) - alkuperäisen ja lopullisen kehon lämpötilan välinen ero,
c - aineen ominaislämpökapasiteetti löytyy asiaankuuluvista taulukoista.
Tämän kaavan avulla voit laskea lämmön määrän, joka tarvitaan minkä tahansa kehon lämmittämiseen tai jonka tämä keho vapauttaa jäähtyessään.
Lämmön määrä mitataan jouleina (1 J), kuten mikä tahansa muu energiamuoto. Tämä arvo otettiin käyttöön ei niin kauan sitten, ja ihmiset alkoivat mitata lämmön määrää paljon aikaisemmin. Ja he käyttivät yksikköä, jota käytetään laajalti meidän aikanamme - kaloria (1 cal). 1 kalori on lämpömäärä, joka tarvitaan nostamaan 1 gramman vettä lämpötilaa yhdellä celsiusasteella. Näiden tietojen ohjaamana syömässään ruoassa olevien kalorien laskemisen ystävät voivat mielenkiinnon vuoksi laskea, kuinka monta litraa vettä voidaan keittää sillä energialla, jonka he kuluttavat päivän aikana.
Työn tekemisen sisäisen energian muutokselle on ominaista työn määrä, ts. työ on sisäisen energian muutoksen mitta tietyssä prosessissa. Kehon sisäisen energian muutosta lämmönsiirron aikana luonnehditaan suurella, jota kutsutaan lämmön määräksi.
on kehon sisäisen energian muutos lämmönsiirtoprosessissa ilman työtä. Lämmön määrä on merkitty kirjaimella K .
Työ, sisäinen energia ja lämmön määrä mitataan samoissa yksiköissä - jouleina ( J), kuten mikä tahansa muu energiamuoto.
Lämpömittauksissa erityinen energiayksikkö, kalori ( ulosteet), yhtä kuin lämpömäärä, joka tarvitaan nostamaan 1 gramman vettä lämpötilaa 1 celsiusasteella (tarkemmin sanottuna 19,5 - 20,5 ° C). Erityisesti tätä yksikköä käytetään tällä hetkellä kerrostalojen lämmön (lämpöenergian) kulutuksen laskennassa. Empiirisesti on määritetty lämmön mekaaninen ekvivalentti - kalorien ja jouleen välinen suhde: 1 cal = 4,2 J.

Kun keho siirtää tietyn määrän lämpöä tekemättä työtä, sen sisäinen energia kasvaa, jos keho luovuttaa tietyn määrän lämpöä, sen sisäinen energia vähenee.
Jos kaadat 100 g vettä kahteen identtiseen astiaan ja 400 g toiseen samassa lämpötilassa ja laitat ne samoihin polttimiin, niin ensimmäisessä astiassa oleva vesi kiehuu aikaisemmin. Eli mitä suurempi kehon massa on, sitä enemmän se tarvitsee lämmittääkseen lämpöä. Sama koskee jäähdytystä.

Kehon lämmittämiseen tarvittava lämmön määrä riippuu myös aineesta, josta tämä kappale on valmistettu. Tälle kehon lämmittämiseen tarvittavan lämpömäärän riippuvuudelle ainetyypistä on ominaista fysikaalinen määrä, jota kutsutaan ominaislämpökapasiteetti aineet.
- tämä on fysikaalinen määrä, joka on yhtä suuri kuin lämpömäärä, joka on ilmoitettava 1 kg:aan ainetta, jotta se lämmitetään 1 °C:lla (tai 1 K:lla). Saman määrän lämpöä luovuttaa 1 kg ainetta jäähdytettäessä 1 °C.
Ominaislämpökapasiteetti on merkitty kirjaimella kanssa. Ominaislämpökapasiteetin yksikkö on 1 J/kg °C tai 1 J/kg °K.
Aineiden ominaislämpökapasiteetin arvot määritetään kokeellisesti. Nesteiden ominaislämpökapasiteetti on suurempi kuin metallien; Vedellä on suurin ominaislämpökapasiteetti, kullalla erittäin pieni ominaislämpökapasiteetti.
Koska lämmön määrä on yhtä suuri kuin kehon sisäisen energian muutos, voidaan sanoa, että ominaislämpökapasiteetti näyttää kuinka paljon sisäinen energia muuttuu 1 kg ainetta, kun sen lämpötila muuttuu 1 °C. Erityisesti 1 kilon lyijyä sisäenergia kasvaa 1 °C lämmitettynä 140 J ja jäähdytettynä pienenee 140 J.
K tarvitaan kehon massan lämmittämiseen m lämpötila t 1 °С lämpötilaan asti t 2 °С, on yhtä suuri kuin aineen ominaislämpökapasiteetin, ruumiinmassan sekä loppu- ja alkulämpötilan eron tulo, ts.Q \u003d c ∙ m (t 2 - t 1)
Saman kaavan mukaan lasketaan myös lämmön määrä, jonka keho luovuttaa jäähtyessään. Vain tässä tapauksessa loppulämpötila tulee vähentää alkulämpötilasta, ts. Vähennä pienempi lämpötila suuremmasta lämpötilasta.

Tämä on synopsis aiheesta. "Lämmön määrä. ominaislämpö". Valitse seuraavat vaiheet:
- Siirry seuraavaan abstraktiin:
« Fysiikka - luokka 10 "
Missä prosesseissa aineen aggregaattimuutos tapahtuu?
Miten aineen tilaa voidaan muuttaa?
Voit muuttaa minkä tahansa kehon sisäistä energiaa tekemällä työtä, lämmittämällä tai päinvastoin jäähdyttämällä sitä.
Näin ollen metallia takottaessa tehdään työtä ja se kuumennetaan, samalla kun metallia voidaan lämmittää palavan liekin päällä.
Lisäksi, jos mäntä on kiinteä (kuva 13.5), kaasun tilavuus ei muutu kuumennettaessa eikä työtä tehdä. Mutta kaasun lämpötila ja siten sen sisäinen energia nousee.
Sisäinen energia voi kasvaa ja laskea, joten lämmön määrä voi olla positiivinen tai negatiivinen.
Prosessia, jossa energia siirtyy kehosta toiseen ilman työtä, kutsutaan lämmönvaihto.
Lämmönsiirron aikana tapahtuvan sisäisen energian muutoksen kvantitatiivista mittaa kutsutaan lämmön määrä.
Molekyylikuva lämmönsiirrosta.
Lämmönvaihdon aikana kappaleiden välisellä rajalla kylmän kappaleen hitaasti liikkuvat molekyylit ovat vuorovaikutuksessa kuuman kappaleen nopeasti liikkuvien molekyylien kanssa. Tämän seurauksena molekyylien kineettiset energiat tasoittuvat ja kylmän kappaleen molekyylien nopeudet kasvavat, kun taas kuuman kappaleen nopeudet pienenevät.
Lämmönvaihdon aikana ei tapahdu energian muuntamista muodosta toiseen, vaan osa kuumemman kappaleen sisäisestä energiasta siirtyy vähemmän lämmitettyyn kappaleeseen.
Lämmön määrä ja lämpökapasiteetti.
Tiedät jo, että kappaleen, jonka massa on m, lämmittämiseksi lämpötilasta t 1 lämpötilaan t 2, on välttämätöntä siirtää siihen lämpömäärä:
Q \u003d cm (t 2 - t 1) \u003d cm Δt. (13.5)
Kun keho jäähtyy, sen lopullinen lämpötila t 2 osoittautuu alhaisemmaksi kuin alkulämpötila t 1 ja kehon luovuttaman lämmön määrä on negatiivinen.
Kaavan (13.5) kerrointa c kutsutaan ominaislämpökapasiteetti aineet.
Ominaislämpö- tämä on numeerisesti yhtä suuri lämpömäärä, jonka aine, jonka massa on 1 kg, vastaanottaa tai luovuttaa, kun sen lämpötila muuttuu 1 K.
Kaasujen ominaislämpökapasiteetti riippuu prosessista, jolla lämpöä siirretään. Jos lämmität kaasua vakiopaineessa, se laajenee ja toimii. Kuumentaakseen kaasua 1 °C:lla vakiopaineessa sen täytyy siirtää enemmän lämpöä kuin lämmittää sitä vakiotilavuudessa, kun kaasu vain lämpenee.
Nesteet ja kiinteät aineet laajenevat hieman kuumennettaessa. Niiden ominaislämpökapasiteetit vakiotilavuudessa ja vakiopaineessa eroavat vähän.
Höyrystyksen ominaislämpö.
Nesteen muuttamiseksi höyryksi kiehumisprosessin aikana on tarpeen siirtää tietty määrä lämpöä siihen. Nesteen lämpötila ei muutu kiehuessaan. Nesteen muuttuminen höyryksi vakiolämpötilassa ei johda molekyylien kineettisen energian kasvuun, vaan siihen liittyy niiden vuorovaikutuksen potentiaalisen energian kasvu. Loppujen lopuksi keskimääräinen etäisyys kaasumolekyylien välillä on paljon suurempi kuin nestemolekyylien välillä.
Arvoa, joka on numeerisesti yhtä suuri kuin lämpömäärä, joka tarvitaan muuttamaan 1 kg nestettä höyryksi vakiolämpötilassa, on ns. ominaishöyrystyslämpö.
Nesteen haihtumisprosessi tapahtuu missä tahansa lämpötilassa, kun taas nopeimmat molekyylit poistuvat nesteestä ja se jäähtyy haihtumisen aikana. Höyrystymisen ominaislämpö on yhtä suuri kuin höyrystymislämpö.
Tämä arvo on merkitty kirjaimella r ja ilmaistaan jouleina kilogrammaa kohti (J / kg).
Veden höyrystymislämpö on erittäin korkea: r H20 = 2,256 10 6 J/kg 100 °C:n lämpötilassa. Muissa nesteissä, kuten alkoholissa, eetterissä, elohopeassa, kerosiinissa, höyrystymislämpö on 3-10 kertaa pienempi kuin veden.
Nesteen, jonka massa on m, muuttamiseksi höyryksi tarvitaan lämpöä, joka on yhtä suuri kuin:
Q p \u003d rm. (13.6)
Kun höyry tiivistyy, vapautuu sama määrä lämpöä:
Q k \u003d -rm. (13.7)
Spesifinen sulamislämpö.
Kun kiteinen kappale sulaa, kaikki siihen syötetty lämpö menee lisäämään molekyylien vuorovaikutuksen potentiaalista energiaa. Molekyylien kineettinen energia ei muutu, koska sulaminen tapahtuu vakiolämpötilassa.
Arvoa, joka on numeerisesti yhtä suuri kuin lämpömäärä, joka tarvitaan sulamispisteessä 1 kg painavan kiteisen aineen muuttamiseen nesteeksi ns. spesifinen sulamislämpö ja niitä merkitään kirjaimella λ.
1 kg:n massaisen aineen kiteytyessä vapautuu täsmälleen sama määrä lämpöä kuin sulamisen aikana absorboituu.
Jään sulamislämpö on melko korkea: 3,34 10 5 J/kg.
”Jos jäällä ei olisi korkeaa sulamislämpöä, niin keväällä koko jäämassan pitäisi sulaa muutamassa minuutissa tai sekunnissa, koska lämpöä siirtyy ilmasta jatkuvasti jäälle. Tämän seuraukset olisivat kauheita; sillä jopa nykyisessä tilanteessa suuria tulvia ja suuria vesivirtoja syntyy suurten jää- tai lumimassojen sulamisesta." R. Black, 1700-luku
Kiteisen kappaleen, jonka massa on m, sulattamiseksi tarvitaan lämpöä, joka on yhtä suuri kuin:
Qpl \u003d λm. (13.8)
Kehon kiteytymisen aikana vapautuva lämpömäärä on yhtä suuri:
Q cr = -λm (13,9)
Lämpötasapainon yhtälö.
Harkitse lämmönvaihtoa järjestelmässä, joka koostuu useista kappaleista, joiden lämpötila on alun perin erilainen, esimerkiksi lämmönvaihtoa astiassa olevan veden ja veteen lasketun kuuman rautapallon välillä. Energian säilymislain mukaan yhden kappaleen luovuttama lämpö on numeerisesti yhtä suuri kuin toisen kappaleen vastaanottama lämmön määrä.
Annettua lämpömäärää pidetään negatiivisena, vastaanotettua lämpömäärää pidetään positiivisena. Siksi lämmön kokonaismäärä Q1 + Q2 = 0.
Jos lämmönvaihto tapahtuu useiden kappaleiden välillä eristetyssä järjestelmässä, niin
Q 1 + Q 2 + Q 3 + ... = 0. (13.10)
Yhtälöä (13.10) kutsutaan lämpötasapainon yhtälö.
Tässä Q 1 Q 2 , Q 3 - kappaleiden vastaanottaman tai luovuttaman lämmön määrä. Nämä lämpömäärät ilmaistaan kaavalla (13.5) tai kaavoilla (13.6) - (13.9), jos lämmönsiirtoprosessissa tapahtuu aineen erilaisia faasimuutoksia (sulaminen, kiteytyminen, höyrystyminen, kondensaatio).
Sylinterissä olevan kaasun sisäenergiaa voi muuttaa paitsi työnteon lisäksi myös kaasua lämmittämällä (kuva 43). Jos mäntä on kiinteä, niin kaasun tilavuus ei muutu, mutta lämpötila ja siten sisäinen energia kasvavat.
Prosessia, jossa energia siirtyy kehosta toiseen ilman työtä, kutsutaan lämmönsiirroksi tai lämmönsiirroksi.
Lämmönsiirron seurauksena kehoon siirtyvää energiaa kutsutaan lämmön määräksi. Lämmön määrää kutsutaan myös energiaksi, jonka keho luovuttaa lämmönsiirtoprosessissa.
Molekyylikuva lämmönsiirrosta. Lämmönvaihdon aikana kappaleiden välisellä rajalla kylmän kappaleen hitaasti liikkuvat molekyylit ovat vuorovaikutuksessa kuuman kappaleen nopeammin liikkuvien molekyylien kanssa. Tämän seurauksena kineettiset energiat
molekyylit asettuvat kohdakkain ja kylmän kappaleen molekyylien nopeudet kasvavat ja kuuman molekyylien nopeudet laskevat.
Lämmönvaihdon aikana ei tapahdu energian muuntamista muodosta toiseen: osa kuuman kappaleen sisäisestä energiasta siirtyy kylmään kappaleeseen.
Lämmön määrä ja lämpökapasiteetti. Luokan VII fysiikan kurssista tiedetään, että massallisen kappaleen lämmittämiseksi lämpötilasta lämpötilaan on tarpeen ilmoittaa sille lämmön määrä
![]()
Kun keho jäähtyy, sen lopullinen lämpötila on alhaisempi kuin alkuperäinen ja kehon luovuttaman lämmön määrä on negatiivinen.
Kaavan (4.5) kerrointa c kutsutaan ominaislämpökapasiteetiksi. Ominaislämpökapasiteetti on lämpömäärä, jonka 1 kg ainetta vastaanottaa tai luovuttaa, kun sen lämpötila muuttuu 1 K -
Ominaislämpökapasiteetti ilmaistaan jouleina kilogrammaa kohti kertaa kelvin. Eri kappaleet vaativat erisuuruisen määrän energiaa nostaakseen lämpötilaa I K:lla. Näin ollen veden ja kuparin ominaislämpökapasiteetti
Ominaislämpökapasiteetti ei riipu pelkästään aineen ominaisuuksista, vaan myös prosessista, jolla lämmönsiirto tapahtuu.Jos lämmität kaasua vakiopaineessa, se laajenee ja toimii. Kaasun lämmittämiseksi 1 °C:lla vakiopaineessa sen täytyy siirtää enemmän lämpöä kuin lämmittää sitä vakiotilavuudessa.
Nesteet ja kiinteät aineet laajenevat hieman kuumennettaessa, ja niiden ominaislämpökapasiteetit vakiotilavuudessa ja vakiopaineessa eroavat vähän.
Höyrystyksen ominaislämpö. Jotta neste muuttuisi höyryksi, siihen on siirrettävä tietty määrä lämpöä. Nesteen lämpötila ei muutu tämän muutoksen aikana. Nesteen muuttuminen höyryksi vakiolämpötilassa ei johda molekyylien kineettisen energian kasvuun, vaan siihen liittyy niiden potentiaalisen energian kasvu. Loppujen lopuksi keskimääräinen etäisyys kaasumolekyylien välillä on monta kertaa suurempi kuin nestemolekyylien välillä. Lisäksi tilavuuden kasvu aineen siirtyessä nestemäisestä olomuodosta kaasumaiseen tilaan vaatii työtä ulkoisen paineen voimia vastaan.
Lämpömäärää, joka tarvitaan muuttamaan 1 kg nestettä höyryksi vakiolämpötilassa, kutsutaan
ominaishöyrystyslämpö. Tämä arvo on merkitty kirjaimella ja ilmaistaan jouleina kilogrammaa kohti.
Veden höyrystymislämpö on erittäin korkea: 100°C:n lämpötilassa. Muiden nesteiden (alkoholi, eetteri, elohopea, kerosiini jne.) ominaishöyrystyslämpö on 3-10 kertaa pienempi.
Nestemassan muuntaminen höyryksi vaatii lämpöä, joka on yhtä suuri kuin:
Kun höyry tiivistyy, vapautuu sama määrä lämpöä:
Spesifinen sulamislämpö. Kun kiteinen kappale sulaa, kaikki siihen syötetty lämpö menee lisäämään molekyylien potentiaalienergiaa. Molekyylien kineettinen energia ei muutu, koska sulaminen tapahtuu vakiolämpötilassa.
Sitä lämpömäärää A, joka tarvitaan muuttamaan 1 kg kiteistä ainetta sulamispisteessä samanlämpöiseksi nesteeksi, kutsutaan ominaisfuusiolämpöksi.
Kun 1 kg ainetta kiteytyy, vapautuu täsmälleen sama määrä lämpöä. Jään sulamislämpö on melko korkea:
Kiteisen kappaleen sulattamiseksi massalla tarvitaan lämpöä, joka on yhtä suuri kuin:
Kehon kiteytymisen aikana vapautuva lämpömäärä on yhtä suuri:
1. Mitä kutsutaan lämmön määräksi? 2. Mikä määrittää aineiden ominaislämpökapasiteetin? 3. Mitä kutsutaan höyrystymislämmöksi? 4. Mitä kutsutaan ominaisfuusiolämpöksi? 5. Missä tapauksissa siirretyn lämmön määrä on negatiivinen?
