განმარტება
ბენზოლი(ციკლოჰექსატრიენი - 1,3,5) - ორგანული ნივთიერება, მთელი რიგი არომატული ნახშირწყალბადების უმარტივესი წარმომადგენელი.
ფორმულა - C 6 H 6 (სტრუქტურული ფორმულა - სურ. 1). მოლეკულური წონა - 78, 11.
ბრინჯი. 1. ბენზოლის სტრუქტურული და სივრცითი ფორმულები.
ბენზოლის მოლეკულაში ნახშირბადის ექვსივე ატომი sp 2 ჰიბრიდულ მდგომარეობაშია. ნახშირბადის თითოეული ატომი აყალიბებს 3σ კავშირს ორ სხვა ნახშირბადის ატომთან და წყალბადის ერთ ატომთან, რომელიც მდებარეობს იმავე სიბრტყეში. ნახშირბადის ექვსი ატომი ქმნის რეგულარულ ექვსკუთხედს (ბენზოლის მოლეკულის σ-ჩონჩხი). ნახშირბადის თითოეულ ატომს აქვს ერთი არაჰიბრიდირებული p-ორბიტალი, რომელიც შეიცავს ერთ ელექტრონს. ექვსი p-ელექტრონი ქმნის ერთ π-ელექტრონულ ღრუბელს (არომატიული სისტემა), რომელიც გამოსახულია წრეში ექვსწევრიანი ციკლის შიგნით. ბენზოლისგან მიღებულ ნახშირწყალბადის რადიკალს ეწოდება C 6 H 5 - - ფენილი (Ph-).
ბენზოლის ქიმიური თვისებები
ბენზოლს ახასიათებს ჩანაცვლების რეაქციები, რომლებიც მიმდინარეობს ელექტროფილური მექანიზმის მიხედვით:
- ჰალოგენაცია (ბენზოლი ურთიერთქმედებს ქლორთან და ბრომთან კატალიზატორების თანდასწრებით - უწყლო AlCl 3, FeCl 3, AlBr 3)
C 6 H 6 + Cl 2 \u003d C 6 H 5 -Cl + HCl;
- ნიტრაცია (ბენზოლი ადვილად რეაგირებს ნიტრატირებულ ნარევთან - კონცენტრირებული აზოტის და გოგირდის მჟავების ნარევი)

- ალკილაცია ალკენებით
C 6 H 6 + CH 2 \u003d CH-CH 3 → C 6 H 5 -CH (CH 3) 2;
ბენზოლზე დამატების რეაქციები იწვევს არომატული სისტემის განადგურებას და მიმდინარეობს მხოლოდ მძიმე პირობებში:
- ჰიდროგენიზაცია (რეაქცია მიმდინარეობს გაცხელებისას, კატალიზატორი არის Pt)

- ქლორის დამატება (წარმოიქმნება ულტრაიისფერი გამოსხივების ზემოქმედებით მყარი პროდუქტის - ჰექსაქლოროციკლოჰექსანის (ჰექსაქლორანის) წარმოქმნით - C 6 H 6 Cl 6)

ნებისმიერი ორგანული ნაერთის მსგავსად, ბენზოლი შედის წვის რეაქციაში ნახშირორჟანგის და წყლის წარმოქმნით, როგორც რეაქციის პროდუქტები (იწვის კვამლის ალივით):
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O.
ბენზოლის ფიზიკური თვისებები
ბენზოლი არის უფერო სითხე, მაგრამ აქვს სპეციფიკური მკვეთრი სუნი. წყალთან ქმნის აზეოტროპულ ნარევს, კარგად ერევა ეთერებთან, ბენზინთან და სხვადასხვა ორგანულ გამხსნელებთან. დუღილის წერტილი - 80,1C, დნობის წერტილი - 5,5C. ტოქსიკური, კანცეროგენი (ანუ ხელს უწყობს კიბოს განვითარებას).
ბენზოლის მიღება და გამოყენება
ბენზოლის მიღების ძირითადი მეთოდები:
- ჰექსანის დეჰიდროციკლიზაცია (კატალიზატორები - Pt, Cr 3 O 2)
CH 3 -(CH 2) 4 -CH 3 → C 6 H 6 + 4H 2;
- ციკლოჰექსანის დეჰიდროგენაცია (რეაქცია მიმდინარეობს გაცხელებისას, კატალიზატორი არის Pt)
C 6 H 12 → C 6 H 6 + 4H 2;
- აცეტილენის ტრიმერიზაცია (რეაქცია გრძელდება 600C-მდე გაცხელებისას, კატალიზატორი არის გააქტიურებული ნახშირბადი)
3HC≡CH → C 6 H 6 .
ბენზოლი ემსახურება როგორც ნედლეულს ჰომოლოგების (ეთილბენზოლი, კუმენი), ციკლოჰექსანი, ნიტრობენზოლი, ქლორბენზოლი და სხვა ნივთიერებების წარმოებისთვის. ადრე ბენზოლს იყენებდნენ როგორც დანამატს ბენზინზე მისი ოქტანური რიცხვის გასაზრდელად, თუმცა ახლა, მაღალი ტოქსიკურობის გამო, მკაცრად რეგულირდება ბენზოლის შემცველობა საწვავში. ზოგჯერ ბენზოლი გამოიყენება გამხსნელად.
პრობლემის გადაჭრის მაგალითები
მაგალითი 1
| ვარჯიში | ჩამოწერეთ განტოლებები, რომლებითაც შეგიძლიათ განახორციელოთ შემდეგი გარდაქმნები: CH 4 → C 2 H 2 → C 6 H 6 → C 6 H 5 Cl. |
| გადაწყვეტილება | მეთანისგან აცეტილენის მისაღებად გამოიყენება შემდეგი რეაქცია: 2CH 4 → C 2 H 2 + 3H 2 (t = 1400C). აცეტილენისგან ბენზოლის მიღება შესაძლებელია აცეტილენის ტრიმერიზაციის რეაქციით, რომელიც ხდება გაცხელებისას (t = 600C) და გააქტიურებული ნახშირბადის თანდასწრებით: 3C 2 H 2 → C 6 H 6 . ბენზოლის ქლორირების რეაქცია პროდუქტის სახით ქლორბენზოლის მისაღებად ტარდება რკინის (III) ქლორიდის თანდასწრებით: C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl. |
მაგალითი 2
| ვარჯიში | 39 გ ბენზოლს რკინის (III) ქლორიდის თანდასწრებით დაემატა 1 მოლი ბრომიანი წყალი. ნივთიერების რა რაოდენობა და რამდენი გრამი რა პროდუქტები მოჰყვა ამას? |
| გადაწყვეტილება | მოდით დავწეროთ ბენზოლის ბრომირების რეაქციის განტოლება რკინის (III) ქლორიდის თანდასწრებით: C 6 H 6 + Br 2 → C 6 H 5 Br + HBr. რეაქციის პროდუქტებია ბრომბენზოლი და წყალბადის ბრომიდი. ბენზოლის მოლური მასა, გამოთვლილი D.I. ქიმიური ელემენტების ცხრილის გამოყენებით. მენდელეევი - 78 გ/მოლ. იპოვეთ ბენზოლის ნივთიერების რაოდენობა: n(C 6 H 6) = m (C 6 H 6) / M (C 6 H 6); n (C 6 H 6) = 39/78 = 0.5 მოლი. პრობლემის მდგომარეობის მიხედვით, ბენზოლი რეაგირებდა 1 მოლ ბრომთან. შესაბამისად, ბენზოლი დეფიციტურია და შემდგომი გათვლები გაკეთდება ბენზოლზე. რეაქციის განტოლების მიხედვით n (C 6 H 6): n (C 6 H 5 Br) : n (HBr) \u003d 1: 1: 1, შესაბამისად n (C 6 H 6) \u003d n (C 6 H 5 Br) \u003d: n(HBr) = 0,5 მოლი. მაშინ ბრომბენზოლის და წყალბადის ბრომიდის მასები ტოლი იქნება: m(C6H5Br) =n(C6H5Br)×M(C6H5Br); m(HBr) = n(HBr)×M(HBr). ბრომბენზოლის და წყალბადის ბრომიდის მოლური მასები, გამოთვლილი D.I. ქიმიური ელემენტების ცხრილის გამოყენებით. მენდელეევი - 157 და 81 გ/მოლი, შესაბამისად. m(C 6 H 5 Br) = 0.5×157 = 78.5 გ; m(HBr) = 0,5 x 81 = 40,5 გ. |
| უპასუხე | რეაქციის პროდუქტებია ბრომბენზოლი და წყალბადის ბრომიდი. ბრომბენზოლის და წყალბადის ბრომიდის მასებია, შესაბამისად, 78,5 და 40,5 გ. |
   |
|
| სისტემატური სახელი | ბენზოლი |
| აბრევიატურები | PhH |
| ტრადიციული სახელები | თმის საშრობი (Laurent, 1837), ფენილ წყალბადი, ბენზოლი |
| ქიმ. ფორმულა | C₆H₆ |
| სახელმწიფო | თხევადი |
| Მოლური მასა | 78,11 გ/მოლ |
| სიმკვრივე | 0,8786 გ/სმ³ |
| დინამიური სიბლანტე | 0.0652 Pa s |
| იონიზაციის ენერგია | 9,24 ± 0,01 ევ |
| თ.დნობა. | 5.5° |
| თ.კიპ. | 80.1° |
| თ რევ. | -11° |
| T. svsp. | 562° |
| და ა.შ. აფეთქება | 1.2 ± 0.1 vol% |
| ორთქლის წნევა | 75 ± 1 მმ Hg |
| წყალში ხსნადობა | 0,073 გ/100 მლ |
| GOST | GOST 5955-75 |
| რეგ. CAS ნომერი | 71-43-2 |
| PubChem | 241 |
| რეგ. EINECS ნომერი | 200-753-7 |
| იღიმება | C1=CC=CC=C1 |
| InChI | |
| RTECS | CY1400000 |
| CHEBI | 16716 |
| ChemSpider | 236 |
| ტოქსიკურობა | ტოქსიკური, აქვს კანცეროგენული და ნარკოტიკული თვისებები |
| სასიგნალო სიტყვა | სახიფათო! |
| მონაცემები მოცემულია სტანდარტული პირობებისთვის (25°, 100 კპა), თუ სხვა რამ არ არის მითითებული. | |
ქიმიური თვისებები
ბენზოლისთვის დამახასიათებელია ჩანაცვლებითი რეაქციები - ბენზოლი რეაგირებს ალკენებთან, ქლოროალკანებთან, ჰალოგენებთან, აზოტთან და გოგირდის მჟავებთან. ბენზოლის რგოლის გაყოფის რეაქციები მიმდინარეობს მძიმე პირობებში (ტემპერატურა, წნევა).
- ალკენებთან ურთიერთქმედება (ალკილაცია), რეაქციის შედეგად წარმოიქმნება ბენზოლის ჰომოლოგები, მაგალითად, ეთილბენზოლი და კუმენი:
- ქლორთან და ბრომთან ურთიერთქმედება კატალიზატორის თანდასწრებით ქლორბენზოლის წარმოქმნით (ელექტროფილური ჩანაცვლების რეაქცია):
- კატალიზატორის არარსებობის შემთხვევაში, გაცხელების ან განათებისას, რადიკალური დამატების რეაქცია ხდება ჰექსაქლოროციკლოჰექსანის იზომერების ნარევის წარმოქმნით.
- როდესაც ბენზოლი რეაგირებს ბრომთან ოლეუმის ხსნარში, წარმოიქმნება ჰექსაბრომობენზოლი:
- ურთიერთქმედება ალკანების ჰალოგენურ წარმოებულებთან (ბენზოლის ალკილაცია, ფრიდელ-კრაფტის რეაქცია) ალკილბენზოლების წარმოქმნით:

- ბენზოლის ანჰიდრიდების, კარბოქსილის მჟავას ჰალოიდების ფრიდელ-კრაფტის აცილირების რეაქცია იწვევს არომატული და ცხიმოვანი არომატული კეტონების წარმოქმნას:

6 6 + 6 5 COCl → AlCl 3 6 5 COC 6 5 + HCl
პირველ და მეორე რეაქციებში წარმოიქმნება აცეტოფენონი (მეთილფენილ კეტონი), ალუმინის ქლორიდის ჩანაცვლება ანტიმონის ქლორიდით საშუალებას იძლევა რეაქციის ტემპერატურა შემცირდეს 25 ° C-მდე. მესამე რეაქციაში წარმოიქმნება ბენზოფენონი (დიფენილ კეტონი).
- ფორმილაციის რეაქცია - ბენზოლის ურთიერთქმედება CO და HCl ნარევთან, მიმდინარეობს მაღალი წნევით და კატალიზატორის მოქმედებით, რეაქციის პროდუქტია ბენზალდეჰიდი:
- სულფონაციის და ნიტრაციის რეაქციები (ელექტროფილური ჩანაცვლება):
- ბენზოლის შემცირება წყალბადით (კატალიტიკური ჰიდროგენიზაცია):
ჟანგვის რეაქციები
ბენზოლი, მისი სტრუქტურის გამო, ძალიან მდგრადია დაჟანგვის მიმართ, მასზე გავლენას არ ახდენს, მაგალითად, კალიუმის პერმანგანატის ხსნარი. თუმცა, მალეინის ანჰიდრიდამდე დაჟანგვა შეიძლება განხორციელდეს ვანადიუმის ოქსიდის კატალიზატორის გამოყენებით:

- ოზონოლიზის რეაქცია. ასევე, ბენზოლი გადის ოზონოლიზს, მაგრამ პროცესი უფრო ნელია, ვიდრე უჯერი ნახშირწყალბადებით:

რეაქციის შედეგად წარმოიქმნება დიალდეჰიდი - გლიოქსალი (1,2-ეთანდიალი).
- წვის რეაქცია. ბენზოლის წვა არის ჟანგვის შემზღუდველი შემთხვევა. ბენზოლი ძალიან აალებადია და ჰაერში იწვის ძალიან კვამლის ალით:
სტრუქტურა
შემადგენლობით, ბენზოლი მიეკუთვნება უჯერი ნახშირწყალბადებს (ჰომოლოგური სერია ნ 2ნ−6), მაგრამ ეთილენის სერიის ნახშირწყალბადებისგან განსხვავებით, 2 4, ის ავლენს უჯერი ნახშირწყალბადების თანდაყოლილ თვისებებს (მათ ახასიათებთ დამატების რეაქციები), მხოლოდ მძიმე პირობებში, მაგრამ ბენზოლი უფრო მიდრეკილია ჩანაცვლების რეაქციებისკენ. ბენზოლის ეს „ქცევა“ აიხსნება მისი სპეციალური სტრუქტურით: ატომების არსებობა იმავე სიბრტყეში და კონიუგირებული 6π-ელექტრონული ღრუბლის არსებობა სტრუქტურაში. ბენზოლში ობლიგაციების ელექტრონული ბუნების თანამედროვე იდეა ემყარება ლინუს პაულინგის ჰიპოთეზას, რომელმაც შესთავაზა გამოესახა ბენზოლის მოლეკულა ექვსკუთხედად ჩაწერილი წრით, რითაც ხაზს უსვამს ფიქსირებული ორმაგი ბმების არარსებობას და არსებობას. ერთი ელექტრონული ღრუბელი, რომელიც ფარავს ციკლის ექვსივე ნახშირბადის ატომს.
სპეციალიზებულ და პოპულარულ ლიტერატურაში ტერმინი ბენზოლის ბეჭედი, როგორც წესი, გულისხმობს ბენზოლის ნახშირბადის სტრუქტურას ნახშირბადის ატომებთან დაკავშირებული სხვა ატომებისა და ჯგუფების გათვალისწინების გარეშე. ბენზოლის რგოლი მრავალი განსხვავებული ნაერთის ნაწილია.
წარმოება
დღეისათვის ბენზოლის წარმოების რამდენიმე ფუნდამენტურად განსხვავებული მეთოდი არსებობს.

განაცხადი

ბენზოლის ტრანსპორტირება სარკინიგზო ტრანსპორტით ხორციელდება სპეციალიზებული ცისტერნის ვაგონებით
მიღებული ბენზოლის მნიშვნელოვანი ნაწილი გამოიყენება სხვა პროდუქტების სინთეზისთვის:
- ბენზოლის დაახლოებით 50% გარდაიქმნება ეთილბენზოლად (ბენზოლის ალკილაცია ეთილენით);
- ბენზოლის დაახლოებით 25% გარდაიქმნება კუმენად (ბენზოლის ალკილაცია პროპილენით);
- ბენზოლის დაახლოებით 10-15% ჰიდროგენირებულია ციკლოჰექსანში;
- ბენზოლის დაახლოებით 10% იხარჯება ნიტრობენზოლის წარმოებაზე;
- ბენზოლის 2-3% გარდაიქმნება ხაზოვან ალკილბენზოლებად;
- ბენზოლის დაახლოებით 1% გამოიყენება ქლორობენზოლის სინთეზისთვის.
გაცილებით მცირე რაოდენობით, ბენზოლი გამოიყენება სხვა ნაერთების სინთეზისთვის. ხანდახან და უკიდურეს შემთხვევაში, მაღალი ტოქსიკურობის გამო, ბენზოლს იყენებენ გამხსნელად.
გარდა ამისა, ბენზოლი არის ბენზინის ნაწილი. 1920-იან და 1930-იან წლებში ბენზოლი დაემატა ru de პირდაპირ ბენზინს, რათა გაზარდოს მისი ოქტანური მაჩვენებელი, მაგრამ 1940-იანი წლებისთვის ასეთი ნარევები ვერ გაუწევდა კონკურენციას მაღალი ოქტანის ბენზინებს. მაღალი ტოქსიკურობის გამო საწვავში ბენზოლის შემცველობა თანამედროვე სტანდარტებით შემოიფარგლება 1%-მდე შეყვანით.
ბიოლოგიური მოქმედება და ტოქსიკოლოგია
ბენზოლი ერთ-ერთი ყველაზე გავრცელებული ანთროპოგენური ქსენობიოტიკია.
ბენზოლი ძალიან ტოქსიკურია. პერორალური მიღებისას მინიმალური ლეტალური დოზაა 15 მლ, საშუალოდ 50-70 მლ. ბენზოლის ორთქლის ხანმოკლე ინჰალაციის დროს არ ხდება დაუყოვნებელი მოწამვლა, ამიტომ ბოლო დრომდე ბენზოლთან მუშაობის პროცედურა განსაკუთრებით არ იყო რეგულირებული. დიდი დოზებით ბენზოლი იწვევს გულისრევას და თავბრუსხვევას, ზოგიერთ მძიმე შემთხვევებში კი მოწამვლა შეიძლება ფატალური იყოს. ბენზოლით მოწამვლის პირველი ნიშანი ხშირად ეიფორიაა. ბენზოლის ორთქლს შეუძლია შეაღწიოს ხელუხლებელ კანში. თხევადი ბენზოლი საკმაოდ აღიზიანებს კანს. თუ ადამიანის სხეული ექვემდებარება ბენზოლის ხანგრძლივ ზემოქმედებას მცირე რაოდენობით, შედეგები შეიძლება ასევე იყოს ძალიან სერიოზული.
ბენზოლი არის ძლიერი კანცეროგენი. კვლევები აჩვენებს ბენზოლის კავშირს ისეთ დაავადებებთან, როგორიცაა აპლასტიკური ანემია, მწვავე ლეიკემია (მიელოიდური, ლიმფობლასტური), ქრონიკული მიელოიდური ლეიკემია, მიელოდისპლასტიკური სინდრომი და ძვლის ტვინის დაავადებები.
ბენზოლის ტრანსფორმაციის მექანიზმი და მუტაგენური ეფექტი
ადამიანის ორგანიზმში ბენზოლის ტრანსფორმაციის მექანიზმის რამდენიმე ვარიანტი არსებობს. პირველ ვარიანტში ბენზოლის მოლეკულა ჰიდროქსილირებულია მიკროსომური დაჟანგვის სისტემის მიერ ციტოქრომ P450-ის მონაწილეობით. მექანიზმის მიხედვით, ბენზოლი ჯერ იჟანგება ძლიერ რეაქტიულ ეპოქსიდად, რომელიც შემდგომ გარდაიქმნება ფენოლად. გარდა ამისა, თავისუფალი რადიკალები (რეაქტიული ჟანგბადის სახეობები) წარმოიქმნება რეაქციის მიხედვით P450-ის მაღალი აქტივაციის გამო:
ბენზოლის მუტაგენეზის მოლეკულური მექანიზმი
ბენზოლი არის პრომუტაგენიმუტაგენურ თვისებებს მხოლოდ ბიოტრანსფორმაციის შემდეგ იძენს, რის შედეგადაც წარმოიქმნება მაღალრეაქტიული ნაერთები. ერთ-ერთი მათგანია ბენზოლის ეპოქსიდი. ეპოქსიდური ციკლის მაღალი კუთხური სტრესის გამო, -C-O-C- ბმები იშლება და მოლეკულა ხდება ელექტროფილი, ის ადვილად რეაგირებს ნუკლეინის მჟავას მოლეკულების, განსაკუთრებით დნმ-ის აზოტოვანი ფუძეების ნუკლეოფილურ ცენტრებთან.
ეპოქსიდური ციკლის ურთიერთქმედების მექანიზმი ნუკლეოფილურ ცენტრებთან - აზოტოვანი ფუძეების ამინო ჯგუფები (არილირების რეაქცია) მიმდინარეობს როგორც ნუკლეოფილური ჩანაცვლების რეაქცია. 2 . შედეგად, წარმოიქმნება საკმაოდ ძლიერი კოვალენტურად შეკრული დნმ-ის დანამატები, ყველაზე ხშირად ასეთი წარმოებულები შეინიშნება გუანინში (რადგან გუანინის მოლეკულას აქვს ნუკლეოფილური ცენტრების მაქსიმალური რაოდენობა), მაგალითად, N7-ფენილგუანინი. შედეგად წარმოქმნილმა დნმ-ის დანამატებმა შეიძლება გამოიწვიოს დნმ-ის მშობლიური სტრუქტურის ცვლილება, რითაც დაარღვიოს ტრანსკრიფციისა და რეპლიკაციის სწორი კურსი. რა არის გენეტიკური მუტაციების წყარო. ჰეპატოციტებში (ღვიძლის უჯრედებში) ეპოქსიდის დაგროვება იწვევს შეუქცევად შედეგებს: დნმ-ის არილირების ზრდას და ამავე დროს მუტანტის ცილების ექსპრესიის (გადაჭარბებული გამოხატვის) ზრდას, რომლებიც წარმოადგენენ გენეტიკური მუტაციის პროდუქტებს; აპოპტოზის დათრგუნვა; უჯრედების ტრანსფორმაცია და სიკვდილიც კი. გამოხატული გენოტოქსიურობისა და მუტაგენურობის გარდა, ბენზოლს აქვს ძლიერი მიელოტოქსიურობა და კანცეროგენული მოქმედება, განსაკუთრებით ეს ეფექტი ვლინდება მიელოიდური ქსოვილის უჯრედებში (ამ ქსოვილის უჯრედები ძალიან მგრძნობიარეა ქსენობიოტიკების ასეთი ეფექტების მიმართ).
ბენზოლი და ნივთიერებების ბოროტად გამოყენება
ბენზოლს აქვს გამაოგნებელი ეფექტი ადამიანზე და შეიძლება გამოიწვიოს ნარკომანია.
მწვავე მოწამვლა
ძალიან მაღალი კონცენტრაციის დროს - გონების თითქმის მყისიერი დაკარგვა და სიკვდილი რამდენიმე წუთში. სახის ფერი ციანოტურია, ლორწოვანი გარსები ხშირად ალუბლისფერია. დაბალ კონცენტრაციებში - აგზნება, ალკოჰოლის მსგავსი, შემდეგ ძილიანობა, ზოგადი სისუსტე, თავბრუსხვევა, გულისრევა, ღებინება, თავის ტკივილი, გონების დაკარგვა. ასევე შეინიშნება კუნთების კრუნჩხვები, რაც შეიძლება გადაიზარდოს მატონიზირებელ კრუნჩხვით. გუგები ხშირად გაფართოებულია და არ რეაგირებს სინათლეზე. სუნთქვა ჯერ აჩქარდება, შემდეგ ნელდება. სხეულის ტემპერატურა მკვეთრად ეცემა. პულსი აჩქარებული, პატარა შევსება. არტერიული წნევა დაქვეითებულია. დაფიქსირდა გულის მძიმე არითმიის შემთხვევები.
მძიმე მოწამვლის შემდეგ, რომელიც არ იწვევს უშუალოდ სიკვდილს, ხანდახან შეინიშნება ჯანმრთელობის ხანგრძლივი დარღვევები: პლევრიტი, ზედა სასუნთქი გზების კატარი, რქოვანას და ბადურის დაავადებები, ღვიძლის დაზიანება, გულის დარღვევები და ა.შ. ვაზომოტორული შემთხვევა. ნევროზი სახისა და კიდურების შეშუპებით, მგრძნობელობის დარღვევა და კრუნჩხვები ბენზოლის ორთქლის მწვავე მოწამვლის შემდეგ მალევე. ზოგჯერ სიკვდილი ხდება მოწამვლის შემდეგ გარკვეული პერიოდის შემდეგ.
ქრონიკული მოწამვლა
მძიმე შემთხვევებში აღინიშნება: თავის ტკივილი, უკიდურესი დაღლილობა, ქოშინი, თავბრუსხვევა, სისუსტე, ნერვიულობა, ძილიანობა ან უძილობა, საჭმლის მონელების დარღვევა, გულისრევა, ზოგჯერ ღებინება, მადის ნაკლებობა, გახშირებული შარდვა, მენსტრუაცია, მუდმივი სისხლდენა პირის ღრუს ლორწოვანიდან, განსაკუთრებით. ღრძილები, ხშირად ვითარდება და ცხვირი, გრძელდება საათობით და დღეობითაც კი. ზოგჯერ მუდმივი სისხლდენა ხდება კბილის ამოღების შემდეგ. მრავალრიცხოვანი მცირე სისხლჩაქცევები (სისხლჩაქცევები) კანში. სისხლი განავალში, საშვილოსნოს სისხლდენა, ბადურის სისხლდენა. ჩვეულებრივ, მოწამლულს საავადმყოფოში მიჰყავს სისხლდენა და ხშირად თანმხლები ცხელება (ტემპერატურა 40°-მდე და ზემოთ). ასეთ შემთხვევებში პროგნოზი ყოველთვის სერიოზულია. სიკვდილის მიზეზი ზოგჯერ მეორადი ინფექციებია: არის პერიოსტეუმის განგრენული ანთების და ყბის ნეკროზის შემთხვევები, ღრძილების მძიმე წყლულოვანი ანთება, ზოგადი სეფსისი სეპტიური ენდომეტრიტით.
ზოგჯერ მძიმე მოწამვლისას ვითარდება ნერვული დაავადებების სიმპტომები: მყესის რეფლექსების მატება, ორმხრივი კლონუსი, ბაბინსკის დადებითი სიმპტომი, ღრმა მგრძნობელობის დარღვევა, ფსევდოტაბეტური დარღვევები პარესთეზიით, ატაქსია, პარაპლეგია და მოტორული დარღვევები (დაზიანების ნიშნები ზურგის ტვინის და პირამიდული ტრაქტის უკანა სვეტები).
ყველაზე ტიპიური ცვლილებები სისხლში. ერითროციტების რაოდენობა ჩვეულებრივ მკვეთრად მცირდება, 1-2 მილიონამდე და ქვემოთ. მკვეთრად ეცემა ჰემოგლობინის შემცველობაც, ზოგჯერ 10%-მდე. ფერის ინდექსი ზოგ შემთხვევაში დაბალია, ხან ნორმასთან ახლოს, ხან კი მაღალი (განსაკუთრებით მძიმე ანემიის დროს). აღინიშნება ანისოციტოზი და პოიკილოციტოზი, ბაზოფილური პუნქცია და ბირთვული ერითროციტების გამოჩენა, რეტიკულოციტების რაოდენობისა და ერითროციტების მოცულობის ზრდა. უფრო დამახასიათებელია ლეიკოციტების რაოდენობის მკვეთრი შემცირება. ზოგჯერ თავდაპირველად ლეიკოციტოზი, სწრაფად იცვლება ლეიკოპენია, ESR-ის დაჩქარება. სისხლში ცვლილებები ერთდროულად არ ვითარდება. ყველაზე ხშირად ლეიკოპოეზური სისტემა უფრო ადრე ზიანდება, მოგვიანებით უერთდება თრომბოციტოპენია. ერითრობლასტური ფუნქციის დამარცხება ხშირად გვიანაც კი ხდება. მომავალში შესაძლოა განვითარდეს მძიმე მოწამვლის დამახასიათებელი სურათი - აპლასტიკური ანემია.
მოწამვლის ეფექტი შეიძლება გაგრძელდეს და პროგრესირებდეს ბენზოლთან მუშაობის შეწყვეტიდან თვეების და წლების შემდეგ.
პირველი დახმარება მოწამვლისა და მკურნალობისთვის
ბენზოლით (ბენზოლის ორთქლით) მწვავე მოწამვლისას დაზარალებული ჯერ სუფთა ჰაერზე უნდა გაიყვანონ, სუნთქვის გაჩერების შემთხვევაში ტარდება ხელოვნური სუნთქვა ნორმალიზებამდე, სუნთქვის სტიმულატორებად გამოიყენება ჟანგბადი და ლობელინი. სასტიკად აკრძალულია ადრენალინის, როგორც ანალეფსიის გამოყენება! თუ ღებინება მოხდა ინტრავენურად გლუკოზის 40%-იანი ხსნარი, სისხლის მიმოქცევის დარღვევის შემთხვევაში - კოფეინის ხსნარის ინექცია. თუ მოწამვლა მოხდა პერორალურად და ბენზოლი მოხვდა კუჭში, აუცილებელია მცენარეული ზეთით ჩამოიბანოთ (ბენზოლი კარგად შეიწოვება), პროცედურა უნდა ჩატარდეს სიფრთხილით, რადგან შესაძლებელია ასპირაცია. მსუბუქი მოწამვლისას პაციენტს უჩვენებენ დასვენებას. აღგზნებულ მდგომარეობებში საჭიროა სედატიური საშუალებები. ანემიის დროს ტარდება სისხლის გადასხმა, ვიტამინი B12, ფოლიუმის მჟავა, ლეიკოპენიის დროს - ვიტამინი B6, პენტოქსილი. იმუნიტეტის დაქვეითების შემთხვევაში (იმუნოდეფიციტის მდგომარეობა) – იმუნოსტიმულატორები.
ბენზოლის მოქმედება ბიომემბრანებზე
ბიოლოგიური გარსები არის სუპრამოლეკულური სტრუქტურები - ორმაგი ლიპიდური ფენა, რომელშიც ინტეგრირებულია (ჩანერგილი) ან მიმაგრებულია ცილების, პოლისაქარიდების მოლეკულების ზედაპირზე. ლიპიდები, რომლებიც ქმნიან ბიომემბრანებს, თავიანთი ბუნებით ამფიფილური (ამოფილური) ნაერთებია, ანუ შეუძლიათ დაითხოვონ როგორც პოლარულ, ისე არაპოლარულ ნივთიერებებში, მათში პოლარული ჯგუფების არსებობის გამო, ე.წ. "თავი"(კარბოქსილის -COOH, ჰიდროქსილ -OH, ამინოჯგუფები -NH 2 და სხვა) და არაპოლარული ე.წ. "კუდები"(ნახშირწყალბადის რადიკალები - ალკილები, არილები, პოლიციკლური სტრუქტურები, როგორიცაა ქოლესტანი და სხვა).
ბენზოლი არის ბიოლოგიური მემბრანების ეფექტური გამხსნელი, ის სწრაფად ხსნის არაპოლარულ ჯგუფებს (ე.წ. ნახშირწყალბადები. "კუდები") ლიპიდები, ძირითადად ქოლესტერინი, რომელიც გარსების ნაწილია. ხსნადიზაციის პროცესი შემოიფარგლება ბენზოლის კონცენტრაციით, რაც მეტია, მით უფრო სწრაფად მიმდინარეობს ეს პროცესი. ხსნადობის პროცესში გამოიყოფა ენერგია, ფაქტიურად არღვევს ორმაგ ლიპიდურ ფენას (ლიპიდური ორშერი), რაც იწვევს მემბრანის სრულ განადგურებას (სტრუქტურის განადგურებას) და შემდგომ უჯრედის აპოპტოზს (ბიომემბრანების განადგურების დროს მემბრანის რეცეპტორები აქტიურდება (მაგ. როგორც: CD95, TNFR1, DR3, DR4 და სხვა), რომლებიც ააქტიურებენ უჯრედის აპოპტოზს).
მოქმედება კანზე
ბენზოლთან ხელების ხშირი შეხებისას აღინიშნება კანის სიმშრალე, ბზარები, ქავილი, სიწითლე (ჩვეულებრივ თითებს შორის), შეშუპება, ფეტვის მსგავსი ბუშტუკოვანი გამონაყარი. ზოგჯერ კანის დაზიანებების გამო მუშები იძულებულნი არიან დატოვონ სამსახური.
მაქსიმალური დასაშვები კონცენტრაციაა 5 მგ/მ 3.
უსაფრთხოება
ბენზოლთან მუშაობა შეიცავს მოწამვლისა და ჯანმრთელობის სერიოზულ პრობლემებს. ბენზოლი არის უაღრესად აქროლადი სითხე (არასტაბილურობა 320 მგ/ლ 20 ° C ტემპერატურაზე) აალებადი მაღალი ხარისხით, ამიტომ მასთან მუშაობისას აუცილებელია უსაფრთხოების ზომების დაცვა აალებადი სითხეებთან მუშაობისას. ბენზოლის ორთქლი დიდი საფრთხის შემცველია, რადგან მათ შეუძლიათ ჰაერთან ფეთქებადი ნარევების შექმნა. ამჟამად, ბენზოლის, როგორც ორგანული გამხსნელის გამოყენება მკაცრად შეზღუდულია მისი ორთქლის ტოქსიკურობისა და კანცეროგენული ზემოქმედებისა და კანზე უარყოფითი ზემოქმედების გამო. ლაბორატორიებში ბენზოლთან მუშაობა ასევე ითვალისწინებს მის შეზღუდვას (მკაცრად რეგლამენტირებულს). ბენზოლის გამოყენება რეკომენდებულია ექსპერიმენტებში მხოლოდ მცირე მოცულობებში (არაუმეტეს 50 მლ), სამუშაო უნდა ჩატარდეს ექსკლუზიურად ფტორ-რეზინის ხელთათმანებით (ლატექსი იხსნება და შეშუპებულია ბენზოლის ზემოქმედებისას).
- შეინახეთ სითბოს წყაროებთან, ღია ცეცხლთან, ძლიერ ჟანგვის აგენტებთან, საკვებ პროდუქტებთან და ა.შ.
- დატოვე ბენზოლის შემცველი კონტეინერები ღია, მოწევა,
- გამოიყენეთ ბენზოლის კონტეინერები საკვების გამოყენებისთვის, ხელების დასაბანად, ჭურჭლის,
- მუშაობა დახურულ, ცუდად ვენტილირებადი ოთახში, ჰაერის ტემპერატურა 30 ° C-ზე მეტი,
- დიდი მოცულობის ნივთიერების გამოყენება გამხსნელად,
- მუშაობა ხელების, თვალების და სასუნთქი ორგანოების კანის დამცავი აღჭურვილობის გარეშე.
ეკოლოგია
ბენზოლი არის ეკოლოგიურად სახიფათო ნივთიერება, ანთროპოგენური წარმოშობის ტოქსიკური. ბენზოლის ძირითადი წყარო, რომელიც შედის გარემოში ჩამდინარე წყლებით ან ჰაერის გამონაბოლქვით, არის ნავთობქიმიური და კოქსის მრეწველობა, საწვავის წარმოება და ტრანსპორტი. რეზერვუარებიდან ბენზოლი ადვილად აორთქლდება, შეუძლია ნიადაგიდან მცენარეებად გარდაქმნა, რაც სერიოზულ საფრთხეს უქმნის ეკოსისტემებს.
ბენზოლს აქვს კუმულაციის თვისება, მისი ლიპოფილურობის გამო, მას შეუძლია შეიტანოს ცხოველთა ცხიმოვანი ქსოვილის უჯრედებში, რითაც მოწამვლა მათ.
ფიზიკური თვისებები
ბენზოლი და მისი უახლოესი ჰომოლოგები არის უფერო სითხეები სპეციფიკური სუნით. არომატული ნახშირწყალბადები წყალზე მსუბუქია და მასში არ იხსნება, თუმცა ადვილად იხსნება ორგანულ გამხსნელებში - ალკოჰოლში, ეთერში, აცეტონში.
ბენზოლი და მისი ჰომოლოგები თავად არიან კარგი გამხსნელები მრავალი ორგანული ნივთიერებისთვის. ყველა არენა იწვის კვამლის ალით მათი მოლეკულების ნახშირბადის მაღალი შემცველობის გამო.
ზოგიერთი არენის ფიზიკური თვისებები წარმოდგენილია ცხრილში.
მაგიდა. ზოგიერთი არენის ფიზიკური თვისებები
|
სახელი |
ფორმულა |
t°.pl., |
t°.bp., |
|
ბენზოლი |
C 6 H 6 |
5,5 |
80,1 |
|
ტოლუენი (მეთილბენზოლი) |
C 6 H 5 CH 3 |
95,0 |
110,6 |
|
ეთილბენზოლი |
C 6 H 5 C 2 H 5 |
95,0 |
136,2 |
|
ქსილენი (დიმეთილბენზოლი) |
C 6 H 4 (CH 3) 2 |
||
|
ორთო- |
25,18 |
144,41 |
|
|
მეტა- |
47,87 |
139,10 |
|
|
წყვილი - |
13,26 |
138,35 |
|
|
პროპილბენზოლი |
C 6 H 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
კუმენი (იზოპროპილბენზოლი) |
C 6 H 5 CH (CH 3) 2 |
96,0 |
152,39 |
|
სტირონი (ვინილბენზოლი) |
C 6 H 5 CH \u003d CH 2 |
30,6 |
145,2 |
ბენზოლი - დაბალი დუღილის ( ტკიპ= 80,1°C), უფერო სითხე, წყალში უხსნადი
ყურადღება! ბენზოლი - შხამი, მოქმედებს თირკმელებზე, ცვლის სისხლის ფორმულას (ხანგრძლივი ზემოქმედებით), შეუძლია დაარღვიოს ქრომოსომების სტრუქტურა.
არომატული ნახშირწყალბადების უმეტესობა სიცოცხლისათვის საშიში და ტოქსიკურია.
არენების მიღება (ბენზოლი და მისი ჰომოლოგები)
ლაბორატორიაში
1. ბენზოის მჟავას მარილების შერწყმა მყარ ტუტეებთან
C 6 H 5 -COONa + NaOH t → C 6 H 6 + Na 2 CO 3
ნატრიუმის ბენზოატი
2. ვურც-ფიტინგის რეაქცია: (აქ G არის ჰალოგენი)
6-დანჰ 5 -G+2ნა + რ-G →C 6 ჰ 5 - რ + 2 ნაგ
თან 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
ინდუსტრიაში
- ნავთობისა და ნახშირისგან იზოლირებული ფრაქციული დისტილაციით, რეფორმირება;
- ქვანახშირის ტარიდან და კოქსის ღუმელის გაზიდან
1. ალკანების დეჰიდროციკლიზაცია 6-ზე მეტი ნახშირბადის ატომით:
C 6 H 14 ტ , კატ→C 6 H 6 + 4H 2
2. აცეტილენის ტრიმერიზაცია(მხოლოდ ბენზოლისთვის) - რ. ზელინსკი:
3С 2 H2 600°C, აქტი. ქვანახშირი→C 6 H 6
3. დეჰიდროგენაციაციკლოჰექსანი და მისი ჰომოლოგები:
საბჭოთა აკადემიკოსმა ნიკოლაი დიმიტრიევიჩ ზელინსკიმ დაადგინა, რომ ბენზოლი წარმოიქმნება ციკლოჰექსანისგან (ციკლოალკანების დეჰიდროგენაცია).
C 6 H 12 ტ, კატა→C 6 H 6 + 3H 2

C 6 H 11 -CH 3 ტ , კატ→C 6 H 5 -CH 3 + 3H 2
მეთილციკლოჰექსანტოლუენი
4. ბენზოლის ალკილაცია(ბენზოლის ჰომოლოგების მიღება) – r Friedel-Crafts.
C 6 H 6 + C 2 H 5 -Cl t, AlCl3→C 6 H 5 -C 2 H 5 + HCl
ქლოროეთანი ეთილბენზოლი

არენების ქიმიური თვისებები
მე. ოქსიდაციის რეაქციები
1. წვა (კვამლის ალი):
2C 6 H 6 + 15O 2 ტ→12CO 2 + 6H 2 O + Q
2. ბენზოლი ნორმალურ პირობებში არ აფერხებს ბრომიან წყალს და კალიუმის პერმანგანატის წყალხსნარს.
3. ბენზოლის ჰომოლოგები იჟანგება კალიუმის პერმანგანატით (კალიუმის პერმანგანატის ფერის შეცვლა):
ა) მჟავე გარემოში ბენზოის მჟავამდე
კალიუმის პერმანგანატის და სხვა ძლიერი ოქსიდანტების ზემოქმედებით ბენზოლის ჰომოლოგებზე, გვერდითი ჯაჭვები იჟანგება. რაც არ უნდა რთული იყოს შემცვლელის ჯაჭვი, ის ნადგურდება, გარდა -ნახშირბადის ატომისა, რომელიც იჟანგება კარბოქსილის ჯგუფად.
ბენზოლის ჰომოლოგები ერთი გვერდითი ჯაჭვით იძლევა ბენზოის მჟავას:
ორ გვერდითი ჯაჭვის შემცველი ჰომოლოგები იძლევა ორფუძიან მჟავებს:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 + 28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 + 14H 2 O
გამარტივებული :
C 6 H 5 -CH 3 + 3O KMnO4→C 6 H 5 COOH + H 2 O
ბ) ნეიტრალურ და ოდნავ ტუტე ბენზოის მჟავას მარილების მიმართ
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K OH + 2MnO 2 + H 2 O
II. დანამატის რეაქციები (უფრო მძიმე ვიდრე ალკენები)
1. ჰალოგენაცია
C 6 H 6 + 3Cl 2 თ ν → C 6 H 6 Cl 6 (ჰექსაქლოროციკლოჰექსანი - ჰექსაქლორანი)
2. ჰიდროგენიზაცია
C 6 H 6 + 3H 2 ტ , პტანნი→C 6 H 12 (ციკლოჰექსანი)
3. პოლიმერიზაცია
III. ჩანაცვლების რეაქციები - იონური მექანიზმი (უფრო მსუბუქი ვიდრე ალკანები)
1. ჰალოგენაცია -
ა ) ბენზოლი
C 6 H 6 + Cl 2 AlCl 3 → C 6 H 5 -Cl + HCl (ქლორბენზოლი)
C 6 H 6 + 6Cl 2 t,AlCl3→C 6 Cl 6 + 6HCl( ჰექსაქლორბენზოლი)
C 6 H 6 + Br 2 t, FeCl3→ C 6 H 5 -Br + HBr( ბრომბენზოლი)
ბ) ბენზოლის ჰომოლოგები დასხივების ან გაცხელებისას
ქიმიური თვისებების მიხედვით, ალკილის რადიკალები ალკანების მსგავსია. წყალბადის ატომები მათში თავისუფალი რადიკალების მექანიზმით იცვლება ჰალოგენებით. ამრიგად, კატალიზატორის არარსებობის შემთხვევაში, გათბობა ან ულტრაიისფერი გამოსხივება იწვევს რადიკალურ ჩანაცვლების რეაქციას გვერდითი ჯაჭვში. ბენზოლის რგოლის გავლენა ალკილის შემცვლელებზე იწვევს იმ ფაქტს, რომ წყალბადის ატომი ყოველთვის იცვლება ნახშირბადის ატომში, რომელიც პირდაპირ არის დაკავშირებული ბენზოლის რგოლთან (ა-ნახშირბადის ატომი).
1) C 6 H 5 -CH 3 + Cl 2 თ ν → C 6 H 5 -CH 2 -Cl + HCl
გ) ბენზოლის ჰომოლოგები კატალიზატორის თანდასწრებით
C 6 H 5 -CH 3 + Cl 2 AlCl 3 → (ორტას ნაზავი, წარმოებულების წყვილი) +HCl
2. ნიტრაცია (აზოტის მჟავით)
C 6 H 6 + HO-NO 2 t, H2SO4→C 6 H 5 -NO 2 + H 2 O
ნიტრობენზოლი - სუნი ნუშის!
C 6 H 5 -CH 3 + 3HO-NO 2 t, H2SO4→ თან H 3 -C 6 H 2 (NO 2) 3 + 3H 2 O2,4,6-ტრინიტროტოლუენი (ტოლი, ტროტილი)
ბენზოლის და მისი ჰომოლოგების გამოყენება
ბენზოლი C 6 H 6 არის კარგი გამხსნელი. ბენზოლი, როგორც დანამატი აუმჯობესებს საავტომობილო საწვავის ხარისხს. ის ემსახურება როგორც ნედლეულს მრავალი არომატული ორგანული ნაერთების - ნიტრობენზოლი C 6 H 5 NO 2 (მისგან მიიღება გამხსნელი, ანილინი), ქლორობენზოლი C 6 H 5 Cl, ფენოლი C 6 H 5 OH, სტირონი და სხვ.
ტოლუენი C 6 H 5 -CH 3 - გამხსნელი, რომელიც გამოიყენება საღებავების, ნარკოტიკების და ასაფეთქებელი ნივთიერებების წარმოებაში (ტროტილი (ტოლი), ან 2,4,6-ტრინიტროტოლუენი TNT).
ქსილენი C 6 H 4 (CH 3) 2 . ტექნიკური ქსილენი არის სამი იზომერის ნარევი ( ორთო-, მეტა- და წყვილი-ქსილენები) - გამოიყენება როგორც გამხსნელი და საწყისი პროდუქტი მრავალი ორგანული ნაერთის სინთეზისთვის.
იზოპროპილბენზოლი C 6 H 5 -CH (CH 3) 2 ემსახურება ფენოლისა და აცეტონის მიღებას.
ბენზოლის ქლორის წარმოებულებიგამოიყენება მცენარეთა დაცვისთვის. ამრიგად, H ატომების ბენზოლში ქლორის ატომებით ჩანაცვლების პროდუქტი არის ჰექსაქლორბენზოლი C 6 Cl 6 - ფუნგიციდი; გამოიყენება ხორბლისა და ჭვავის მშრალი თესლების მოსამზადებლად მყარი ნაღვლის წინააღმდეგ. ბენზოლში ქლორის დამატების პროდუქტია ჰექსაქლოროციკლოჰექსანი (ჰექსაქლორანი) C 6 H 6 Cl 6 - ინსექტიციდი; იგი გამოიყენება მავნე მწერების გასაკონტროლებლად. ეს ნივთიერებები ეხება პესტიციდებს - მიკროორგანიზმებთან, მცენარეებთან და ცხოველებთან ბრძოლის ქიმიურ საშუალებებს.
სტირონი C 6 H 5 - CH \u003d CH 2 პოლიმერირდება ძალიან მარტივად, წარმოქმნის პოლისტიროლს და კოპოლიმერირდება ბუტადიენით - სტირონო-ბუტადიენის რეზინებით.
ვიდეო გამოცდილება
PRTSVSH (F) FGBOU VPO
სახანძრო უსაფრთხოების დეპარტამენტი
ტესტი
დისციპლინაში "წვის და აფეთქებების თეორია"
დავალება ნომერი 1
განსაზღვრეთ ბენზოლის ორთქლის სრული წვისთვის საჭირო ჰაერის სპეციფიკური თეორიული რაოდენობა და მოცულობა. პირობები, რომელშიც ჰაერი მდებარეობს, ხასიათდება ტემპერატურით Tv და წნევით Pv, ხოლო ბენზოლის ორთქლი - ტემპერატურა Tg და წნევა Pg. გამოთვალეთ გამოთვლის შედეგები შემდეგი ერთეულებით: ; ;;;
საწყისი მონაცემები (N - ჯგუფის ნომერი, n - ნომერი მოსწავლეთა სიის მიხედვით:
TV=300+(-1) N *2*N-(-1) n *0.2*n= 277.6 K
Pv \u003d? 10 3 \u003d 95900 Pa;
Тg=300?(?1) N?2?N?(?1) n?0.2?n= 321.6 K;
Pr \u003d? 10 3 \u003d 79400 Pa.
С6Н6+7.5О2+7.5?3.76N2=6CO2+3pO+7.5?3.76N2+Qp (1),
სადაც Qp არის ქიმიური რეაქციის სითბო. ამ განტოლებიდან შესაძლებელია ბენზოლისა და მოლეკულური ჟანგბადის სტოქიომეტრიული კოეფიციენტების დადგენა: Vg = 1, V0 = 7,5
2. ჰაერის სპეციფიკური თეორიული რაოდენობა - ჰაერის კილომოლთა რაოდენობა, რომელიც აუცილებელია ერთი კილომოლი ბენზოლის სრული წვისთვის, გამოითვლება ფორმულით:
სადაც 4.76 არის ჰაერის რაოდენობა, რომელიც შეიცავს ჟანგბადის ერთეულს, \u003d არის მოლეკულური ჟანგბადის (Vo) და ბენზოლის (Vg) სტექიომეტრიული კოეფიციენტების თანაფარდობა.
Vo და Vg მნიშვნელობების (დ) ჩანაცვლებით, მივიღებთ:
3. ერთი კილომოლი ბენზოლის სრული წვისთვის საჭირო ჰაერის მოცულობა განისაზღვრება შემდეგნაირად:
სად არის ერთი კილომოლი ჰაერის მოცულობა Tv ტემპერატურაზე და წნევა Pv. ღირებულება გამოითვლება ფორმულის გამოყენებით
სადაც 22.4 არის გაზის მოლური მოცულობა ნორმალურ პირობებში, Po = 101325 Pa არის ნორმალური წნევა, To = 273 K არის ნორმალური ტემპერატურა.
Tv, To, Pv, Po ჩანაცვლებით (5) ვიღებთ
ჰაერის სპეციფიკური თეორიული მოცულობა გამოითვლება ფორმულით (4):
4. აირისებრი საწვავის ერთეული მოცულობის სრული წვისთვის საჭირო ჰაერის მოცულობა განისაზღვრება შემდეგნაირად:
სად არის ერთი კილომოლი საწვავის მოცულობა - ბენზოლის ორთქლი ტემპერატურაზე Tg და წნევა Pg. Იმის გათვალისწინებით, რომ
და (8) და (5) (7) ჩანაცვლებით, მივიღებთ შემდეგ გამოხატულებას ჰაერის სპეციფიკური თეორიული მოცულობისთვის:
ჩვენ ვიანგარიშებთ წვის პროცესის ამ პარამეტრის მნიშვნელობას:
ერთი კილოგრამი ბენზოლის სრული წვისთვის საჭირო ჰაერის მოცულობა განისაზღვრება შემდეგნაირად:
სადაც - საწვავის მოლური მასა არის ბენზოლის ერთი კილომოლის მასა, გამოხატული კილოგრამებში. ბენზოლის მოლური მასა რიცხობრივად მისი მოლეკულური წონის ტოლია ფორმულით:
Ac?nc + An?nn, UiAi?ni (11)
სადაც Ac და An არის ნახშირბადის და წყალბადის ატომური წონა, nc და nn არის ნახშირბადის ატომების რაოდენობა ბენზოლის მოლეკულაში. Ac = 12, nc = 6, An = 1, nn = 6 მნიშვნელობების ჩანაცვლებით, მივიღებთ:
ჩვენ ვპოულობთ ჰაერის სპეციფიკურ თეორიულ მოცულობას n-ის მნიშვნელობების ჩანაცვლებით და ფორმულაში (10):
გაანგარიშების შედეგი:
დავალება ნომერი 2
განსაზღვრეთ ბენზოლის წვის პროდუქტების სპეციფიკური თეორიული რაოდენობა, მოცულობა და შემადგენლობა, თუ ცნობილია ჭარბი ჰაერის კოეფიციენტი c, ტემპერატურა Tp და წვის პროდუქტების წნევა Pp, ტემპერატურა Tg და ბენზოლის ორთქლის წნევა Pg. გამოთვალეთ გამოთვლის შედეგები მოლური წილადებით (პროცენტებში) და შემდეგ ერთეულებში: ; ;;
საწყისი მონაცემები:
c=1.5+(?1) N?0.1?N?(?1) n?0.01?n = 0.2;
Rp \u003d? 10 3 \u003d 68400 Pa;
Tp=1600?(?1) N?20?N?(?1) n?2?n = 1816 K;
Тg=273?(?1) N?2?N+(?1) n?0.2?n = 295.4 K;
Rg \u003d? 10 3 \u003d 111600 Pa;
ხსნარი (N=11, n=2).
1. ვწერთ სტოქიომეტრულ განტოლებას ჰაერში ბენზოლის წვის რეაქციისთვის:
C 6 H 6 +7.5O 2 +7.5? 3.76N 2 \u003d 6CO 2 + 3H 2 O + 7.5? 3.76N 2 + Qp, (1)
სადაც Qp არის ქიმიური რეაქციის სითბო. ამ განტოლებიდან ჩვენ ვადგენთ შემდეგ სტექიომეტრულ კოეფიციენტებს:
V CO2 \u003d 6, V pO \u003d 3, V C6H6 \u003d 1, V O2 \u003d 7.5, V N2 \u003d 7.5? 3.76
2. დაადგინეთ ერთი კილომოლი საწვავის წვის პროდუქტების სავარაუდო რაოდენობა:
წვის პროდუქტებისა და საწვავის სტოქიომეტრიული კოეფიციენტების (2) მნიშვნელობების ჩანაცვლებით, მივიღებთ:
3. ჰაერის სპეციფიკური თეორიული რაოდენობა - ერთი კილომოლი საწვავის სრული წვისთვის საჭირო კილომოლ ჰაერის რაოდენობას, ვადგენთ ფორმულის გამოყენებით:
სადაც 4.76 არის ჰაერის რაოდენობა, რომელიც შეიცავს ჟანგბადის ერთეულს,
მოლეკულური ჟანგბადისა და ბენზოლის სტოქიომეტრიული კოეფიციენტების თანაფარდობა.
(4) V O2 =7.5 და V C6H6 =1 მნიშვნელობების ჩანაცვლებით, მივიღებთ:
4. ჰაერის ჭარბი რაოდენობა, რომელიც მოდის 1 კმოლ საწვავზე, განისაზღვრება გამოთქმით:
ბენზოლის ორთქლის წვის ჰაერი
ამ გამოსახულებაში მნიშვნელობების ჩანაცვლება
37,7(0,2-1)=30,16(7)
5. წვის პროდუქტების ჯამური რაოდენობა საწვავის ნივთიერების ერთეულ რაოდენობაზე განისაზღვრება ჯამით:
მნიშვნელობების ჩანაცვლების შემდეგ მივიღებთ:
6. წვის პროდუქტების მოლური ფრაქციები, გამოხატული პროცენტულად, განისაზღვრება შემდეგნაირად:
ფორმულებში (9) წვის პროდუქტებში აზოტისა და ჟანგბადის მოლური ფრაქციებისთვის, 0,79 და 0,21 არის ამ ნივთიერებების მოლური ფრაქციები ჰაერში, რომელთა ჭარბი რაოდენობა იწვევს აზოტის პროპორციის ზრდას და ჟანგბადის გამოჩენას. წვის პროდუქტებში.
7. წვის კონკრეტული მოცულობებისა და პროდუქტების დასადგენად საჭიროა მათი მოლური მოცულობის გამოთვლა - ერთი კილომოლი აირის მოცულობა იმ პირობებში, რომელშიც პროდუქცია მდებარეობს:
სადაც 22.4 არის ერთი კილომოლი გაზის მოცულობა ნორმალურ პირობებში, T 0 \u003d 273K - ნორმალური ტემპერატურა, Po \u003d 101325 Pa - ნორმალური წნევა.
თუ შევცვლით (10) მნიშვნელობებს, Po, To, მივიღებთ:
პროდუქციის მოცულობა, რომელიც წარმოიქმნება ერთი კილოგრამი საწვავის წვის დროს, ზედმეტი ჰაერის გამოკლებით, გამოითვლება შემდეგნაირად:
სადაც - საწვავის მოლური მასა არის ბენზოლის ერთი კილომოლის მასა, გამოხატული კილოგრამებში. ბენზოლის მოლური მასა გვხვდება ფორმულით:
სადაც Ac და An არის ნახშირბადის (12) და წყალბადის (1) ატომური წონა, nc და n n არის ნახშირბადის (6) და წყალბადის (6) ატომების რიცხვი ბენზოლის მოლეკულებში (C 6 H 6).
მნიშვნელობების ჩანაცვლება და (12)-ში ვიღებთ
ჰაერის ჭარბი მოცულობა 1 კილოგრამ საწვავზე განისაზღვრება შემდეგნაირად:
სად არის ერთი კილომოლის ჭარბი ჰაერის მოცულობა, რომელიც წვის პროდუქტების ნაწილია. ვინაიდან ჭარბი ჰაერის ტემპერატურა და წნევა შეესაბამება წვის პროდუქტების ტემპერატურასა და წნევას, მაშინ = = 220.7.
ამ მნიშვნელობის ჩანაცვლებით, ისევე როგორც (14), ვიღებთ:
საწვავის სრული წვის პროდუქტების სპეციფიკური მოცულობის გამოსათვლელად, ჩვენ ვვარაუდობთ, რომ ბენზოლის ორთქლს აქვს ტემპერატურა Tg წნევაზე:
სად არის ერთი კილომოლი ბენზოლის ორთქლის მოცულობა Tg ტემპერატურაზე და წნევა Pg. საწვავის მოლური მოცულობა გამოითვლება ფორმულით:
მიღებული მნიშვნელობის ჩანაცვლებით და ასეთი მნიშვნელობებით (17), ვიღებთ:
ჰაერის ჭარბი მოცულობა ბენზოლის ორთქლის კუბურ მეტრზე განისაზღვრება შემდეგნაირად:
ჩანაცვლება (20) მნიშვნელობებში \u003d 30.16, \u003d და
იძლევა შემდეგ შედეგს:
წვის პროდუქტების მთლიანი სპეციფიკური მოცულობა, ჭარბი ჰაერის გათვალისწინებით, განისაზღვრება ჯამით
გაანგარიშების შედეგი:
X CO2 \u003d%; X H2O \u003d 4.4%; X N2 =%; X O2 \u003d 11.7%
მსგავსი დოკუმენტები
ნიტრობენზოლის C6H5NO2 და ნახშირბადის დისულფიდის CS2 წვადობის კოეფიციენტის გამოთვლა. ჰაერში პროპილაცეტატის წვის რეაქციის განტოლება. ჰაერისა და წვის პროდუქტების მოცულობის გაანგარიშება წვადი აირის წვის დროს. ტოლუოლის აალების წერტილის განსაზღვრა ვ.ბლინოვის ფორმულის მიხედვით.
ტესტი, დამატებულია 04/08/2017
ნივთიერების წვის დროს წარმოქმნილი ჰაერისა და წვის პროდუქტების მოცულობის გაანგარიშება. ჰაერში ეთილენგლიკოლის წვის რეაქციის განტოლება. წვადი აირების ნარევის წვა. ადიაბატური წვის ტემპერატურის გაანგარიშება სტექიომეტრული ნარევისთვის. პროპანოლის წვა.
ტესტი, დამატებულია 17/10/2012
წვის ტიპი და მისი ძირითადი პარამეტრები. საწვავის და ოქსიდანტის ქიმიური გარდაქმნა წვის პროდუქტად. წვის რეაქციის მატერიალური და თერმული ბალანსის განტოლებები. ჭარბი ჰაერის კოეფიციენტის გავლენა წვის პროდუქტების შემადგენლობაზე და წვის ტემპერატურაზე.
ტესტი, დამატებულია 01/17/2013
წვადი ნივთიერების ერთეული მასის სრული წვისთვის საჭირო ჰაერის მოცულობის განსაზღვრა. წვადი ნივთიერების ერთეული მასის წვის პროდუქტების შემადგენლობა. აირის, ორთქლის, მტვერ-ჰაერის ნარევების ალი გავრცელების საზღვრები. ფეთქებადი დაშლის წნევა.
ნაშრომი, დამატებულია 23.12.2013
ხანძრისა და აფეთქების თავიდან აცილების ღონისძიებების შემუშავება, მათი განვითარებისა და ჩახშობის პირობების შეფასება. დამწვრობის სიჩქარის ცნება, მისი განსაზღვრის მეთოდი. წვის რეაქციის განტოლების შედგენის პროცედურა. აალებადი ჰაერის მოცულობის გაანგარიშება.
საკურსო ნაშრომი, დამატებულია 07/10/2014
გაზის სრული წვის პროდუქტების შემადგენლობის განსაზღვრა. აირის ნარევის ადიაბატური წვის ტემპერატურის გაანგარიშება მუდმივ მოცულობაზე და მუდმივ წნევაზე. ბუნებრივი აირის თვითანთების კინეტიკური რეაქციის მუდმივები. გაზის ნარევის აალების ლიმიტი.
ნაშრომი, დამატებულია 19.02.2014
ბენზოლის პროპილენით ალკილირების სამრეწველო მეთოდების დახასიათება. ბენზოლის ოლეფინებით ალკილაციის პრინციპები ქიმიურ ტექნოლოგიაში. ბენზოლის ალკილირების ტექნოლოგიური დანადგარების დაპროექტების პრობლემები. წარმოების პროცესის ტექნოლოგიის აღწერა.
დისერტაცია, დამატებულია 15/11/2010
წვა არის ძლიერი დაჟანგვის პროცესი. წვის სახეები: დნება და წვა ალივით. აფეთქება, როგორც წვის განსაკუთრებული შემთხვევა. ცეცხლის ელექტრული თვისებები. წვის პროდუქტების მრავალფეროვნება საწვავის არასრული წვის შედეგად. კვამლის ფილტრაცია წყლის მეშვეობით.
სამეცნიერო ნაშრომი, დამატებულია 29.07.2009წ
პროპანის მოცემული რაოდენობის სრული წვისთვის საჭირო ჰაერის მოცულობის განსაზღვრა. ენთალპიის, ენტროპიისა და გიბსის ენერგიის ცვლილების გამოთვლა ჰესის კანონის შედეგების გამოყენებით. ჟანგვის და აღმდგენი აგენტის მოლური მასის ეკვივალენტების განსაზღვრა.
ტესტი, დამატებულია 02/08/2012
შთამნთქმელი ზეთის მოხმარების განსაზღვრის მეთოდები, შთამნთქმელ ზეთში ბენზოლის კონცენტრაცია, რომელიც ტოვებს შთამნთქმელს. შეფუთული შთანთქმის დიამეტრისა და სიმაღლის გაანგარიშება. სვეტის კუბში საჭირო გათბობის ზედაპირის განსაზღვრა და გათბობის ორთქლის მოხმარება.
რეაქციების პირველი ჯგუფი არის ჩანაცვლების რეაქციები. ჩვენ ვთქვით, რომ არენებს არ აქვთ მრავალჯერადი ბმა მოლეკულურ სტრუქტურაში, მაგრამ შეიცავს ექვსი ელექტრონის კონიუგირებულ სისტემას, რომელიც ძალიან სტაბილურია და დამატებით ძალას ანიჭებს ბენზოლის რგოლს. ამრიგად, ქიმიურ რეაქციებში, პირველ რიგში, ხდება წყალბადის ატომების ჩანაცვლება და არა ბენზოლის რგოლის განადგურება.
ალკანებზე საუბრისას უკვე შევხვდით ჩანაცვლების რეაქციებს, მაგრამ მათთვის ეს რეაქციები რადიკალური მექანიზმით მიმდინარეობდა, ხოლო არენებს ახასიათებთ ჩანაცვლებითი რეაქციების იონური მექანიზმი.
Პირველიქიმიური თვისება - ჰალოგენაცია. წყალბადის ატომის ჩანაცვლება ჰალოგენის ატომით - ქლორი ან ბრომი.
რეაქცია მიმდინარეობს გაცხელებისას და ყოველთვის კატალიზატორის მონაწილეობით. ქლორის შემთხვევაში, ეს შეიძლება იყოს ალუმინის ქლორიდი ან რკინის ქლორიდი სამი. კატალიზატორი ახდენს ჰალოგენის მოლეკულის პოლარიზებას, რის შედეგადაც ხდება ჰეტეროლიზური ბმის გაწყვეტა და იონების მიღება.
დადებითად დამუხტული ქლორიდის იონი რეაგირებს ბენზოლთან.
თუ რეაქცია ხდება ბრომთან, მაშინ რკინის ტრიბრომიდი ან ალუმინის ბრომიდი მოქმედებს როგორც კატალიზატორი.

მნიშვნელოვანია აღინიშნოს, რომ რეაქცია ხდება მოლეკულურ ბრომთან და არა ბრომით წყალთან. ბენზოლი არ რეაგირებს ბრომიან წყალთან.
ბენზოლის ჰომოლოგების ჰალოგენიზაციას აქვს საკუთარი მახასიათებლები. ტოლუენის მოლეკულაში მეთილის ჯგუფი ხელს უწყობს ჩანაცვლებას რგოლში, რეაქტიულობა იზრდება და რეაქცია მიმდინარეობს უფრო რბილ პირობებში, ანუ უკვე ოთახის ტემპერატურაზე.

მნიშვნელოვანია აღინიშნოს, რომ ჩანაცვლება ყოველთვის ხდება ორთო და პარა პოზიციებზე, ამიტომ მიიღება იზომერების ნარევი.
მეორეთვისება - ბენზოლის ნიტრაცია, ნიტრო ჯგუფის შეყვანა ბენზოლის რგოლში.

წარმოიქმნება მძიმე მოყვითალო სითხე მწარე ნუშის სუნით - ნიტრობენზოლი, ამიტომ რეაქცია შეიძლება იყოს ხარისხობრივი ბენზოლისთვის. ნიტრატირებისთვის გამოიყენება კონცენტრირებული აზოტისა და გოგირდის მჟავების ნიტრატირების ნარევი. რეაქცია ხორციელდება გაცხელებით.
შეგახსენებთ, რომ კონოვალოვის რეაქციაში ალკანების ნიტრაციისთვის გამოიყენებოდა განზავებული აზოტის მჟავა გოგირდმჟავას დამატების გარეშე.
ტოლუოლის ნიტრაციისას, ასევე ჰალოგენიზაციისას წარმოიქმნება ორთო- და პარა-იზომერების ნარევი.

მესამეთვისება - ბენზოლის ალკილაცია ჰალოალკანებით.

ეს რეაქცია იძლევა ბენზოლის რგოლში ნახშირწყალბადის რადიკალის შეყვანის საშუალებას და შეიძლება ჩაითვალოს ბენზოლის ჰომოლოგების მიღების მეთოდად. ალუმინის ქლორიდი გამოიყენება როგორც კატალიზატორი, რომელიც ხელს უწყობს ჰალოალკანის მოლეკულის იონებად დაშლას. მას ასევე სჭირდება გათბობა.
მეოთხეთვისება - ბენზოლის ალკილაცია ალკენებით.

ამ გზით, მაგალითად, კუმენის ან ეთილბენზოლის მიღება შეიძლება. კატალიზატორი არის ალუმინის ქლორიდი.
2. ბენზოლთან დამატების რეაქციები
რეაქციების მეორე ჯგუფი არის დანამატის რეაქციები. ჩვენ ვთქვით, რომ ეს რეაქციები არ არის დამახასიათებელი, მაგრამ ისინი შესაძლებელია საკმაოდ მძიმე პირობებში პი-ელექტრონული ღრუბლის განადგურებით და ექვსი სიგმა ბმის წარმოქმნით.
მეხუთესაკუთრება ზოგად სიაში - ჰიდროგენიზაცია, წყალბადის დამატება.

ტემპერატურა, წნევა, კატალიზატორი ნიკელი ან პლატინი. ტოლუენს შეუძლია ანალოგიურად რეაგირება.
მეექვსექონება - ქლორირება. გთხოვთ გაითვალისწინოთ, რომ ჩვენ ვსაუბრობთ კონკრეტულად ქლორთან ურთიერთქმედების შესახებ, რადგან ბრომი არ შედის ამ რეაქციაში.
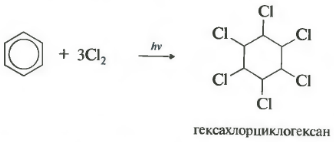
რეაქცია მიმდინარეობს მძიმე ულტრაიისფერი გამოსხივების ქვეშ. ჰექსაქლოროციკლოჰექსანი, ჰექსაქლორანის სხვა სახელი, წარმოიქმნება მყარი.
მნიშვნელოვანია გვახსოვდეს, რომ ბენზოლისთვის შეუძლებელიწყალბადის ჰალოგენების დამატების რეაქციები (ჰიდროჰალოგენაცია) და წყლის დამატება (ჰიდრატაცია).
3. ჩანაცვლება ბენზოლის ჰომოლოგების გვერდით ჯაჭვში
რეაქციების მესამე ჯგუფი ეხება მხოლოდ ბენზოლის ჰომოლოგებს - ეს არის ჩანაცვლება გვერდითი ჯაჭვში.
მეშვიდეთვისება ზოგად სიაში არის ჰალოგენაცია გვერდითი ჯაჭვის ალფა ნახშირბადის ატომზე.

რეაქცია ხდება გაცხელების ან დასხივებისას და ყოველთვის მხოლოდ ალფა ნახშირბადზე. როდესაც ჰალოგენაცია გრძელდება, მეორე ჰალოგენის ატომი ალფა პოზიციას დაუბრუნდება.
4. ბენზოლის ჰომოლოგების დაჟანგვა
რეაქციების მეოთხე ჯგუფი არის დაჟანგვა.
ბენზოლის რგოლი ძალიან ძლიერია, ამიტომ ბენზოლი არ იჟანგებაკალიუმის პერმანგანატი - არ აფერხებს მის ხსნარს. ეს ძალიან მნიშვნელოვანია გახსოვდეთ.
მეორეს მხრივ, ბენზოლის ჰომოლოგები იჟანგება კალიუმის პერმანგანატის დამჟავებული ხსნარით გაცხელებისას. და ეს არის მერვე ქიმიური თვისება.

გამოდის ბენზოის მჟავა. შეინიშნება ხსნარის გაუფერულება. ამ შემთხვევაში, რაც არ უნდა გრძელი იყოს შემცვლელის ნახშირბადის ჯაჭვი, ის ყოველთვის იშლება ნახშირბადის პირველი ატომის შემდეგ და ალფა ატომი იჟანგება კარბოქსილის ჯგუფში ბენზოინის მჟავის წარმოქმნით. დანარჩენი მოლეკულა იჟანგება შესაბამის მჟავამდე ან, თუ ეს მხოლოდ ერთი ნახშირბადის ატომია, ნახშირორჟანგამდე.
თუ ბენზოლის ჰომოლოგს აქვს ერთზე მეტი ნახშირწყალბადის შემცვლელი არომატულ რგოლზე, მაშინ დაჟანგვა ხდება იგივე წესების მიხედვით - ალფა მდგომარეობაში მყოფი ნახშირბადი იჟანგება.

ამ მაგალითში მიიღება ორფუძიანი არომატული მჟავა, რომელსაც ფტალინის მჟავა ეწოდება.
განსაკუთრებულად აღვნიშნავ კუმენის, იზოპროპილბენზოლის დაჟანგვას ატმოსფერული ჟანგბადით გოგირდმჟავას თანდასწრებით.

ეს არის ეგრეთ წოდებული კუმენის მეთოდი ფენოლის წარმოებისთვის. როგორც წესი, ამ რეაქციას უნდა გაუმკლავდეთ ფენოლის წარმოებასთან დაკავშირებულ საკითხებში. ეს არის ინდუსტრიული გზა.
მეცხრეთვისება - წვა, სრული დაჟანგვა ჟანგბადით. ბენზოლი და მისი ჰომოლოგები იწვება ნახშირორჟანგად და წყალში.
დავწეროთ ბენზოლის წვის განტოლება ზოგადი ფორმით.
მასის შენარჩუნების კანონის მიხედვით, მარცხნივ იმდენი ატომები უნდა იყოს, რამდენიც მარჯვნივ. იმიტომ რომ, ბოლოს და ბოლოს, ქიმიურ რეაქციებში ატომები არსად მიდიან, მაგრამ მათ შორის ობლიგაციების რიგი უბრალოდ იცვლება. ამრიგად, ნახშირორჟანგის იმდენი მოლეკულა იქნება, რამდენი ნახშირბადის ატომია არენის მოლეკულაში, რადგან მოლეკულა შეიცავს ნახშირბადის ერთ ატომს. ეს არის n CO 2 მოლეკულები. იქნება წყალბადის ატომების ნახევარი მეტი წყლის მოლეკულა, ანუ (2n-6) / 2, რაც ნიშნავს n-3.
მარცხნივ და მარჯვნივ არის ჟანგბადის ატომების იგივე რაოდენობა. მარჯვნივ არის 2n ნახშირორჟანგიდან, რადგან თითოეულ მოლეკულაში არის ორი ჟანგბადის ატომი, პლუს n-3 წყლისგან, სულ 3n-3. მარცხნივ არის ჟანგბადის ატომების იგივე რაოდენობა - 3n-3, რაც ნიშნავს, რომ მოლეკულების ნახევარი მეტია, რადგან მოლეკულა შეიცავს ორ ატომს. ანუ (3n-3)/2 ჟანგბადის მოლეკულა.
ამრიგად, ჩვენ შევადგინეთ ბენზოლის ჰომოლოგების წვის განტოლება ზოგადი ფორმით.
