გენეტიკური ინჟინერია(სინ. გენეტიკური ინჟინერია) - კვლევის მიმართულება მოლეკულურ ბიოლოგიასა და გენეტიკაში, რომლის საბოლოო მიზანია ლაბორატორიული ტექნიკის გამოყენებით ორგანიზმების მოპოვება ახალი, მათ შორის ბუნებაში არ აღმოჩენილი, მემკვიდრეობითი თვისებების კომბინაციებით. გ-ის გულში და. ნუკლეინის მჟავების ფრაგმენტებით მიზანმიმართული მანიპულირების შესაძლებლობა მოლეკულური ბიოლოგიისა და გენეტიკის უახლესი მიღწევების გამო დევს. ეს მიღწევები მოიცავს გენეტიკური კოდის უნივერსალურობის დადგენას (იხ.), ანუ იმ ფაქტს, რომ ყველა ცოცხალ ორგანიზმში ერთი და იგივე ამინომჟავების ჩართვა ცილის მოლეკულაში კოდირებულია დნმ-ის ჯაჭვში იგივე ნუკლეოტიდური თანმიმდევრობით; გენეტიკური ფერმენტოლოგიის წარმატებები, რომელმაც მკვლევარს მიაწოდა ფერმენტების ნაკრები, რომლებიც შესაძლებელს ხდის იზოლირებულ ფორმაში მიიღონ ცალკეული გენები ან ნუკლეინის მჟავების ფრაგმენტები, განახორციელონ ნუკლეინის მჟავების ფრაგმენტების in vitro სინთეზი - t, შერწყმა. მიღებული ფრაგმენტები ერთ მთლიანობაში. ამრიგად, ორგანიზმის მემკვიდრეობითი თვისებების შეცვლა გ. და. მცირდება სხვადასხვა ფრაგმენტებიდან ახალი გენეტიკური მასალის აგებამდე, ამ მასალის მიმღებ ორგანიზმში შეყვანამდე, მისი ფუნქციონირებისა და სტაბილური მემკვიდრეობითობის პირობების შექმნით.
გენების მიღების ერთ-ერთი გზა ქიმ. სინთეზი. მას შემდეგ, რაც ჰოლიმ (ა. ჰოლი) აშშ-ში, ა. ა. ბაევმა სსრკ-ში და სხვა მკვლევარებმა მოახერხეს სხვადასხვა სატრანსპორტო RBGK (tRNA) სტრუქტურის გაშიფვრა, X. Koran-მა და სხვებმა ჩაატარეს ქიმ. დნმ-ის სინთეზი, რომელიც აკოდირებს მცხობელის საფუარის ალანინის tRNA.
მაგრამ ხელოვნური გენის სინთეზის ყველაზე ეფექტური მეთოდი დაკავშირებულია ფერმენტის რნმ-დამოკიდებული დნმ პოლიმერაზას (უკუ ტრანსკრიპტაზა) გამოყენებასთან, რომელიც აღმოჩენილია ბალტიმორის (დ. ბალტიმორი) და ტემინის (ჰ. ტემინის) მიერ ონკოგენურ ვირუსებში (იხ.). ეს ფერმენტი იზოლირებული და გაწმენდილია უჯრედებიდან, რომლებიც ინფიცირებულია გარკვეული რნმ-ის შემცველი ონკოგენური ვირუსებით, მათ შორის ფრინველის მიელობლასტოზის ვირუსი, რუს სარკომა და თაგვის ლეიკემია. საპირისპირო ტრანსკრიპტაზა უზრუნველყოფს დნმ-ის სინთეზს მესინჯერ რნმ-ის (mRNA) შაბლონზე. mRNA მოლეკულების გამოყენება დნმ-ის სინთეზის შაბლონებად მნიშვნელოვნად უწყობს ხელს უმაღლესი ორგანიზმების ცალკეული სტრუქტურული გენების ხელოვნურ სინთეზს, ვინაიდან mRNA მოლეკულაში აზოტოვანი ფუძეების თანმიმდევრობა არის შესაბამისი სტრუქტურული გენების აზოტოვანი ფუძეების თანმიმდევრობის ზუსტი ასლი. საკმაოდ კარგად არის განვითარებული mRNA სხვადასხვა მოლეკულების იზოლირების ტექნიკა. გლობინის პროტეინის mRNA, რომელიც ადამიანის, ცხოველის და ფრინველის ჰემოგლობინის ნაწილია, თვალის ლინზების პროტეინის mRNA, იმუნოგლობინის mRNA, ავთვისებიანი სიმსივნის (მიელომა) სპეციფიკური ცილის mRNA იზოლირების მიღწევებმა შესაძლებელი გახადა გენების სტრუქტურული ნაწილის სინთეზირება. ამ ცილების ზოგიერთი ნაწილი საპირისპირო ტრანსკრიპტაზის გამოყენებით.
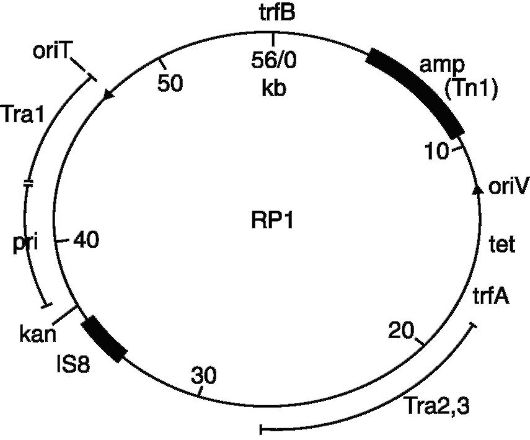
თუმცა, ორგანიზმში სტრუქტურული გენები ფუნქციონირებს მარეგულირებელ გენებთან ერთად, რომელთა ნუკლეოტიდური თანმიმდევრობა არ არის რეპროდუცირებული mRNA მოლეკულის მიერ. ამიტომ არცერთი ეს მეთოდი არ იძლევა სტრუქტურული და მარეგულირებელი გენების ნაკრების სინთეზის საშუალებას. ამ პრობლემის გადაწყვეტა შესაძლებელი გახდა ცალკეული გენების იზოლირების მეთოდების შემუშავების შემდეგ. ბაქტერიული გენების იზოლირებისთვის გამოიყენება მცირე დნმ-ის შემცველი ციტოპლაზმური სტრუქტურები, რომლებსაც შეუძლიათ რეპლიკაცია (იხ. რეპლიკაცია) ბაქტერიული ქრომოსომისგან დამოუკიდებლად. ეს სტრუქტურები ქმნიან ბაქტერიების ექსტრაქრომოსომული გენეტიკური ელემენტების ერთ ჯგუფს - პლაზმიდებს (იხ. პლაზმიდები). ზოგიერთი მათგანი შეიძლება შევიდეს ბაქტერიულ ქრომოსომაში, შემდეგ კი სპონტანურად ან ინდუქციური აგენტების გავლენის ქვეშ, მაგალითად. ულტრაიისფერი გამოსხივება, გადაინაცვლებს ქრომოსომიდან ციტოპლაზმაში, თან ატარებს მასპინძლის მიმდებარე ქრომოსომულ გენებს-უჯრედებს. ასეთი თვისებების მქონე ბაქტერიების ექსტრაქრომოსომულ გენეტიკურ ელემენტებს ეპიზომებს უწოდებენ [F. იაკობი, ვოლმანი (E. Wollman)]. ეპიზომები (იხ.) მოიცავს ზომიერ ფაგებს (იხ. ბაქტერიოფაგი), ბაქტერიების სქესის ფაქტორს, მიკროორგანიზმების წამლისმდგრადობის ფაქტორებს (იხ.), ბაქტერიოცინოგენურ ფაქტორებს (იხ.). ციტოპლაზმაში, ეპიზომების მიერ დატყვევებული გენები იმეორებენ მათ შემადგენლობაში და ხშირად ქმნიან ბევრ ასლს. პლაზმიდების, განსაკუთრებით ზომიერი ფაგების იზოლირების ეფექტური მეთოდის შემუშავებამ, რომლებიც ატარებენ ბაქტერიული ქრომოსომის გენეტიკური მასალის მატარებელს, და ბაქტერიოფაგის გენომში შემავალი ბაქტერიული უჯრედის ქრომოსომის ფრაგმენტის იზოლირებას, 1969 წელს შესაძლებელი გახადა J. Beckwith et al. გამოყავით ლაქტოზას ოპერონი, გენების ჯგუფი, რომელიც აკონტროლებს სინთეზის ფერმენტებს, რომლებიც აუცილებელია Escherichia coli-ს მიერ ლაქტოზის შეწოვისთვის. მსგავსი ტექნიკა გამოიყენეს გენის იზოლირებისთვის და გასაწმენდად, რომელიც აკონტროლებს Escherichia coli ტიროზინის გადაცემის რნმ-ის სინთეზს (იხ. რიბონუკლეინის მჟავები).
პლაზმიდების გამოყენება შესაძლებელს ხდის პრაქტიკულად ნებისმიერი ბაქტერიული გენის იზოლირებულ ფორმაში მიღებას და, შესაბამისად, დნმ-ის მოლეკულების სხვადასხვა წყაროდან აგების შესაძლებლობას. ასეთი ჰიბრიდული სტრუქტურები შეიძლება დაგროვდეს უჯრედებში მნიშვნელოვანი რაოდენობით, რადგან ბევრი პლაზმიდი გარკვეულ პირობებში ინტენსიურად მეორდება ბაქტერიულ ციტოპლაზმაში, ქმნიან ათობით, ასობით და თუნდაც ათასობით ეგზემპლარს.
გ-ის წარმატებები და. დაკავშირებულია დნმ-ის ერთ მოლეკულაში სხვადასხვა წყაროდან გენეტიკური სტრუქტურების გაერთიანების ტექნიკის შემუშავებასთან. გადამწყვეტი ფაქტორი ჰიბრიდული მოლეკულების დიზაინში in vitro იყო შეზღუდვის ენდონუკლეაზების გამოყენება - სპეციალური ფერმენტები, რომლებსაც შეუძლიათ დნმ-ის მოლეკულების დაჭრა მკაცრად განსაზღვრულ ადგილებში. ასეთი ფერმენტები გვხვდება Escherichia coli-ს უჯრედებში, რომლებიც ატარებენ R- ტიპის პლაზმიდებს, რომლებიც იწვევენ ბაქტერიების წინააღმდეგობას გარკვეული მედიკამენტების მიმართ, ჰემოფილუს გრიპის, Serratia marcescens და სხვა მიკროორგანიზმების უჯრედებში. ამ ტიპის ერთ-ერთი ყველაზე ხშირად გამოყენებული ფერმენტი არის EcoRI რესტრიქციული ენდონუკლეაზა, რომელიც სინთეზირებულია RI პლაზმიდის მიერ E. coli უჯრედებში. ფერმენტი ამოიცნობს დნმ-ის მონაკვეთს ექვსი ბაზის წყვილის უნიკალური თანმიმდევრობით და წყვეტს ორჯაჭვიანი დნმ-ის სტრუქტურას ამ ნაწილში ისე, რომ ოთხი ნუკლეოტიდის ერთჯაჭვიანი ბოლოები წარმოიქმნება ორივე მხარეს (ე.წ. წებოვანი ბოლოები). ვინაიდან ფერმენტი ჭრის დნმ-ის მოლეკულებს, მიუხედავად მათი წარმოშობისა, მკაცრად განსაზღვრული გზით, ფერმენტის მოქმედების შედეგად წარმოქმნილ დნმ-ის ყველა ფრაგმენტს ექნება იგივე წებოვანი ბოლოები. ნებისმიერი დნმ-ის ფრაგმენტის დამატებითი წებოვანი ბოლოები გაერთიანებულია წყალბადის ბმებით, ქმნიან ჰიბრიდულ წრიულ დნმ-ს (ნახ.). ჰიბრიდული დნმ-ის მოლეკულის სტაბილიზაციისთვის გამოიყენება სხვა ფერმენტი - პოლინუკლეოტიდური ლიგაზა, რომელიც აღადგენს რესტრიქციული ფერმენტით გაწყვეტილ კოვალენტურ ბმებს. EcoRI-ს მიერ სპეციალურად აღიარებული თანმიმდევრობა გვხვდება დნმ-ში არაუმეტეს 4000-16000 ბაზის წყვილის დაშორებით. ამიტომ, EcoRI-ს მოქმედებით წარმოქმნილი დნმ-ის ფრაგმენტი შეიძლება შეიცავდეს ფერმენტის მიერ დაუზიანებელ მინიმუმ ერთ გენს (საშუალოდ ერთი გენი შეიცავს 1000-1500 ბაზის წყვილს).
რესტრიქციული ენდონუკლეაზების და რიგი სხვა ფერმენტების გამოყენება შესაძლებელს ხდის რთული რეკომბინანტული დნმ-ის მიღებას. შეერთებულ შტატებში მკვლევართა ჯგუფმა პ.ბერგის ხელმძღვანელობით მოახერხა გენეტიკური ინფორმაციის გაერთიანება სამი წყაროდან, როგორც ერთი დნმ-ის მოლეკულის ნაწილი: ონკოგენური მაიმუნის ვირუსის SV40 სრული გენომი (იხ.), ზომიერი ბაქტერიოფაგის გენომის ნაწილი. λ და E. coli გენების ჯგუფი, რომელიც პასუხისმგებელია გალაქტოზის ასიმილაციაზე. შექმნილი რეკომბინანტული მოლეკულა არ იყო ტესტირება ფუნქციური აქტივობისთვის, რადგან ამ ნაშრომის ავტორებმა შეაჩერეს ონკოგენური ცხოველური ვირუსების გავრცელების პოტენციური საფრთხე ადამიანის ნაწლავში მცხოვრებ ბაქტერიულ პოპულაციაში. ცნობილია, რომ ვირუსების გასუფთავებულ დნმ-ს შეუძლია შეაღწიოს ძუძუმწოვრების სხვადასხვა უჯრედებში და სტაბილურად გადაიცეს მათ მიერ.
პირველად, ფუნქციურად აქტიური ჰიბრიდული დნმ-ის მოლეკულები აშენდა აშშ-ში S. Cohen et al. კოენის ჯგუფი თანმიმდევრულად წყვეტდა ფილოგენეტიკური თვალსაზრისით ერთმანეთისგან სულ უფრო დაშორებული სახეობებისგან იზოლირებული დნმ-ის მოლეკულების კომბინირებისა და კლონირების (შერჩევითი დაგროვების) პრობლემას. კლონირების პროცედურა ჩვეულებრივ შედგება იმაში, რომ სხვადასხვა წყაროდან დნმ ფრაგმენტირებულია შეზღუდვის ენდონუკლეაზების გამოყენებით, შემდეგ ეს ფრაგმენტები ინ ვიტრო გაერთიანებულია საერთო სტრუქტურაში და შეჰყავთ მიმღებ ორგანიზმში, რომელიც კოენის ექსპერიმენტებში არის Escherichia coli. დადგენილია, რომ რამდენიმე ბაქტერიული სახეობის უჯრედები (მათ შორის Escherichia coli, Salmonella typhimurium, Staphylococcus aureus) შეიძლება გარდაიქმნას (იხ. ტრანსფორმაცია) რეკომბინანტული დნმ-ის მოლეკულების გამოყენებით. ამ შემთხვევაში, ჰიბრიდული მოლეკულის პლაზმური ნაწილი (ან ერთ-ერთი პლაზმიდი, თუ ჰიბრიდულ მოლეკულაში გაერთიანებულია ორი პლაზმიდი სხვადასხვა წყაროდან) ემსახურება როგორც ვექტორს, ანუ უზრუნველყოფს ფილოგენეტიკურად უცხო გენეტიკური მასალის გადაცემას მიმღებ უჯრედებში და მისი რეპროდუქცია მათში. პირველი პლაზმიდი, რომელიც გამოიყენა კოენმა და სხვებმა, როგორც ვექტორი, იყო მის მიერ in vitro მიღებული პლაზმიდი pSC101, რომელიც აკონტროლებს ბაქტერიების წინააღმდეგობას ტეტრაციკლინის მიმართ. ეს პატარა პლაზმიდი მხოლოდ 8000 bp სიგრძისაა. მასზე თავდასხმა ხდება EcoRI ფერმენტის მიერ მხოლოდ ერთ ადგილზე და ფერმენტი არ აზიანებს პლაზმიდის უნარს შემდგომში გამრავლდეს E. coli უჯრედებში და გააკონტროლოს ტეტრაციკლინის წინააღმდეგობა. ამ მახასიათებლებმა შესაძლებელი გახადა მისი გამოყენება ჰიბრიდული დნმ-ის მოლეკულების კონსტრუქციისთვის in vitro. პირველ ეტაპებზე, პლაზმიდური დნმ იზოლირებული სხვადასხვა ბაქტერიული სახეობიდან და შემდეგ უფრო მაღალი ორგანიზმებიდან იყო მიმაგრებული pSC101-ზე. ამგვარად, შეიქმნა „ქიმერული“ პლაზმიდები (ანუ ბუნებრივ პირობებში წარმოშობის უნარის გარეშე), რომლებიც თავიანთ შემადგენლობაში აერთიანებდნენ Escherichia coli-ს გენეტიკურ მასალას, დნმ-ის სეგმენტს კლანჭიანი ბაყაყის კვერცხუჯრედებიდან Xenopus laevis, რომელიც აკონტროლებს სინთეზს. რიბოსომური რნმ და ზღვის ზღარბის დნმ-ის სეგმენტი, რომელიც აკონტროლებს ჰისტონის ცილების, ან თაგვის მიტოქონდრიული დნმ-ის სინთეზს. Escherichia coli-ს უჯრედებში, რომლებშიც შეიყვანეს ასეთი ჰიბრიდული, „ქიმერული“ პლაზმიდები, დარეგისტრირდა უმაღლესი ორგანიზმების გენების მუშაობა.
განსხვავებით pSC101-ისგან, რომელიც უჯრედში მხოლოდ 4-6 ეგზემპლარად არის წარმოდგენილი, ზოგიერთ სხვა პლაზმიდს, რომელიც გამოიყენება როგორც ვექტორები, შეიძლება ბევრჯერ გაიმეოროს გარკვეულ პირობებში, ქმნიან რამდენიმე ათას ასლს ერთ უჯრედში. ასეთ თვისებებს ფლობს, მაგალითად, ColEI პლაზმიდი, რომელიც აკონტროლებს კოლიცინის სინთეზს (იხ. ბაქტერიოცინოგენეზი). pSC101-ის მსგავსად, ColEI იშლება EcoRl ფერმენტის მიერ მხოლოდ ერთ ადგილას და უცხო დნმ, რომელიც ასევე დამუშავებულია EcoRI-ით, ადვილად მიმაგრებულია მიღებულ ხაზოვან მოლეკულაზე წებოვანი ბოლოებით. ამრიგად, Escherichia coli-ს ტრიპტოფანის ოპერონის გენები „შეკერილი“ იქნა ColEI-ზე. უჯრედებში, რომლებიც ატარებენ აგებული ჰიბრიდული პლაზმიდის მრავალ ასლს, ტრიპტოფანის ბიოსინთეზის გენების მიერ კონტროლირებადი ფერმენტული ცილების წარმოება მკვეთრად გაიზარდა. ინ ვიტრო სისტემაში შესაძლებელი იყო ColEI პლაზმიდის მიმაგრება გარკვეულ R-ფაქტორებთან და ზომიერ ფაგთან. ასეთი ნამუშევარი პირველად შესრულდა სსრკ-ში აკადემიკოს ა.ა.ბაევისა და პროფესორ ს.ი.ალიხანიანის ხელმძღვანელობით. ColEI და R-ფაქტორებით წარმოქმნილ კომბინირებულ ვექტორულ პლაზმიდებს შეუძლიათ ინტენსიურად გამრავლდნენ ბაქტერიულ უჯრედებში, როგორიცაა ColEI, და ამავდროულად განსაზღვრონ უჯრედების წინააღმდეგობა ანტიბიოტიკების მიმართ, რაც მნიშვნელოვნად ამარტივებს ბაქტერიების შერჩევას - ჰიბრიდული პლაზმიდების მატარებლები.
ზომიერი ფაგები ასევე გამოიყენება როგორც ვექტორები. In vitro სისტემაში აშენდა ჰიბრიდული ბაქტერიოფაგის ნაწილაკები, რომლებიც მოიცავდა მათ სტრუქტურაში ბაქტერიულ გენებს, სხვა ფაგების ან უფრო მაღალი ორგანიზმების დნმ-ს (მაგალითად, ბუზ Drosophila-ს დნმ).
ჰიბრიდული დნმ-ის ფუნქციური აქტივობა განისაზღვრება მიმღები ორგანიზმების უჯრედებში მათი გადატანისა და ამ უჯრედებში შემდგომი გამრავლების (ამპლიფიკაციის) შესაძლებლობით. როგორც მიმღებები, უკვე ეფექტურად გამოიყენება არა მხოლოდ ბაქტერიები, როგორც ზემოთ აღინიშნა, არამედ უმაღლესი ორგანიზმების უჯრედებიც, თუმცა ჯერჯერობით მხოლოდ სხეულის გარეთ გაშენებული ქსოვილის კულტურის სახით. არსებობს მინიშნებები, რომ ბაქტერიული გენების მატარებელი ფაგების დნმ შეიძლება შეაღწიოს ადამიანის შემაერთებელი ქსოვილის უჯრედებში (ფიბრობლასტები), პროტოპლასტებში ან მცენარეთა უჯრედების არადიფერენცირებულ კულტურაში (კალუსში). 1971 წელს ამერ. მკვლევარმა მერილმა (S. R. Merril) და სხვებმა, მოახსენეს მემკვიდრეობითი დეფექტის - გალაქტოზემიის გამოსწორების ექსპერიმენტებზე (იხ.) ტრანსდუქციური ფაგის დნმ-ში შემავალი ბაქტერიების გალაქტოზის გენების "ავადმყოფ" უჯრედებში შეყვანით. შედეგად, გალაქტოზემიის მქონე პაციენტის უჯრედებმა, რომლებიც დეფექტურია ფერმენტ ბეტა-D-გალაქტოზა-1-ფოსფატ ურიდილტრანსფერაზაში, ვერ ახერხებდნენ გალაქტოზის ათვისებას, აღადგინეს მათი ნორმალური ზრდის უნარი გალაქტოზის თანდასწრებით და ადრე არ იყო ფერმენტული აქტივობა. რეგისტრირებულია მათ ამონაწერებში. მსგავსი შედეგი მიიღეს Horst (J. Horst) და სხვებმა, ბაქტერიული გენის შემოღებით, რომელიც აკონტროლებს ბეტა-გალაქტოზიდაზას სინთეზს გენერალიზებული განგლიოზიდოზის მქონე პაციენტის ფიბრობლასტებში, რომელიც ხასიათდება ამ ფერმენტის მძიმე დეფიციტით. Manion (W. Munyon) და მისი თანამშრომლები. ჰერპესის ვირუსის გამოყენებით, მათ გადაიტანეს გენი, რომელიც აკონტროლებს თიმიდინ კინაზას სინთეზს ადამიანის უჯრედებიდან თაგვის უჯრედებში, რაც აღადგენს დეფექტურ ფიბრობლასტებს ამ ფერმენტის სინთეზის უნარს.
ადამიანის, ცხოველისა და მცენარის უჯრედების კულტურაში გენეტიკური ინფორმაციის გადაცემის ერთ-ერთი გზაა სომატური უჯრედების ჰიბრიდიზაცია, შემუშავებული ეფრუსის (V. Ephrussi) და ბარსკის (G. Barski) მიერ. ამ მეთოდის ეფექტურობა მნიშვნელოვნად გაუმჯობესდა მას შემდეგ, რაც დადგინდა, რომ ინაქტივირებული სენდაის ტიპის პარაგრიპის ვირუსის ნაწილაკები ზრდის უჯრედების შერწყმის სიხშირეს სხვადასხვა წყაროებიდან. ნაჩვენებია ცალკეული გენების გადატანის შესაძლებლობა იზოლირებული ჩინური ზაზუნის ქრომოსომებიდან თაგვის შემაერთებელი ქსოვილის უჯრედებში. აღწერილია ადამიანის და თაგვის უჯრედების ჰიბრიდები, რომლებშიც ადამიანის ქრომოსომების ნაწილი ამოღებულია, ხოლო მეორე ნაწილი რჩება ფუნქციურად აქტიური. უჯრედული მიკროქირურგიის მეთოდების შემუშავებამ შესაძლებელი გახადა უჯრედის ბირთვების გადანერგვა სომატური უჯრედებიდან განაყოფიერებულ კვერცხუჯრედში და, შედეგად, აბსოლუტურად იდენტური ორგანიზმების მიღება. უჯრედის ჰიბრიდიზაციამ შესაძლებელი გახადა ბაყაყის ჩანასახის უჯრედებში ადამიანის გლობინის სინთეზის ინდუქცია. ყველა ეს მაგალითი გვიჩვენებს გ-ის პოტენციალს და.
გ-ის პრაქტიკული ღირებულება და. რადგან მედიცინა დაკავშირებულია ადამიანებში მემკვიდრეობითი მეტაბოლური დეფექტების გამოსწორების პერსპექტივასთან (იხ. გენური თერაპია), მიკროორგანიზმების შექმნა, რომლებმაც დაკარგეს პათოგენურობა, მაგრამ შეინარჩუნეს იმუნიტეტის ფორმირების უნარი, ანტიბიოტიკების, ამინომჟავების, ჰორმონების, ვიტამინების, ფერმენტების სინთეზი. იმუნოგლობულინები და ა.შ., ეფუძნება მიკროორგანიზმების გამოყენებას, რომლებიც შეიცავდნენ შესაბამის გენებს. განსაკუთრებული შედეგების მიღება შესაძლებელია უახლოეს მომავალში გ. მცენარეები. გ-ის მეთოდების დახმარებით და. ისინი ცდილობენ შექმნან მცენარეები, რომლებსაც შეუძლიათ ატმოსფერული აზოტის შთანთქმა და მცენარეული საკვების ცილოვანი შემადგენლობის გაუმჯობესება. ამ პრობლემების წარმატებული გადაწყვეტა მკვეთრად გაზრდის მცენარეთა პროდუქტიულობას, შეამცირებს მინერალური აზოტის წარმოებას და მოხმარებას და ამით მნიშვნელოვნად გააუმჯობესებს გარემოს (იხ.). შესწავლილია ცხოველთა და მცენარეთა სრულიად ახალი ფორმების შექმნის შესაძლებლობა შეჯვარების სახეობათაშორისი ბარიერების გადალახვით. თუმცა გ-ის შეფასებით და. როგორც ველური ბუნების დაუფლების ახალი ფორმა, მხედველობაში უნდა იქნას მიღებული არა მხოლოდ მისი შესაძლო რევოლუციური როლი ბიოლოგიაში, მედიცინასა და სოფლის მეურნეობაში, არამედ მის განვითარებასთან დაკავშირებით წარმოქმნილი შესაძლებლობები პათოგენური მიკროორგანიზმების ახალი ფორმების გაჩენის მიზნით. ჰიბრიდული დნმ-ის გავრცელება ადამიანებში მცხოვრები ბაქტერიების პოპულაციაში, რომლებიც ატარებენ ონკოგენურ ვირუსებს და ა.შ. რა თქმა უნდა, მეცნიერების მიღწევების მიზანმიმართული გამოყენება, მათ შორის G. და. ადამიანის სიკეთე ეწირება მოგებასა და აგრესიას.
დამატებითი მასალებისგან
გენეტიკური ინჟინერია კვლავაც სწრაფად პროგრესირებს კვლევის მეთოდად მოლეკულურ ბიოლოგიასა და გენეტიკაში. უნდა აღინიშნოს, რომ „გენეტიკური ინჟინერიის“ და „გენეტიკური ინჟინერიის“ ცნებები არ არის სრულიად სინონიმები, ვინაიდან გენური ინჟინერიასთან დაკავშირებული კვლევა არ შემოიფარგლება მხოლოდ გენებით, როგორც ასეთი, მანიპულაციებით. ამჟამად, გენეტიკური ინჟინერიის მეთოდები იძლევა ბუნებრივი ნუკლეინის მჟავების ყველაზე ღრმა და დეტალურ ანალიზს - ნივთიერებებს, რომლებიც პასუხისმგებელნი არიან გენეტიკური ინფორმაციის შენახვაზე, გადაცემასა და განხორციელებაზე (იხ. ნუკლეინის მჟავები.), ასევე შექმნან შეცვლილი ან სრულიად ახალი. ბუნებაში არ გვხვდება გენები (იხ. გენი), გენების კომბინაციები და მაღალი ეფექტურობით გამოხატვა ცოცხალ უჯრედში (იხ. გენის ექსპრესიულობა). ბოლო ათწლეულის გენეტიკური ინჟინერიის სპეციფიკური პრაქტიკული მიღწევებიდან ყველაზე მნიშვნელოვანი უნდა იყოს ბიოლოგიურად აქტიური ცილების - ინსულინის (იხ.), ინტერფერონის (იხ.), ზრდის ჰორმონის (იხ. სომატოტროპული ჰორმონი) მწარმოებლების შექმნაც. როგორც გენეტიკური ინჟინერიის მეთოდების შემუშავება, ნივთიერებათა ცვლის ამ რგოლების გააქტიურება, ჭვავის დაბალმოლეკულური ბიოლოგიურად აქტიური ნივთიერებების წარმოქმნას უკავშირდება. ამ გზით მიიღება გარკვეული ანტიბიოტიკების, ამინომჟავების და ვიტამინების მწარმოებლები, რომლებიც ბევრჯერ უფრო ეფექტურია, ვიდრე ამ ნივთიერებების მწარმოებლები, რომლებიც მიღებულია გენეტიკისა და სელექციის ტრადიციული მეთოდებით. მუშავდება მეთოდები სუფთა ცილოვანი ვაქცინების მისაღებად ჰეპატიტის, გრიპის, ჰერპესის და ფეხის და პირის ღრუს ვირუსების წინააღმდეგ, განხორციელდა ვაქცინის ვირუსით ვაქცინაციის გამოყენების იდეა, რომლის გენომშიც ცილების სინთეზის კოდირებული გენები. ჩართულია სხვა ვირუსები (მაგალითად, ჰეპატიტი ან გრიპის ვირუსები): ამგვარად აგებულ ვირუსთან ინოკულაციის შედეგად ორგანიზმი ავითარებს იმუნიტეტს არა მხოლოდ ჩუტყვავილას, არამედ ჰეპატიტის, გრიპის ან ამ ვირუსით გამოწვეული სხვა დაავადებების მიმართ. ცილა ტო-როგო კოდირებულია ჩაშენებული გენით.
საგრძნობლად გაიზარდა რესტრიქციული ენდონუკლეაზების მსოფლიო კოლექცია - რესტრისტაზები, გენეტიკური ინჟინერიის მანიპულაციების მთავარი „ინსტრუმენტები“. 400-ზე მეტი ზღუდავს "აღიარებას" დაახლ. დნმ-ის მოლეკულებში განსხვავებული სტრუქტურის 100 სპეციფიკური ადგილი (ადგილი) (იხ. დეოქსირიბონუკლეინის მჟავები) და ამ უბნებზე დნმ-ის პოლინუკლეოტიდური ჯაჭვის გაყოფა. ერთი ასეთი ფერმენტის ან რამდენიმე შემაკავებელი ფერმენტის კომბინაციით, თითქმის ნებისმიერი გენი შეიძლება იზოლირებული იყოს, როგორც ერთი ან მეტი დნმ-ის ფრაგმენტის ნაწილი (ე.წ. შეზღუდვის ფრაგმენტები). ამან გააფართოვა გენეტიკური ინჟინერიის შესაძლებლობები არა მხოლოდ გენების იზოლაციასთან, არამედ მათი მუშაობის გააქტიურებასთან, გენების სტრუქტურისა და მათი მოლეკულური გარემოს ანალიზთან დაკავშირებით. შემუშავებულია მთელი გენების სინთეზის მეთოდები ნუკლეოტიდების მოცემული თანმიმდევრობით, შესაძლებელი გახდა სინთეზირებული და ბუნებრივი გენების მიწოდება სხვადასხვა მარეგულირებელი ნუკლეოტიდური თანმიმდევრობით, ჩანაცვლება, ჩასმა, წაშლა ერთი ნუკლეოტიდების გენის მკაცრად მითითებულ მონაკვეთებში, შემოკლება ან დაასრულეთ მისი ნუკლეოტიდური ჯაჭვი ერთი ნუკლეოტიდის სიზუსტით.
გენეტიკური ინჟინერიის მიღწევა იყო მისი შეღწევა უმაღლესი ორგანიზმების უჯრედებში, მათ შორის ადამიანებში, მემკვიდრეობის მექანიზმების ორგანიზაციასა და ფუნქციონირებაში. სწორედ უფრო მაღალ ევკარიოტებზეა მიღებული ყველაზე საინტერესო მონაცემები გენეტიკური ინჟინერიის მეთოდების გამოყენებით. გენეტიკური ინჟინერიის წარმატება დიდწილად ასოცირდება ახალი სპეციალიზებული ვექტორების წარმოებასთან, რომლებიც საშუალებას იძლევა დნმ-ის ცალკეული ფრაგმენტების (გენების) ეფექტური კლონირება (გამრავლება) და ამ გენების მიერ კოდირებული ცილების სინთეზირება.
დნმ-ის ვექტორებთან დაკავშირებული შეზღუდვის ფრაგმენტები კლონირებულია ცოცხალ უჯრედში, ასეთი ვექტორების უნარის გამოყენებით, გამრავლდნენ (გამრავლდნენ) უჯრედში მრავალ ეგზემპლარად. კლონირებადი ფრაგმენტების ზომიდან და კვლევის მიზნიდან გამომდინარე, გამოიყენება ოთხიდან ერთი ტიპის ვექტორები - პლაზმიდები (იხ.), ფაგები (იხ. ბაქტერიოფაგი), კოსმიდები ან ფაგების წარმოებულები ერთჯაჭვიანი დნმ-ით.
შედარებით მცირე დნმ-ის ფრაგმენტების (10 ათასამდე ბაზის წყვილამდე) კლონირებისთვის გამოიყენება პლაზმიდური ვექტორები (pBR322, pAT 153, pUR250, pUC19 და სხვ.). გენეტიკური ინჟინერიის მიღწევა ბოლო წლებში იყო ვექტორების წარმოება, რომელიც დაფუძნებულია ფაგ X-ზე (Charon 4A, gtwes-B), რომელშიც გენომის ნაწილი ჩანაცვლებულია უცხო დნმ-ის ფრაგმენტით. ჰიბრიდული გენომი ხელოვნურად "შეფუთულია" ცილოვან გარსში და ბაქტერიები ინფიცირდება ამ რეკონსტრუქციული ფაგით. რეპროდუცირების დროს უჯრედში რამდენიმე ათასი ეგზემპლარის წარმოქმნით, რეკონსტრუირებული ფაგი ასუფთავებს მას და გამოიყოფა კულტურის გარემოში. ასეთი ვექტორების დახმარებით ხდება 10-25 ათასი ბაზის წყვილის დნმ-ის ფრაგმენტების კლონირება.
კოსმიდული ვექტორები (pIB8, MUA-3) არის ფაგის X და პლაზმიდის ჰიბრიდი. ისინი შეიცავს ე.წ ფაგის დნმ-ის COS თანმიმდევრობები, რომლებიც საჭიროა ფაგის გენომის ცილოვან გარსში შესაფუთად და პლაზმიდური დნმ-ის სეგმენტი, რომელიც საშუალებას აძლევს კოსმიდურ ვექტორებს გამრავლდნენ ბაქტერიებში ისევე, როგორც პლაზმიდები. ამრიგად, შედეგად მიღებული რეკომბინანტული გენომი აინფიცირებს მაღალი ეფექტურობის მქონე ბაქტერიებს, როგორიცაა ბაქტერიოფაგი, მაგრამ მრავლდება მათში, როგორც პლაზმიდი, ბაქტერიული უჯრედის სიკვდილის გარეშე. კოსმიდები გამოიყენება დნმ-ის ფრაგმენტების კლონირებისთვის 35-45 ათას ბაზის წყვილამდე.
ვექტორები, რომლებიც წარმოადგენენ ფაგების წარმოებულებს ერთჯაჭვიანი დნმ-ით (M13 mp8, M13, mp73 და სხვ.), აგებულია M13 ბაქტერიოფაგის წრიული დნმ-ის მოლეკულის საფუძველზე. უცხო დნმ-ის ჩასართავად გამოიყენება რეპლიკაციური ორჯაჭვიანი ფაგის დნმ-ის მოლეკულა. ვექტორი, რომელიც ატარებს უცხო DIC-ს, შეჰყავთ ბაქტერიულ უჯრედებში, სადაც რეკომბინანტული მოლეკულები მრავლდება ამ უჯრედის ლიზისის გარეშე და "იწევა" კულტურის გარემოში, როგორც ვირუსული ნაწილაკი ერთჯაჭვიანი დნმ-ის მოლეკულით. ეს ვექტორები გამოიყენება დნმ-ის ფრაგმენტების კლონირებისთვის (300-400 ბაზის წყვილამდე).
გენეტიკური ინჟინერიის მანიპულაციებისთვის საჭირო გენი მიიღება შესაბამისი რეკომბინანტული დნმ-ის მოლეკულების კლონირებით და ასეთი კლონების შერჩევით. იმ შემთხვევებში, როდესაც კლონირებულია უმაღლესი ორგანიზმების და ადამიანების გენები / E. coli-ში to-rykh-ის ექსპრესია (ყველაზე ხშირად გამოიყენება ასეთი მიზნებისათვის) შეუძლებელია, კლონირება და შერჩევის პროცედურა ტარდება რამდენიმე ეტაპად. პირველ ეტაპზე ე.წ გენების ბიბლიოთეკა დნმ-ის ფრაგმენტებიდან (კლონირებული პირდაპირ უჯრედის გენომიდან) ან შესაბამისი მესენჯერი რნმ-ის კლონირებული დნმ-ის ასლებიდან (cDNA). გენომის დნმ-ის ფრაგმენტების სტრუქტურისა და შესაბამისი cDNA-ს სტრუქტურის შედარებისას ისინი იღებენ მნიშვნელოვან ინფორმაციას გენეტიკური მასალის ორგანიზების შესახებ, ხოლო მემკვიდრეობითი დაავადებების შემთხვევაში გენეტიკურ მასალაში არსებული ანომალიების ბუნების შესახებ, რის შედეგადაც დაავადება. გენების ბიბლიოთეკიდან, თანამედროვე ტექნიკის გამოყენებით, შესაძლებელია საჭირო გენის ამოღება მის გარშემო არსებული გენომის რეგიონებით. დღეისათვის შექმნილია მრავალი მიკროორგანიზმის, მცენარისა და ცხოველის გენების სრული ბიბლიოთეკა (ძუძუმწოვართა და ადამიანებამდე). ადამიანის დნმ-ში რამდენიმე ასეული გენი და სხვა ნუკლეოტიდური თანმიმდევრობა უკვე კლონირებული და გარკვეულწილად შესწავლილია.
გენეტიკური ინჟინერიის კვლევის შესაძლებლობები არ შემოიფარგლება მხოლოდ გენის კლონირებით და მისი ასლების დიდი რაოდენობით მოპოვებით. ხშირად საჭიროა არა მხოლოდ გენის კლონირება, არამედ მისი ექსპრესიის უზრუნველყოფა უჯრედში, ანუ მასში არსებული ინფორმაციის დანერგვა ამ გენით კოდირებული ცილის პოლიპეპტიდური ჯაჭვის ამინომჟავის თანმიმდევრობაში. თუ ბაქტერიულ უჯრედში შეყვანილი გენი მიიღება იმავე (ან ახლო) სახეობის ბაქტერიებისგან, მაშინ შეიძლება საკმარისი იყოს გენის იზოლირება მარეგულირებელი ელემენტებით, რომლებიც აკონტროლებენ მის გამოხატვას. თუმცა, რამდენიმე გამონაკლისის გარდა, ევოლუციურად შორეული ორგანიზმების მარეგულირებელი ნუკლეოტიდური თანმიმდევრობები ურთიერთშემცვლელი არ არის. ამიტომ, მაგალითად, E. coli-ს უჯრედებში ევკარიოტული გენის ექსპრესიის მისაღწევად, მისგან ამოღებულია მარეგულირებელი რეგიონი და ასეთი გენის სტრუქტურული ნაწილი მიმაგრებულია (გარკვეულ მანძილზე) მარეგულირებელ რეგიონს. ბაქტერიული გენის. ამ ტექნიკის შემუშავებაში მნიშვნელოვანი პროგრესი მიღწეული იქნა Ba131 ნუკლეაზას ფერმენტის აღმოჩენის შემდეგ, რომელსაც აქვს უნიკალური თვისება ჰიდროლიზების ორჯაჭვიანი ხაზოვანი დნმ-ის მოლეკულის ორივე ჯაჭვის, მოლეკულის ბოლოდან დაწყებული, ანუ ეს ფერმენტი შლის „ზედმეტს. ”დნმ-ის ფრაგმენტის ბოლოდან ნებისმიერი სიგრძის ნუკლეოტიდური თანმიმდევრობები. ამჟამად, სტრუქტურული და მარეგულირებელი რეგიონები იზოლირებულია ცალ-ცალკე იმ ზღუდაზების გამოყენებით, რომელთა „ამოცნობის“ ადგილები ყველაზე წარმატებით განლაგებულია პოლინუკლეოტიდურ ჯაჭვზე, შემდეგ ამოღებულია „ზედმეტი“ ნუკლეოტიდური თანმიმდევრობები და უკავშირდება ევკარიოტული გენის სტრუქტურული რეგიონი. ბაქტერიული გენის მარეგულირებელი რეგიონი. ამ გზით შესაძლებელია ბაქტერიულ უჯრედებში არა მხოლოდ ევკარიოტული გენების ექსპრესიის მიღწევა, არამედ, პირიქით, ბაქტერიული გენების მაღალი და ქვედა ევკარიოტების უჯრედებში.
გენური ინჟინერიის მიღწევები მჭიდრო კავშირშია დნმ-ის მოლეკულებში ნუკლეოტიდური თანმიმდევრობის (სეკვევენირების) განსაზღვრის მეთოდების შემუშავებასა და გაუმჯობესებასთან. მკვლევართა განკარგულებაში არსებული შეზღუდვების მნიშვნელოვანი რაოდენობა შესაძლებელს ხდის დნმ-ის გარკვეული ფრაგმენტების აბსოლუტური სპეციფიკის იზოლირებას, ხოლო კლონირების მეთოდების შემუშავება და გაუმჯობესება შესაძლებელს ხდის უნიკალური გენების ფრაგმენტების მიღებას ანალიზისთვის საჭირო რაოდენობით. დნმ-ის თანმიმდევრობის მეთოდები იმდენად ეფექტურია, რომ ხშირად, დნმ-ის ნუკლეოტიდური თანმიმდევრობის განსაზღვრით, მიიღება მონაცემები ნუკლეოტიდის თანმიმდევრობის შესახებ რნმ-ის შესაბამის მოლეკულებში და ამინომჟავების ნარჩენების თანმიმდევრობაზე სინთეზირებულ ცილის მოლეკულაში. დნმ-ის თანმიმდევრობის შედეგების დამუშავებისას კომპიუტერები ფართოდ გამოიყენება. მიღებული ექსპერიმენტული მონაცემების უფრო სრულყოფილი და სწრაფი ინტერპრეტაციისთვის იქმნება ნუკლეოტიდური თანმიმდევრობების ეროვნული და საერთაშორისო კომპიუტერული „ბანკები“. დღეისათვის დადგენილია მთელი რიგი ბაქტერიული პლაზმიდების და ვირუსების გენომის სრული ნუკლეოტიდური თანმიმდევრობები და უკვე არის ცალკეული ქრომოსომების სრული ნუკლეოტიდური თანმიმდევრობების განსაზღვრის პრობლემა, შემდეგ კი უმაღლესი ორგანიზმების, მათ შორის ადამიანების მთელი გენომის განსაზღვრა. მოგვარდება.
გენეტიკური ინჟინერიის მეთოდების დახმარებით აღმოჩენილი იქნა ადამიანის გენების გარკვეული მონაკვეთების სტრუქტურაში გადახრები, რაც იყო მემკვიდრეობითი დაავადებების მიზეზი. ყველაზე ხშირად ეს მეთოდი ე.წ. ბ ლოტის ანალიზი. იზოლირებული უჯრედული დნმ ექვემდებარება რესტრიქციული ფერმენტის ჰიდროლიზს, შედეგად მიღებული ფრაგმენტები გამოყოფილია ზომის მიხედვით აგაროზის ან პოლიაკრილამიდის გელის ელექტროფორეზის გამოყენებით. გამოყოფილი ფრაგმენტები გადადის („ხელახლა ბეჭდვა“) სპეციალურად დამუშავებულ ქრომატოგრაფიულ ქაღალდზე, ნიტროცელულოზის ან ნეილონის ფილტრზე და კვლავ ექვემდებარება ელექტროფორეზულ გამოყოფას. ცალკეული ფრაქციების შესაბამისი და იგივე ტიპის დნმ-ის ფრაგმენტების შემცველი ელექტროფეროგრამების ადგილების ამოჭრა; ელექტროფორეგრამების მოჭრილი მონაკვეთები ინკუბირებულია ადრე კლონირებული გენით ან მისი ნაწილით, ან ქიმიურად მიღებული გენით. სინთეზი ნუკლეოტიდური თანმიმდევრობით, რომელიც შეიცავს რადიოაქტიურ ეტიკეტს. მონიშნული დნმ უკავშირდება მხოლოდ გაანალიზებული უჯრედული დნმ-ის იმ ფრაგმენტებს, ჭვავის ჭვავის აქვს ნუკლეოტიდების თანმიმდევრობა, რომლებიც მას ავსებენ. ნორმასთან შედარებით ფიქსირებული ეტიკეტის განაწილებისა და მოცულობის ცვლილება შესაძლებელს ხდის განვსაჯოთ ანალიზებულ გენში ან მის მიმდებარე ნუკლეოტიდულ თანმიმდევრობებში გადაკეთების შესახებ.
დნმ-ის მოლეკულაში გარკვეული რესტრიტაზების „აღიარების“ ადგილები არათანაბრად ნაწილდება, ამიტომ ამ ფერმენტების მიერ ჰიდროლიზის დროს დნმ-ის მოლეკულა იყოფა სხვადასხვა სიგრძის ფრაგმენტებად. დნმ-ის სტრუქტურის გადაკეთება, რის შედეგადაც ქრება ან ჩნდება არსებული „აღიარების“ ადგილები, იწვევს ამ ფრაგმენტების სიმრავლის ცვლილებას (ე.წ. შეზღუდვის ფრაგმენტები), ანუ შეზღუდვის ფრაგმენტის სიგრძის გამოჩენამდე. პოლიმორფიზმი (GVDRF). დნმ-ის მოლეკულის გადანაწილებამ შეიძლება გამოიწვიოს ან არ გამოიწვიოს ცვლილებები სინთეზის დროს ან კოდირებული ცილის სტრუქტურაში; გადაკეთებები, რომლებიც არ იწვევენ ცვლილებებს, უმეტესობაა და ისინი იწვევენ ნორმალურ RFLP-ს. აღმოჩნდა, რომ RFLP აშკარა გენეტიკური თვისებაა. ამჟამად, RFLP ანალიზი გახდა ერთ-ერთი ყველაზე ზუსტი მეთოდი, რომელიც გამოიყენება ადამიანის გენეტიკასა და სამედიცინო გენეტიკაში. რიგი მემკვიდრეობითი დაავადებებისთვის აღწერილია RFLP-ის ფორმები, რომლებიც პირდაპირ მიუთითებს დაავადების არსებობაზე ან პათოლოგიურად შეცვლილი გენის მატარებელზე.
გენეტიკური ინჟინერიით დაიწყო კვლევის ახალი მიმართულება, სახელწოდებით „გენეტიკა საპირისპიროში“. ტრადიციული გენეტიკური ანალიზი (იხ.) ტარდება შემდეგი თანმიმდევრობით: არჩეულია ნიშანი, დგინდება ნიშნის კავშირი გენეტიკურ დეტერმინანტთან და ამ განმსაზღვრელი ლოკალიზაცია უკვე ცნობილთან მიმართებაში. საპირისპირო გენეტიკაში ყველაფერი ხდება საპირისპირო თანმიმდევრობით: ირჩევა უცნობი ფუნქციის მქონე დნმ-ის ფრაგმენტი, დგინდება ამ დნმ-ის ფრაგმენტის კავშირი გენომის სხვა უბნებთან და მისი კავშირი გარკვეულ მახასიათებლებთან. ამ მიდგომამ შესაძლებელი გახადა ისეთი დაავადებების მატარებლების ადრეული დიაგნოსტიკისა და გამოვლენის მეთოდების შემუშავება, როგორიცაა ჰანტინგტონის ქორეა, დუშენის დაავადება, კისტოზური ფიბროზი, მემკვიდრეობითი დეფექტების ბიოქიმიური ბუნება, რომლებშიც ჯერ არ არის ცნობილი. ჰანტინგტონის ქორეის მემკვიდრეობითი გადაცემის ნიმუშების დასადგენად გენეალოგიური მეთოდის გამოყენებით ნაჩვენებია, რომ ადამიანის გენომიდან გამოყოფილი G8 დნმ-ის ფრაგმენტი მჭიდროდ არის დაკავშირებული დაავადების განმსაზღვრელ გენთან და ამ პოპულაციაში G8 RFLP ფრაგმენტის ფორმასთან. შეუძლია ამ დაავადების დიაგნოსტიკა და დეფექტური გენების მატარებლების იდენტიფიცირება.
ჯერ კიდევ ბევრი ტექნიკური სირთულეა გენური ინჟინერიაში გამოყენებული მეთოდების სამედიცინო პრაქტიკაში დანერგვის გზაზე. მრავალი ლაბორატორია მთელს მსოფლიოში აქტიურად ავითარებს პრაქტიკულად შესაფერის გენეტიკური ინჟინერიის დიაგნოსტიკის მეთოდებს და იმედოვნებენ, რომ მსგავსი მეთოდები იპოვის გამოყენებას უახლოეს მომავალში, თუ არა მასობრივი გენეტიკური სკრინინგისთვის (სკრინინგისთვის) მოსახლეობის სამედიცინო გამოკვლევის დროს, მაშინ, მინიმუმ, მემკვიდრეობითი დაავადებების მაღალი რისკის ჯგუფების შერჩევისთვის.
გენეტიკური ინჟინერია შესაძლებელს ხდის არა მხოლოდ ბუნებრივი ნაერთებისა და პროცესების კოპირებას, არამედ მათ შეცვლას და უფრო ეფექტურს. ამის მაგალითია კვლევის ახალი ხაზი, რომელსაც ეწოდება ცილის ინჟინერია. ამინომჟავების თანმიმდევრობისა და ცილის მოლეკულების სივრცითი ორგანიზაციის მონაცემების საფუძველზე ჩატარებული გამოთვლები აჩვენებს, რომ გარკვეული ამინომჟავების ნარჩენების გარკვეული ჩანაცვლებით რამდენიმე ფერმენტის მოლეკულებში, შესაძლებელია მათი ფერმენტული აქტივობის მნიშვნელოვანი ზრდა. იზოლირებულ გენში, რომელიც აკოდირებს კონკრეტული ფერმენტის სინთეზს, გარკვეული ნუკლეოტიდების მკაცრად კონტროლირებადი ჩანაცვლება ხორციელდება გენეტიკური ინჟინერიის მეთოდებით. ასეთი მოდიფიცირებული გენის კონტროლის ქვეშ მყოფი ფერმენტული ცილის სინთეზის დროს ხდება მკაცრად განსაზღვრული ამინომჟავების ნარჩენების წინასწარ დაგეგმილი ჩანაცვლება პოლიპეპტიდურ ჯაჭვში, რაც იწვევს ფერმენტული აქტივობის მრავალჯერ ზრდას ბუნებრივ აქტივობასთან შედარებით. პროტოტიპი.
სოფლის მეურნეობის სფეროში გენეტიკური ინჟინერიას დიდი წვლილი შეაქვს გვალვის, დაავადებებისა და მავნებლების მიმართ მდგრადი მაღალმოსავლიანი მცენარის ჯიშების შერჩევაში, აგრეთვე ახალი მაღალპროდუქტიული კულტურების ჯიშების განვითარებაში. ცხოველები.
როგორც მეცნიერების ნებისმიერი მიღწევა, გენეტიკური ინჟინერიის წარმატებები შეიძლება გამოყენებულ იქნას არა მხოლოდ სარგებლობისთვის, არამედ კაცობრიობის საზიანოდ. სპეციალურად ჩატარებულმა კვლევებმა აჩვენა, რომ რეკომბინანტული დნმ-ის უკონტროლო გავრცელების საშიშროება არც ისე დიდია, როგორც ადრე ეგონათ. რეკომბინანტული დნმ და ბაქტერიები, რომლებიც მათ ატარებენ, აღმოჩნდა ძალიან არასტაბილური გარემოზე ზემოქმედების მიმართ და არ იყო სიცოცხლისუნარიანი ადამიანებისა და ცხოველებისთვის. ცნობილია, რომ ბუნებაში და ადამიანის ჩარევის გარეშე არის პირობები, რომელიც უზრუნველყოფს გენეტიკური ინფორმაციის აქტიურ გაცვლას, ეს არის ე.წ. გენის ნაკადი. თუმცა, ბუნებამ შექმნა მრავალი ეფექტური ბარიერი უცხო გენეტიკური ინფორმაციის ორგანიზმში შეღწევისთვის. ამჟამად, აშკარაა, რომ უმეტეს რეკომბინანტულ დნმ-ის მოლეკულებთან მუშაობისას, ჩვეულებრივი სიფრთხილის ზომები საკმაოდ საკმარისია, ჭვავის გამოყენება გამოიყენება, მაგალითად, მიკრობიოლოგების მიერ ინფექციურ მასალასთან მუშაობისას. განსაკუთრებული შემთხვევებისთვის შემუშავებულია ეფექტური მეთოდები ექსპერიმენტული ობიექტების როგორც ბიოლოგიური დაცვის, ასევე ფიზიკური იზოლაციისთვის ადამიანებისა და გარემოსგან. ამიტომ, რეკომბინანტულ დნმ-თან მუშაობის წესების ძალიან მკაცრი პირველი ვერსიები გადაიხედა და მნიშვნელოვნად შემსუბუქდა. რაც შეეხება გენეტიკური ინჟინერიის მიღწევების მიზანმიმართულ გამოყენებას ადამიანებისთვის ზიანის მიყენების მიზნით, მეცნიერებმაც და საზოგადოებამაც აქტიურად უნდა იბრძოლონ იმისთვის, რომ ეს საფრთხე მხოლოდ თეორიულად იყოს შესაძლებელი.
აგრეთვე ბიოტექნოლოგია.
ბიბლიოგრაფია:ალიხანიანი S. I. გენეტიკური ინჟინერიის წარმატებები და პერსპექტივები, გენეტიკა, ტ.12, Jvft 7, გვ. 150, 1976, ბიბლიოგრ.; ალიხანიანი ს. I. et al., ფუნქციონირებადი რეკომბინანტების (ჰიბრიდული) დნმ-ის მოლეკულების მიღება, in vitro, იქვე, ტ.I, No11, გვ. 34, 1975, ბიბლიოგრ.; Baev A. A. გენეტიკური ინჟინერია, Priroda, M1, გვ. 8, 1976; ტიხომიროვა L.P. და სხვები. X ფაგის ჰიბრიდული დნმ-ის მოლეკულები და პლაზმიდები ColEl, Dokl. სსრკ მეცნიერებათა აკადემია, ტ.223, No4, გვ. 995, 1975, ბიბლიოგრ.; ყავისფერი D.D.a. S t e r n R. გენის იზოლაციის მეთოდები, ენ. რევ. ბიოქიმი., ვ. 43, გვ. 667, 1974, ბიბლიოგრ.; C h a n g A. C. Y. a. ო. თაგვის მიტოქონდრიული დნმ-ის კვლევები Escherichia coli-ში, Cell, v. 6, გვ. 231.1975, ბიბლიოგრ.; ჰეჯპეტ ჯ., გუდმენ ჰ.მ.ა. B o y e r H. W. დნმ ნუკლეოტიდური თანმიმდევრობა შეზღუდული R1 ენდონუკლეაზათ, Proc. ნათ. აკად. მეცნიერება. (Wash.), ვ. 69, გვ. 3448, 1972, ბიბლიოგრ.; ჰერშფილდ ვ.ა. ო. პლაზმიდი ColEl, როგორც მოლეკულური სატრანსპორტო საშუალება დნმ-ის კლონირებისა და გაძლიერებისთვის, იქვე, v. 71, გვ. 3455, 1974; მოროუ ჯ.ფ.ა. ო. ევკარიოტული დნმ-ის რეპლიკაცია და ტრანსკრიფცია Escherichia coli-ში, იქვე, გვ. 1743; თ ე მ ი ნ ჰ მ ა. Mizu-tani S. რნმ-დამოკიდებული დნმ-პოლიმერაზა Rous sarcoma virus-ის ვირიონებში, Nature (ლონდონი), v. 226, გვ. 1211, 1970 წ.
ბიოტექნოლოგია, რედ. A. A. Baeva, M., 1984; B დაახლოებით h-დან დაახლოებით N. P.-ში, Zakharov A. F. and Ivanov V. I. სამედიცინო გენეტიკა, M., 1984; მ ა ნ ი ა-ტის გ., ფრიჩე. და სამბრუკ ჯ. გენეტიკური ინჟინერიის მეთოდები. მოლეკულური კლონირება, ტრანს. ინგლისურიდან, მ., 1984; ა ნ ტ ო ნ ა რ ა კ ი ს ს ე ა. ო. დნმ-ის პოლიმორფიზმი და ადამიანის გლობინის გენების მტევნის მოლეკულური პათოლოგია, Hum. გენეტ., ვ. 69, გვ. 1, 1985; Beaudet A. L. კლონირებული ადამიანის და სხვა შერჩეული დნმ-ების ბიბლიოგრაფია, ამერ. J. hum. გენეტ., ვ. 37, გვ. 386, 1985; In o t s t e i n D. ა. ო. გენეტიკური კავშირის რუქის აგება ადამიანში შეზღუდვის ფრაგმენტის სიგრძის პოლიმორფიზმის გამოყენებით, იქვე, v. 32, გვ. 314, 1980; გ უ ს ე 1 1 ა ჯ ე ა. ო. დნმ მარკერები ნერვული სისტემის დაავადებებისათვის, მეცნიერება, ვ. 225, გვ. 1320, 1984; Motulsky A. G. გენეტიკური მანიპულაციის გავლენა საზოგადოებასა და მედიცინაზე, იქვე, ვ. 219, გვ. 135, 1983; თეთრი რ ა. ო. მჭიდროდ დაკავშირებული გენეტიკური მარკერი კისტოზური ფიბროზისთვის, Nature (ლონდონი), v. 318, გვ. 382, 1985; Wo o S. L. C., L i d s to y A. S. a. Guttler F. კლასიკური ფენილკეტონურიის პრენატალური დიაგნოზი გენის რუკებით, J. Amer. მედ. ასს., ვ. 251, გვ. 1998, 1984 წ.
L. S. Chernin, V. H. Kalinin.
გენეტიკური ინჟინერია
თანამედროვე ბიოლოგია ფუნდამენტურად განსხვავდება ტრადიციული ბიოლოგიისგან არა მხოლოდ შემეცნებითი იდეების განვითარების უფრო დიდი სიღრმით, არამედ საზოგადოების ცხოვრებასთან, პრაქტიკასთან უფრო მჭიდრო კავშირში. შეიძლება ითქვას, რომ ჩვენს დროში ბიოლოგია იქცა ცოცხალი სამყაროს გარდაქმნის საშუალებად საზოგადოების მატერიალური მოთხოვნილებების დასაკმაყოფილებლად. ეს დასკვნა, უპირველეს ყოვლისა, ილუსტრირებულია ბიოლოგიისა და ბიოტექნოლოგიის მჭიდრო ურთიერთობით, რომელიც გახდა მატერიალური წარმოების უმნიშვნელოვანესი სფერო, ადამიანის მიერ შექმნილი მექანიკური და ქიმიური ტექნოლოგიების, ასევე მედიცინის თანაბარი პარტნიორი.
დაარსების დღიდან ბიოლოგია და ბიოტექნოლოგია ყოველთვის ერთად ვითარდებოდა და თავიდანვე ბიოლოგია იყო ბიოტექნოლოგიის მეცნიერული საფუძველი. თუმცა, დიდი ხნის განმავლობაში, საკუთარი მონაცემების ნაკლებობა არ აძლევდა საშუალებას ბიოლოგიას ძალიან დიდი გავლენა მოეხდინა ბიოტექნოლოგიაზე. ვითარება მკვეთრად შეიცვალა მე-20 საუკუნის მეორე ნახევარში შექმნით. გენეტიკური ინჟინერიის მეთოდოლოგია,რაც გაგებულია, როგორც გენეტიკური მანიპულირება ახალი გენოტიპების აგებისა და რეკონსტრუქციის მიზნით. როგორც თავისი ბუნებით მეთოდური მიღწევა, გენეტიკურმა ინჟინერიამ არ გამოიწვია ბიოლოგიური ფენომენების შესახებ გაბატონებული იდეების რღვევა, არ იმოქმედა ბიოლოგიის ძირითად დებულებებზე, ისევე როგორც რადიოასტრონომიამ არ შეარყია ასტროფიზიკის ძირითადი დებულებები, დაარსება. "სითბოს მექანიკურმა ეკვივალენტმა" არ გამოიწვია სითბოს გამტარობის კანონების ცვლილება და მტკიცებულება მატერიის ატომისტურმა თეორიამ არ შეცვალა თერმოდინამიკის, ჰიდროდინამიკის და ელასტიურობის თეორიის ურთიერთობები (A.A. Baev).
მიუხედავად ამისა, გენეტიკურმა ინჟინერიამ გახსნა ახალი ერა ბიოლოგიაში იმ მიზეზით, რომ გაჩნდა ახალი შესაძლებლობები ბიოლოგიური ფენომენების სიღრმეში შეღწევისთვის, რათა შემდგომში დაეხასიათებინა ცოცხალი ნივთიერების არსებობის ფორმები, უფრო ეფექტურად შეისწავლოს გენების სტრუქტურა და ფუნქცია. მოლეკულურ დონეზე და გენეტიკური აპარატის მუშაობის დახვეწილი მექანიზმების გაგება. გენური ინჟინერიის მიღწევები თანამედროვეში რევოლუციას ნიშნავს
საბუნებისმეტყველო მეცნიერება. ისინი განსაზღვრავენ თანამედროვე იდეების ღირებულების კრიტერიუმებს ცოცხალი მატერიის მოლეკულური და ფიჭური დონის სტრუქტურული და ფუნქციური მახასიათებლების შესახებ. ცოცხალ არსებებზე თანამედროვე მონაცემები გიგანტური შემეცნებითი მნიშვნელობისაა, რადგან ისინი უზრუნველყოფენ ორგანული სამყაროს ერთ-ერთი ყველაზე მნიშვნელოვანი ასპექტის გაგებას და ამით ფასდაუდებელ წვლილს შეიტანენ სამყაროს მეცნიერული სურათის შექმნაში. ამრიგად, მკვეთრად გააფართოვა თავისი შემეცნებითი ბაზა, ბიოლოგიამ გენეტიკური ინჟინერიის საშუალებით ასევე მოახდინა წამყვანი გავლენა ბიოტექნოლოგიის აღზევებაზე.
გენეტიკური ინჟინერია ქმნის საფუძველს ახალი ან არსებული ორგანიზმების „დაპროექტების“ გზებისა და საშუალებების გასაგებად, რაც მათ დიდ ეკონომიკურ ღირებულებას და ბიოტექნოლოგიური პროცესების პროდუქტიულობის მკვეთრად გაზრდის უნარს აძლევს. თუმცა, გენური ინჟინერიამ მედიცინას ახალი ჰორიზონტები შეუქმნა მრავალი დაავადების დიაგნოსტიკისა და მკურნალობის სფეროში, როგორც არამემკვიდრეობითი, ისე მემკვიდრეობითი. მან გახსნა ახალი გზები მედიცინაში გამოყენებული ახალი წამლებისა და მასალების ძიებაში. გენეტიკურმა ინჟინერიამ და ბიოტექნოლოგიამ ხელი შეუწყო ბიონანოტექნოლოგიური მეთოდების განვითარებას.
გენეტიკური ინჟინერიის ფარგლებში არსებობს გენეტიკურიდა ფიჭურისაინჟინრო. გენეტიკური ინჟინერია არის მანიპულირება რეკომბინანტული დნმ-ის მოლეკულების შესაქმნელად. ამ მეთოდოლოგიას ხშირად მოიხსენიებენ როგორც მოლეკულურ კლონირებას, გენის კლონირებას, რეკომბინანტულ დნმ ტექნოლოგიას ან უბრალოდ გენეტიკურ მანიპულირებას. მნიშვნელოვანია აღინიშნოს, რომ გენეტიკური ინჟინერიის ობიექტია დნმ-ის მოლეკულები, ინდივიდუალური გენები. პირიქით, უჯრედული ინჟინერია გაგებულია, როგორც გენეტიკური მანიპულაციები იზოლირებულ ცალკეულ უჯრედებთან ან მცენარეთა და ცხოველთა უჯრედების ჯგუფებთან.
გენეტიკური ინჟინერია და მისი ინსტრუმენტები
გენეტიკური ინჟინერია არის სხვადასხვა ექსპერიმენტული მეთოდების (ტექნიკის) ერთობლიობა, რომელიც უზრუნველყოფს დნმ-ის მოლეკულების და გენების კონსტრუქციას (რეკონსტრუქციას), კლონირებას განსაზღვრული მიზნებით.
გენეტიკური ინჟინერიის მეთოდები გამოიყენება გარკვეული თანმიმდევრობით (სურ. 127) და შესრულებისას გამოიყოფა რამდენიმე ეტაპი.
ტიპიური გენეტიკური ინჟინერიის ექსპერიმენტი, რომელიც მიზნად ისახავს გენის კლონირებას, კერძოდ:
1. პლაზმური დნმ-ის გამოყოფა საინტერესო ორგანიზმის უჯრედებიდან (საწყისი) და დნმ ვექტორის იზოლაცია.
2. თავდაპირველი ორგანიზმის დნმ-ის დაჭრა (შეზღუდვა) საინტერესო გენების შემცველ ფრაგმენტებად ერთ-ერთი შემზღუდველი ფერმენტის გამოყენებით და ამ გენების გამოყოფა შემაკავებელი ნარევიდან. ამავდროულად, ვექტორული დნმ იჭრება (შეიზღუდება), წრიული სტრუქტურიდან ხაზოვანში აქცევს.
3. დნმ-ის საინტერესო სეგმენტის (გენის) დაკავშირება ვექტორულ დნმ-თან ჰიბრიდული დნმ-ის მოლეკულების მისაღებად.
4. რეკომბინანტული დნმ-ის მოლეკულების შეყვანა სხვა ორგანიზმში გარდაქმნით, მაგალითად, E. coliან სომატური უჯრედები.
5. ბაქტერიების ინოკულაცია, რომელშიც შეყვანილი იყო ჰიბრიდული დნმ-ის მოლეკულები, მკვებავ გარემოზე, რაც მხოლოდ ჰიბრიდული დნმ-ის მოლეკულების შემცველი უჯრედების ზრდის საშუალებას იძლევა.
6. ჰიბრიდული დნმ-ის მოლეკულების შემცველი ბაქტერიებისგან შემდგარი კოლონიების იდენტიფიცირება.
7. კლონირებული დნმ-ის (კლონირებული გენების) გამოყოფა და მისი დახასიათება, კლონირებულ დნმ-ის ფრაგმენტში აზოტოვანი ფუძეების თანმიმდევრობის ჩათვლით.
ბრინჯი. 127.გენეტიკური ინჟინერიის ექსპერიმენტის თანმიმდევრული ეტაპები
ევოლუციის პროცესში ბაქტერიებს განუვითარდათ ეგრეთ წოდებული რესტრიქციული ფერმენტების (ენდონუკლეაზების) სინთეზის უნარი, რომლებიც გახდა უჯრედული (ბაქტერიული) შეზღუდვა-მოდიფიკაციის სისტემის ნაწილი. ბაქტერიებში შეზღუდვა-მოდიფიკაციის სისტემები წარმოადგენს უჯრედშიდა იმუნურ თავდაცვის სისტემას უცხო დნმ-ისგან. განსხვავებით უმაღლესი ორგანიზმებისგან, რომლებშიც ვირუსების, ბაქტერიების და სხვა პათოგენების ამოცნობა და განადგურება ხდება უჯრედგარეთ, ბაქტერიებში, დაცვა უცხო დნმ-ისგან (მცენარეთა და ცხოველის დნმ, რომელშიც ისინი ცხოვრობენ) ხდება უჯრედშიდა, ე.ი. როდესაც უცხო დნმ შედის ბაქტერიების ციტოპლაზმაში. საკუთარი თავის დასაცავად, ბაქტერიებს ასევე განუვითარდათ უნარი „მონიშნოთ“ საკუთარი დნმ მეთილაციური ბაზებით კონკრეტულ თანმიმდევრობებზე. ამავე მიზეზით, უცხო დნმ, მასში მეთილის ჯგუფების არარსებობის გამო, იმავე თანმიმდევრობებზე, დნება (იჭრება) ფრაგმენტებად სხვადასხვა ბაქტერიული შეზღუდვის ფერმენტებით, შემდეგ კი ბაქტერიული ეგზონუკლეაზებით იშლება ნულეოტიდებად. შეგვიძლია ვთქვათ, რომ ამ გზით ბაქტერიები იცავენ თავს მცენარეებისა და ცხოველების დნმ-ისგან, რომელთა ორგანიზმში ისინი ცხოვრობენ დროებით (როგორც პათოგენები) ან მუდმივად (როგორც საპროფიტები).
შეზღუდვის ფერმენტები პირველად იზოლირებული იყო E. coli 1968 წელს. აღმოჩნდა, რომ მათ შეუძლიათ შეზღუდვის სხვადასხვა ადგილას (ადგილებზე) დნმ-ის მოლეკულების მოჭრა (დნობა). ამ ფერმენტებს ეწოდა I კლასის ენდონუკლეაზები, შემდეგ კი II კლასის ენდონუკლეაზები აღმოაჩინეს ბაქტერიებში, რომლებიც სპეციალურად ცნობენ შეზღუდვის ადგილებს უცხო დნმ-ში და ასევე ახორციელებენ შეზღუდვას ამ ადგილებში. სწორედ ამ კლასის ფერმენტებმა დაიწყეს გამოყენება გენური ინჟინერიაში. ამავდროულად, III კლასის ფერმენტები აღმოაჩინეს, რომლებიც დნმ დნმ-ს ამოცნობის ადგილებთან ახლოს, მაგრამ ამ ფერმენტებს გენეტიკურ ინჟინერიაში არანაირი მნიშვნელობა არ აქვთ.
შეზღუდვა-მოდიფიკაციის სისტემის მოქმედების „რაციონალიზაცია“ ხდება აზოტოვანი ფუძეების ეგრეთ წოდებული პალინდრომული (გამცნობი) თანმიმდევრობებით, რომლებიც წარმოადგენს დნმ-ის შეზღუდვის ადგილებს. პალინდრომული მიმდევრობები არის ფუძეების თანმიმდევრობა, რომლებიც იკითხება ერთნაირად წინ და უკან, როგორიცაა ასოების თანმიმდევრობა რადარი.ვინაიდან დნმ-ის ძაფებს აქვთ ანტიპარალელური მიმართულება, მიმდევრობა ითვლება პალინდრომულად, თუ ის იდენტურია, როდესაც იკითხება 5"-დან 3"-მდე ბოლო მიმართულებით და ქვედა ჯაჭვში 3"-დან 5"-მდე. დასასრული, კერძოდ:

პალინდრომები შეიძლება იყოს ნებისმიერი ზომის, მაგრამ პალინდრომების უმეტესობა, რომლებიც გამოიყენება როგორც შეზღუდვის ფერმენტის ამოცნობის ადგილი, არის 4, 5, 6 და იშვიათად 8 ბაზის სიგრძე.
შეზღუდვის ფერმენტები არის აბსოლუტურად აუცილებელი ინსტრუმენტი გენური ინჟინერიაში დიდი დნმ-ის მოლეკულებიდან საინტერესო ფრაგმენტების (გენების) ამოკვეთისთვის. ვინაიდან ცნობილია 100-ზე მეტი შემაკავებელი ფერმენტი, ეს საშუალებას იძლევა შერჩევის შეზღუდვის ფერმენტები და ორიგინალური დნმ-დან ფრაგმენტების შერჩევითი ამოკვეთა.
რესტრიტაზების შესანიშნავი თვისება ის არის, რომ ისინი წარმოქმნიან მოლეკულების ჭრას დნმ-ის რამდენიმე ფრაგმენტად (შეზღუდვა) რაფებში, რის შედეგადაც მიღებულ ბოლოებზე ერთი ჯაჭვი მეორეზე გრძელია, რაც ქმნის ერთგვარ კუდს. ასეთ ბოლოებს (კუდებს) უწოდებენ "წებოვან" ბოლოებს, რადგან მათ შეუძლიათ თვითკომპლექტირება.
განვიხილოთ შეზღუდვის შედეგები ერთ-ერთი ყველაზე ცნობილი შეზღუდვის მაგალითზე EcoRIშეზღუდვა-მოდიფიკაციის სისტემიდან E. coi.იმის ნაცვლად, რომ დნობა დნმ-ს პალინდრომული ამომცნობი მიმდევრობის ცენტრში, ეს ფერმენტი დნობს დნმ-ს ცენტრის გარეთ და წარმოქმნის 4 თვითშემავსებელ ("წებოვან") ბოლოს, რომელიც შედგება სხვადასხვა რაოდენობის ნუკლეოტიდებისგან, კერძოდ:

ეს "წებოვანი" ბოლოები სასარგებლოა გენეტიკურ ინჟინერიაში, რადგან ისინი შეიძლება დაბალ ტემპერატურაზე დამატებით იყოს დაკავშირებული, რაც საშუალებას იძლევა ეფექტურად დაიხუროს დნმ-ის ფრაგმენტები.
ამოცნობის ადგილები და დნობის ადგილები სხვა შეზღუდვების შემთხვევაში განსხვავებული შინაარსია, კერძოდ:

დნმ-ის შეზღუდვის შემდეგ, შეზღუდვის დნმ-ის ფრაგმენტები (დნმ-შეზღუდვები) იზოლირებულია შემაკავებელი ნარევიდან, რომლებიც შემდეგ საჭიროა ვექტორთან ასოცირებისთვის. შეზღუდული დნმ იზოლირებულია ელექტროფორეზის გამოყენებით, რადგან ამ მეთოდით ძალიან ადვილია შეზღუდული დნმ-ის დანაწილება შეზღუდული ფრაგმენტების ზომისა და მუდმივი ელექტრული მუხტი-მასის თანაფარდობის გამო. ელექტროფორეზის დროს ელექტროფორეზის დროს ფრაგმენტები მიგრირდება მათ ზომაზე (მასაზე) დამოკიდებული. რაც უფრო დიდია (გრძელი) ფრაგმენტი, მით უფრო ნელა მოძრაობს ის ელექტრულ ველში. მასალა, რომელშიც ტარდება ელექტროფორეზი, არის არადამუხტული აგაროზა ან პოლიაკრილამიდი. ფრაგმენტების იდენტიფიცირებისთვის გამოიყენება ეთიდიუმის ბრომიდი, რომელიც აფერხებს ფრაგმენტებს, რაც იწვევს მათ უფრო მარტივ აღმოჩენას.
ელექტროფორეზის ეფექტურობა ძალიან მაღალია, ვინაიდან მისი გამოყენება შესაძლებელია 2-დან 50000 ფუძის ზომის ფრაგმენტების გამოსაყოფად.
ელექტროფორეზის შემდეგ, აგაროზის ფრაგმენტები იზოლირებულია სხვადასხვა მეთოდით. ზომის შედარების შედეგებზე დაყრდნობით
ერთიდაიგივე დნმ-ის შეზღუდვები, მიღებული სხვადასხვა შემაკავებელი ფერმენტების გამოყენებით, აგებს შეზღუდვის რუქებს, რომლებშიც ნაჩვენებია თითოეული გამოყენებული შეზღუდვის ფერმენტის შეზღუდვის ადგილი. პრაქტიკული თვალსაზრისით, შეზღუდვის რუქები შესაძლებელს ხდის არა მხოლოდ შეზღუდვების ზომის დადგენას, არამედ დნმ-ის მოლეკულებში გარკვეული გენების ლოკუსების ადგილმდებარეობის დადგენას.
ვინაიდან მაღალ ორგანიზმებში, ტრანსკრიფციის დროს, ჰეტეროგენული დნმ სინთეზირდება, კორექტირებულია დამუშავებით, გენეტიკურ ინჟინერიაში ჩვეულებრივ გამოიყენება დამატებითი დნმ (cDNA), რომელიც მიიღება mRNA შაბლონის გამოყენებით, რომელზეც საპირისპირო ტრანსკრიპტაზა სინთეზირებს ერთჯაჭვიან დნმ-ს. cDNA), რომელიც არის mRNA-ს ასლი. შემდგომში, ეს ერთჯაჭვიანი დნმ-ები გარდაიქმნება ორჯაჭვიან დნმ-ებად. ჩათვალეთ, რომ cDNA შეიცავს უწყვეტ ნუკლეოტიდურ თანმიმდევრობებს (ტრანსკრიბირებული და თარგმნილი). ეს არის cDNA, რომელიც გამოიყენება შეზღუდვისთვის.
დნმ-ის ფრაგმენტები (შეზღუდვები), რომლებიც იზოლირებულია ელექტროფორეზის შემდეგ აგაროზის გელებიდან, შეიძლება წინასწარ დაექვემდებაროს თანმიმდევრობას; განსაზღვრეთ მათი ნუკლეოტიდური თანმიმდევრობა. ამისთვის გამოიყენება ქიმიური და ფერმენტული თანმიმდევრობის მეთოდები. ქიმიური მეთოდი ეფუძნება რადიოაქტიური ფოსფორით (32 P) მარკირებული ფრაგმენტების მიღებას და ამ ფრაგმენტებიდან ერთ-ერთი ფუძის ამოღებას, რასაც მოჰყვება ამ ფრაგმენტების შემცველი გელების რადიოავტოგრაფიის შედეგების გათვალისწინება. ფერმენტული მეთოდი ეფუძნება იმ ფაქტს, რომ გაანალიზებული ფრაგმენტის ბოლოს შეჰყავთ ნუკლეოტიდი, რომელიც შემდეგ გამოიყენება სხვადასხვა ფრაგმენტების სინთეზში. ინ ვიტრო,გაანალიზებულია ნუკლეოტიდური თანმიმდევრობისთვის ელექტროფორეტულად. დნმ-ის მოლეკულაში სპეციფიკური ნუკლეოტიდური თანმიმდევრობების შესასწავლად გამოიყენეთ
ასევე დნმ-დნმ, რნმ-რნმ, დნმ-რნმ, ჩრდილოეთის ჰიბრიდიზაცია
და სამხრეთის ლაქები.
გენეტიკური ვექტორები. დნმ-ის სეგმენტს (გენს), რომელიც განკუთვნილია მოლეკულური კლონირებისთვის, უნდა შეეძლოს გამრავლება, როდესაც ის გადატანილია ბაქტერიულ უჯრედში, ე.ი. იყოს რეპლიკა. თუმცა მას ეს უნარი არ გააჩნია. ამიტომ, უჯრედებში კლონირებული გენების გადაცემისა და გამოვლენის უზრუნველსაყოფად ხდება მათი გაერთიანება ე.წ. გენეტიკურ ვექტორებთან. ამ უკანასკნელს უნდა ჰქონდეს მინიმუმ ორი თვისება. პირველ რიგში, ვექტორებს უნდა შეეძლოთ რეპლიკაცია
უჯრედებში და რამდენიმე ბოლოში. მეორეც, მათ უნდა დაუშვან ვექტორის შემცველი უჯრედების შერჩევა, ე.ი. ფლობენ მარკერს, რომლისთვისაც შესაძლებელია ვექტორის შემცველი უჯრედების კლონირებულ გენთან ერთად (რეკომბინანტული დნმ-ის მოლეკულები) არჩევა. ამ მოთხოვნებს აკმაყოფილებენ პლაზმიდები და ფაგები. პლაზმიდები კარგი ვექტორებია, რადგან ისინი რეპლიკონები არიან და შეიძლება შეიცავდეს გენებს ნებისმიერი ანტიბიოტიკის მიმართ რეზისტენტობისთვის, რაც საშუალებას აძლევს ბაქტერიების შერჩევას ამ ანტიბიოტიკის მიმართ რეზისტენტობისთვის და, შესაბამისად, ადვილად აღმოაჩენს რეკომბინანტული დნმ-ის მოლეკულებს.
(სურ. 128).
ბრინჯი. 128.ვექტორი pBRl
ვინაიდან არ არსებობს ბუნებრივი პლაზმიდური ვექტორები, აქამდე ცნობილი ყველა პლაზმიდური ვექტორი ხელოვნურად არის აგებული. R-პლაზმიდები იყო საწყისი მასალა რიგი გენეტიკური ვექტორების შესაქმნელად, რომლებშიც დნმ-ის გადაჭარბებული თანმიმდევრობები, მათ შორის მრავალი შეზღუდვის ადგილის მქონე, ამოღებულ იქნა რესტრიტაზების დახმარებით. ეს მოცილება განისაზღვრა იმით, რომ პლაზმიდურ ვექტორს უნდა ჰქონდეს მხოლოდ ერთი ამომცნობი ადგილი ერთი შეზღუდვის ფერმენტისთვის და ეს ადგილი უნდა იყოს პლაზმური გენომის ფუნქციურად უმნიშვნელო რეგიონში. მაგალითად, pBR 322 პლაზმიდური ვექტორი, რომელსაც აქვს ამპიცილინის და ტეტრაციკლინის წინააღმდეგობის გენები, რაც მას ძალიან კომფორტულს ხდის.
კლონირებული დნმ-ის სეგმენტის შემცველი ბაქტერიების შერჩევისთვის, მას აქვს ერთი შეზღუდვის ადგილი 20-ზე მეტი შემაკავებელი ფერმენტისთვის, მათ შორის ისეთი ცნობილი შემზღუდველი ფერმენტები, როგორიცაა Eco RI, Hind III, Pst I, Pva II და Sal I.
ფაგის ვექტორებს ასევე აქვთ მრავალი უპირატესობა. ისინი შეიძლება შეიცავდეს უფრო დიდ (გრძელ) კლონირებულ დნმ-ის ფრაგმენტებს პლაზმის ვექტორებთან შედარებით. გარდა ამისა, ფაგების მიერ კლონირებული ფრაგმენტის გადატანა უჯრედებში ამ უკანასკნელის ინფექციის შედეგად უფრო ეფექტურია, ვიდრე დნმ-ის ტრანსფორმაცია. დაბოლოს, ფაგის ვექტორები იძლევა კლონირებული გენის მატარებელი უჯრედების შემცველი კოლონიების აგარის ზედაპირზე უფრო ეფექტურ სკრინინგს (აღიარებას). ბევრი ფაგის ვექტორი ეფუძნება ლამბდა ფაგს.
გარდა ფაგისა, ასევე გამოიყენება ჰერპესის ვირუსის საფუძველზე აგებული სხვა ვირუსული ვექტორები, აგრეთვე საფუარის დნმ-ის საფუძველზე აგებული ვექტორები.
თუ გენის კლონირება ხორციელდება ძუძუმწოვრების ან მცენარის უჯრედების გამოყენებით, მაშინ ვექტორების მიმართ მოთხოვნები იგივეა, რაც ბაქტერიულ უჯრედებში კლონირების შემთხვევაში.
რეკომბინანტული დნმ-ის მოლეკულების აგება. რეკომბინანტული დნმ-ის მოლეკულების პირდაპირი კონსტრუქცია ხდება შესწავლილი დნმ-ის და ვექტორული დნმ-ის შეზღუდვის მიღების შემდეგ. იგი შედგება შესწავლილი დნმ-ის შეზღუდვის სეგმენტების დახურვაში ვექტორული დნმ-ის შეზღუდვით, რომელიც, შეზღუდვის შედეგად, წრიული დნმ-დან წრფივში გადადის.
ვექტორის დნმ-ით შესასწავლი დნმ-ის ფრაგმენტების დასახურავად გამოიყენება დნმ ლიგაზა (სურ. 129). ლიგირება წარმატებული იქნება, თუ შესაერთებელ სტრუქტურებს ექნებათ 3'-ჰიდროქსილის და 5'-ფოსფატის ჯგუფები და თუ ეს ჯგუფები განლაგებულია ერთმანეთთან შესაბამის მიმართებაში. ფრაგმენტები შერწყმულია მათი „წებოვანი“ ბოლოების მეშვეობით თვითკომპლიმენტურობის შედეგად. ფრაგმენტების მაღალი კონცენტრაციის დროს ეს უკანასკნელი დროდადრო სწორ პოზიციაში ხვდება (ერთმანეთის საპირისპიროდ). ბევრი შეზღუდვა, როგორიცაა Eco RI, წარმოქმნის ოთხფუძიან "წებოვან" ბოლოებს. ოთხი ფუძისაგან შემდგარი „წებოვანი“ ბოლოების დამაგრების პროცესი ხდება დაბალ ტემპერატურაზე (12? C-მდე).

ბრინჯი. 129.დნმ-ის ლიგირება
თუ შეზღუდვისას წარმოიქმნება ფრაგმენტები „წებოვანი“ ბოლოების გარეშე, მაშინ ისინი ტრანსფერაზას ფერმენტის გამოყენებით „იძულებით“ გარდაიქმნება მოლეკულებად „წებოვანი“ ბოლოებით. ეს ფერმენტი ამატებს ნუკლეოტიდებს დნმ-ის 3" ბოლოში. ერთ ფრაგმენტზე შეიძლება დაემატოს პოლი-A კუდი, მეორეზე პოლი-T კუდი. პოლიმერაზული ჯაჭვური რეაქცია (PCR) ასევე გამოიყენება ნებისმიერი სასურველი დნმ-ის ბოლოების შესაქმნელად. PCR-ის პრინციპი ემყარება უჯრედებიდან გამოყოფილი დნმ-ის დენატურაციას და მის „ანილირებას“ დნმ-ის ოლიგონუკლეოტიდის დამატებით, რომელიც შედგება 15-20 ნუკლეოტიდისგან, რენატურაციულ ჯაჭვებში. 50-2000 ნუკლეოტიდი.დნმ-ის სინთეზი ინ ვიტრო,ისინი საშუალებას აძლევს დნმ პოლიმერაზას დააკოპიროს ის რეგიონები, რომლებიც "თესლებს" შორისაა. ეს კოპირება იძლევა შესწავლილი დნმ-ის ფრაგმენტის ასლების დიდ რაოდენობას.
რეკომბინანტული დნმ-ის მოლეკულების შეყვანა უჯრედებში. მას შემდეგ, რაც საინტერესო დნმ-ის ფრაგმენტი (გენი) შერწყმულია გენეტიკურ ვექტორთან დნმ ლიგაზას გამოყენებით, შედეგად მიღებული რეკომბინანტული მოლეკულები შეჰყავთ უჯრედებში მათი რეპლიკაციის მისაღწევად (გენეტიკური ვექტორის გამო) და ასლების რაოდენობის გაზრდის მიზნით. რეკომბინანტული დნმ-ის მოლეკულების უჯრედებში შეყვანის ყველაზე პოპულარული გზა, რომელშიც ვექტორი არის პლაზმიდი, არის ტრანსფორმაცია. E. coli.ამ მიზნით ბაქტერიული უჯრედები წინასწარ მუშავდება კალციუმით ან რუბიდიუმით (იონებით), რათა
რათა ისინი გახდნენ „კომპეტენტური“ რეკომბინანტული დნმ-ის აღქმაში. უჯრედებში დნმ-ის შეღწევის სიხშირის გასაზრდელად გამოიყენება ელექტროპორაციის მეთოდი, რომელიც მოიცავს უჯრედების ხანმოკლე ზემოქმედებას ინტენსიურ ელექტრულ ველზე. ეს მკურნალობა ქმნის ღრუს უჯრედის მემბრანებში, რაც აადვილებს უჯრედებს დნმ-ის აღებას. ბაქტერიებში რეკომბინანტული დნმ-ის მოლეკულების შეყვანის შემდეგ, ეს უკანასკნელი ითესება ანტიბიოტიკებით გამდიდრებულ MPA-ზე (ხორც-პეპტონ აგარი) სასურველი უჯრედების შესარჩევად, ე.ი. უჯრედები, რომლებიც შეიცავს რეკომბინანტულ დნმ-ის მოლეკულებს. ტრანსფორმაციის სიხშირე დაბალია. როგორც წესი, ერთი ტრანსფორმანტი ხდება 10 5 დათესილ უჯრედზე. თუ ვექტორი არის ფაგი, მაშინ უჯრედები (ბაქტერიები ან საფუარი) გადაიჭრება ფაგით. რაც შეეხება ცხოველთა სომატურ უჯრედებს, ისინი დნმ-ით გადაიცემა ქიმიკატების თანდასწრებით, რომლებიც ხელს უწყობენ დნმ-ის გავლას პლაზმური მემბრანების მეშვეობით. ასევე შესაძლებელია დნმ-ის პირდაპირი მიკროინექცია კვერცხუჯრედებში, კულტივირებულ სომატურ უჯრედებში და ძუძუმწოვრების ემბრიონებში.
მოლეკულურ კლონირებასთან დაკავშირებული ყველაზე მნიშვნელოვანი პუნქტი არის მეთოდის ძიება, რათა დადგინდეს, კლონირებული ფრაგმენტი ნამდვილად შედის თუ არა ვექტორში და ვექტორთან ერთად, რომელიც ქმნის რეკომბინანტულ დნმ-ის მოლეკულას, შედის უჯრედებში. თუ ვსაუბრობთ ბაქტერიულ უჯრედებზე, მაშინ ერთ-ერთი მეთოდი ეფუძნება პლაზმური (ვექტორის) რეზისტენტობის გენის ჩანერგვის ინაქტივაციის გათვალისწინებას. მაგალითად, პლაზმიდურ ვექტორში pBR 322, რომელიც განსაზღვრავს რეზისტენტობას ამპიცილინისა და ტეტრაციკლინის მიმართ, Pst I შეზღუდვის ფერმენტის ერთადერთი ადგილი მდებარეობს იმ ლოკუსში, რომელსაც იკავებს ამპიცილინის რეზისტენტობის გენი. Pst I ამ ადგილას დნობისას წარმოქმნის წებოვან ბოლოებს, რაც საშუალებას იძლევა კლონირებული ფრაგმენტის მიმაგრება ვექტორულ დნმ-თან. თუმცა, ამ შემთხვევაში, პლაზმიდური (ვექტორი) ამპიცილინის რეზისტენტობის გენი ინაქტივირებულია, ხოლო ტეტრაციკლინის წინააღმდეგობის გენი ვექტორზე ხელუხლებელი რჩება. ეს არის ტეტრაციკლინის წინააღმდეგობის გენი, რომელიც გამოიყენება რეკომბინანტული დნმ-ის მოლეკულებით გარდაქმნილი უჯრედების შესარჩევად. ეს შესაძლებელს ხდის გადაამოწმოს, რომ ტეტრაციკლინით გარემოზე გაზრდილი კოლონიების უჯრედები მართლაც შეიცავს რეკომბინანტულ დნმ-ის მოლეკულებს. შეიცავს ამპიცილინს, მეორე კი ამ ანტიბიოტიკს მოკლებულია. კლონირებადი დნმ არის
მხოლოდ ტეტრაციკლინისადმი რეზისტენტული ტრანსფორმანტებში. რაც შეეხება ტრანსფორმანტებს, რომლებიც რეზისტენტულია როგორც ამპიცილინის, ასევე ტეტრაციკლინის (ArTc) მიმართ, ისინი შეიცავს პლაზმიდურ (ვექტორ) მოლეკულებს, რომლებმაც სპონტანურად შეიძინეს წრიული ფორმა უცხო (კლონირებული) დნმ-ის გარეშე.
პლაზმიდურ ვექტორში უცხო (კლონირებული) ფრაგმენტების შეყვანის კიდევ ერთი მეთოდი ეფუძნება β-გალაქტოზიდაზას გენის შემცველ ვექტორის გამოყენებას. ამ გენში უცხო დნმ-ის შეყვანა გარდაუვალად ააქტიურებს β-გალაქტოზიდაზას სინთეზს, რომელიც შეიძლება გამოვლინდეს ტრანსფორმირებული უჯრედების დათესვით გარემოზე, რომელიც შეიცავს β-გალაქტოზიდაზას სუბსტრატს. ეს საშუალება იძლევა შეღებილი უჯრედების კოლონიების შერჩევას. არის სხვა მეთოდებიც.
როგორც უკვე აღვნიშნეთ, ვექტორული დნმ-ის ხაზოვანი შეზღუდვის ფრაგმენტებს შეუძლიათ აღადგინონ წრიული სტრუქტურა მათში კლონირებული სეგმენტების ჩართვის გარეშე. ასეთი წრიული ვექტორის დნმ-ის მოლეკულების სპონტანური წარმოქმნის სიხშირის შესამცირებლად, ვექტორული დნმ-ის შეზღუდვა მკურნალობს ფოსფატაზას. შედეგად, წრიული დნმ-ის მოლეკულების ფორმირება შეუძლებელი ხდება, რადგან ლიგაზას მოქმედებისთვის აუცილებელი 5'-PO 4 ბოლოები არ იქნება.
სელექციურ გარემოზე გაზრდილი ტრანსფორმაციული კოლონიების ნაკრები არის უჯრედების ნაკრები, რომელიც შეიცავს კლონირებული გენომის ან cDNA-ს სხვადასხვა ფრაგმენტების (გენების) კლონებს. ამ კლონების კოლექციები ქმნიან ეგრეთ წოდებულ დნმ ბიბლიოთეკებს, რომლებიც ფართოდ გამოიყენება გენური ინჟინერიაში.
გენის კლონირების საბოლოო ეტაპი არის კლონირებული დნმ-ის იზოლაცია და შესწავლა, თანმიმდევრობის ჩათვლით. ბაქტერიების ან სომატური უჯრედების პერსპექტიული შტამები, რომლებიც შეიცავს რეკომბინანტულ დნმ-ის მოლეკულებს, რომლებიც აკონტროლებენ საინტერესო ცილების სინთეზს, რომლებსაც აქვთ კომერციული ღირებულება, გადაეცემა ინდუსტრიას.
უჯრედის ინჟინერია
როგორც თავის დასაწყისში აღინიშნა, უჯრედული ინჟინერია ეხება ცხოველთა და მცენარეთა იზოლირებული უჯრედების გენეტიკურ მანიპულირებას. ეს მანიპულაციები ხშირია ინ ვიტრო,და მათი მთავარი მიზანია მოიპოვონ ამ ორგანიზმების გენოტიპები სასურველი თვისებებით, პირველ რიგში ეკონომიკურად სასარგებლო. რაც შეეხება -
Xia კაცი, მაშინ უჯრედული ინჟინერია მისი ჩანასახის უჯრედებისთვის იყო გამოყენებული.
ადამიანებში და ცხოველებში უჯრედული ინჟინერიის განვითარების წინაპირობა იყო მათი სომატური უჯრედების კულტივირების მეთოდების შემუშავება ხელოვნურ საკვებ მედიაზე, ასევე სომატური უჯრედების ჰიბრიდების მიღებას, მათ შორის სახეობებს შორის ჰიბრიდებს. თავის მხრივ, სომატური უჯრედების გაშენების მიღწევებმა გავლენა მოახდინა ჩანასახოვანი უჯრედების შესწავლაზე და განაყოფიერებაზე ადამიანებში და ცხოველებში. 60-იანი წლებიდან. მე -20 საუკუნე მრავალი ექსპერიმენტი ჩატარდა მსოფლიოს რამდენიმე ლაბორატორიაში სომატური უჯრედის ბირთვების გადანერგვის კვერცხებში ხელოვნურად ბირთვებისგან დაცლილ კვერცხებში. ამ ექსპერიმენტების შედეგები ხშირად ურთიერთგამომრიცხავი იყო, მაგრამ მთლიანობაში მათ გამოავლინეს უჯრედის ბირთვების უნარი, უზრუნველყონ კვერცხუჯრედის ნორმალური განვითარება (იხ. თავი IV).
60-იან წლებში განაყოფიერებული კვერცხუჯრედების განვითარების შესწავლის შედეგებზე დაყრდნობით. მე -20 საუკუნე ასევე დაიწყო კვლევები დედის სხეულის გარეთ კვერცხუჯრედების განაყოფიერების შესაძლებლობის დასადგენად. ძალიან სწრაფად, ამ კვლევებმა გამოიწვია კვერცხუჯრედების სპერმატოზოიდებით განაყოფიერების შესაძლებლობა in vitro და ამ გზით წარმოქმნილი ემბრიონების შემდგომი განვითარება ქალის საშვილოსნოში ჩანერგვისას. ამ სფეროში შემუშავებული მეთოდების შემდგომმა დახვეწამ განაპირობა ის, რომ „სინჯ-მილის“ ბავშვების დაბადება რეალობად იქცა. უკვე 1981 წლისთვის მსოფლიოში 12 ბავშვი დაიბადა, რომელთა სიცოცხლეც ლაბორატორიაში, სინჯარაში გადაეცა. დღეისათვის უჯრედების ინჟინერიის ეს განყოფილება ფართოდ გავრცელდა და „სატესტო მილის“ ბავშვების რაოდენობა უკვე ათიათასს აღწევს (სურ. 130). რუსეთში „სატესტო მილის“ ბავშვების მოპოვებაზე მუშაობა მხოლოდ 1986 წელს დაიწყო.
1993 წელს შემუშავდა ტექნიკა მონოზიგოტური ადამიანის ტყუპების მისაღებად ინ ვიტროემბრიონების ბლასტომერებად დაყოფით და ამ უკანასკნელის 32 უჯრედამდე გაზრდით, რის შემდეგაც შესაძლებელი იყო მათი იმპლანტაცია ქალის საშვილოსნოში.
ტესტის მილის ჩვილებთან დაკავშირებული შედეგების გავლენით ცხოველებმა ასევე შეიმუშავეს ტექნოლოგია ე.წ გადანერგვებიემბრიონები. იგი დაკავშირებულია პოლიოვულაციის გამოწვევის მეთოდის შემუშავებასთან, კვერცხუჯრედების ხელოვნური განაყოფიერების მეთოდებთან და ემბრიონების იმპლანტაციასთან ცხოველთა - აღმზრდელ დედების ორგანიზმში. ამ ტექნოლოგიის არსი შემდეგია:
შუსში. მაღალპროდუქტიულ ძროხას უსვამენ ჰორმონებს, რის შედეგადაც ხდება პოლიოვულაცია, რომელიც შედგება 10-20 უჯრედის ერთდროულად მომწიფებაში. შემდეგ კვერცხუჯრედები ხელოვნურად განაყოფიერდება მამრობითი რეპროდუქციული უჯრედებით კვერცხუჯრედში. მე-7-8 დღეს ემბრიონები საშვილოსნოდან გამოირეცხება და გადანერგილია სხვა ძროხების საშვილოსნოში (მიმღები დედა), რომლებიც შემდეგ ტყუპ ხბოებს შობენ. ხბოები მემკვიდრეობით იღებენ ორიგინალური მშობლების გენეტიკურ სტატუსს.

ბრინჯი. 130."ტუბი" ბავშვები
ცხოველებში უჯრედული ინჟინერიის კიდევ ერთი სფეროა ტრანსგენური ცხოველების შექმნა. ასეთი ცხოველების მისაღებად უმარტივესი გზაა დნმ-ის ხაზოვანი მოლეკულების შეყვანა ორიგინალური ცხოველების კვერცხებში. ცხოველები, რომლებიც განვითარდებიან ასე განაყოფიერებული კვერცხუჯრედებიდან, ატარებენ შეყვანილი გენის ასლს მათ ერთ-ერთ ქრომოსომაში და გარდა ამისა, ისინი გადასცემენ ამ გენს მემკვიდრეობით. ტრანსგენური ცხოველების მიღების უფრო რთული მეთოდი შემუშავდა თაგვებზე, რომლებიც განსხვავდებიან ქურთუკის ფერით და ასეთია. პირველ რიგში, ოთხდღიანი ემბრიონები ამოღებულია ორსული ნაცრისფერი თაგვის სხეულიდან და დაჭყლეტილია ცალკეულ უჯრედებში. შემდეგ ბირთვები ამოღებულია ემბრიონის უჯრედებიდან, ისინი გადააქვთ შავი თაგვების კვერცხებში, რომლებიც ადრე მოკლებულია ბირთვებს. უცხო ბირთვების შემცველი შავი თაგვის კვერცხები მოთავსებულია სინჯარებში
მკვებავი ხსნარით შემდგომი განვითარებისთვის. შავი თაგვების კვერცხებიდან განვითარებული ემბრიონები იმპლანტირებულია თეთრი თაგვების საშვილოსნოში. ამრიგად, ამ ექსპერიმენტებში შესაძლებელი გახდა თაგვების კლონი ნაცრისფერი ქურთუკის ფერის, ე.ი. სასურველი თვისებების მქონე ემბრიონის უჯრედების კლონირება. IV თავში ჩვენ განვიხილეთ ცხვრის კვერცხების ხელოვნურად დაცლილი ბირთვების განაყოფიერების შედეგები იმავე სახეობის ცხოველების სომატური უჯრედების ბირთვული მასალით. კერძოდ, ცხვრის კვერცხებიდან ამოიღეს ბირთვები, შემდეგ კი სომატური უჯრედების ბირთვები (ემბრიონული, ნაყოფი ან ზრდასრული ცხოველების უჯრედები) შეიყვანეს ასეთ კვერცხუჯრედში, რის შემდეგაც ამ გზით განაყოფიერებული კვერცხუჯრედები შეიყვანეს საშვილოსნოში. ზრდასრული ცხვარი. დაბადებული ბატკნები ცხვრის დონორის იდენტური აღმოჩნდა. ამის მაგალითია დოლი ცხვარი. ასევე მოპოვებულია ხბოების, თაგვების, კურდღლების, კატების, ჯორების და სხვა ცხოველების კლონირება. ტრანსგენური ცხოველების ასეთი კონსტრუქცია არის ეკონომიკურად სასარგებლო თვისებების მქონე ცხოველების, გარკვეული სქესის ინდივიდების ჩათვლით, კლონირების პირდაპირი გზა.
ტრანსგენური ცხოველები ასევე მიიღეს სხვადასხვა სახეობის წყაროს მასალის გამოყენებით. კერძოდ, ცნობილია გენის გადაცემის მეთოდი, რომელიც აკონტროლებს ზრდის ჰორმონს ვირთხებიდან თაგვის კვერცხებში, ასევე ცხვრის ბლასტომერების თხის ბლასტომერებთან შერწყმის მეთოდი, რამაც გამოიწვია ჰიბრიდული ცხოველების (ძროხების) გაჩენა. ეს ექსპერიმენტები მიუთითებს სახეობების შეუთავსებლობის დაძლევის შესაძლებლობაზე განვითარების ადრეულ ეტაპზე. განსაკუთრებით მაცდური პერსპექტივები იხსნება (თუ სახეობების შეუთავსებლობა მთლიანად დაძლეულია) ერთი სახეობის კვერცხუჯრედების განაყოფიერების გზაზე სხვა სახეობის სომატური უჯრედების ბირთვებით. საუბარია ცხოველების ეკონომიკურად ღირებული ჰიბრიდების შექმნის რეალურ პერსპექტივაზე, რომელთა მიღება შეუძლებელია გადაკვეთით.
უნდა აღინიშნოს, რომ ბირთვული ტრანსპლანტაციის სამუშაოები ჯერ კიდევ არ არის ძალიან ეფექტური. ამფიბიებსა და ძუძუმწოვრებზე ჩატარებულმა ექსპერიმენტებმა ზოგადად აჩვენა, რომ მათი ეფექტურობა დაბალია და ეს დამოკიდებულია დონორის ბირთვებსა და მიმღებ კვერცხუჯრედებს შორის შეუთავსებლობაზე. გარდა ამისა, შემდგომი განვითარების პროცესში გადანერგილ ბირთვებში წარმოქმნილი ქრომოსომული აბერაციები, რასაც თან ახლავს ტრანსგენური ცხოველების სიკვდილი, ასევე წარმოადგენს წარმატების დაბრკოლებას.
უჯრედების ჰიბრიდიზაციისა და იმუნოლოგიური კვლევების შესწავლაზე მუშაობის კვეთაზე წარმოიშვა პრობლემა, რომელიც დაკავშირებულია ეგრეთ წოდებული მონოკლონური ანტისხეულების წარმოებასთან და შესწავლასთან. როგორც ზემოთ აღინიშნა, ორგანიზმის მიერ ანტიგენის შეყვანის საპასუხოდ წარმოქმნილი ანტისხეულები (ბაქტერიები, ვირუსები, სისხლის წითელი უჯრედები და ა.შ.) არის პროტეინები, რომლებსაც იმუნოგლობულინები ჰქვია და ქმნიან ორგანიზმის თავდაცვის სისტემის ფუნდამენტურ ნაწილს პათოგენებისგან. მაგრამ სხეულში შეყვანილი ნებისმიერი უცხო სხეული არის სხვადასხვა ანტიგენის ნაზავი, რომელიც ასტიმულირებს სხვადასხვა ანტისხეულების გამომუშავებას. მაგალითად, ადამიანის ერითროციტებს აქვთ ანტიგენები არა მხოლოდ სისხლის ჯგუფებისთვის A (II) და B (III), არამედ მრავალი სხვა ანტიგენისთვის, მათ შორის Rh ფაქტორისთვის. გარდა ამისა, ბაქტერიული უჯრედის კედლის ცილები ან ვირუსების კაფსიდი ასევე შეიძლება იმოქმედონ როგორც სხვადასხვა ანტიგენი, რამაც გამოიწვიოს სხვადასხვა ანტისხეულების წარმოქმნა. ამავდროულად, სხეულის იმუნური სისტემის ლიმფოიდური უჯრედები, როგორც წესი, წარმოდგენილია კლონებით. ეს ნიშნავს, რომ მხოლოდ ამ მიზეზითაც კი, იმუნიზირებული ცხოველების სისხლის შრატში ანტისხეულები ყოველთვის არის ნარევი, რომელიც შედგება სხვადასხვა კლონის უჯრედების მიერ წარმოებული ანტისხეულებისგან. იმავდროულად, პრაქტიკული მიზნებისთვის საჭიროა მხოლოდ ერთი ტიპის ანტისხეულები; ეგრეთ წოდებული მონოსპეციფიკური შრატები, რომლებიც შეიცავს მხოლოდ ერთი ტიპის ანტისხეულებს ან, როგორც მათ უწოდებენ, მონოკლონურ ანტისხეულებს.
მონოკლონური ანტისხეულების მოპოვების მეთოდების ძიებაში შვეიცარიელმა მკვლევარებმა 1975 წელს აღმოაჩინეს თაგვის ლიმფოციტების ჰიბრიდიზაციის მეთოდი ამა თუ იმ ანტიგენით იმუნიზირებულ და ძვლის ტვინის კულტივირებულ სიმსივნურ უჯრედებს შორის. ასეთ ჰიბრიდებს „ჰიბრიდომას“ უწოდებენ. "ლიმფოციტური" ნაწილიდან, რომელიც წარმოდგენილია ერთი კლონის ლიმფოციტით, ერთი ჰიბრიდომა მემკვიდრეობით იღებს უნარს, გამოიწვიოს აუცილებელი ანტისხეულების წარმოქმნა და იგივე ტიპის, და "სიმსივნური (მიელომა)" ნაწილის წყალობით ხდება. შეუძლია, ისევე როგორც ყველა სიმსივნურ უჯრედს, განუსაზღვრელი ვადით გამრავლდეს ხელოვნურ საკვებ გარემოზე, რაც იძლევა ჰიბრიდების დიდ პოპულაციას. ნახ. 131 გვიჩვენებს მონოკლონური ანტისხეულების სინთეზირების უჯრედული ხაზების იზოლაციის სქემას. მონოკლონური ანტისხეულების წარმომქმნელი თაგვის უჯრედული ხაზები იზოლირებულია მიელომის უჯრედების ლიმფოციტებთან შერწყმით თაგვების ელენთადან, რომლებიც იმუნიზირებულია ხუთი დღის წინ.
სასურველი ანტიგენი. უჯრედების შერწყმა მიიღწევა მათი შერევით პოლიეთილენ გლიკოლის თანდასწრებით, რაც იწვევს უჯრედის მემბრანების შერწყმას და შემდეგ მათ საკვებ გარემოზე ინოკულაციას, რაც მხოლოდ ჰიბრიდული უჯრედების (ჰიბრიდომა) ზრდისა და რეპროდუქციის საშუალებას იძლევა. ჰიბრიდომების რეპროდუქცია ხორციელდება თხევად გარემოში, სადაც ისინი უფრო იზრდებიან და ანტისხეულებს გამოყოფენ კულტურის სითხეში და მხოლოდ ერთი ტიპის, უფრო მეტიც, შეუზღუდავი რაოდენობით. ამ ანტისხეულებს მონოკლონური ეწოდება. ანტისხეულების წარმოქმნის სიხშირის გასაზრდელად მიმართავენ ჰიბრიდომის კლონირებას, ე.ი. ჰიბრიდომების ცალკეული კოლონიების შერჩევას, რომლებსაც შეუძლიათ გამოიმუშავონ სასურველი ტიპის ანტისხეულების უდიდესი რაოდენობა. მონოკლონურმა ანტისხეულებმა ფართო გამოყენება ჰპოვა მედიცინაში რიგი დაავადებების დიაგნოსტიკისა და მკურნალობისთვის. ამავდროულად, მონოკლონური ტექნოლოგიის ყველაზე მნიშვნელოვანი უპირატესობა ის არის, რომ მისი გამოყენება შესაძლებელია ანტისხეულების წარმოქმნის მიზნით იმ მასალების წინააღმდეგ, რომლებიც არ შეიძლება განიწმინდოს. პირიქით, შესაძლებელია მონოკლონური ანტისხეულების მიღება ცხოველური ნეირონების უჯრედული (პლაზმური) მემბრანების წინააღმდეგ. ამისათვის თაგვებს უტარდებათ იმუნიზაცია იზოლირებული ნეირონული მემბრანებით, რის შემდეგაც მათი ელენთის ლიმფოციტები შერწყმულია მიელომას უჯრედებთან და შემდეგ აგრძელებენ ზემოთ აღწერილი.

ბრინჯი. 131. მონოკლონური ანტისხეულების მიღება
გენეტიკური ინჟინერია და მედიცინა
გენეტიკური ინჟინერია ძალიან პერსპექტიული აღმოჩნდა მედიცინისთვის, პირველ რიგში, მედიკამენტად გამოყენებული ფიზიოლოგიურად აქტიური ცილების (ინსულინი, სომატოსტატინი, ინტერფერონები, სომატოტროპინი და ა.შ.) მიღების ახალი ტექნოლოგიების შესაქმნელად.
ინსულინი გამოიყენება დიაბეტის მქონე ადამიანების სამკურნალოდ, რომელიც სიკვდილის მესამე ყველაზე გავრცელებული მიზეზია გულის დაავადებებისა და კიბოს შემდეგ. ინსულინზე მსოფლიო მოთხოვნა რამდენიმე ათეული კილოგრამია. ტრადიციულად, მას იღებენ ღორისა და ძროხის პანკრეასის ჯირკვლებიდან, მაგრამ ამ ცხოველების ჰორმონები ოდნავ განსხვავდება ადამიანის ინსულინისგან. ღორის ინსულინი განსხვავდება ერთი ამინომჟავით, ხოლო მსხვილფეხა რქოსანი ინსულინი - სამში. ითვლება, რომ ცხოველური ინსულინი ხშირად იწვევს გვერდით მოვლენებს. მართალია ინსულინის ქიმიური სინთეზი დიდი ხნის განმავლობაში მიმდინარეობდა, მაგრამ აქამდე ჰორმონების სამრეწველო წარმოება ძალიან ძვირი რჩებოდა. ახლა იაფფასიანი ინსულინი მიიღება გენეტიკური ინჟინერიის მეთოდით ინსულინის გენის ქიმიურ-ფერმენტული სინთეზით, რასაც მოჰყვება ამ გენის შეყვანა E. coli-ში, რომელიც შემდეგ ახდენს ჰორმონის სინთეზს. ასეთი ინსულინი უფრო „ბიოლოგიურია“, რადგან ის ქიმიურად იდენტურია ადამიანის პანკრეასის უჯრედების მიერ წარმოებული ინსულინის.
ინტერფერონები არის ცილები, რომლებიც სინთეზირდება უჯრედების მიერ ძირითადად ვირუსებით ორგანიზმის ინფექციის საპასუხოდ. ინტერფერონები სპეციფიკური სახეობებია. მაგალითად, ადამიანებში არსებობს ინტერფერონების სამი ჯგუფი, რომლებიც წარმოიქმნება სხვადასხვა უჯრედების მიერ შესაბამისი გენების კონტროლის ქვეშ. ინტერფერონებისადმი ინტერესი განისაზღვრება იმით, რომ ისინი ფართოდ გამოიყენება კლინიკურ პრაქტიკაში ადამიანის მრავალი დაავადების, განსაკუთრებით ვირუსული დაავადების სამკურნალოდ.
დიდი ზომის მქონე ინტერფერონის მოლეკულები ძნელად ხელმისაწვდომია სინთეზისთვის. ამიტომ, ინტერფერონების უმეტესობა ახლა მიიღება ადამიანის სისხლიდან, მაგრამ მოსავლიანობა ამ მეთოდით მცირეა. იმავდროულად, ინტერფერონის საჭიროება უკიდურესად მაღალია. ეს წარმოადგენდა ინტერფერონის წარმოების ეფექტური მეთოდის პოვნას სამრეწველო რაოდენობით. გენეტიკური ინჟინერია საფუძვლად უდევს "ბაქტერიული" ინტერფერონის თანამედროვე წარმოებას.
გაიზარდა გენეტიკური ინჟინერიის გავლენა იმ სამკურნალო ნივთიერებების ტექნოლოგიაზე, რომლებიც დიდი ხანია შეიქმნა ბიოლოგიური ტექნოლოგიის გამოყენებით. ჯერ კიდევ 40-50-იან წლებში. მე -20 საუკუნე იყო შექმნილი
ბიოლოგიური ინდუსტრია ანტიბიოტიკების წარმოებისთვის, რომლებიც თანამედროვე მედიცინის წამლების არსენალის ყველაზე ეფექტური ნაწილია. თუმცა, ბოლო წლებში საგრძნობლად გაიზარდა ბაქტერიების, განსაკუთრებით ანტიბიოტიკების მიმართ წამლისმიერი რეზისტენტობა. მიზეზი მდგომარეობს პლაზმიდების მიკრობულ სამყაროში ფართო გავრცელებაში, რომლებიც განსაზღვრავენ ბაქტერიების წამლის წინააღმდეგობას. ამიტომ ბევრმა ადრე ცნობილმა ანტიბიოტიკმა დაკარგა ადრინდელი ეფექტურობა. ჯერჯერობით, ანტიბიოტიკების მიმართ ბაქტერიული რეზისტენტობის დაძლევის ერთადერთი გზა არის ახალი ანტიბიოტიკების ძიება. ექსპერტების აზრით, მსოფლიოში ყოველწლიურად 300-მდე ახალი ანტიბიოტიკი იქმნება. თუმცა, მათი უმეტესობა ან არაეფექტურია ან ტოქსიკური. ყოველწლიურად მხოლოდ რამდენიმე ანტიბიოტიკი ინერგება პრაქტიკაში, რაც აუცილებლობას ხდის არა მხოლოდ შეინარჩუნოს, არამედ გაიზარდოს ანტიბიოტიკების ინდუსტრიის შესაძლებლობები გენეტიკური ინჟინერიის განვითარებაზე დაყრდნობით.
გენეტიკური ინჟინერიის ძირითადი ამოცანები სამკურნალო ნივთიერებების იმ ტექნოლოგიებში, რომლებშიც მიკროორგანიზმები წამლის მწარმოებლები არიან, განისაზღვრება ამ უკანასკნელის გენეტიკური ინჟინერიის რეკონსტრუქციის საჭიროებით მათი აქტივობის გაზრდის მიზნით. Ამავე
ამავდროულად, დაიწყო მცირე მოლეკულების სახით წამლების შექმნის იდეა, რაც ხელს უწყობს მათ უფრო დიდ ეფექტურობას.
იმუნური ბიოტექნოლოგია უპირველეს ყოვლისა ასოცირდება ახალი თაობის ვაქცინების წარმოებასთან ადამიანებში და ცხოველებში ინფექციური დაავადებების პროფილაქტიკისთვის. გენეტიკური ინჟინერიის გამოყენებით შექმნილი პირველი კომერციული პროდუქტები იყო ვაქცინები ადამიანის ჰეპატიტის, ცხოველის ტერფის და პირის ღრუს დაავადების წინააღმდეგ და ზოგიერთი სხვა. ამ სფეროში უაღრესად მნიშვნელოვანი მიმართულება დაკავშირებულია მონოკლონური ანტისხეულების, პათოგენების დიაგნოსტიკისთვის საჭირო რეაგენტების წარმოებასთან, აგრეთვე სხვადასხვა ხასიათის ჰორმონების, ვიტამინებისა და ცილების (ფერმენტები, ტოქსინები და ა.შ.) გაწმენდისთვის.
მნიშვნელოვანი პრაქტიკული ინტერესია ხელოვნური ჰემოგლობინის მიღების მეთოდი თამბაქოს მცენარეებში ჰემოგლობინის გენების შეყვანით, სადაც α- და β-გლობინის ჯაჭვები წარმოიქმნება ამ გენების კონტროლის ქვეშ, რომლებიც გაერთიანებულია ჰემოგლობინში. თამბაქოს მცენარეების უჯრედებში სინთეზირებული ჰემოგლობინი სრულად ფუნქციონირებს (აკავშირებს ჟანგბადს). უჯრედული ინჟინერია, რომელიც გამოიყენება ადამიანებზე, დაკავშირებულია არა მხოლოდ ადამიანის ბიოლოგიის ფუნდამენტური პრობლემების გადაჭრასთან, არამედ, უპირველეს ყოვლისა, ქალის უნაყოფობის დაძლევასთან. მიღებული ემბრიონის ქალთა საშვილოსნოში იმპლანტაციის დადებითი შემთხვევების სიხშირის გამო ინ ვიტრო,არის პატარა, შემდეგ იღებს მონოზიგოტურ ტყუპის ემბრიონებს ინ ვიტროასევე მნიშვნელოვანია, რადგან ხელახალი იმპლანტაციის შესაძლებლობა იზრდება ემბრიონების "რეზერვის" გამო. განსაკუთრებით საინტერესოა ღეროვანი უჯრედების, როგორც უჯრედებისა და ქსოვილების ჩანაცვლების წყაროს გამოყენების პერსპექტივები ისეთი დაავადებების სამკურნალოდ, როგორიცაა დიაბეტი, ზურგის ტვინის დაზიანება, გულის ტკივილი, ოსტეოართრიტი და პარკინსონის დაავადება. მაგრამ ამ პერსპექტივების რეალიზებისთვის საჭიროა ღეროვანი უჯრედების ბიოლოგიის სიღრმისეული შესწავლა.
მედიცინის პრობლემებთან მიმართებაში გენეტიკური ინჟინერიის გამოყენებისას განსაკუთრებული მნიშვნელობა შეიძინა მემკვიდრეობითი დაავადებების რადიკალური მკურნალობის გენეტიკური ინჟინერიის მეთოდების შემუშავების ამოცანას, რომლებიც, სამწუხაროდ, ჯერ კიდევ არ არის განკურნებადი არსებული მეთოდებით. ამ ამოცანის შინაარსი არის მუტაციების გამოსწორების (ნორმალიზების) გზების შემუშავება, რომლებიც იწვევს მემკვიდრეობით დაავადებებს და უზრუნველყოს „შესწორებების“ გადაცემა მემკვიდრეობით. ითვლება, რომ მემკვიდრეობითი დაავადებების მკურნალობის გენეტიკურად ინჟინერიის მეთოდების წარმატებული განვითარება იქნება
წვლილი შეიტანოს საერთაშორისო სამეცნიერო პროგრამის „ადამიანის გენომის“ განხორციელების შედეგად მიღებულ მონაცემებში ადამიანის გენომის შესახებ.
გენური ინჟინერიის გარემოსდაცვითი პრობლემები
ბიოტექნოლოგიის ახალ დონეზე ამაღლებით, გენური ინჟინერიამ ასევე იპოვა გამოყენება გარემოს დაბინძურების განსაზღვრისა და აღმოფხვრის მეთოდების შემუშავებაში. კერძოდ, აგებულია ბაქტერიული შტამები, რომლებიც ქიმიური დამაბინძურებლების მუტაგენური აქტივობის ერთგვარი მაჩვენებელია. მეორეს მხრივ, პლაზმიდების შემცველი ბაქტერიული შტამები გენეტიკურად არის შემუშავებული, რათა გააკონტროლონ ფერმენტების სინთეზი, რომელსაც შეუძლია გაანადგუროს მრავალი ქიმიური ნაერთი, რომელიც აბინძურებს გარემოს. კერძოდ, ზოგიერთ პლაზმიდის შემცველ ბაქტერიას შეუძლია ნავთობისა და ნავთობპროდუქტების დაშლა გარემოში სხვადასხვა უბედური შემთხვევის ან უვნებელი ნაერთების სხვა არახელსაყრელი მიზეზების შედეგად.
თუმცა, გენეტიკური ინჟინერია არის გენეტიკური მასალის ტრანსფორმაცია, რომელიც ბუნებაში არ არსებობს. შესაბამისად, გენეტიკური ინჟინერიის პროდუქტები არის აბსოლუტურად ახალი პროდუქტები, რომლებიც ბუნებაში არ არსებობს. ამიტომ, მისი პროდუქციის უცნობი ბუნების გამო, ის თავისთავად საფრთხეს უქმნის როგორც ბუნებას, ასევე გარემოს, ასევე ლაბორატორიებში მომუშავე პერსონალს, რომლებიც იყენებენ გენური ინჟინერიის მეთოდებს ან მუშაობენ გენეტიკური ინჟინერიის მუშაობის პროცესში შექმნილ სტრუქტურებთან.
ვინაიდან გენების კლონირების შესაძლებლობები უსაზღვროა, ამ კვლევების დასაწყისშივე მეცნიერებს შორის გაჩნდა კითხვები შექმნილი ორგანიზმების ბუნების შესახებ. ამავდროულად, იყო წინადადებები ამ მეთოდოლოგიის არასასურველი შედეგების შესახებ და ამ წინადადებებმა ასევე ჰპოვა მხარდაჭერა ფართო საზოგადოებაში. კერძოდ, წარმოიშვა უთანხმოება ბაქტერიების თვისებებზე, რომლებმაც მიიღეს ცხოველური გენები გენეტიკური ინჟინერიის ექსპერიმენტებში. მაგალითად, ინარჩუნებენ თუ არა ბაქტერიებს E. coliმათი სახეობრივი კუთვნილება მათში შეყვანილი ცხოველური გენების შემცველობის გამო (მაგალითად, ინსულინის გენი) თუ უნდა ჩაითვალოს ისინი ახალ სახეობად? გარდა ამისა, რამდენად გამძლეა ასეთი ბაქტერიები, რა ეკოლოგიურ ნიშებში შეუძლიათ
არსებობს? მაგრამ ყველაზე მნიშვნელოვანი იყო შიშის გაჩენა, რომ რეკომბინანტული დნმ-ის მოლეკულების წარმოებისა და მანიპულირების დროს შეიძლება შეიქმნას გენეტიკური სტრუქტურები ადამიანის ჯანმრთელობისთვის გაუთვალისწინებელი და საშიში თვისებებით, ისტორიულად ჩამოყალიბებული ეკოლოგიური ბალანსისთვის. ამავე დროს, დაიწყო მოწოდებები გენური ინჟინერიის მორატორიუმის შესახებ. ამ მოწოდებებმა გამოიწვია საერთაშორისო პროტესტი და გამოიწვია საერთაშორისო კონფერენცია, რომელიც გაიმართა 1975 წელს აშშ-ში, სადაც ფართოდ იქნა განხილული ამ სფეროში კვლევის შესაძლო შედეგები. შემდეგ, ქვეყნებში, სადაც გენეტიკური ინჟინერია დაიწყო განვითარება, შემუშავდა წესები რეკომბინანტულ დნმ-ის მოლეკულებთან მუშაობისთვის. ეს წესები მიზნად ისახავს გენეტიკური ინჟინერიის ლაბორატორიების საქმიანობის პროდუქტების ჰაბიტატში შეღწევის თავიდან აცილებას.
გენეტიკური ინჟინერიის მუშაობის არასასურველი შედეგების კიდევ ერთი ასპექტი დაკავშირებულია ლაბორატორიებში მომუშავე პერსონალის ჯანმრთელობის საშიშროებასთან, სადაც გენეტიკური ინჟინერიის მეთოდები გამოიყენება, ვინაიდან ასეთ ლაბორატორიებში გამოიყენება ფენოლი, ეთიდიუმის ბრომიდი, ულტრაიისფერი გამოსხივება, რომლებიც საზიანოა ჯანმრთელობისთვის. გარდა ამისა, ამ ლაბორატორიებში არსებობს ბაქტერიებით დაბინძურების შესაძლებლობა, რომლებიც შეიცავს რეკომბინანტულ დნმ-ის მოლეკულებს, რომლებიც აკონტროლებენ არასასურველ თვისებებს, როგორიცაა ბაქტერიების წამლის წინააღმდეგობა. ეს და სხვა პუნქტები განსაზღვრავს გენური ინჟინერიის სამუშაოებში უსაფრთხოების დონის გაუმჯობესების აუცილებლობას.
და ბოლოს, გენმოდიფიცირებული პროდუქტების (გენმოდიფიცირებული პომიდორი, კარტოფილი, სიმინდი, სოიო) საშიშროების პრობლემა, ასევე ისეთი პროდუქტები, როგორიცაა პური, მაკარონი, ტკბილეული, ნაყინი, ყველი, მცენარეული ზეთი, ხორცპროდუქტები, ქვეყნები, განსაკუთრებით შეერთებულ შტატებში, ფართოდ გავრცელდა. სოფლის მეურნეობის 12000 წლის განმავლობაში ადამიანები იყენებდნენ ბუნებრივ პროდუქტებს. ამიტომ ვარაუდობენ, რომ გენმოდიფიცირებულ საკვებთან ერთად ადამიანის ორგანიზმში შემოვა ახალი ტოქსინები, ალერგენები, ბაქტერიები, კანცეროგენები, რაც მომავალი თაობის სრულიად ახალ დაავადებებს გამოიწვევს. ეს აჩენს საკითხს გენმოდიფიცირებული საკვების ჭეშმარიტად მეცნიერული შეფასების შესახებ.
განსახილველი საკითხები
1. რა იგულისხმება გენეტიკურ, უჯრედულ და გენეტიკურ ინჟინერიაში? არის განსხვავება ამ ცნებებსა და მოლეკულურ კლონირებას შორის?
2. როგორია გენური ინჟინერიის პროგრესული ბუნება ბიოლოგიაში გამოყენებულ სხვა მეთოდებთან შედარებით?
3. ჩამოთვალეთ გენეტიკური ინჟინერიის ძირითადი „ინსტრუმენტები“.
4. რა არის შემზღუდველი ფერმენტები, რა თვისებები და როლი აქვთ გენეტიკურ ინჟინერიაში?
5. ქმნის თუ არა ყველა რესტრიტაზა შესწავლილი დნმ-ის „წებოვან“ ბოლოებს და არის თუ არა დამოკიდებული „წებოვანი“ ბოლოების სტრუქტურა რეპრესიტაზას ტიპზე?
6. განსაზღვრეთ გენეტიკური ვექტორები. არსებობს ბუნებრივი ვექტორები?
7. როგორ მიიღება გენეტიკური ვექტორები ლაბორატორიაში? რომელი ბიოლოგიური ობიექტებია საწყის მასალა ვექტორების მისაღებად?
8. რამდენია დნმ-ის აზოტოვანი ბაზის თანმიმდევრობების მაქსიმალური სიგრძე, რომელიც მაინც შეიძლება შევიდეს გენეტიკურ ვექტორში? განსხვავდებიან თუ არა ვექტორები "ძალაში"?
9. აღწერეთ დნმ ლიგაზას თვისებები და განსაზღვრეთ მისი როლი გენური ინჟინერიაში.
10. როგორ უკავშირდება კლონირებული დნმ-ის სეგმენტი (გენი) გენეტიკურ ვექტორთან?
11. რა სიხშირით ხდება დნმ-ის რეკომბინანტული მოლეკულების ბაქტერიულ უჯრედებში შეყვანა?
12. რა პრინციპს ეფუძნება რეკომბინანტული დნმ-ის მოლეკულების შემცველი ბაქტერიული უჯრედების შერჩევა? მოიყვანეთ ასეთი შერჩევის ერთი მაგალითი.
14. ბაქტერიების ბევრ შტამს აქვს იგივე ფერმენტები, რომლებიც უზრუნველყოფენ თითქმის ერთსა და იმავე მეტაბოლიზმს. იმავდროულად, ბაქტერიული შეზღუდვა-მოდიფიკაციის სისტემების ნუკლეოტიდური სპეციფიკა განსხვავებულია. შეგიძლიათ ახსნათ ეს ფენომენი?
15. რატომ არ შეიძლება შეიცავდეს რვაზე მეტ ბაზის წყვილს დნმ-ის თანმიმდევრობა, რომელიც წარმოადგენს რესტრიქციული ფერმენტის ამოცნობის ადგილს?
16. რამდენჯერ მოხდება Hae III რესტრიქციული ფერმენტის მიერ აღიარებული HHCC თანმიმდევრობა 50000 bp დნმ-ის სეგმენტში 30, 50 და 70 პროცენტი HC შემცველობით?
17. შემაკავებელი ფერმენტები Bam HI და Bgl I დნება G GATCC და T GATCA თანმიმდევრობებს შესაბამისად. შეიძლება თუ არა Bgl I შეზღუდვით წარმოქმნილი დნმ-ის ფრაგმენტები შევიდეს Bam HI უბანში? თუ კი, რატომ? თუ გამოყენებული პლაზმიდი (ვექტორი) შეიცავს ერთ Bgl I შეზღუდვის ადგილს, მაშინ რომელ საკვებ გარემოზე შეიძლება შეირჩეს ბაქტერიები, ეს პლაზმიდი?
18. გამოთვალეთ ბაქტერიული ტრანსფორმაციის სიხშირე დნმ-ის მოლეკულაზე, თუ 5000 პლაზმური ბაზის წყვილზე წარმოიქმნება 5-10 5 ტრანსფორმანტი?
19. შესაძლებელია თუ არა დნმ-ის რეპლიკაციის 0-პუნქტიანი კლონირება E. coliდა თუ ასეა, როგორ?
20. შესაძლებელია თუ არა იმის დადგენა, რამდენი დნმ-ის მოლეკულაა საჭირო ერთი უჯრედის გარდაქმნისთვის E. coli?
21. შესაძლებელია თუ არა mRNA-ზე შერწყმის ადგილის დადგენა პოლიმერაზული ჯაჭვური რეაქციის გამოყენებით?
22. როგორ შეიძლება გამოვიყენოთ პოლიმერაზული ჯაჭვური რეაქცია კლონირებად დნმ-ის ფრაგმენტზე საინტერესო შეზღუდვის ადგილის შესატანად?
23. დაასახელეთ უჯრედების ინჟინერიის მეთოდები, რომლებიც გამოიყენება ცხოველებზე. რა არის ამ მეთოდებით წარმოებული ცხოველების ეკონომიკური ღირებულება?
24. განსაზღვრეთ ტერმინები „ტრანსგენური მცენარეები“ და „ტრანსგენური ცხოველები“. ინარჩუნებენ თუ არა ტრანსგენური ორგანიზმები თავის სახეობას თუ შეიძლება ჩაითვალოს ახალი სახეობების ორგანიზმებად?
25. რა არის ჰიბრიდომები და მონოკლონური ანტისხეულები? როგორ მიიღებენ მათ?
26. გამოიყენება თუ არა უჯრედული ინჟინერია ადამიანებზე?
27. დავუშვათ, რომ უცხო დნმ-ის შეყვანა თაგვის კვერცხუჯრედში და ამ გზით განაყოფიერებული კვერცხუჯრედის იმპლანტაცია თაგვის სხეულში დასრულდა მისი ორსულობა და თაგვების დაბადება, რომლებიც შეიცავდნენ გენომში შეყვანილი დნმ-ის ასლებს. თუმცა, თაგვები მოზაიკა აღმოჩნდა; მათი ზოგიერთი უჯრედი შეიცავს შეყვანილი დნმ-ის ასლებს, ზოგს კი ეს დნმ აკლია. შეგიძლიათ ახსნათ ამ ფენომენის ბუნება?
28. მიგაჩნიათ თუ არა გენმოდიფიცირებული საკვებისგან მომზადებული საკვები გენეტიკურად საშიშად?
29. აუცილებელია თუ არა გენმოდიფიცირებული საკვების სამეცნიერო მიმოხილვა?
შემეცნება განისაზღვრება იმით, რასაც ჩვენ ვადასტურებთ, როგორც ჭეშმარიტებას.
პ.ა. ფლორენსკი, 1923 წ
როდესაც გამოიყენება ადამიანებზე, გენეტიკური ინჟინერია შეიძლება გამოყენებულ იქნას მემკვიდრეობითი დაავადებების სამკურნალოდ. თუმცა, ტექნიკურად მნიშვნელოვანი განსხვავებაა თავად პაციენტის მკურნალობასა და მისი შთამომავლების გენომის შეცვლას შორის.
ზრდასრული ადამიანის გენომის შეცვლის ამოცანა გარკვეულწილად უფრო რთულია, ვიდრე ცხოველთა ახალი გენეტიკურად ინჟინერირებული ჯიშის მოშენება, რადგან ამ შემთხვევაში აუცილებელია უკვე ჩამოყალიბებული ორგანიზმის მრავალი უჯრედის გენომის შეცვლა და არა მხოლოდ ერთი ემბრიონის კვერცხუჯრედის. ამისთვის შემოთავაზებულია ვირუსული ნაწილაკების ვექტორად გამოყენება. ვირუსის ნაწილაკებს შეუძლიათ შეაღწიონ ზრდასრული უჯრედების მნიშვნელოვან პროცენტს, მათში თავიანთი მემკვიდრეობითი ინფორმაციის ჩანერგვას; ორგანიზმში ვირუსული ნაწილაკების შესაძლო კონტროლირებადი რეპროდუქცია. ამავდროულად, გვერდითი ეფექტების შესამცირებლად, მეცნიერები ცდილობენ თავიდან აიცილონ გენეტიკურად ინჟინერიული დნმ-ის შეყვანა სასქესო ორგანოების უჯრედებში, რითაც თავიდან აიცილონ პაციენტის მომავალი შთამომავლების ზემოქმედება. ასევე აღსანიშნავია მედიაში ამ ტექნოლოგიის მნიშვნელოვანი კრიტიკა: გენმოდიფიცირებული ვირუსების განვითარება ბევრის მიერ აღიქმება, როგორც საფრთხე მთელი კაცობრიობისთვის.
გენური თერაპიის დახმარებით მომავალში შესაძლებელია ადამიანის გენომის შეცვლა. ამჟამად ადამიანის გენომის მოდიფიკაციის ეფექტური მეთოდები შემუშავებისა და ტესტირების პროცესშია პრიმატებზე. დიდი ხნის განმავლობაში მაიმუნების გენეტიკური ინჟინერია სერიოზულ სირთულეებს აწყდებოდა, მაგრამ 2009 წელს ექსპერიმენტები წარმატებით დაგვირგვინდა: ჟურნალ Nature-ში გამოჩნდა პუბლიკაცია გენეტიკურად ინჟინერირებული ვირუსული ვექტორების წარმატებული გამოყენების შესახებ ზრდასრული მამრი მაიმუნის დალტონიზმისგან განკურნების მიზნით. იმავე წელს პირველმა გენმოდიფიცირებულმა პრიმატმა (მოდიფიცირებული კვერცხუჯრედიდან ამოსული) შთამომავლობა - ჩვეულებრივი მარმოსეტი გააჩინა.
თუმცა მცირე მასშტაბით, გენეტიკური ინჟინერია უკვე გამოიყენება, რათა ზოგიერთი სახის უნაყოფობის მქონე ქალებს დაორსულების შანსი მისცენ. ამისათვის გამოიყენეთ ჯანმრთელი ქალის კვერცხები. შედეგად, ბავშვი მემკვიდრეობით იღებს გენოტიპს ერთი მამისა და ორი დედისგან.
თუმცა, ადამიანის გენომში უფრო მნიშვნელოვანი ცვლილებების შეტანის შესაძლებლობა არაერთ სერიოზულ ეთიკურ პრობლემას აწყდება.
_____________________________________________________________________________________________
გენეტიკური ინჟინერია (გენეტიკური ინჟინერია)
ეს არის ტექნიკის, მეთოდებისა და ტექნოლოგიების ერთობლიობა რეკომბინანტული რნმ-ისა და დნმ-ის მისაღებად, ორგანიზმიდან (უჯრედებიდან) გენების იზოლირებისთვის, გენების მანიპულირებისთვის და სხვა ორგანიზმებში მათი შეყვანისთვის.
გენეტიკური ინჟინერია არ არის მეცნიერება ფართო გაგებით, მაგრამ არის ინსტრუმენტი ბიოტექნოლოგიაისეთი ბიოლოგიური მეცნიერებების მეთოდების გამოყენებით, როგორიცაა მოლეკულური და ფიჭური ბიოლოგია, ციტოლოგია, გენეტიკა, მიკრობიოლოგია, ვირუსოლოგია.
ბიოტექნოლოგიის მნიშვნელოვანი კომპონენტია გენეტიკური ინჟინერია. 70-იანი წლების დასაწყისში დაბადებულმა დღეს დიდ წარმატებას მიაღწია. გენეტიკური ინჟინერიის ტექნიკა გარდაქმნის ბაქტერიულ, საფუარის და ძუძუმწოვრების უჯრედებს „ქარხნებში“ ნებისმიერი ცილის ფართომასშტაბიანი წარმოებისთვის. ეს შესაძლებელს ხდის ცილების სტრუქტურისა და ფუნქციების დეტალურად გაანალიზებას და მათ სამკურნალოდ გამოყენებას.
ამჟამად Escherichia coli (E. coli) გახდა ისეთი მნიშვნელოვანი ჰორმონების მიმწოდებელი, როგორიცაა ინსულინი და სომატოტროპინი. ადრე ინსულინს ცხოველური პანკრეასის უჯრედებიდან იღებდნენ, ამიტომ მისი ღირებულება ძალიან მაღალი იყო. 100 გრ კრისტალური ინსულინის მისაღებად საჭიროა 800-1000 კგ პანკრეასი, ხოლო ძროხის ერთი ჯირკვალი 200-250 გრამს იწონის. ამან ინსულინი ძვირი და ძნელად მისაწვდომი გახადა დიაბეტით დაავადებულთა ფართო სპექტრისთვის. 1978 წელს Genentech-ის მკვლევარებმა შექმნეს პირველი ინსულინი Escherichia coli-ს სპეციალურად შემუშავებულ შტამში. ინსულინი შედგება ორი A და B პოლიპეპტიდური ჯაჭვისგან, 20 და 30 ამინომჟავების სიგრძისგან. როდესაც ისინი დაკავშირებულია დისულფიდურ ობლიგაციებთან, წარმოიქმნება ბუნებრივი ორმაგი ჯაჭვის ინსულინი. ნაჩვენებია, რომ ის არ შეიცავს E. coli ცილებს, ენდოტოქსინებს და სხვა მინარევებს, არ გააჩნია გვერდითი მოვლენები, როგორც ცხოველური ინსულინი და არ განსხვავდება მისგან ბიოლოგიური აქტივობით. შემდგომში, პროინსულინი სინთეზირებული იყო E. coli უჯრედებში, რისთვისაც დნმ-ის ასლი სინთეზირებული იყო რნმ-ის შაბლონზე საპირისპირო ტრანსკრიპტაზის გამოყენებით. მიღებული პროინსულინის გაწმენდის შემდეგ, იგი გაიყო და მიიღეს ბუნებრივი ინსულინი, ხოლო ჰორმონის ექსტრაქციისა და იზოლაციის ეტაპები მინიმუმამდე იყო დაყვანილი. 1000 ლიტრი კულტურული სითხიდან 200 გრამამდე ჰორმონის მიღება შეიძლება, რაც უდრის ღორის ან ძროხის პანკრეასის 1600 კგ გამოყოფილ ინსულინის რაოდენობას.
სომატოტროპინი არის ადამიანის ზრდის ჰორმონი, რომელიც გამოიყოფა ჰიპოფიზის ჯირკვალში. ამ ჰორმონის ნაკლებობა იწვევს ჰიპოფიზის ჯუჯას. თუ სომატოტროპინი ინიშნება დოზით 10 მგ კგ სხეულის წონაზე კვირაში სამჯერ, მაშინ ერთი წლის შემდეგ მისი დეფიციტით დაავადებული ბავშვი შეიძლება გაიზარდოს 6 სმ-ით საბოლოო ფარმაცევტული პროდუქტი. ამრიგად, ხელმისაწვდომი ჰორმონის რაოდენობა შეზღუდული იყო, უფრო მეტიც, ამ მეთოდით წარმოებული ჰორმონი იყო ჰეტეროგენული და შეიძლება შეიცავდეს ნელა განვითარებად ვირუსებს. კომპანია „გენენტეკმა“ 1980 წელს შეიმუშავა ბაქტერიების გამოყენებით სომატოტროპინის წარმოების ტექნოლოგია, რომელიც მოკლებული იყო ამ ნაკლოვანებებს. 1982 წელს საფრანგეთის პასტერის ინსტიტუტში E. coli-ს და ცხოველური უჯრედების კულტურაში მიიღეს ადამიანის ზრდის ჰორმონი, ხოლო 1984 წლიდან სსრკ-ში დაიწყო ინსულინის ინდუსტრიული წარმოება. ინტერფერონის წარმოებისას გამოიყენება როგორც E. coli, S. cerevisae (საფუარი), ასევე ფიბრობლასტების ან ტრანსფორმირებული ლეიკოციტების კულტურა. ანალოგიური მეთოდებით მიიღება უსაფრთხო და იაფი ვაქცინებიც.
მაღალსპეციფიკური დნმ-ის ზონდების წარმოება დაფუძნებულია რეკომბინანტული დნმ-ის ტექნოლოგიაზე, რომლის დახმარებით ისინი სწავლობენ გენის ექსპრესიას ქსოვილებში, გენების ლოკალიზაციას ქრომოსომებში და იდენტიფიცირებენ გენებს, რომლებსაც აქვთ დაკავშირებული ფუნქციები (მაგალითად, ადამიანებში და ქათმებში. ). დნმ-ის ზონდები ასევე გამოიყენება სხვადასხვა დაავადების დიაგნოსტიკაში.
რეკომბინანტულმა დნმ-ის ტექნოლოგიამ შესაძლებელი გახადა არატრადიციული პროტეინ-გენის მიდგომა, რომელსაც ეწოდება საპირისპირო გენეტიკა. ამ მიდგომით, ცილა იზოლირებულია უჯრედიდან, ხდება ამ ცილის გენის კლონირება და მისი მოდიფიცირება, რაც ქმნის მუტანტის გენს, რომელიც აკოდირებს ცილის შეცვლილ ფორმას. შედეგად მიღებული გენი შეჰყავთ უჯრედში. თუ ის გამოხატულია, მისი მატარებელი უჯრედი და მისი შთამომავლები შეცვლიან პროტეინს სინთეზირებენ. ამ გზით შესაძლებელია დეფექტური გენების გამოსწორება და მემკვიდრეობითი დაავადებების მკურნალობა.
თუ ჰიბრიდული დნმ შეყვანილია განაყოფიერებულ კვერცხუჯრედში, შეიძლება მიღებულ იქნეს ტრანსგენური ორგანიზმები, რომლებიც გამოხატავენ მუტაციურ გენს და გადასცემენ მას შთამომავლობას. ცხოველების გენეტიკური ტრანსფორმაცია შესაძლებელს ხდის ცალკეული გენების და მათი ცილოვანი პროდუქტების როლის დადგენას როგორც სხვა გენების აქტივობის რეგულირებაში, ასევე სხვადასხვა პათოლოგიურ პროცესებში. გენეტიკური ინჟინერიის დახმარებით შეიქმნა ვირუსული დაავადებების მიმართ მდგრადი ცხოველების ხაზები, ასევე ცხოველთა ჯიშები, რომლებსაც აქვთ ადამიანებისთვის სასარგებლო თვისებები. მაგალითად, მსხვილფეხა რქოსანი სომატოტროპინის გენის შემცველი რეკომბინანტული დნმ-ის მიკროინექციით კურდღლის ზიგოტაში შესაძლებელი გახდა ტრანსგენური ცხოველის მიღება ამ ჰორმონის ჰიპერპროდუქციით. შედეგად ცხოველებს ჰქონდათ გამოხატული აკრომეგალია.
ახლა კი რთულია ყველა იმ შესაძლებლობის პროგნოზირება, რომელიც განხორციელდება მომდევნო რამდენიმე ათწლეულში.
გენეტიკური ინჟინერია არის ბიოტექნოლოგიის დარგი, რომელიც მოიცავს გენოტიპების გადაწყობის მოქმედებებს. დღესაც, გენეტიკური ინჟინერია შესაძლებელს ხდის ცალკეული გენების ჩართვას და გამორთვას, რითაც აკონტროლებს ორგანიზმების აქტივობას და ასევე გენეტიკური ინსტრუქციების გადაცემას ერთი ორგანიზმიდან მეორეზე, მათ შორის სხვა სახეობის ორგანიზმების ჩათვლით. რამდენადაც გენეტიკოსები სულ უფრო მეტს სწავლობენ გენებისა და ცილების მუშაობის შესახებ, უფრო და უფრო რეალური ხდება გენოტიპის თვითნებურად დაპროგრამება (უპირველეს ყოვლისა ადამიანის), ადვილად მიაღწიოს ნებისმიერ შედეგს: როგორიცაა რადიაციისადმი წინააღმდეგობა, წყლის ქვეშ ცხოვრების უნარი. , დაზიანებული ორგანოების რეგენერაციის უნარი და უკვდავებაც კი.
ენციკლოპედიური YouTube
-
1 / 5
გენეტიკური ინჟინერია ემსახურება მოდიფიცირებული ან გენმოდიფიცირებული ორგანიზმის სასურველი თვისებების მიღებას. ტრადიციული მეცხოველეობისგან განსხვავებით, რომლის დროსაც გენოტიპი მხოლოდ ირიბად იცვლება, გენეტიკური ინჟინერია საშუალებას გაძლევთ უშუალოდ ჩაერიოთ გენეტიკურ აპარატში მოლეკულური კლონირების ტექნიკის გამოყენებით. გენეტიკური ინჟინერიის გამოყენების მაგალითებია კულტურების ახალი გენმოდიფიცირებული ჯიშების წარმოება, ადამიანის ინსულინის წარმოება გენმოდიფიცირებული ბაქტერიების გამოყენებით, ერითროპოეტინის წარმოება უჯრედულ კულტურაში ან ექსპერიმენტული თაგვების ახალი ჯიშები სამეცნიერო კვლევისთვის.
მიკრობიოლოგიური, ბიოსინთეზური ინდუსტრიის საფუძველია ბაქტერიული უჯრედი. სამრეწველო წარმოებისთვის საჭირო უჯრედები შეირჩევა გარკვეული კრიტერიუმების მიხედვით, რომელთაგან უმთავრესი არის გარკვეული ნაერთის - ამინომჟავის ან ანტიბიოტიკის, სტეროიდული ჰორმონის ან ორგანული მჟავის წარმოქმნის, სინთეზის უნარი, მაქსიმალური შესაძლო რაოდენობით. . ზოგჯერ აუცილებელია ისეთი მიკროორგანიზმის არსებობა, რომელსაც შეუძლია, მაგალითად, გამოიყენოს ზეთი ან ჩამდინარე წყალი, როგორც „საკვები“ და გადაამუშაოს ისინი ბიომასად ან თუნდაც ცილად, რომელიც შესაფერისია საკვების დანამატებისთვის. ზოგჯერ საჭიროა ორგანიზმები, რომლებიც შეიძლება გაიზარდონ ამაღლებულ ტემპერატურაზე ან სხვა სახის მიკროორგანიზმებისთვის უდავოდ სასიკვდილო ნივთიერებების თანდასწრებით.
ასეთი სამრეწველო შტამების მოპოვების ამოცანა ძალიან მნიშვნელოვანია, მათი მოდიფიკაციისა და შერჩევისთვის შემუშავებულია უჯრედზე აქტიური გავლენის მრავალი მეთოდი - ძლიერი შხამებით დამუშავებიდან რადიოაქტიურ დასხივებამდე. ამ ტექნიკის დანიშნულება იგივეა - უჯრედის მემკვიდრეობითი, გენეტიკური აპარატის ცვლილების მიღწევა. მათი შედეგია მრავალი მუტანტის მიკრობების წარმოება, რომელთაგან ასობით და ათასობით მეცნიერები ცდილობენ აირჩიონ ყველაზე შესაფერისი კონკრეტული მიზნისთვის. ქიმიური ან რადიაციული მუტაგენეზის ტექნიკის შექმნა ბიოლოგიაში გამორჩეული მიღწევა იყო და ფართოდ გამოიყენება თანამედროვე ბიოტექნოლოგიაში.
მაგრამ მათი შესაძლებლობები შეზღუდულია თავად მიკროორგანიზმების ბუნებით. მათ არ შეუძლიათ მცენარეებში დაგროვილი მთელი რიგი ღირებული ნივთიერებების სინთეზირება, პირველ რიგში სამკურნალო და ეთერზეთები. მათ არ შეუძლიათ ცხოველებისა და ადამიანების სიცოცხლისთვის ძალიან მნიშვნელოვანი ნივთიერებების სინთეზირება, მრავალი ფერმენტი, პეპტიდური ჰორმონი, იმუნური ცილები, ინტერფერონები და მრავალი სხვა უბრალოდ მოწყობილი ნაერთები, რომლებიც სინთეზირდება ცხოველებში და ადამიანებში. რა თქმა უნდა, მიკროორგანიზმების შესაძლებლობები შორს არის ამოწურვისაგან. მიკროორგანიზმების სიმრავლიდან მხოლოდ მცირე ნაწილი იქნა გამოყენებული მეცნიერების და განსაკუთრებით მრეწველობის მიერ. მიკროორგანიზმების შერჩევის მიზნებისთვის დიდი ინტერესია, მაგალითად, ანაერობული ბაქტერიები, რომლებსაც შეუძლიათ იცხოვრონ ჟანგბადის ნაკლებობით, ფოტოტროფები, რომლებიც იყენებენ სინათლის ენერგიას, როგორიცაა მცენარეები, ქიმიოავტოტროფები, თერმოფილური ბაქტერიები, რომლებსაც შეუძლიათ იცხოვრონ ტემპერატურაზე, როგორც ეს ახლახან აღმოაჩინეს. დაახლოებით 110 ° C და ა.შ.
და მაინც აშკარაა „ბუნებრივი მასალის“ შეზღუდვები. ისინი ცდილობდნენ და ცდილობენ თავიდან აიცილონ შეზღუდვები უჯრედული კულტურების და მცენარეებისა და ცხოველების ქსოვილების დახმარებით. ეს არის ძალიან მნიშვნელოვანი და პერსპექტიული გზა, რომელიც ასევე დანერგილია ბიოტექნოლოგიაში. ბოლო რამდენიმე ათწლეულის განმავლობაში, მეცნიერებმა შეიმუშავეს მეთოდები, რომლითაც მცენარეული ან ცხოველური ქსოვილის ცალკეული უჯრედები შეიძლება გაიზარდოს და გამრავლდეს სხეულისგან დამოუკიდებლად, ბაქტერიული უჯრედების მსგავსად. ეს მნიშვნელოვანი მიღწევა იყო - შედეგად მიღებული უჯრედული კულტურები გამოიყენება ექსპერიმენტებისთვის და გარკვეული ნივთიერებების სამრეწველო წარმოებისთვის, რომელთა მიღებაც შეუძლებელია ბაქტერიული კულტურების გამოყენებით.
კვლევის კიდევ ერთი მიმართულებაა დნმ-დან იმ გენების ამოღება, რომლებიც არასაჭიროა ცილების კოდირებისთვის და ორგანიზმების ფუნქციონირებისთვის და ამ დნმ-ზე დაფუძნებული ხელოვნური ორგანიზმების შექმნა გენების „შეკვეცილი ნაკრებით“. ეს შესაძლებელს ხდის მკვეთრად გაზარდოს მოდიფიცირებული ორგანიზმების წინააღმდეგობა ვირუსების მიმართ.
განვითარების ისტორია და ტექნოლოგიის მიღწეული დონე
მე-20 საუკუნის მეორე ნახევარში გაკეთდა რამდენიმე მნიშვნელოვანი აღმოჩენა და გამოგონება გენეტიკური ინჟინერია. გენებში „ჩაწერილი“ ბიოლოგიური ინფორმაციის „წაკითხვის“ მრავალწლიანი მცდელობა წარმატებით დასრულდა. ეს სამუშაო დაიწყეს ინგლისელმა მეცნიერმა ფრედერიკ სენგერმა და ამერიკელმა მეცნიერმა ვალტერ გილბერტმა (ნობელის პრემია ქიმიაში 1980 წელს). მოგეხსენებათ, გენები შეიცავს ინფორმაციას-ინსტრუქციას ორგანიზმში რნმ-ის მოლეკულებისა და ცილების, მათ შორის ფერმენტების სინთეზისთვის. იმისათვის, რომ უჯრედმა აიძულოს ახალი, მისთვის უჩვეულო ნივთიერებების სინთეზირება, აუცილებელია მასში ფერმენტების შესაბამისი ნაკრების სინთეზირება. და ამისთვის საჭიროა ან მასში არსებული გენების მიზანმიმართული შეცვლა, ან მასში ახალი, მანამდე არმყოფი გენების შეყვანა. ცოცხალ უჯრედებში გენების ცვლილებები მუტაციაა. ისინი წარმოიქმნება, მაგალითად, მუტაგენების - ქიმიური შხამების ან რადიაციის გავლენის ქვეშ. მაგრამ ასეთი ცვლილებები არ შეიძლება იყოს კონტროლირებადი ან მიმართული. ამიტომ, მეცნიერებმა კონცენტრირდნენ თავიანთი ძალისხმევის მცდელობაზე, რათა შეემუშავებინათ უჯრედში ახალი, ძალიან სპეციფიკური გენების შეყვანა, რომლებიც ადამიანს სჭირდება.
გენეტიკური ინჟინერიის პრობლემის გადაჭრის ძირითადი ეტაპები შემდეგია:
- იზოლირებული გენის მიღება.
- გენის შეყვანა ვექტორში ორგანიზმში გადასატანად.
- გენის მქონე ვექტორის გადატანა მოდიფიცირებულ ორგანიზმში.
- სხეულის უჯრედების ტრანსფორმაცია.
- გენმოდიფიცირებული ორგანიზმების შერჩევა ( გმო) და მათ აღმოფხვრა, რომლებიც წარმატებით არ შეცვლილა.
გენის სინთეზის პროცესი ამჟამად ძალიან კარგად არის განვითარებული და დიდწილად ავტომატიზირებულიც კი. არსებობს კომპიუტერებით აღჭურვილი სპეციალური მოწყობილობები, რომელთა მეხსიერებაში ინახება სხვადასხვა ნუკლეოტიდური თანმიმდევრობის სინთეზის პროგრამები. ასეთი აპარატი ასინთეზებს დნმ-ის სეგმენტებს 100-120 აზოტოვანი ბაზის სიგრძემდე (ოლიგონუკლეოტიდები). ფართოდ გავრცელდა ტექნიკა, რომელიც საშუალებას იძლევა გამოიყენოს პოლიმერაზული ჯაჭვური რეაქცია დნმ-ის სინთეზისთვის, მუტანტის დნმ-ის ჩათვლით. მასში დნმ-ის შაბლონური სინთეზისთვის გამოიყენება თერმოსტაბილური ფერმენტი, დნმ პოლიმერაზა, რომელიც გამოიყენება ნუკლეინის მჟავის ხელოვნურად სინთეზირებული ნაჭრების - ოლიგონუკლეოტიდების თესლად. საპირისპირო ტრანსკრიპტაზას ფერმენტი შესაძლებელს ხდის დნმ-ის სინთეზს ასეთი პრაიმერების (პრაიმერების) გამოყენებით უჯრედებიდან იზოლირებულ რნმ-ის მატრიცაზე. ამ გზით სინთეზირებულ დნმ-ს ეწოდება დამატებითი (რნმ) ან cDNA. იზოლირებული, „ქიმიურად სუფთა“ გენის მიღება ასევე შესაძლებელია ფაგის ბიბლიოთეკიდან. ასე ჰქვია ბაქტერიოფაგის პრეპარატს, რომლის გენომში ჩასმულია გენომის ან cDNA შემთხვევითი ფრაგმენტები, რომლებიც რეპროდუცირებულია ფაგის მიერ მთელ მის დნმ-სთან ერთად.
ბაქტერიებში გენების შეყვანის ტექნიკა განვითარდა მას შემდეგ, რაც ფრედერიკ გრიფიტმა აღმოაჩინა ბაქტერიების ტრანსფორმაციის ფენომენი. ეს მოვლენა ემყარება პრიმიტიულ სექსუალურ პროცესს, რომელსაც ბაქტერიებში თან ახლავს არაქრომოსომული დნმ-ის მცირე ფრაგმენტების, პლაზმიდების გაცვლა. პლაზმური ტექნოლოგიები საფუძვლად დაედო ხელოვნური გენების ბაქტერიულ უჯრედებში შეყვანას.
მნიშვნელოვანი სირთულეები დაკავშირებული იყო მზა გენის შეყვანასთან მცენარეთა და ცხოველთა უჯრედების მემკვიდრეობით აპარატში. თუმცა, ბუნებაში არის შემთხვევები, როდესაც უცხო დნმ (ვირუსის ან ბაქტერიოფაგის) შედის უჯრედის გენეტიკურ აპარატში და მისი მეტაბოლური მექანიზმების დახმარებით იწყებს "საკუთარი" ცილის სინთეზს. მეცნიერებმა შეისწავლეს უცხო დნმ-ის შეყვანის თავისებურებები და გამოიყენეს ის, როგორც პრინციპი გენეტიკური მასალის უჯრედში შესატანად. ამ პროცესს ტრანსფექცია ეწოდება.
თუ ერთუჯრედული ორგანიზმები ან მრავალუჯრედიანი უჯრედების კულტურები მოდიფიცირებულია, მაშინ ამ ეტაპზე იწყება კლონირება, ანუ იმ ორგანიზმებისა და მათი შთამომავლების (კლონების) შერჩევა, რომლებმაც განიცადეს მოდიფიკაცია. როდესაც ამოცანაა მრავალუჯრედიანი ორგანიზმების მიღება, მაშინ შეცვლილი გენოტიპის მქონე უჯრედები გამოიყენება მცენარეების ვეგეტატიური გამრავლებისთვის ან შეჰყავთ სუროგატი დედის ბლასტოცისტებში, როდესაც საქმე ეხება ცხოველებს. შედეგად იბადებიან შეცვლილი ან უცვლელი გენოტიპის ბები, რომელთა შორის ირჩევენ და ერთმანეთს კვეთენ მხოლოდ ისეთებს, რომლებიც აჩვენებენ მოსალოდნელ ცვლილებებს.
გამოყენება სამეცნიერო კვლევებში
თუმცა მცირე მასშტაბით, გენეტიკური ინჟინერია უკვე გამოიყენება, რათა ზოგიერთი სახის უნაყოფობის მქონე ქალებს დაორსულების შანსი მისცენ. ამისათვის გამოიყენეთ ჯანმრთელი ქალის კვერცხები. შედეგად, ბავშვი მემკვიდრეობით იღებს გენოტიპს ერთი მამისა და ორი დედისგან.
თუმცა, ადამიანის გენომში უფრო მნიშვნელოვანი ცვლილებების შეტანის შესაძლებლობა არაერთ სერიოზულ ეთიკურ პრობლემას აწყდება. 2016 წელს, შეერთებულ შტატებში მეცნიერთა ჯგუფმა მიიღო დამტკიცება კიბოს მკურნალობის მეთოდის კლინიკურ კვლევებზე პაციენტის საკუთარი იმუნური უჯრედების გამოყენებით, ექვემდებარება გენის მოდიფიკაციას CRISPR / Cas9 ტექნოლოგიის გამოყენებით.
უჯრედის ინჟინერია
ფიჭური ინჟინერია ემყარება მცენარეთა და ცხოველთა უჯრედებისა და ქსოვილების კულტივირებას, რომლებსაც შეუძლიათ გამოიმუშაონ ადამიანებისთვის აუცილებელი ნივთიერებები სხეულის გარეთ. ეს მეთოდი გამოიყენება მცენარეთა ძვირფასი ფორმების კლონური (ასექსუალური) გამრავლებისთვის; ჰიბრიდული უჯრედების მისაღებად, რომლებიც აერთიანებს, მაგალითად, სისხლის ლიმფოციტების და სიმსივნური უჯრედების თვისებებს, რაც საშუალებას გაძლევთ სწრაფად მიიღოთ ანტისხეულები.
გენეტიკური ინჟინერია რუსეთში
აღნიშნულია, რომ გმო-ს სახელმწიფო რეგისტრაციის შემოღების შემდეგ, შესამჩნევად გაიზარდა ზოგიერთი საზოგადოებრივი ორგანიზაციისა და სახელმწიფო სათათბიროს ცალკეული დეპუტატების აქტივობა, რომლებიც ცდილობენ თავიდან აიცილონ ინოვაციური ბიოტექნოლოგიების დანერგვა რუსეთის სოფლის მეურნეობაში. 350-ზე მეტმა რუსმა მეცნიერმა ხელი მოაწერა მეცნიერთა საზოგადოების ღია წერილს რუსეთის ფედერაციაში გენეტიკური ინჟინერიის განვითარების მხარდასაჭერად. ღია წერილში აღნიშნულია, რომ რუსეთში გმო-ს აკრძალვა არა მხოლოდ ზიანს აყენებს ჯანსაღ კონკურენციას სოფლის მეურნეობის ბაზარზე, არამედ გამოიწვევს საკვების წარმოების ტექნოლოგიების მნიშვნელოვან ჩამორჩენას, გაზრდის საკვების იმპორტზე დამოკიდებულებას და ძირს უთხრის რუსეთის, როგორც სახელმწიფოს პრესტიჟს. რომელიც ინოვაციური განვითარების კურსი ოფიციალურად გამოცხადდა [ ფაქტის მნიშვნელობა? ] .
იხილეთ ასევე
შენიშვნები
- ალექსანდრე პანჩინიღმერთის ცემა // პოპულარული მექანიკა. - 2017. - No 3. - S. 32-35. - URL: http://www.popmech.ru/magazine/2017/173-issue/
- ინვივო გენომის რედაქტირება მაღალი ეფექტურობის TALEN სისტემის გამოყენებით(ინგლისური) . ბუნება. წაკითხვის თარიღი: 2017 წლის 10 იანვარი.
- ელემენტები - მეცნიერების სიახლე: მაიმუნები დალტონიკებისგან გენური თერაპიით განიკურნენ (განუსაზღვრელი) (2009 წლის 18 სექტემბერი). წაკითხვის თარიღი: 2017 წლის 10 იანვარი.
