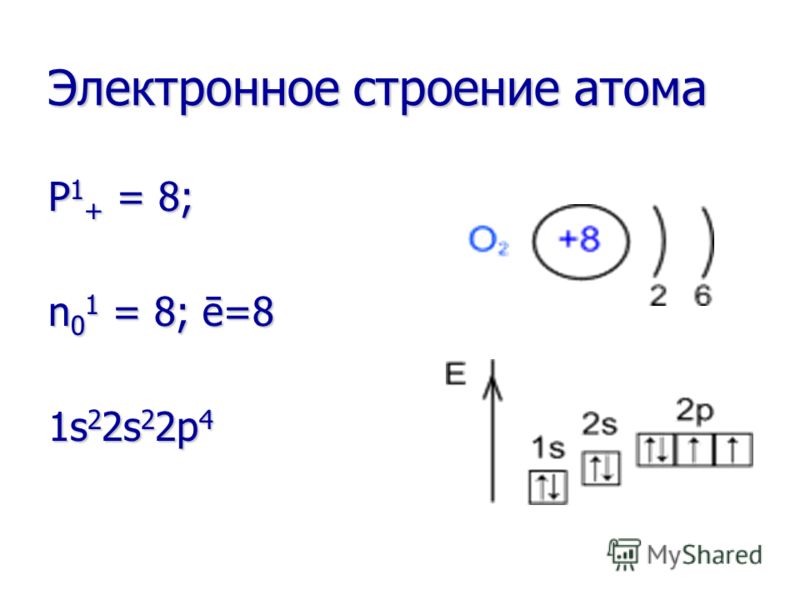
Antuāns Lorāns LAVOZĪRS () () Pētīja skābekli un izveidoja skābekļa degšanas teoriju, kas aizstāja flogistona teoriju. Viņš pētīja skābekli un izveidoja skābekļa sadegšanas teoriju, kas aizstāja flogistona teoriju.

Skābeklis ir visizplatītākais elements uz Zemes Gaisā 21% (pēc tilpuma), Gaisā 21% (pēc tilpuma), zemes garozā 49% (pēc masas), zemes garozā 49% (pēc masas), hidrosfērā 89% (pēc masas), hidrosfērā 89% (masas), dzīvos organismos līdz 65% pēc masas. dzīvos organismos līdz 65% no masas.

Fizikālās īpašības Agregāta stāvoklis - gāze normālos apstākļos. Ļoti zemā temperatūrā (-183°C) tas pārvēršas šķidrā agregācijas stāvoklī (zils šķidrums), un vēl zemākā temperatūrā (-219°C) kļūst ciets (zili sniega kristāli). Agregāta stāvoklis - gāze normālos apstākļos. Ļoti zemā temperatūrā (-183°C) tas pārvēršas šķidrā agregācijas stāvoklī (zils šķidrums), un vēl zemākā temperatūrā (-219°C) kļūst ciets (zili sniega kristāli). Krāsa - bezkrāsaina. Krāsa - bezkrāsaina. Smarža - bez smaržas. Smarža - bez smaržas. Šķīdība ūdenī - slikti šķīst. Šķīdība ūdenī - slikti šķīst. Smagāks par gaisu (M gaiss = 29 g / mol, un M O 2 = 32 g / mol. Smagāks par gaisu (M gaiss = 29 g / mol, un M O 2 = 32 g / mol).

Ķīmiskās īpašības Skābeklis ir ļoti spēcīgs oksidētājs! Tas oksidē daudzas vielas jau istabas temperatūrā (lēna oksidēšanās) un vēl jo vairāk tad, kad vielu karsē vai sadedzina (ātrā oksidēšanās). Skābeklis ir ļoti spēcīgs oksidētājs! Tas oksidē daudzas vielas jau istabas temperatūrā (lēna oksidēšanās) un vēl jo vairāk tad, kad vielu karsē vai sadedzina (ātrā oksidēšanās). Reakcijās ar visiem elementiem (izņemot fluoru) skābeklis vienmēr ir oksidētājs. Reakcijās ar visiem elementiem (izņemot fluoru) skābeklis vienmēr ir oksidētājs.

Reakcijas ar metāliem Reakcijas rezultātā veidojas šī metāla oksīds. Piemēram, alumīniju oksidē ar skābekli saskaņā ar vienādojumu: Reakcijas rezultātā veidojas šī metāla oksīds. Piemēram, alumīniju oksidē ar skābekli saskaņā ar vienādojumu: t° 4Al + 3O 2 2Al 2 O 3 t° 4Al + 3O 2 2Al 2 O 3 Cits piemērs. Nolaižot karstu dzelzs stiepli skābekļa pudelē, stieple izdeg, uz sāniem izsmidzinot dzirksteles - karstas dzelzs nogulšņu daļiņas Fe 3 O 4: t ° 3Fe + 2O 2 Fe 3 O 4 t ° 3Fe + 2O 2 Fe 3 O 4


Citi piemēri reakcijām ar nemetāliem Sēra sadedzināšana skābeklī, veidojot sēra dioksīdu SO 2: t ° S + O 2 SO 2 t ° S + O 2 SO 2 Ogļu sadedzināšana skābeklī, veidojot oglekļa dioksīdu: Ogļu sadedzināšana skābeklis, veidojot oglekļa dioksīdu: t° C + O 2 CO 2 t° C + O 2 CO 2
Reakcijas ar dažām sarežģītām vielām Šajā gadījumā veidojas elementu oksīdi, kas veido kompleksās vielas molekulu. Šajā gadījumā veidojas elementu oksīdi, kas veido sarežģītas vielas molekulu. Piemēram, dedzinot vara (II) sulfīdu Piemēram, dedzinot vara (II) sulfīdu t ° 2CuS + 3O 2 2CuO + 2SO 2 t ° 2CuS + 3O 2 2CuO + 2SO 2, veidojas divi oksīdi vara (II) oksīds. un sēra oksīds (IV). veidojas divi oksīdi, vara(II) oksīds un sēra(IV) oksīds. Sulfīdu apdedzināšanas laikā vienmēr veidojas sēra oksīds, kurā sēra valence ir IV. Sulfīdu apdedzināšanas laikā vienmēr veidojas sēra oksīds, kurā sēra valence ir IV. Vēl viens piemērs ir metāna CH 4 sadegšana. Tā kā šī molekula sastāv no elementu oglekļa C un ūdeņraža H atomiem, tas nozīmē, ka veidojas divi oksīdi oglekļa monoksīds (IV) CO 2 un ūdeņraža oksīds, tas ir, ūdens - H 2 O: t ° CH 4 + 2O 2 CO 2 + 2H 2 O t ° CH 4 + 2O 2 CO 2 + 2H 2 O

Vielas ķīmisko mijiedarbību ar skābekli sauc par oksidācijas reakciju. Oksidācijas reakcijas, ko pavada siltuma un gaismas izdalīšanās, sauc par degšanas reakcijām. Vielu sadegšanas reakcijas ir ātras oksidēšanās piemēri, bet pūšana, rūsēšana utt. tie ir piemēri vielu lēnai oksidēšanai ar skābekli Vielu sadegšanas reakcijas ir ātras oksidēšanās piemēri, bet pūšana, rūsēšana utt. šie ir piemēri lēnai vielu oksidēšanai ar skābekli

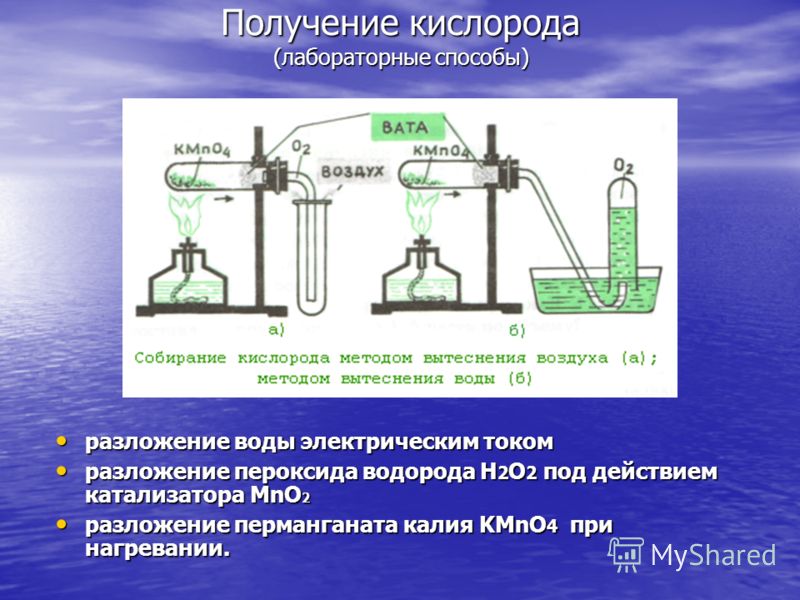
Skābekļa iegūšana (laboratorijas metodes) ūdens sadalīšanās ar elektrisko strāvu ūdens sadalīšanās ar elektrisko strāvu ūdeņraža peroksīda H 2 O 2 sadalīšanās MnO 2 iedarbībā katalizators ūdeņraža peroksīda H 2 O 2 sadalīšanās MnO 2 iedarbībā katalizators kālija permanganāta sadalīšanās KMnO 4 sildot. kālija permanganāta KMnO 4 sadalīšanās karsējot.
Skābekļa iegūšana (rūpnieciskā metode) Rūpniecībā tīra skābekļa iegūšanai izmanto šķidrā gaisa destilāciju, pamatojoties uz dažādām gaisa komponentu viršanas temperatūrām. Gaiss tiek atdzesēts līdz aptuveni -200°C un pēc tam lēnām uzsildīts. Kad temperatūra sasniedz -183°C, no šķidrā gaisa izplūst skābeklis, pārējās sašķidrinātā gaisa sastāvdaļas šajā temperatūrā paliek šķidrā agregācijas stāvoklī. Rūpniecībā, lai iegūtu tīru skābekli, tiek izmantota šķidrā gaisa destilācija, kuras pamatā ir dažādas gaisa komponentu viršanas temperatūras. Gaiss tiek atdzesēts līdz aptuveni -200°C un pēc tam lēnām uzsildīts. Kad temperatūra sasniedz -183°C, no šķidrā gaisa izplūst skābeklis, pārējās sašķidrinātā gaisa sastāvdaļas šajā temperatūrā paliek šķidrā agregācijas stāvoklī.

Skābekļa izmantošana celtniecībā un mašīnbūvē celtniecībā un mašīnbūvē - skābekļa-acetilēna gāzes metināšanai un metālu griešanai ar gāzi - oksi-acetilēna gāzes metināšanai un metālu griešanai ar gāzi - metālu izsmidzināšanai un virskārtai eļļas ražošanā eļļas ražošanā - ievadot veidojumā, lai palielinātu pārvietošanas enerģiju metalurģijā un kalnrūpniecībā metalurģijā un kalnrūpniecībā - konvektīvā tērauda ražošanā, skābekļa strūklā domnas krāsnīs, zelta un rūdas ieguvē, ferosakausējumu ražošanā, niķeļa, cinka, svina kausēšanā , cirkonijs un citi krāsainie metāli - konvektīvā tērauda ražošanā, skābekļa strūklā domnas krāsnīs, zelta un rūdu ieguvē, ferosakausējumu ražošanā, niķeļa, cinka, svina, cirkonija un citu krāsaino metālu kausēšanā - ar tiešu reducēšanu dzelzs - ar tiešu dzelzs reducēšanu - ar ugunsdrošības tīrīšanu lietuvju ražošanā - ar ugunsdzēsības tīrīšanu lietuvju ražošanā - ar ugunsdrošības urbšanu x šķirnes

Skābekļa izmantošana medicīnā medicīnā - oksibārkamerās - skābekļa kamerās - pildot skābekļa maskas, spilvenus u.c. - pildot skābekļa maskas, spilvenus utt. - palātās ar īpašu mikroklimatu - palātās ar īpašu mikroklimatu - skābekļa kokteiļu ražošanai - skābekļa kokteiļu ražošanai - mikroorganismu audzēšanā - mikroorganismu audzēšanā ekoloģijā ekoloģijā - dzeramā attīrīšanā ūdens - dzeramā ūdens attīrīšanā - metālu pārstrādē - metālu pārstrādē - notekūdeņus pūšot ar skābekli - notekūdeņus pūšot ar skābekli - neitralizējot ķīmiski aktīvos atkritumus attīrīšanas iekārtās sadedzināšanas iekārtās - neitralizējot ķīmiski aktīvos atkritumus attīrīšanas iekārtās dedzinātavās

Skābekļa izmantošana ķīmiskajā rūpniecībā ķīmiskajā rūpniecībā - acetilēna, celulozes, metilspirta, amonjaka, slāpekļskābes un sērskābes ražošanā - acetilēna, celulozes, metilspirta, amonjaka, slāpekļskābes un sērskābes ražošanā - in dabasgāzes katalītiskā pārveide (sintētiskā amonjaka ražošanā) - dabasgāzes katalītiskā pārveide (sintētiskā amonjaka ražošanā) - metāna pārveide augstā temperatūrā - metāna pārveide augstā temperatūrā enerģētika enerģētikā - cietā kurināmā gazifikācijā - cietā kurināmā gazifikācijā - gaisa bagātināšanai sadzīves un rūpnieciskajiem katliem - gaisa bagātināšanai sadzīves un rūpnieciskajiem katliem - ūdens-ogļu maisījuma saspiešanai - ūdens saspiešanai- ogļu maisījums

Skābekļa izmantošana militārajā aprīkojumā militārajā aprīkojumā - spiediena kamerās - spiediena kamerās - dīzeļdzinēju darbībai zem ūdens - dīzeļdzinēju darbībai zem ūdens - kā degvielas oksidētājs raķešu dzinējiem - kā degvielas oksidētājs raķešu dzinēji lauksaimniecībā lauksaimniecībā - ūdens vides bagātināšanai ar skābekli makšķerēšanā - ūdens vides bagātināšanai ar skābekli zvejniecībā - skābekļa kokteiļu ražošanā - skābekļa kokteiļu ražošanā - dzīvnieku svara palielināšanai - dzīvnieku svara palielināšanai

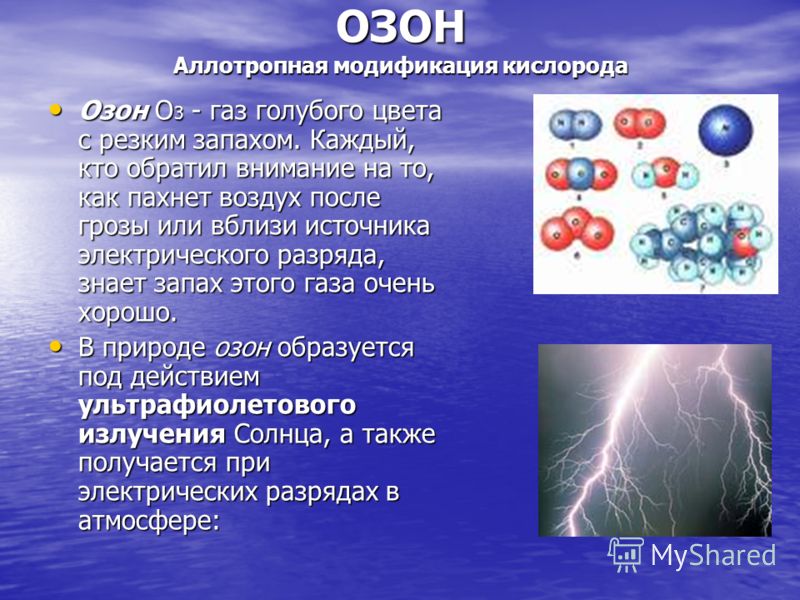
OZONS Skābekļa alotropā modifikācija Ozons O 3 ir zila gāze ar asu smaku. Ikviens, kurš ir pievērsis uzmanību tam, kā smaržo gaiss pēc pērkona negaisa vai elektriskās izlādes avota tuvumā, ļoti labi zina šīs gāzes smaku. Ozons O 3 ir zila gāze ar asu smaku. Ikviens, kurš ir pievērsis uzmanību tam, kā smaržo gaiss pēc pērkona negaisa vai elektriskās izlādes avota tuvumā, ļoti labi zina šīs gāzes smaku. Dabā ozons veidojas saules ultravioletā starojuma iedarbībā, un to rada arī elektriskās izlādes atmosfērā:
Ozons ir ļoti spēcīgs oksidētājs, tāpēc to izmanto dzeramā ūdens dezinfekcijai. Saskaroties ar lielāko daļu oksidējamo vielu, notiek sprādziens. Ozons veidojas Zemes atmosfērā 25 km augstumā saules starojuma ietekmē, tas absorbē bīstamo Saules starojumu. Taču tikai aptuveni 30 metrus biezajā Zemes ozona "lietussargā" ik pa brīdim parādās "caurumi". Arvien vairāk gaisā nonāk ozonam "kaitīgas" gāzes, piemēram, slāpekļa monoksīds NO vai tās vielas, ar kurām pilda saldēšanas iekārtas un aerosola balonus. Pat daļēja ozona slāņa izzušana virs Zemes apdraud visu dzīvo būtni ar nāvi... Tomēr Zemes ozona "lietussargā" tikai aptuveni 30 metrus biezā ik pa brīdim parādās "caurumi". Arvien vairāk gaisā nonāk ozonam "kaitīgas" gāzes, piemēram, slāpekļa monoksīds NO vai tās vielas, ar kurām pilda saldēšanas iekārtas un aerosola balonus. Pat daļēja ozona slāņa izzušana virs Zemes draud ar nāvi visam dzīvajam...


