730. De ce se folosește apa pentru a răci unele mecanisme?
Apa are o capacitate de căldură specifică mare, ceea ce contribuie la o bună îndepărtare a căldurii din mecanism.
731. În ce caz ar trebui cheltuită mai multă energie: pentru încălzirea unui litru de apă cu 1 °C sau pentru încălzirea a o sută de grame de apă cu 1 °C?
Pentru a încălzi un litru de apă, deoarece cu cât masa este mai mare, cu atât mai multă energie trebuie cheltuită.
732. Cupronickel și furculițe de argint de aceeași masă au fost scufundate în apă fierbinte. Primesc aceeași cantitate de căldură din apă?
O furculiță cu cupronickel va primi mai multă căldură, deoarece căldura specifică a cupronickelului este mai mare decât cea a argintului.
733. O bucată de plumb și o bucată de fontă de aceeași masă au fost lovite de trei ori cu un baros. Care parte a devenit mai fierbinte?
Plumbul se va încălzi mai mult deoarece capacitatea sa de căldură specifică este mai mică decât fonta și este nevoie de mai puțină energie pentru a încălzi plumbul.
734. Un balon conține apă, celălalt conține kerosen de aceeași masă și temperatură. În fiecare balon a fost aruncat câte un cub de fier la fel de încălzit. Ce se va încălzi la o temperatură mai mare - apă sau kerosen?
Kerosenul.
735. De ce sunt fluctuațiile de temperatură mai puțin accentuate iarna și vara în orașele de pe malul mării decât în orașele situate în interior?
Apa se încălzește și se răcește mai lent decât aerul. Iarna, se răcește și mișcă masele de aer cald pe uscat, făcând clima de pe coastă mai caldă.
736. Capacitatea termică specifică a aluminiului este de 920 J/kg °C. Ce inseamna asta?
Aceasta înseamnă că este nevoie de 920 J pentru a încălzi 1 kg de aluminiu cu 1 °C.
737. Barele de aluminiu și cupru de aceeași masă de 1 kg se răcesc cu 1 °C. Cât de mult se va schimba energia internă a fiecărui bloc? Care bară se va schimba mai mult și cu cât?
738. Ce cantitate de căldură este necesară pentru a încălzi un kilogram de țăgle de fier cu 45 °C?

739. Câtă căldură este necesară pentru a încălzi 0,25 kg de apă de la 30°C la 50°C?

740. Cum se va schimba energia internă a doi litri de apă când sunt încălzite cu 5 °C?

741. Câtă căldură este necesară pentru a încălzi 5 g de apă de la 20 °C la 30 °C?
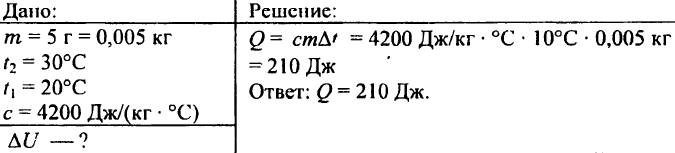
742. Ce cantitate de căldură este necesară pentru a încălzi o minge de aluminiu cu o greutate de 0,03 kg cu 72 °C?

743. Calculați cantitatea de căldură necesară pentru a încălzi 15 kg de cupru la 80 °C.
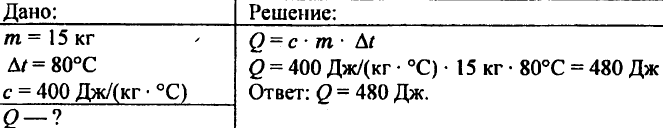
744. Calculați cantitatea de căldură necesară pentru a încălzi 5 kg de cupru de la 10 °C la 200 °C.

745. Ce cantitate de căldură este necesară pentru a încălzi 0,2 kg de apă de la 15 °C la 20 °C?

746. Apa care cântărește 0,3 kg s-a răcit cu 20 °C. Cu cât se reduce energia internă a apei?

747. Câtă căldură este necesară pentru a încălzi 0,4 kg de apă la o temperatură de 20 °C la o temperatură de 30 °C?

748. Câtă căldură se consumă pentru a încălzi 2,5 kg de apă cu 20 °C?
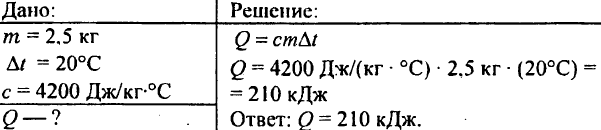
749. Câtă căldură s-a eliberat când 250 g de apă s-au răcit de la 90 °C la 40 °C?
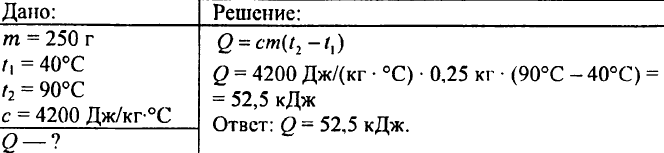
750. Ce cantitate de căldură este necesară pentru a încălzi 0,015 litri de apă cu 1 °C?

751. Calculați cantitatea de căldură necesară pentru a încălzi un iaz cu un volum de 300 m3 cu 10 °C?
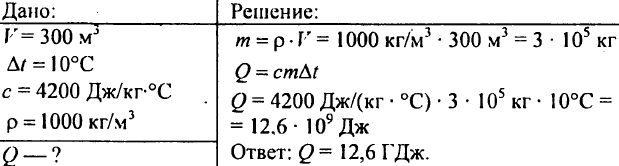
752. Câtă căldură trebuie transmisă unui kg de apă pentru a-i ridica temperatura de la 30°C la 40°C?

753. Apa cu un volum de 10 litri s-a răcit de la o temperatură de 100 °C la o temperatură de 40 °C. Câtă căldură se eliberează în acest caz?

754. Calculați cantitatea de căldură necesară pentru a încălzi 1 m3 de nisip cu 60 °C.

755. Volum aer 60 mc, capacitate termică specifică 1000 J/kg °C, densitate aer 1,29 kg/m3. Câtă căldură este necesară pentru a o ridica la 22°C?

756. Apa a fost încălzită cu 10 ° C, cheltuind 4,20 103 J de căldură. Determinați cantitatea de apă.
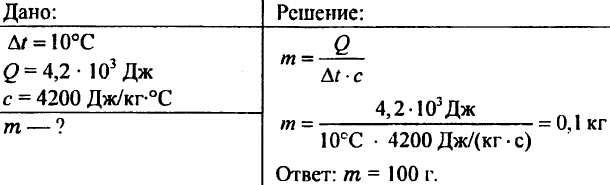
757. Apa cu o greutate de 0,5 kg a raportat 20,95 kJ de căldură. Care a fost temperatura apei dacă temperatura inițială a apei era de 20°C?

758. 8 kg de apă la 10 °C se toarnă într-o cratiță de cupru de 2,5 kg. Câtă căldură este necesară pentru a aduce apa la fiert într-o cratiță?

759. Se toarnă un litru de apă la o temperatură de 15 °C într-un oală de cupru cu o greutate de 300 g. Câtă căldură este necesară pentru a încălzi apa din oală cu 85 °C?

760. Se pune în apă o bucată de granit încălzit de 3 kg. Granitul transferă 12,6 kJ de căldură în apă, răcindu-se cu 10 °C. Care este capacitatea termică specifică a pietrei?

761. S-a adăugat apă fierbinte la 50°C la 5 kg apă la 12°C, obţinându-se un amestec cu o temperatură de 30°C. Câtă apă a fost adăugată?

762. S-a adăugat apă la 20°C la 3 litri de apă la 60°C pentru a obţine apă la 40°C. Câtă apă a fost adăugată?

763. Care va fi temperatura amestecului dacă se amestecă 600 g apă la 80 °C cu 200 g apă la 20 °C?

764. Un litru de apă la 90°C a fost turnat în apă la 10°C, iar temperatura apei a devenit 60°C. Câtă apă rece era acolo?

765. Determinați câtă apă caldă încălzită la 60°C trebuie turnată într-un vas dacă vasul conține deja 20 litri de apă rece la o temperatură de 15°C; temperatura amestecului trebuie să fie de 40 °C.

766. Stabiliți câtă căldură este necesară pentru a încălzi 425 g de apă cu 20 °C.

767. Câte grade se vor încălzi 5 kg de apă dacă apa primește 167,2 kJ?

768. Câtă căldură este necesară pentru a încălzi m grame de apă la o temperatură t1 la o temperatură t2?
769. 2 kg de apă se toarnă într-un calorimetru la temperatura de 15 °C. La ce temperatură se va încălzi apa calorimetrului dacă se coboară în ea o greutate de alamă de 500 g încălzită la 100 °C? Capacitatea termică specifică a alamei este de 0,37 kJ/(kg °C).
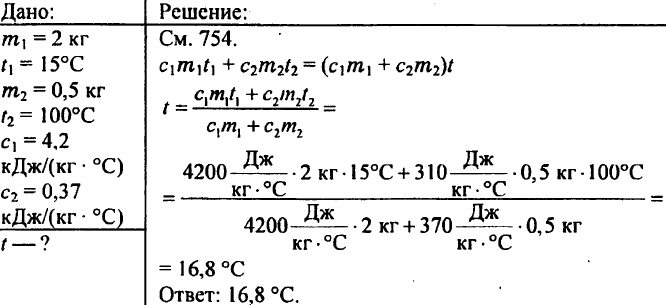
770. Sunt bucăți de cupru, cositor și aluminiu de același volum. Care dintre aceste piese are cea mai mare și care cea mai mică capacitate de căldură?

771. S-au turnat în calorimetru 450 g apă, a cărei temperatură este de 20 °C. Când 200 g de pilitură de fier încălzită la 100°C au fost scufundate în această apă, temperatura apei a devenit 24°C. Determinați capacitatea termică specifică a rumegușului.

772. Un calorimetru de cupru care cântărește 100 g conține 738 g de apă, a cărei temperatură este de 15 °C. 200 g de cupru au fost coborâte în acest calorimetru la o temperatură de 100 °C, după care temperatura calorimetrului a crescut la 17 °C. Care este capacitatea termică specifică a cuprului?

773. O bilă de oțel cântărind 10 g este scoasă din cuptor și coborâtă în apă la o temperatură de 10 °C. Temperatura apei a urcat la 25°C. Care a fost temperatura bilei în cuptor dacă masa de apă este de 50 g? Capacitatea termică specifică a oțelului este de 0,5 kJ/(kg °C).

777. 50 g de apă la 19 °C se toarnă în apă cu greutatea de 150 g la o temperatură de 35 °C. Care este temperatura amestecului?

778. Apa cântărind 5 kg la 90 °C a fost turnată într-un ibric din fontă cu o greutate de 2 kg la o temperatură de 10 °C. Care era temperatura apei?

779. O daltă de oțel cântărind 2 kg a fost încălzită la o temperatură de 800 °C și apoi coborâtă într-un vas care conținea 15 litri de apă la o temperatură de 10 °C. La ce temperatură va fi încălzită apa din vas?

(Indicație. Pentru a rezolva această problemă, este necesar să se creeze o ecuație în care temperatura dorită a apei din vas după coborârea tăietorului este luată drept necunoscută.)
780. Ce temperatură va avea apa dacă amesteci 0,02 kg apă la 15 °C, 0,03 kg apă la 25 °C și 0,01 kg apă la 60 °C?
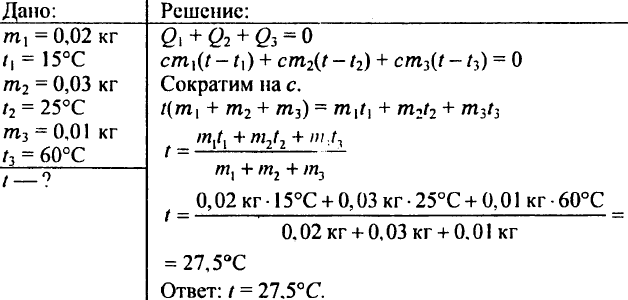
781. Încălzirea unei clase bine ventilate necesită o cantitate de căldură de 4,19 MJ pe oră. Apa intră în caloriferele de încălzire la 80°C și iese la 72°C. Câtă apă ar trebui să fie furnizată caloriferelor la fiecare oră?

782. Plumbul cântărind 0,1 kg la o temperatură de 100 °C a fost scufundat într-un calorimetru de aluminiu cu o greutate de 0,04 kg care conținea 0,24 kg apă la o temperatură de 15 °C. După aceea, temperatura de 16 °C a fost stabilită în calorimetru. Care este capacitatea termică specifică a plumbului?

Ce se încălzește mai repede pe aragaz - un ceainic sau o găleată cu apă? Răspunsul este evident - un ibric. Atunci a doua întrebare este de ce?
Răspunsul nu este mai puțin evident - deoarece masa de apă din ibric este mai mică. Amenda. Și acum poți să faci cea mai reală experiență fizică chiar tu acasă. Pentru a face acest lucru, veți avea nevoie de două cratițe mici identice, o cantitate egală de apă și ulei vegetal, de exemplu, o jumătate de litru fiecare și un aragaz. Pune oale cu ulei și apă pe același foc. Și acum uitați-vă doar ce se va încălzi mai repede. Dacă există un termometru pentru lichide, îl poți folosi, dacă nu, poți doar să încerci din când în când temperatura cu degetul, doar ai grijă să nu te arzi. În orice caz, vei vedea în curând că uleiul se încălzește mult mai repede decât apa. Și încă o întrebare, care poate fi implementată și sub formă de experiență. Care fierbe mai repede - apa calda sau rece? Totul este din nou evident - cel cald va fi primul care va termina. De ce toate aceste întrebări și experimente ciudate? Pentru a determina mărimea fizică numită „cantitatea de căldură”.
Cantitatea de căldură
Cantitatea de căldură este energia pe care corpul o pierde sau o câștigă în timpul transferului de căldură. Acest lucru este clar din nume. La răcire, corpul va pierde o anumită cantitate de căldură, iar atunci când este încălzit, va absorbi. Și răspunsurile la întrebările noastre ne-au arătat de ce depinde cantitatea de caldura?În primul rând, cu cât masa corpului este mai mare, cu atât este mai mare cantitatea de căldură care trebuie consumată pentru a-și schimba temperatura cu un grad. În al doilea rând, cantitatea de căldură necesară pentru încălzirea unui corp depinde de substanța din care este compus, adică de felul de substanță. Și în al treilea rând, diferența de temperatură corporală înainte și după transferul de căldură este, de asemenea, importantă pentru calculele noastre. Pe baza celor de mai sus, putem determinați cantitatea de căldură cu formula:
Q=cm(t_2-t_1) ,
unde Q este cantitatea de căldură,
m - greutatea corporală,
(t_2-t_1) - diferența dintre temperatura inițială și cea finală a corpului,
c - capacitatea termică specifică a substanței, se regăsește din tabelele aferente.
Folosind această formulă, puteți calcula cantitatea de căldură necesară pentru a încălzi orice corp sau pe care acest corp o va elibera atunci când se răcește.
Cantitatea de căldură se măsoară în jouli (1 J), ca orice altă formă de energie. Cu toate acestea, această valoare a fost introdusă nu cu mult timp în urmă, iar oamenii au început să măsoare cantitatea de căldură mult mai devreme. Și au folosit o unitate care este utilizată pe scară largă în vremea noastră - o calorie (1 cal). 1 calorie este cantitatea de căldură necesară pentru a crește temperatura a 1 gram de apă cu 1 grad Celsius. Ghidați de aceste date, iubitorii numărării caloriilor din alimentele pe care le consumă pot, de dragul interesului, să calculeze câți litri de apă pot fi fierți cu energia pe care o consumă cu alimente în timpul zilei.
Modificarea energiei interne prin efectuarea muncii este caracterizată de cantitatea de muncă, adică. munca este o măsură a schimbării energiei interne într-un proces dat. Modificarea energiei interne a unui corp în timpul transferului de căldură este caracterizată de o cantitate numită cantitate de căldură.
este schimbarea energiei interne a corpului în procesul de transfer de căldură fără a face muncă. Cantitatea de căldură este indicată prin literă Q .
Munca, energia internă și cantitatea de căldură sunt măsurate în aceleași unități - jouli ( J), ca orice altă formă de energie.
În măsurătorile termice, o unitate specială de energie, caloriile ( fecale), egal cu cantitatea de căldură necesară pentru a ridica temperatura a 1 gram de apă cu 1 grad Celsius (mai precis, de la 19,5 la 20,5 ° C). Această unitate, în special, este utilizată în prezent la calcularea consumului de căldură (energie termică) în blocurile de locuințe. Din punct de vedere empiric, a fost stabilit echivalentul mecanic al căldurii - raportul dintre calorii și jouli: 1 cal = 4,2 J.

Când un corp transferă o anumită cantitate de căldură fără a lucra, energia sa internă crește, dacă un corp degajă o anumită cantitate de căldură, atunci energia sa internă scade.
Dacă turnați 100 g de apă în două vase identice și 400 g într-un altul la aceeași temperatură și le puneți pe aceleași arzătoare, atunci apa din primul vas va fierbe mai devreme. Astfel, cu cât masa corpului este mai mare, cu atât este mai mare cantitatea de căldură de care are nevoie pentru a se încălzi. Același lucru este valabil și pentru răcire.

Cantitatea de căldură necesară pentru a încălzi un corp depinde și de tipul de substanță din care este făcut acest corp. Această dependență a cantității de căldură necesară pentru încălzirea corpului de tipul de substanță este caracterizată de o cantitate fizică numită capacitate termică specifică substante.
- aceasta este o cantitate fizică egală cu cantitatea de căldură care trebuie raportată la 1 kg dintr-o substanță pentru a o încălzi cu 1 ° C (sau 1 K). Aceeași cantitate de căldură este emisă de 1 kg dintr-o substanță atunci când este răcită cu 1 °C.
Capacitatea termică specifică este indicată prin literă cu. Unitatea de măsură a capacității termice specifice este 1 J/kg °C sau 1 J/kg °K.
Valorile capacității termice specifice a substanțelor sunt determinate experimental. Lichidele au o capacitate termică specifică mai mare decât metalele; Apa are cea mai mare capacitate termică specifică, aurul are o capacitate termică specifică foarte mică.
Deoarece cantitatea de căldură este egală cu modificarea energiei interne a corpului, putem spune că capacitatea termică specifică arată cât de mult se modifică energia internă. 1 kg substanță atunci când temperatura ei se schimbă 1 °C. În special, energia internă a 1 kg de plumb, când este încălzit cu 1 °C, crește cu 140 J, iar când este răcit, scade cu 140 J.
Q necesare pentru încălzirea masei corporale m temperatura t 1 °С până la temperatură t 2 °С, este egal cu produsul capacității termice specifice a substanței, masa corporală și diferența dintre temperaturile finale și inițiale, i.e.Q \u003d c ∙ m (t 2 - t 1)
Conform aceleiași formule, se calculează și cantitatea de căldură pe care corpul o degajă atunci când este răcit. Numai în acest caz temperatura finală trebuie scăzută din temperatura inițială, adică. Scădeți temperatura mai mică din temperatura mai mare.

Acesta este un rezumat al subiectului. „Cantitatea de căldură. Căldura specifică". Alegeți următorii pași:
- Treceți la următorul rezumat:
« Fizica - Clasa 10 "
În ce procese are loc transformarea agregată a materiei?
Cum poate fi schimbată starea materiei?
Puteți schimba energia internă a oricărui corp lucrând, încălzindu-l sau, dimpotrivă, răcindu-l.
Astfel, la forjarea unui metal se lucreaza si se incalzeste, in timp ce in acelasi timp metalul poate fi incalzit peste o flacara care arde.
De asemenea, dacă pistonul este fix (Fig. 13.5), atunci volumul de gaz nu se modifică atunci când este încălzit și nu se lucrează. Dar temperatura gazului și, prin urmare, energia sa internă, crește.
Energia internă poate crește și scădea, astfel încât cantitatea de căldură poate fi pozitivă sau negativă.
Se numește procesul de transfer de energie de la un corp la altul fără a lucra schimb de caldura.
Măsura cantitativă a modificării energiei interne în timpul transferului de căldură se numește cantitatea de căldură.
Imaginea moleculară a transferului de căldură.
În timpul schimbului de căldură la granița dintre corpuri, moleculele care se mișcă încet ale unui corp rece interacționează cu moleculele care se mișcă rapid ale unui corp fierbinte. Ca urmare, energiile cinetice ale moleculelor sunt aliniate și vitezele moleculelor unui corp rece cresc, în timp ce cele ale unui corp fierbinte scad.
În timpul schimbului de căldură, nu există nicio conversie a energiei de la o formă la alta, o parte din energia internă a unui corp mai fierbinte este transferată unui corp mai puțin încălzit.
Cantitatea de căldură și capacitatea de căldură.
Știți deja că pentru a încălzi un corp cu masa m de la temperatura t 1 la temperatura t 2, este necesar să se transfere în el cantitatea de căldură:
Q \u003d cm (t 2 - t 1) \u003d cm Δt. (13,5)
Când corpul se răcește, temperatura sa finală t 2 se dovedește a fi mai mică decât temperatura inițială t 1 și cantitatea de căldură degajată de corp este negativă.
Se numește coeficientul c din formula (13.5). capacitate termică specifică substante.
Căldura specifică- aceasta este o valoare egală numeric cu cantitatea de căldură pe care o primește sau o degajă o substanță cu masa de 1 kg atunci când temperatura sa se modifică cu 1 K.
Capacitatea termică specifică a gazelor depinde de procesul prin care este transferată căldura. Dacă încălziți un gaz la presiune constantă, acesta se va extinde și va funcționa. Pentru a încălzi un gaz cu 1 °C la presiune constantă, trebuie să transfere mai multă căldură decât să-l încălzească la un volum constant, când gazul se va încălzi doar.
Lichidele și solidele se extind ușor când sunt încălzite. Capacitățile lor specifice de căldură la volum constant și presiune constantă diferă puțin.
Căldura specifică de vaporizare.
Pentru a transforma un lichid în vapori în timpul procesului de fierbere, este necesar să îi transferați o anumită cantitate de căldură. Temperatura unui lichid nu se schimbă atunci când fierbe. Transformarea lichidului în vapori la o temperatură constantă nu duce la o creștere a energiei cinetice a moleculelor, ci este însoțită de o creștere a energiei potențiale a interacțiunii lor. La urma urmei, distanța medie dintre moleculele de gaz este mult mai mare decât între moleculele lichide.
Valoarea egală numeric cu cantitatea de căldură necesară pentru a transforma un lichid de 1 kg în abur la o temperatură constantă se numește căldură specifică de vaporizare.
Procesul de evaporare a lichidului are loc la orice temperatură, în timp ce cele mai rapide molecule părăsesc lichidul, iar acesta se răcește în timpul evaporării. Căldura specifică de vaporizare este egală cu căldura specifică de vaporizare.
Această valoare este notă cu litera r și este exprimată în jouli pe kilogram (J / kg).
Căldura specifică de vaporizare a apei este foarte mare: r H20 = 2,256 10 6 J/kg la o temperatură de 100 °C. În alte lichide, precum alcoolul, eterul, mercurul, kerosenul, căldura specifică de vaporizare este de 3-10 ori mai mică decât cea a apei.
Pentru a transforma un lichid cu masa m în abur, este necesară o cantitate de căldură egală cu:
Q p \u003d rm. (13,6)
Când aburul se condensează, se eliberează aceeași cantitate de căldură:
Q k \u003d -rm. (13,7)
Căldura specifică de fuziune.
Când un corp cristalin se topește, toată căldura furnizată acestuia duce la creșterea energiei potențiale de interacțiune a moleculelor. Energia cinetică a moleculelor nu se modifică, deoarece topirea are loc la o temperatură constantă.
Valoarea egală numeric cu cantitatea de căldură necesară pentru a transforma o substanță cristalină care cântărește 1 kg la punctul de topire într-un lichid se numește căldură specifică de fuziuneși sunt notate cu litera λ.
În timpul cristalizării unei substanțe cu o masă de 1 kg, se eliberează exact aceeași cantitate de căldură cum este absorbită în timpul topirii.
Căldura specifică de topire a gheții este destul de mare: 3,34 10 5 J/kg.
„Dacă gheața nu ar avea o căldură mare de fuziune, atunci în primăvară întreaga masă de gheață ar trebui să se topească în câteva minute sau secunde, deoarece căldura este transferată continuu în gheață din aer. Consecințele acestui lucru ar fi cumplite; căci chiar și în situația actuală, din topirea unor mase mari de gheață sau zăpadă apar mari inundații și torenți mari de apă.” R. Black, secolul al XVIII-lea
Pentru a topi un corp cristalin de masă m este necesară o cantitate de căldură egală cu:
Qpl \u003d λm. (13,8)
Cantitatea de căldură eliberată în timpul cristalizării corpului este egală cu:
Q cr = -λm (13,9)
Ecuația de echilibru termic.
Luați în considerare schimbul de căldură în cadrul unui sistem format din mai multe corpuri având inițial temperaturi diferite, de exemplu, schimbul de căldură între apa dintr-un vas și o minge fierbinte de fier coborâtă în apă. Conform legii conservării energiei, cantitatea de căldură degajată de un corp este numeric egală cu cantitatea de căldură primită de altul.
Cantitatea dată de căldură este considerată negativă, cantitatea de căldură primită este considerată pozitivă. Prin urmare, cantitatea totală de căldură Q1 + Q2 = 0.
Dacă schimbul de căldură are loc între mai multe corpuri dintr-un sistem izolat, atunci
Q 1 + Q 2 + Q 3 + ... = 0. (13.10)
Ecuația (13.10) se numește ecuația de echilibru termic.
Aici Q 1 Q 2 , Q 3 - cantitatea de căldură primită sau eliberată de corpuri. Aceste cantități de căldură sunt exprimate prin formula (13.5) sau formulele (13.6) - (13.9), dacă în procesul de transfer de căldură au loc diverse transformări de fază ale substanței (topire, cristalizare, vaporizare, condensare).
Puteți modifica energia internă a gazului din cilindru nu numai lucrând, ci și încălzind gazul (Fig. 43). Dacă pistonul este fix, atunci volumul gazului nu se va modifica, dar temperatura și, prin urmare, energia internă, va crește.
Procesul de transfer de energie de la un corp la altul fără a lucra se numește transfer de căldură sau transfer de căldură.
Energia transferată organismului ca rezultat al transferului de căldură se numește cantitatea de căldură. Cantitatea de căldură se mai numește și energia pe care corpul o eliberează în procesul de transfer de căldură.
Imaginea moleculară a transferului de căldură.În timpul schimbului de căldură la granița dintre corpuri, moleculele care se mișcă încet ale unui corp rece interacționează cu moleculele care se mișcă mai rapid ale unui corp fierbinte. Ca rezultat, energiile cinetice
moleculele sunt aliniate și vitezele moleculelor unui corp rece cresc, iar cele ale unui corp cald scad.
În timpul schimbului de căldură, nu există o conversie a energiei dintr-o formă în alta: o parte din energia internă a unui corp fierbinte este transferată unui corp rece.
Cantitatea de căldură și capacitatea de căldură. Din cursul de fizică clasa a VII-a se știe că, pentru a încălzi un corp cu o masă de la temperatură la temperatură, este necesar să se informeze despre cantitatea de căldură.
![]()
Când corpul se răcește, temperatura sa finală este mai mică decât cea inițială și cantitatea de căldură degajată de corp este negativă.
Coeficientul c din formula (4.5) se numește capacitatea termică specifică. Capacitatea termică specifică este cantitatea de căldură pe care 1 kg dintr-o substanță o primește sau o degajă atunci când temperatura acesteia se schimbă cu 1 K -
Capacitatea termică specifică este exprimată în jouli pe kilogram ori kelvin. Corpurile diferite necesită o cantitate inegală de energie pentru a crește temperatura cu I K. Astfel, capacitatea termică specifică a apei și a cuprului
Capacitatea termică specifică depinde nu numai de proprietățile substanței, ci și de procesul prin care are loc transferul de căldură.Dacă încălziți un gaz la presiune constantă, acesta se va extinde și va funcționa. Pentru a încălzi un gaz cu 1 °C la presiune constantă, va trebui să transfere mai multă căldură decât să-l încălzească la volum constant.
Lichidele și solidele se extind ușor atunci când sunt încălzite, iar capacitățile lor specifice de căldură la volum constant și presiune constantă diferă puțin.
Căldura specifică de vaporizare. Pentru a transforma un lichid în vapori, trebuie să i se transfere o anumită cantitate de căldură. Temperatura lichidului nu se modifică în timpul acestei transformări. Transformarea unui lichid în vapori la o temperatură constantă nu duce la o creștere a energiei cinetice a moleculelor, ci este însoțită de o creștere a energiei potențiale a acestora. La urma urmei, distanța medie dintre moleculele de gaz este de multe ori mai mare decât între moleculele lichide. În plus, o creștere a volumului în timpul tranziției unei substanțe de la starea lichidă la starea gazoasă necesită un lucru care trebuie efectuat împotriva forțelor presiunii externe.
Se numește cantitatea de căldură necesară pentru a transforma 1 kg de lichid în vapori la o temperatură constantă
căldură specifică de vaporizare. Această valoare este notată printr-o literă și exprimată în jouli pe kilogram.
Căldura specifică de vaporizare a apei este foarte mare: la o temperatură de 100°C. Pentru alte lichide (alcool, eter, mercur, kerosen etc.), căldura specifică de vaporizare este de 3-10 ori mai mică.
Pentru a transforma o masă lichidă în vapori este nevoie de o cantitate de căldură egală cu:
Când aburul se condensează, se eliberează aceeași cantitate de căldură:
Căldura specifică de fuziune. Când un corp cristalin se topește, toată căldura furnizată acestuia duce la creșterea energiei potențiale a moleculelor. Energia cinetică a moleculelor nu se modifică, deoarece topirea are loc la o temperatură constantă.
Cantitatea de căldură A necesară pentru a transforma 1 kg dintr-o substanță cristalină la punctul de topire într-un lichid de aceeași temperatură se numește căldură specifică de fuziune.
În timpul cristalizării a 1 kg dintr-o substanță, se eliberează exact aceeași cantitate de căldură. Căldura specifică de topire a gheții este destul de mare:
Pentru a topi un corp cristalin cu o masă, este necesară o cantitate de căldură egală cu:
Cantitatea de căldură eliberată în timpul cristalizării corpului este egală cu:
1. Cum se numește cantitatea de căldură? 2. Ce determină capacitatea termică specifică a substanțelor? 3. Ce se numește căldura specifică de vaporizare? 4. Ce se numește căldura specifică de fuziune? 5. În ce cazuri este negativă cantitatea de căldură transferată?
