វិស្វកម្មហ្សែន(ស. វិស្វកម្មហ្សែន) - ទិសដៅនៃការស្រាវជ្រាវក្នុងជីវវិទ្យាម៉ូលេគុល និងពន្ធុវិទ្យា គោលដៅចុងក្រោយគឺដើម្បីទទួលបាន ដោយប្រើបច្ចេកទេសមន្ទីរពិសោធន៍ អង្គការជាមួយថ្មី រួមទាំងវត្ថុដែលមិនត្រូវបានរកឃើញនៅក្នុងធម្មជាតិ បន្សំនៃលក្ខណៈសម្បត្តិតំណពូជ។ នៅបេះដូងរបស់ G. និង។ លទ្ធភាពនៃការរៀបចំដោយចេតនាជាមួយនឹងបំណែកនៃអាស៊ីត nucleic ដោយសារតែសមិទ្ធិផលចុងក្រោយបំផុតនៃជីវវិទ្យាម៉ូលេគុល និងហ្សែនភូតកុហក។ សមិទ្ធិផលទាំងនេះរួមមានការបង្កើតសកលនៃក្រមពន្ធុ (សូមមើល) ពោលគឺការពិតដែលថានៅក្នុងសារពាង្គកាយមានជីវិតទាំងអស់ ការដាក់បញ្ចូលអាស៊ីតអាមីណូដូចគ្នានៅក្នុងម៉ូលេគុលប្រូតេអ៊ីនត្រូវបានអ៊ិនកូដដោយលំដាប់នុយក្លេអូទីតដូចគ្នានៅក្នុងខ្សែសង្វាក់ DNA ។ ជោគជ័យនៃអង់ស៊ីមហ្សែន ដែលផ្តល់ឱ្យអ្នកស្រាវជ្រាវនូវសំណុំនៃអង់ស៊ីមដែលធ្វើឱ្យវាអាចទទួលបានហ្សែនដាច់ដោយឡែក ឬបំណែកនៃអាស៊ីតនុយក្លេអ៊ីកក្នុងទម្រង់ដាច់ដោយឡែក ដើម្បីអនុវត្តការសំយោគនៅក្នុង vitro នៃបំណែកនៃអាស៊ីត nucleic ដើម្បី - t ដើម្បីបញ្ចូលគ្នា។ បំណែកដែលទទួលបានទៅជាបំណែកតែមួយ។ ដូច្នេះការផ្លាស់ប្តូរលក្ខណៈសម្បត្តិតំណពូជនៃសារពាង្គកាយមួយដោយមធ្យោបាយ G. និង។ ត្រូវបានកាត់បន្ថយទៅនឹងការសាងសង់សម្ភារៈហ្សែនថ្មីពីបំណែកផ្សេងៗ ការណែនាំនៃសម្ភារៈនេះទៅក្នុងសារពាង្គកាយអ្នកទទួល ការបង្កើតលក្ខខណ្ឌសម្រាប់ដំណើរការ និងតំណពូជដែលមានស្ថេរភាព។
មធ្យោបាយមួយដើម្បីទទួលបានហ្សែនគឺគីមី។ ការសំយោគ។ បន្ទាប់ពី Holly (A. Holli) នៅសហរដ្ឋអាមេរិក A. A. Baev នៅសហភាពសូវៀត និងអ្នកស្រាវជ្រាវផ្សេងទៀតបានគ្រប់គ្រងដើម្បីបកស្រាយរចនាសម្ព័ន្ធនៃការដឹកជញ្ជូនផ្សេងៗ RBGK (tRNA), X. Koran et al ។ , បានអនុវត្តគីមីមួយ។ ការសំយោគ DNA នៃការអ៊ិនកូដ tRNA ដំបែរបស់អ្នកដុតនំ។
ប៉ុន្តែវិធីសាស្រ្តដ៏មានប្រសិទ្ធភាពបំផុតនៃការសំយោគហ្សែនសិប្បនិម្មិតត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងការប្រើប្រាស់អង់ស៊ីម RNA-dependent DNA polymerase (reverse transcriptase) ដែលត្រូវបានរកឃើញដោយ Baltimore (D. Baltimore) និង Temin (H. Temin) នៅក្នុងមេរោគ oncogenic (សូមមើល)។ អង់ស៊ីមនេះត្រូវបានញែកដាច់ពីគ្នា និងបន្សុតចេញពីកោសិកាដែលឆ្លងមេរោគដែលមានផ្ទុកមេរោគ RNA មួយចំនួន រួមទាំងមេរោគ myeloblastosis សត្វបក្សី មេរោគ Rous sarcoma និងជំងឺមហារីកឈាមកណ្តុរ។ Reverse transcriptase ផ្តល់នូវការសំយោគ DNA លើគំរូ messenger RNA (mRNA) ។ ការប្រើប្រាស់ម៉ូលេគុល mRNA ជាគំរូសម្រាប់ការសំយោគ DNA ជួយសម្រួលដល់ការសំយោគសិប្បនិម្មិតនៃហ្សែនរចនាសម្ព័ន្ធបុគ្គលនៃសារពាង្គកាយខ្ពស់ជាង ចាប់តាំងពីលំដាប់នៃមូលដ្ឋានអាសូតនៅក្នុងម៉ូលេគុល mRNA គឺជាច្បាប់ចម្លងពិតប្រាកដនៃលំដាប់នៃមូលដ្ឋានអាសូតនៃហ្សែនរចនាសម្ព័ន្ធដែលត្រូវគ្នា និង បច្ចេកទេសសម្រាប់ញែកម៉ូលេគុល mRNA ផ្សេងៗត្រូវបានអភិវឌ្ឍយ៉ាងល្អ។ ភាពជឿនលឿននៃការញែកប្រូតេអ៊ីន globin mRNA ដែលជាផ្នែកមួយនៃអេម៉ូក្លូប៊ីនរបស់មនុស្ស សត្វ និងបក្សី ប្រូតេអ៊ីនកែវភ្នែក mRNA សារធាតុ immunoglobin mRNA mRNA នៃប្រូតេអ៊ីនដុំសាច់សាហាវជាក់លាក់ (myeloma) ធ្វើឱ្យវាអាចសំយោគផ្នែករចនាសម្ព័ន្ធនៃហ្សែនដែលអ៊ិនកូដមួយចំនួន។ នៃប្រូតេអ៊ីនទាំងនេះដោយប្រើ reverse transcriptase ។
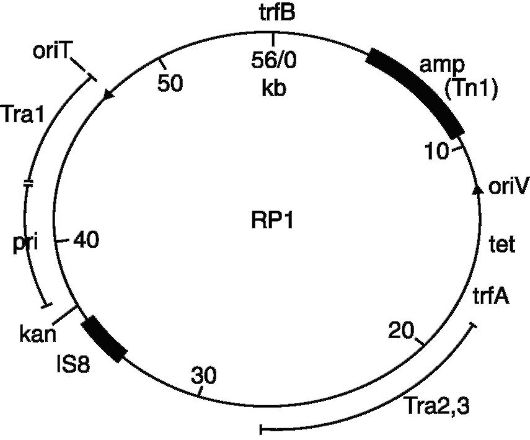
ទោះបីជាយ៉ាងណាក៏ដោយ នៅក្នុងរាងកាយ ហ្សែនរចនាសម្ព័ន្ធដំណើរការរួមគ្នាជាមួយហ្សែននិយតកម្ម ដែលជាលំដាប់នុយក្លេអូទីត ដែលមិនត្រូវបានបង្កើតឡើងវិញដោយម៉ូលេគុល mRNA ទេ។ ដូច្នេះហើយ គ្មានវិធីសាស្រ្តណាមួយក្នុងចំណោមវិធីសាស្រ្តទាំងនេះអនុញ្ញាតឱ្យសំយោគសំណុំនៃហ្សែនរចនាសម្ព័ន្ធ និងបទប្បញ្ញត្តិ។ ដំណោះស្រាយចំពោះបញ្ហានេះបានក្លាយជាអាចធ្វើទៅបានបន្ទាប់ពីការបង្កើតវិធីសាស្រ្តសម្រាប់ការញែកហ្សែនបុគ្គល ដើម្បីញែកហ្សែនបាក់តេរី រចនាសម្ព័ន្ធ cytoplasmic ដែលមាន DNA តូចៗត្រូវបានប្រើប្រាស់ ដែលអាចចម្លង (សូមមើលការចម្លង) ដោយឯករាជ្យពីក្រូម៉ូសូមបាក់តេរី។ រចនាសម្ព័ន្ធទាំងនេះបង្កើតបានជាក្រុមតែមួយនៃធាតុហ្សែន extrachromosomal នៃបាក់តេរី - plasmids (សូមមើល Plasmids) ។ ពួកវាមួយចំនួនអាចត្រូវបានណែនាំទៅក្នុងក្រូម៉ូសូមបាក់តេរី ហើយបន្ទាប់មកដោយឯកឯង ឬស្ថិតនៅក្រោមឥទ្ធិពលនៃភ្នាក់ងារជំរុញ។ វិទ្យុសកម្មកាំរស្មីយូវី ផ្លាស់ទីពីក្រូម៉ូសូមទៅស៊ីតូប្លាស ដោយយកជាមួយវានូវកោសិកាហ្សែនក្រូម៉ូសូមដែលនៅជាប់គ្នា។ ធាតុហ្សែន Extrachromosomal នៃបាក់តេរីដែលមានលក្ខណៈសម្បត្តិបែបនេះត្រូវបានគេហៅថា episomes [F. Jacob, Wollman (E. Wollman)] ។ Episomes (សូមមើល) រួមមានកម្រិតមធ្យម phages (សូមមើល។ Bacteriophage), កត្តាផ្លូវភេទនៃបាក់តេរី, កត្តាធន់ទ្រាំនឹងថ្នាំនៃ microorganisms (សូមមើល), កត្តា bacteriocinogenic (សូមមើល) ។ នៅក្នុង cytoplasm ហ្សែនចាប់យកដោយ episomes ចម្លងនៅក្នុងសមាសភាពរបស់ពួកគេ ហើយជារឿយៗបង្កើតជាច្បាប់ចម្លងជាច្រើន។ ការបង្កើតវិធីសាស្រ្តដ៏មានប្រសិទ្ធភាពមួយសម្រាប់ការញែក plasmids ដាច់ដោយឡែក ជាពិសេស phages សីតុណ្ហភាពដែលផ្ទុកសម្ភារៈហ្សែននៃក្រូម៉ូសូមបាក់តេរី និងការញែកបំណែកនៃក្រូម៉ូសូមកោសិកាបាក់តេរីដែលរួមបញ្ចូលនៅក្នុងហ្សែន bacteriophage បានធ្វើឱ្យវាអាចធ្វើទៅបាននៅឆ្នាំ 1969 សម្រាប់ J. Beckwith et al ។ ញែក lactose operon ដែលជាក្រុមនៃហ្សែនដែលគ្រប់គ្រងអង់ស៊ីមសំយោគដែលចាំបាច់សម្រាប់ការស្រូបយកជាតិ lactose ដោយ Escherichia coli ។ បច្ចេកទេសស្រដៀងគ្នានេះត្រូវបានគេប្រើដើម្បីញែក និងបន្សុទ្ធហ្សែនដែលគ្រប់គ្រងការសំយោគ Escherichia coli tyrosine transfer RNA (សូមមើលអាស៊ីត Ribonucleic)។
ការប្រើប្រាស់ plasmids ធ្វើឱ្យវាអាចទទួលបានជាក់ស្តែងនូវហ្សែនបាក់តេរីណាមួយក្នុងទម្រង់ដាច់ដោយឡែក ហើយជាលទ្ធផល លទ្ធភាពនៃការបង្កើតម៉ូលេគុល DNA ពីប្រភពផ្សេងៗ។ រចនាសម្ព័ន្ធកូនកាត់បែបនេះអាចត្រូវបានប្រមូលផ្តុំនៅក្នុងកោសិកាក្នុងបរិមាណដ៏ច្រើន ដោយសារប្លាស្មាជាច្រើននៅក្រោមលក្ខខណ្ឌមួយចំនួនចម្លងយ៉ាងខ្លាំងក្លានៅក្នុង cytoplasm បាក់តេរី បង្កើតបានរាប់សិប រាប់រយ និងសូម្បីតែរាប់ពាន់ច្បាប់ចម្លង។
ជោគជ័យរបស់ G. និង។ ផ្សារភ្ជាប់ជាមួយនឹងការអភិវឌ្ឍន៍បច្ចេកទេសសម្រាប់ផ្សំរចនាសម្ព័ន្ធហ្សែនពីប្រភពផ្សេងៗគ្នានៅក្នុងម៉ូលេគុល DNA តែមួយ។ កត្តាសម្រេចចិត្តក្នុងការរចនាម៉ូលេគុលកូនកាត់នៅក្នុង vitro គឺការប្រើប្រាស់ endonucleases កម្រិត - អង់ស៊ីមពិសេសដែលមានសមត្ថភាពកាត់ម៉ូលេគុល DNA នៅក្នុងតំបន់ដែលបានកំណត់យ៉ាងតឹងរ៉ឹង។ អង់ស៊ីមបែបនេះត្រូវបានរកឃើញនៅក្នុងកោសិកា Escherichia coli ដែលផ្ទុក plasmids ប្រភេទ R ដែលបណ្តាលឱ្យមានភាពធន់នឹងបាក់តេរីទៅនឹងថ្នាំមួយចំនួននៅក្នុងកោសិកានៃ Haemophilus influenzae, Serratia marcescens និងមីក្រូសរីរាង្គដទៃទៀត។ អង់ស៊ីមមួយក្នុងចំណោមអង់ស៊ីមដែលប្រើជាទូទៅបំផុតនៃប្រភេទនេះគឺ EcoRI restriction endonuclease ដែលត្រូវបានសំយោគដោយ RI plasmid នៅក្នុងកោសិកា E. coli ។ អង់ស៊ីមទទួលស្គាល់ផ្នែកមួយនៃ DNA ជាមួយនឹងលំដាប់តែមួយគត់នៃគូមូលដ្ឋានចំនួនប្រាំមួយ និងកាត់រចនាសម្ព័ន្ធ DNA ពីរខ្សែនៅក្នុងផ្នែកនេះ ដូច្នេះចុងបញ្ចប់ដែលមានខ្សែតែមួយនៃនុយក្លេអូទីតចំនួនបួនត្រូវបានបង្កើតឡើងនៅលើភាគីទាំងពីរ (ដែលគេហៅថាចុងស្អិត)។ ដោយសារអង់ស៊ីមកាត់ម៉ូលេគុល DNA ដោយមិនគិតពីប្រភពដើមរបស់វា តាមវិធីកំណត់យ៉ាងតឹងរ៉ឹង បំណែក DNA ទាំងអស់ដែលកើតចេញពីសកម្មភាពរបស់អង់ស៊ីមនឹងមានចុងស្អិតដូចគ្នា។ ចុងស្អិតដែលបំពេញបន្ថែមនៃបំណែក DNA ណាមួយត្រូវបានផ្សំដោយចំណងអ៊ីដ្រូសែន បង្កើតបានជា DNA រាងជារង្វង់កូនកាត់ (រូបភាព) ។ ដើម្បីធ្វើឱ្យមានស្ថេរភាពនៃម៉ូលេគុល DNA កូនកាត់ អង់ស៊ីមមួយទៀតត្រូវបានប្រើប្រាស់ - polynucleotide ligase ដែលស្ដារចំណង covalent ដែលខូចដោយអង់ស៊ីមរឹតបន្តឹង។ លំដាប់ដែលត្រូវបានទទួលស្គាល់ជាពិសេសដោយ EcoRI កើតឡើងនៅក្នុង DNA មិនលើសពី 4,000-16,000 គូមូលដ្ឋានដាច់ពីគ្នា។ ដូច្នេះ បំណែក DNA ដែលបង្កើតឡើងក្រោមសកម្មភាពរបស់ EcoRI អាចរួមបញ្ចូលហ្សែនមួយយ៉ាងតិចដែលមិនត្រូវបានបំផ្លាញដោយអង់ស៊ីម (ជាមធ្យម ហ្សែនមួយមានគូមូលដ្ឋាន 1000-1500)។
ការប្រើប្រាស់សារធាតុ endonucleases កម្រិត និងអង់ស៊ីមមួយចំនួនទៀត ធ្វើឱ្យវាអាចទទួលបាន DNA ផ្សំឡើងវិញដ៏ស្មុគស្មាញ។ ក្រុមអ្នកស្រាវជ្រាវនៅសហរដ្ឋអាមេរិកដឹកនាំដោយ P. Berg បានគ្រប់គ្រងបញ្ចូលគ្នានូវព័ត៌មានហ្សែនពីប្រភពចំនួនបីដែលជាផ្នែកមួយនៃម៉ូលេគុល DNA តែមួយ៖ ហ្សែនពេញលេញ (សូមមើល) នៃមេរោគស្វា oncogenic SV40 ដែលជាផ្នែកមួយនៃហ្សែននៃ bacteriophage សីតុណ្ហភាព។ λ និងក្រុមនៃហ្សែន E. coli ដែលទទួលខុសត្រូវចំពោះការ assimilation galactose ។ ម៉ូលេគុល recombinant ដែលបានរចនាឡើងមិនត្រូវបានធ្វើតេស្តសម្រាប់សកម្មភាពមុខងារទេ ពីព្រោះអ្នកនិពន្ធនៃការងារនេះបានបញ្ឈប់មុនពេលគ្រោះថ្នាក់នៃការរីករាលដាលនៃមេរោគសត្វ oncogenic នៅក្នុងចំនួនបាក់តេរីដែលរស់នៅក្នុងពោះវៀនរបស់មនុស្ស។ វាត្រូវបានគេដឹងថា DNA ដែលបន្សុតនៃមេរោគអាចជ្រាបចូលទៅក្នុងកោសិកាថនិកសត្វផ្សេងៗ ហើយត្រូវបានទទួលមរតកដោយស្ថេរភាព។
ជាលើកដំបូង ម៉ូលេគុល DNA កូនកាត់សកម្មមានមុខងារត្រូវបានសាងសង់នៅសហរដ្ឋអាមេរិកដោយ S. Cohen et al ។ ក្រុមរបស់ Cohen បានដោះស្រាយបញ្ហានៃការរួមបញ្ចូលគ្នា និងការក្លូន (ការប្រមូលផ្តុំជ្រើសរើស) នៃម៉ូលេគុល DNA ដែលនៅដាច់ដោយឡែកពីប្រភេទសត្វ ដែលកាន់តែឆ្ងាយពីគ្នាទៅវិញទៅមក។ នីតិវិធីក្លូនជាធម្មតាមាននៅក្នុងការពិតដែលថា DNA ពីប្រភពផ្សេងៗត្រូវបានបំបែកដោយប្រើ endonucleases កំហិត បន្ទាប់មកបំណែកទាំងនេះត្រូវបានបញ្ចូលគ្នានៅក្នុង vitro ទៅជារចនាសម្ព័ន្ធទូទៅ ហើយបញ្ចូលទៅក្នុងសារពាង្គកាយអ្នកទទួល ដែលនៅក្នុងការពិសោធន៍របស់ Cohen គឺ Escherichia coli ។ វាត្រូវបានបង្កើតឡើងដែលកោសិកានៃប្រភេទបាក់តេរីជាច្រើន (រួមទាំង Escherichia coli, Salmonella typhimurium, Staphylococcus aureus) អាចផ្លាស់ប្តូរបាន (សូមមើលការផ្លាស់ប្តូរ) ដោយប្រើម៉ូលេគុល DNA ដែលផ្សំឡើងវិញ។ ក្នុងករណីនេះ ផ្នែក plasmid នៃម៉ូលេគុលកូនកាត់ (ឬមួយនៃ plasmids ប្រសិនបើ plasmids ពីរមកពីប្រភពផ្សេងៗគ្នាត្រូវបានបញ្ចូលគ្នាក្នុងម៉ូលេគុលកូនកាត់) ដើរតួជាវ៉ិចទ័រ ពោលគឺធានាការផ្ទេរសារធាតុហ្សែន phylogenetically alien ចូលទៅក្នុងកោសិកាអ្នកទទួល និង ការបន្តពូជរបស់វានៅក្នុងពួកគេ។ plasmid ដំបូងដែលប្រើដោយ Cohen et al ជាវ៉ិចទ័រគឺ plasmid pSC101 ដែលទទួលបានដោយគាត់នៅក្នុង vitro ដែលគ្រប់គ្រងភាពធន់នៃបាក់តេរីទៅនឹង tetracycline ។ plasmid តូចនេះមានប្រវែងត្រឹមតែ 8000 bp ប៉ុណ្ណោះ។ វាត្រូវបានវាយប្រហារដោយអង់ស៊ីម EcoRI នៅកន្លែងតែមួយ ហើយអង់ស៊ីមមិនបំផ្លាញសមត្ថភាពរបស់ plasmid ក្នុងការចម្លងជាបន្តបន្ទាប់នៅក្នុងកោសិកា E. coli និងគ្រប់គ្រងភាពធន់នឹងតេត្រាស៊ីគ្លីន។ លក្ខណៈពិសេសទាំងនេះបានធ្វើឱ្យវាអាចប្រើវាសម្រាប់ការសាងសង់ម៉ូលេគុល DNA កូនកាត់នៅក្នុង vitro ។ នៅដំណាក់កាលដំបូង plasmid DNA ដាច់ដោយឡែកពីប្រភេទបាក់តេរីផ្សេងៗ ហើយបន្ទាប់មកពីសារពាង្គកាយខ្ពស់ជាងត្រូវបានភ្ជាប់ទៅនឹង pSC101។ ដូច្នេះ plasmids "chimeric" (ដែលមិនអាចកើតឡើងក្នុងលក្ខខណ្ឌធម្មជាតិ) ត្រូវបានបង្កើតឡើង ដែលរួមបញ្ចូលគ្នាក្នុងសមាសភាពនៃសារធាតុហ្សែន Escherichia coli ដែលជាផ្នែក DNA ពី oocytes នៃកង្កែបក្រញ៉ាំ Xenopus laevis ដែលគ្រប់គ្រងការសំយោគនៃ ribosomal RNA និងផ្នែក DNA នៃ urchin សមុទ្រ ដែលគ្រប់គ្រងការសំយោគប្រូតេអ៊ីន histone ឬ mouse mitochondrial DNA ។ នៅក្នុងកោសិកានៃ Escherichia coli ដែលក្នុងនោះកូនកាត់បែបនេះ plasmids "chimeric" ត្រូវបានណែនាំការងារនៃហ្សែននៃសារពាង្គកាយខ្ពស់ជាងត្រូវបានចុះបញ្ជី។
មិនដូច pSC101 ដែលមានវត្តមាននៅក្នុងក្រឡាត្រឹមតែ 4-6 ច្បាប់ចម្លងទេ plasmids មួយចំនួនផ្សេងទៀតដែលប្រើជាវ៉ិចទ័រអាចចម្លងបានច្រើនដងក្រោមលក្ខខណ្ឌជាក់លាក់ ដោយបង្កើតបានរាប់ពាន់ច្បាប់ចម្លងក្នុងមួយក្រឡា។ ឧទាហរណ៍ លក្ខណៈសម្បត្តិបែបនេះត្រូវបានកាន់កាប់ដោយ ColEI plasmid ដែលគ្រប់គ្រងការសំយោគកូលីស៊ីន (សូមមើល Bacteriocinogeny) ។ ដូច pSC101 ដែរ ColEI ត្រូវបានបំបែកដោយអង់ស៊ីម EcoRl នៅក្នុងកន្លែងតែមួយ ហើយ DNA បរទេសដែលត្រូវបានព្យាបាលដោយ EcoRI ត្រូវបានភ្ជាប់យ៉ាងងាយស្រួលទៅនឹងម៉ូលេគុលលីនេអ៊ែរលទ្ធផលជាមួយនឹងចុងស្អិត។ ដូច្នេះហ្សែននៃ tryptophan operon នៃ Escherichia coli ត្រូវបាន "ដេរ" ទៅ ColEI ។ នៅក្នុងកោសិកាដែលផ្ទុកនូវច្បាប់ចម្លងជាច្រើននៃ plasmid កូនកាត់ដែលបានសាងសង់ ការផលិតប្រូតេអ៊ីនអង់ស៊ីមដែលគ្រប់គ្រងដោយហ្សែន tryptophan biosynthesis បានកើនឡើងយ៉ាងខ្លាំង។ នៅក្នុងប្រព័ន្ធ in vitro វាអាចភ្ជាប់ ColEI plasmid ទៅនឹងកត្តា R-factors និង temperate phage។ ការងារបែបនេះត្រូវបានអនុវត្តជាលើកដំបូងនៅក្នុងសហភាពសូវៀតក្រោមការណែនាំរបស់អ្នកសិក្សា A. A. Baev និងសាស្រ្តាចារ្យ S. I. Alikhanyan ។ ប្លាស្មាវ៉ិចទ័ររួមបញ្ចូលគ្នាដែលបង្កើតឡើងដោយ ColEI និង R-factors អាចបង្កើនចំនួនច្រើននៅក្នុងកោសិកាបាក់តេរីដូចជា ColEI ហើយក្នុងពេលតែមួយកំណត់ភាពធន់នៃកោសិកាទៅនឹងថ្នាំអង់ទីប៊ីយោទិច ដែលជួយសម្រួលដល់ការជ្រើសរើសបាក់តេរីយ៉ាងខ្លាំង ដែលជាអ្នកផ្ទុកផ្លាស្មាកូនកាត់។
Temperate phages ត្រូវបានគេប្រើជាវ៉ិចទ័រផងដែរ។ ភាគល្អិត bacteriophage កូនកាត់ត្រូវបានសាងសង់នៅក្នុងប្រព័ន្ធ in vitro ដែលរួមបញ្ចូលហ្សែនបាក់តេរី DNA នៃ phages ផ្សេងទៀត ឬសារពាង្គកាយខ្ពស់ជាង (ឧទាហរណ៍ DNA នៃផ្លែ Drosophila ហើរ) នៅក្នុងរចនាសម្ព័ន្ធរបស់វា។
សកម្មភាពមុខងារនៃ DNA កូនកាត់ត្រូវបានកំណត់ដោយលទ្ធភាពនៃការផ្ទេរពួកវាទៅក្នុងកោសិកានៃសារពាង្គកាយអ្នកទទួល និងការគុណជាបន្តបន្ទាប់ (ការពង្រីក) នៅក្នុងកោសិកាទាំងនេះ។ ក្នុងនាមជាអ្នកទទួល មិនត្រឹមតែបាក់តេរីដូចដែលបានរៀបរាប់ខាងលើប៉ុណ្ណោះទេ ប៉ុន្តែកោសិកានៃសារពាង្គកាយកម្រិតខ្ពស់ក៏ត្រូវបានប្រើប្រាស់យ៉ាងមានប្រសិទ្ធភាពផងដែរ រហូតមកដល់ពេលនេះ មានតែនៅក្នុងទម្រង់នៃវប្បធម៌ជាលិកាដែលដាំដុះនៅខាងក្រៅរាងកាយប៉ុណ្ណោះ។ មានការចង្អុលបង្ហាញថា DNA នៃ phages ដែលផ្ទុកហ្សែនបាក់តេរីអាចជ្រាបចូលទៅក្នុងកោសិកាជាលិកាភ្ជាប់របស់មនុស្ស (fibroblasts) ចូលទៅក្នុង protoplasts ឬចូលទៅក្នុងវប្បធម៌ដែលមិនខុសគ្នា (callus) នៃកោសិការុក្ខជាតិ។ នៅឆ្នាំ ១៩៧១ អាមឺរ។ អ្នកស្រាវជ្រាវ Merrill (S. R. Merril) et al ។ , បានរាយការណ៍អំពីការពិសោធន៍ដើម្បីកែកំហុសតំណពូជ - galactosemia (សូមមើល) ដោយបញ្ចូលទៅក្នុងកោសិកា "ឈឺ" នៃហ្សែន galactose នៃបាក់តេរីដែលរួមបញ្ចូលនៅក្នុង DNA នៃ phage transducing ។ ជាលទ្ធផល កោសិកានៃអ្នកជំងឺដែលមានជំងឺ galactosemia ខូចមុខងារអង់ស៊ីម beta-D-galactose-1-phosphate uridyltransferase មិនអាចបញ្ចូល galactose បានស្ដារឡើងវិញនូវសមត្ថភាពលូតលាស់ធម្មតារបស់ពួកគេនៅក្នុងវត្តមាននៃ galactose ហើយសកម្មភាពអង់ស៊ីមពីមុនគឺអវត្តមាន។ បានចុះឈ្មោះនៅក្នុងការដកស្រង់របស់ពួកគេ។ លទ្ធផលស្រដៀងគ្នានេះត្រូវបានទទួលដោយ Horst (J. Horst) et al ជាមួយនឹងការណែនាំនៃហ្សែនបាក់តេរីដែលគ្រប់គ្រងការសំយោគនៃ beta-galactosidase នៅក្នុង fibroblasts នៃអ្នកជំងឺដែលមានជំងឺ gangliosidosis ទូទៅដែលកំណត់ដោយកង្វះអង់ស៊ីមធ្ងន់ធ្ងរនេះ។ Manion (W. Munyon) និងអ្នកសហការរបស់គាត់។ ដោយប្រើវីរុស Herpes ពួកគេបានផ្ទេរហ្សែនដែលគ្រប់គ្រងការសំយោគ thymidine kinase ពីកោសិកាមនុស្សទៅកោសិកាកណ្តុរ ស្តារសមត្ថភាពនៃ fibroblasts កណ្ដុរដែលខូចដើម្បីសំយោគអង់ស៊ីមនេះ។
មធ្យោបាយមួយក្នុងការផ្ទេរព័ត៌មានហ្សែននៅក្នុងវប្បធម៌នៃកោសិកាមនុស្ស សត្វ និងរុក្ខជាតិគឺការបង្កាត់នៃកោសិកា somatic ដែលបង្កើតឡើងដោយ Ephrussi (V. Ephrussi) និង Barsky (G. Barski) ។ ប្រសិទ្ធភាពនៃវិធីសាស្រ្តនេះមានភាពប្រសើរឡើងគួរឱ្យកត់សម្គាល់ចាប់តាំងពីវាត្រូវបានគេរកឃើញថាភាគល្អិតនៃមេរោគ parainfluenza ប្រភេទ Sendai អសកម្មបង្កើនភាពញឹកញាប់នៃការលាយកោសិកាពីប្រភពផ្សេងៗគ្នា។ លទ្ធភាពនៃការផ្ទេរហ្សែនបុគ្គលពីក្រូម៉ូសូម hamster របស់ចិនដាច់ដោយឡែកទៅក្នុងកោសិកាជាលិកាភ្ជាប់របស់កណ្តុរត្រូវបានបង្ហាញ។ កូនកាត់នៃកោសិកាមនុស្ស និងកណ្តុរត្រូវបានពិពណ៌នា ដែលផ្នែកនៃក្រូម៉ូសូមរបស់មនុស្សត្រូវបានដកចេញ ខណៈពេលដែលផ្នែកផ្សេងទៀតនៅតែមានមុខងារ។ ការអភិវឌ្ឍន៍នៃវិធីសាស្ត្រវះកាត់កោសិកាបានធ្វើឱ្យវាអាចធ្វើទៅបានដើម្បីប្តូរស្នូលកោសិកាពីកោសិកា somatic ទៅជាស៊ុតបង្កកំណើត ហើយជាលទ្ធផលទទួលបានសារពាង្គកាយដូចគ្នាបេះបិទ។ ការបង្កាត់កោសិកាបានធ្វើឱ្យវាអាចធ្វើទៅបានដើម្បីជំរុញការសំយោគនៃ globin របស់មនុស្សនៅក្នុងកោសិកាពូជកង្កែប។ ឧទាហរណ៍ទាំងអស់នេះបង្ហាញពីសក្តានុពលរបស់ G. និង។
តម្លៃជាក់ស្តែងនៃ G. និង។ សម្រាប់ថ្នាំត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងការរំពឹងទុកនៃការកែតម្រូវការខូចមុខងារមេតាប៉ូលីសតំណពូជចំពោះមនុស្ស (សូមមើលការព្យាបាលដោយហ្សែន) ការបង្កើតអតិសុខុមប្រាណដែលបានបាត់បង់ធាតុបង្កជំងឺរបស់ពួកគេ ប៉ុន្តែរក្សាបាននូវសមត្ថភាពក្នុងការបង្កើតភាពស៊ាំ ការសំយោគអង់ទីប៊ីយ៉ូទិក អាស៊ីតអាមីណូ អរម៉ូន វីតាមីន អង់ស៊ីម។ immunoglobulins ជាដើមដោយផ្អែកលើការប្រើប្រាស់មីក្រូសរីរាង្គដែលបានរួមបញ្ចូលហ្សែនដែលត្រូវគ្នា។ លទ្ធផលពិសេសអាចទទួលបានក្នុងពេលអនាគតដ៏ខ្លី G. និង។ រុក្ខជាតិ។ ដោយមានជំនួយពីវិធីសាស្រ្តរបស់ G. និង។ ពួកគេកំពុងព្យាយាមបង្កើតរុក្ខជាតិដែលអាចស្រូបយកអាសូតបរិយាកាស និងកែលម្អសមាសធាតុប្រូតេអ៊ីននៃអាហាររុក្ខជាតិ។ ដំណោះស្រាយដ៏ជោគជ័យនៃបញ្ហាទាំងនេះនឹងបង្កើនផលិតភាពរបស់រុក្ខជាតិយ៉ាងខ្លាំង កាត់បន្ថយការផលិត និងការប្រើប្រាស់សារធាតុអាសូតរ៉ែ ហើយដោយហេតុនេះធ្វើអោយបរិស្ថានប្រសើរឡើងយ៉ាងខ្លាំង (សូមមើល)។ លទ្ធភាពនៃការបង្កើតទម្រង់ថ្មីទាំងស្រុងនៃសត្វ និងរុក្ខជាតិដោយការយកឈ្នះលើឧបសគ្គជាក់លាក់នៃការបង្កាត់ពូជកំពុងត្រូវបានសិក្សា។ ទោះយ៉ាងណាក៏ដោយនៅក្នុងការវាយតម្លៃរបស់ G. និង។ ក្នុងនាមជាទម្រង់ថ្មីនៃការរុករកសត្វព្រៃ មនុស្សម្នាក់គួរតែគិតគូរមិនត្រឹមតែតួនាទីបដិវត្តដែលអាចធ្វើទៅបានរបស់ខ្លួនក្នុងជីវវិទ្យា ឱសថ និងកសិកម្មប៉ុណ្ណោះទេ ប៉ុន្តែវាក៏ជាឱកាសដែលកើតឡើងទាក់ទងនឹងការអភិវឌ្ឍន៍របស់វាសម្រាប់ការលេចចេញនូវទម្រង់ថ្មីនៃមីក្រូសរីរាង្គបង្កជំងឺ គ្រោះថ្នាក់នៃ ការរីករាលដាលនៃ DNA កូនកាត់នៅក្នុងចំនួនបាក់តេរីដែលរស់នៅក្នុងមនុស្ស ផ្ទុកមេរោគ Oncogenic ។ សេចក្តីល្អរបស់មនុស្សគឺលះបង់ដើម្បីចំណេញ និងការឈ្លានពាន។
ពីសម្ភារៈបន្ថែម
វិស្វកម្មហ្សែនបន្តជាវិធីសាស្រ្តស្រាវជ្រាវជឿនលឿនមួយក្នុងជីវវិទ្យាម៉ូលេគុល និងពន្ធុវិទ្យា។ វាគួរតែត្រូវបានកត់សម្គាល់ថាគំនិតនៃ "វិស្វកម្មហ្សែន" និង "វិស្វកម្មហ្សែន" មិនមានន័យដូចគ្នាទាំងស្រុងទេព្រោះការស្រាវជ្រាវដែលទាក់ទងនឹងវិស្វកម្មហ្សែនមិនត្រូវបានកំណត់ចំពោះឧបាយកលជាមួយហ្សែនបែបនេះទេ។ បច្ចុប្បន្ននេះ វិធីសាស្ត្រវិស្វកម្មហ្សែនអនុញ្ញាតឱ្យមានការវិភាគស៊ីជម្រៅ និងលម្អិតបំផុតនៃអាស៊ីត nucleic ធម្មជាតិ - សារធាតុដែលទទួលខុសត្រូវចំពោះការរក្សាទុក ការបញ្ជូន និងការអនុវត្តព័ត៌មានហ្សែន (សូមមើលអាស៊ីត Nucleic ។ មិនត្រូវបានរកឃើញនៅក្នុងធម្មជាតិទេ។ ហ្សែន (សូមមើលហ្សែន) ការរួមបញ្ចូលគ្នានៃហ្សែន និងបង្ហាញពួកវាជាមួយនឹងប្រសិទ្ធភាពខ្ពស់នៅក្នុងកោសិការស់មួយ (សូមមើលការបង្ហាញហ្សែន)។ ក្នុងចំណោមសមិទ្ធិផលជាក់ស្តែងជាក់លាក់នៃវិស្វកម្មហ្សែនក្នុងទសវត្សរ៍ចុងក្រោយនេះ អ្វីដែលសំខាន់បំផុតគួរតែជាការបង្កើតអ្នកផលិតប្រូតេអ៊ីនសកម្មជីវសាស្រ្ត - អាំងស៊ុយលីន (សូមមើល) អ៊ីនធឺហ្វេរ៉ុន (សូមមើល) អ័រម៉ូនលូតលាស់ (សូមមើល អរម៉ូនសូម៉ាតូត្រូពិក) ជាដើម។ ដោយសារការវិវឌ្ឍន៍នៃវិធីសាស្ត្រវិស្វកម្មហ្សែន ការធ្វើឱ្យសកម្មនៃតំណភ្ជាប់នៃសារធាតុមេតាបូលីសទាំងនោះ សារធាតុ to-rye ត្រូវបានភ្ជាប់ជាមួយនឹងការបង្កើតសារធាតុសកម្មជីវសាស្ត្រម៉ូលេគុលទាប។ តាមរបៀបនេះ អ្នកផលិតថ្នាំអង់ទីប៊ីយោទិច អាស៊ីតអាមីណូ និងវីតាមីនមួយចំនួនត្រូវបានទទួល ដែលមានប្រសិទ្ធភាពជាងអ្នកផលិតសារធាតុទាំងនេះច្រើនដង ដែលទទួលបានដោយវិធីសាស្ត្រប្រពៃណីនៃហ្សែន និងការជ្រើសរើស។ វិធីសាស្រ្តកំពុងត្រូវបានបង្កើតឡើងសម្រាប់ការទទួលបានវ៉ាក់សាំងប្រូតេអ៊ីនសុទ្ធប្រឆាំងនឹងជំងឺរលាកថ្លើម គ្រុនផ្តាសាយ វីរុស Herpes និងជំងឺពងបែកក្នុងមាត់ គំនិតនៃការប្រើប្រាស់វ៉ាក់សាំងជាមួយនឹងមេរោគ vaccinia ត្រូវបានអនុវត្តនៅក្នុងហ្សែនដែលហ្សែនដែលអ៊ិនកូដការសំយោគប្រូតេអ៊ីន។ មេរោគផ្សេងៗ (ឧទាហរណ៍ ជំងឺរលាកថ្លើម ឬមេរោគគ្រុនផ្តាសាយ) ត្រូវបានដាក់បញ្ចូល៖ ជាលទ្ធផល ការបង្ករោគដោយមេរោគដែលបានបង្កើតតាមរបៀបនេះ រាងកាយបង្កើតភាពស៊ាំមិនត្រឹមតែប្រឆាំងនឹងជំងឺអុតស្វាយប៉ុណ្ណោះទេ ប៉ុន្តែថែមទាំងប្រឆាំងនឹងជំងឺរលាកថ្លើម គ្រុនផ្តាសាយ ឬជំងឺផ្សេងទៀតដែលបណ្តាលមកពីវីរុសនោះផងដែរ។ ប្រូតេអ៊ីនទៅ-រ៉ូហ្គោត្រូវបានអ៊ិនកូដដោយហ្សែនដែលភ្ជាប់មកជាមួយ។
ការប្រមូលផ្តុំពិភពលោកនៃការរឹតបន្តឹង endonucleases - restrictases ដែលជា "ឧបករណ៍" សំខាន់នៃការរៀបចំវិស្វកម្មហ្សែនបានកើនឡើងយ៉ាងខ្លាំង។ ការរឹតបន្តឹងច្រើនជាង 400 "ការទទួលស្គាល់" apprx ។ 100 កន្លែងជាក់លាក់ (កន្លែង) នៃរចនាសម្ព័ន្ធផ្សេងគ្នានៅក្នុងម៉ូលេគុល DNA (សូមមើល អាស៊ីត Deoxyribonucleic) និងការបំបែកខ្សែសង្វាក់ DNA polynucleotide នៅកន្លែងទាំងនេះ។ ដោយមានជំនួយពីអង់ស៊ីមមួយប្រភេទ ឬការរួមបញ្ចូលគ្នានៃអង់ស៊ីមកម្រិតមួយចំនួន ស្ទើរតែហ្សែនណាមួយអាចត្រូវបានញែកដាច់ដោយឡែកពីគ្នាជាផ្នែកនៃបំណែក DNA មួយឬច្រើន (ហៅថាបំណែកកំហិត)។ នេះបានពង្រីកលទ្ធភាពនៃវិស្វកម្មហ្សែនមិនត្រឹមតែទាក់ទងនឹងភាពឯកោនៃហ្សែនប៉ុណ្ណោះទេ ប៉ុន្តែវាក៏ទាក់ទងទៅនឹងការធ្វើឱ្យសកម្មនៃការងាររបស់ពួកគេ ការវិភាគរចនាសម្ព័ន្ធនៃហ្សែន និងបរិយាកាសម៉ូលេគុលរបស់វា។ វិធីសាស្រ្តសម្រាប់ការសំយោគហ្សែនទាំងមូលជាមួយនឹងលំដាប់នៃនុយក្លេអូទីតត្រូវបានបង្កើតឡើង វាអាចផ្គត់ផ្គង់ហ្សែនសំយោគ និងធម្មជាតិជាមួយនឹងលំដាប់នុយក្លេអូទីតនិយតកម្មផ្សេងៗ ជំនួស បញ្ចូល លុបនុយក្លេអូទីតតែមួយនៅក្នុងផ្នែកជាក់លាក់នៃហ្សែន កាត់បន្ថយ ឬ បំពេញខ្សែសង្វាក់នុយក្លេអូទីតរបស់វាជាមួយនឹងភាពត្រឹមត្រូវនៃនុយក្លេអូទីតមួយ។
សមិទ្ធិផលនៃវិស្វកម្មហ្សែនគឺការជ្រៀតចូលទៅក្នុងអង្គការ និងការប្រព្រឹត្តទៅនៃយន្តការនៃតំណពូជនៅក្នុងកោសិកានៃសារពាង្គកាយខ្ពស់ជាង រួមទាំងមនុស្សផងដែរ។ វាស្ថិតនៅលើ eukaryotes ខ្ពស់ដែលទិន្នន័យគួរឱ្យចាប់អារម្មណ៍បំផុតត្រូវបានគេទទួលបានដោយប្រើវិធីសាស្ត្រវិស្វកម្មហ្សែន។ ភាពជោគជ័យនៃវិស្វកម្មហ្សែនត្រូវបានផ្សារភ្ជាប់យ៉ាងខ្លាំងជាមួយនឹងការផលិតវ៉ិចទ័រឯកទេសថ្មីដែលអនុញ្ញាតឱ្យមានការក្លូនប្រកបដោយប្រសិទ្ធភាព (ការបន្តពូជ) នៃបំណែក DNA បុគ្គល (ហ្សែន) និងការសំយោគប្រូតេអ៊ីនដែលបានអ៊ិនកូដដោយហ្សែនទាំងនេះ។
បំណែកដាក់កម្រិតដែលភ្ជាប់ទៅនឹងវ៉ិចទ័រ DNA ត្រូវបានក្លូននៅក្នុងកោសិការស់នៅដោយប្រើសមត្ថភាពនៃវ៉ិចទ័របែបនេះក្នុងការផលិតឡើងវិញ (ចម្លង) នៅក្នុងក្រឡាមួយក្នុងច្បាប់ចម្លងច្រើន។ អាស្រ័យលើទំហំនៃបំណែកដែលត្រូវក្លូន និងគោលបំណងនៃការសិក្សា វ៉ិចទ័រមួយនៃប្រភេទទាំងបួនត្រូវបានគេប្រើ - plasmids (សូមមើល) phages (សូមមើល។ Bacteriophage) cosmids ឬដេរីវេនៃ phages ដែលមាន DNA តែមួយខ្សែ។
សម្រាប់ការក្លូនបំណែក DNA តូចៗ (រហូតដល់ 10 ពាន់គូមូលដ្ឋាន) វ៉ិចទ័រប្លាស្មា (pBR322, pAT 153, pUR250, pUC19 ។ល។) ត្រូវបានប្រើ។ សមិទ្ធិផលនៃវិស្វកម្មហ្សែនក្នុងប៉ុន្មានឆ្នាំថ្មីៗនេះគឺការផលិតវ៉ិចទ័រដោយផ្អែកលើ phage X (Charon 4A, gtwes-B) ដែលផ្នែកនៃហ្សែនត្រូវបានជំនួសដោយបំណែកនៃ DNA បរទេស។ ហ្សែនកូនកាត់ត្រូវបាន "ខ្ចប់" សិប្បនិម្មិតទៅក្នុងស្រទាប់ប្រូតេអ៊ីន ហើយបាក់តេរីត្រូវបានឆ្លងមេរោគជាមួយ phage ដែលត្រូវបានបង្កើតឡើងវិញនេះ។ បង្កើតបានរាប់ពាន់ច្បាប់ចម្លងក្នុងអំឡុងពេលបន្តពូជនៅក្នុងកោសិកា ផូហ្សិនដែលបានបង្កើតឡើងវិញ lyses វា ហើយត្រូវបានបញ្ចេញទៅក្នុងឧបករណ៍ផ្ទុក។ ដោយមានជំនួយពីវ៉ិចទ័របែបនេះបំណែក DNA នៃ 10-25 ពាន់គូមូលដ្ឋានត្រូវបានក្លូន។
វ៉ិចទ័រ Cosmid (pIB8, MUA-3) គឺជាកូនកាត់នៃ phage X និង plasmid ។ ពួកវាផ្ទុកនូវអ្វីដែលគេហៅថា លំដាប់ COS នៃ phage DNA ដែលត្រូវការសម្រាប់ការវេចខ្ចប់ហ្សែន phage ចូលទៅក្នុងសែលប្រូតេអ៊ីន និងផ្នែកនៃ plasmid DNA ដែលអនុញ្ញាតឱ្យវ៉ិចទ័រ cosmid ចម្លងបាក់តេរីតាមរបៀបដូចគ្នានឹង plasmids ដែរ។ ដូច្នេះ ហ្សែនដែលផ្សំគ្នាជាលទ្ធផលបានឆ្លងបាក់តេរីដោយប្រសិទ្ធភាពខ្ពស់ដូចជា bacteriophage ប៉ុន្តែគុណនឹងពួកវាដូចជាប្លាស្មាដោយមិនបណ្តាលឱ្យកោសិកាបាក់តេរីស្លាប់។ Cosmids ត្រូវបានប្រើសម្រាប់ការក្លូនបំណែក DNA រហូតដល់ 35-45 ពាន់គូមូលដ្ឋាន។
វ៉ិចទ័រដែលជាដេរីវេនៃ phages ជាមួយ DNA ខ្សែតែមួយ (M13 mp8, M13, mp73 ។ សម្រាប់ការបង្កប់ DNA បរទេស ម៉ូលេគុល DNA របស់ phage ពីរជាន់ចម្លងត្រូវបានប្រើប្រាស់។ វ៉ិចទ័រដែលផ្ទុក DIC បរទេសត្រូវបានបញ្ចូលទៅក្នុងកោសិកាបាក់តេរី ដែលម៉ូលេគុលដែលផ្សំឡើងវិញបានគុណដោយមិនមានកោសិកានេះ និង "ពន្លក" ចូលទៅក្នុងឧបករណ៍ផ្ទុកវប្បធម៌ជាភាគល្អិតមេរោគដែលមានម៉ូលេគុល DNA ខ្សែតែមួយ។ វ៉ិចទ័រទាំងនេះត្រូវបានប្រើដើម្បីក្លូនបំណែក DNA (រហូតដល់ 300-400 គូមូលដ្ឋាន)។
ហ្សែនដែលត្រូវការសម្រាប់ការរៀបចំវិស្វកម្មហ្សែនត្រូវបានទទួលដោយការក្លូននូវម៉ូលេគុល DNA ដែលសមស្រប និងជ្រើសរើសក្លូនបែបនេះ។ ក្នុងករណីទាំងនោះនៅពេលដែលហ្សែននៃសារពាង្គកាយខ្ពស់ និងមនុស្សត្រូវបានក្លូន / ការបញ្ចេញមតិទៅជា rykh នៅក្នុង E. coli (ភាគច្រើនត្រូវបានគេប្រើសម្រាប់គោលបំណងបែបនេះ) គឺមិនអាចទៅរួចទេ ដំណើរការក្លូន និងការជ្រើសរើសត្រូវបានអនុវត្តក្នុងដំណាក់កាលជាច្រើន។ នៅដំណាក់កាលដំបូងគេហៅថា បណ្ណាល័យនៃហ្សែនពីបំណែក DNA (ក្លូនដោយផ្ទាល់ពីហ្សែនកោសិកា) ឬពីច្បាប់ចម្លង DNA ដែលបានក្លូន (cDNA) នៃ RNA ដែលទាក់ទងគ្នា។ ការប្រៀបធៀបរចនាសម្ព័ន្ធនៃបំណែកនៃ DNA ហ្សែន និង cDNA ដែលត្រូវគ្នា ពួកគេទទួលបានព័ត៌មានសំខាន់ៗអំពីការរៀបចំនៃសម្ភារៈហ្សែន ហើយក្នុងករណីជំងឺតំណពូជ អំពីលក្ខណៈនៃភាពមិនប្រក្រតីនៅក្នុងសម្ភារៈហ្សែន លទ្ធផលគឺនេះ ជំងឺ។ ពីបណ្ណាល័យហ្សែន ដោយប្រើបច្ចេកទេសទំនើប វាអាចទាញយកហ្សែនដែលត្រូវការជាមួយនឹងតំបន់ហ្សែនជុំវិញ។ នាពេលបច្ចុប្បន្ននេះ បណ្ណាល័យពេញលេញនៃហ្សែននៃអតិសុខុមប្រាណ រុក្ខជាតិ និងសត្វជាច្រើន (រហូតដល់ថនិកសត្វ និងមនុស្ស) ត្រូវបានបង្កើតឡើង។ ហ្សែនរាប់រយ និងលំដាប់នុយក្លេអូទីតផ្សេងទៀតនៅក្នុង DNA របស់មនុស្សត្រូវបានក្លូនរួចហើយ និងក្នុងកម្រិតមួយចំនួនដែលបានសិក្សា។
លទ្ធភាពនៃការស្រាវជ្រាវវិស្វកម្មហ្សែនមិនត្រូវបានកំណត់ចំពោះការក្លូនហ្សែន និងទទួលបានច្បាប់ចម្លងមួយចំនួនធំរបស់វានោះទេ។ ជារឿយៗវាចាំបាច់មិនត្រឹមតែក្លូនហ្សែនមួយប៉ុណ្ណោះទេ ប៉ុន្តែថែមទាំងធានានូវការបញ្ចេញមតិរបស់វានៅក្នុងកោសិកាមួយ ពោលគឺដើម្បីអនុវត្តព័ត៌មានដែលមាននៅក្នុងវាទៅក្នុងលំដាប់អាស៊ីតអាមីណូនៃខ្សែសង្វាក់ polypeptide នៃប្រូតេអ៊ីនដែលបានអ៊ិនកូដដោយហ្សែននេះ។ ប្រសិនបើហ្សែនដែលត្រូវបានបញ្ចូលទៅក្នុងកោសិកាបាក់តេរីត្រូវបានទទួលពីបាក់តេរីនៃប្រភេទដូចគ្នា (ឬជិតស្និទ្ធ) នោះវាអាចគ្រប់គ្រាន់ក្នុងការញែកហ្សែនជាមួយនឹងធាតុនិយតកម្មដែលគ្រប់គ្រងការបញ្ចេញមតិរបស់វា។ ទោះបីជាយ៉ាងណាក៏ដោយ ជាមួយនឹងករណីលើកលែងមួយចំនួន លំដាប់នុយក្លេអូទីតបទប្បញ្ញត្តិនៃសារពាង្គកាយឆ្ងាយៗដែលវិវត្តន៍មិនអាចផ្លាស់ប្តូរបានឡើយ។ ដូច្នេះ ដើម្បីសម្រេចបាន ជាឧទាហរណ៍ ការបញ្ចេញហ្សែន eukaryotic នៅក្នុងកោសិកា E. coli តំបន់និយតកម្មត្រូវបានដកចេញពីវា ហើយផ្នែករចនាសម្ព័ន្ធនៃហ្សែនបែបនេះត្រូវបានភ្ជាប់ (នៅចម្ងាយជាក់លាក់មួយ) ទៅតំបន់បទប្បញ្ញត្តិ។ នៃហ្សែនបាក់តេរី។ វឌ្ឍនភាពគួរឱ្យកត់សម្គាល់ក្នុងការអភិវឌ្ឍន៍បច្ចេកទេសនេះត្រូវបានសម្រេចបន្ទាប់ពីការរកឃើញនៃអង់ស៊ីម Ba131 nuclease ដែលមានលក្ខណៈសម្បត្តិពិសេសនៃការបំប្លែងខ្សែសង្វាក់ទាំងពីរនៃម៉ូលេគុល DNA លីនេអ៊ែរពីរខ្សែដែលចាប់ផ្តើមពីចុងបញ្ចប់នៃម៉ូលេគុល ពោលគឺអង់ស៊ីមនេះដក "បន្ថែម ” លំដាប់នុយក្លេអូទីតនៃប្រវែងណាមួយពីចុងបញ្ចប់នៃបំណែក DNA ។ បច្ចុប្បន្ននេះ តំបន់រចនាសម្ព័ន្ធ និងបទប្បញ្ញត្តិត្រូវបានញែកដាច់ដោយឡែកពីគ្នាដោយប្រើការរឹតបន្តឹងទាំងនោះ កន្លែង "ការទទួលស្គាល់" ដែលមានទីតាំងនៅដោយជោគជ័យបំផុតនៅលើខ្សែសង្វាក់ polynucleotide បន្ទាប់មកលំដាប់នុយក្លេអូទីត "បន្ថែម" ត្រូវបានដកចេញ ហើយតំបន់រចនាសម្ព័ន្ធនៃហ្សែន eukaryotic ត្រូវបានតភ្ជាប់ទៅ តំបន់និយតកម្មនៃហ្សែនបាក់តេរី។ នៅក្នុងវិធីនេះ វាអាចសម្រេចបានមិនត្រឹមតែការបញ្ចេញហ្សែន eukaryotic នៅក្នុងកោសិកាបាក់តេរីប៉ុណ្ណោះទេ ប៉ុន្តែផ្ទុយទៅវិញ ហ្សែនបាក់តេរីនៅក្នុងកោសិកានៃ eukaryotes ខ្ពស់ និងទាប។
ភាពជឿនលឿនក្នុងវិស្វកម្មហ្សែនគឺទាក់ទងយ៉ាងជិតស្និទ្ធទៅនឹងការអភិវឌ្ឍន៍ និងការកែលម្អវិធីសាស្រ្តសម្រាប់កំណត់លំដាប់នុយក្លេអូទីត (លំដាប់លំដោយ) នៅក្នុងម៉ូលេគុល DNA ។ ចំនួននៃការរឹតបន្តឹងយ៉ាងសំខាន់នៅក្នុងការចោលរបស់អ្នកស្រាវជ្រាវធ្វើឱ្យវាអាចញែកបំណែក DNA ជាក់លាក់ដោយភាពជាក់លាក់ជាក់លាក់ ហើយការអភិវឌ្ឍន៍ និងការកែលម្អវិធីសាស្ត្រក្លូនធ្វើឱ្យវាអាចទទួលបានបំណែកនៃហ្សែនសូម្បីតែតែមួយគត់ក្នុងបរិមាណចាំបាច់សម្រាប់ការវិភាគ។ វិធីសាស្រ្តលំដាប់ DNA បានបង្ហាញថាមានប្រសិទ្ធភាពខ្លាំង ដែលជារឿយៗ តាមរយៈការកំណត់ DNA nucleotide sequence ទិន្នន័យត្រូវបានទទួលនៅលើលំដាប់ nucleotide ក្នុងម៉ូលេគុល RNA ដែលត្រូវគ្នា និងនៅលើលំដាប់នៃសំណល់អាស៊ីតអាមីណូនៅក្នុងម៉ូលេគុលប្រូតេអ៊ីនសំយោគ។ នៅពេលដំណើរការលទ្ធផលនៃលំដាប់ DNA កុំព្យូទ័រត្រូវបានប្រើប្រាស់យ៉ាងទូលំទូលាយ។ សម្រាប់ការបកស្រាយពេញលេញ និងលឿនជាងមុននៃទិន្នន័យពិសោធន៍ដែលទទួលបាន កុំព្យូទ័រជាតិ និងអន្តរជាតិ "ធនាគារ" នៃលំដាប់នុយក្លេអូទីតកំពុងត្រូវបានបង្កើតឡើង។ នាពេលបច្ចុប្បន្ននេះ លំដាប់នុយក្លេអូទីតពេញលេញនៃហ្សែននៃប្លាស្មាបាក់តេរី និងមេរោគមួយចំនួនត្រូវបានកំណត់ ហើយបញ្ហានៃការកំណត់លំដាប់នុយក្លេអូទីតពេញលេញនៃក្រូម៉ូសូមបុគ្គលដំបូង ហើយបន្ទាប់មកហ្សែនទាំងមូលនៃសារពាង្គកាយខ្ពស់ជាង រួមទាំងមនុស្សផងដែរគឺរួចហើយ។ កំពុងត្រូវបានដោះស្រាយ។
ដោយមានជំនួយពីវិធីសាស្ត្រវិស្វកម្មហ្សែន គម្លាតនៅក្នុងរចនាសម្ព័ន្ធនៃផ្នែកខ្លះនៃហ្សែនរបស់មនុស្សត្រូវបានរកឃើញ ដែលជាមូលហេតុនៃជំងឺតំណពូជ។ ភាគច្រើនជាញឹកញាប់ វិធីសាស្ត្រនេះត្រូវបានគេហៅថា។ b ការវិភាគច្រើន។ DNA កោសិកាដាច់ស្រយាលត្រូវបានទទួលរងនូវការរឹតបន្តឹងអង់ស៊ីម hydrolysis បំណែកលទ្ធផលត្រូវបានបំបែកដោយទំហំដោយប្រើ agarose ឬ polyacrylamide gel electrophoresis ។ បំណែកដែលបានបំបែកត្រូវបានផ្ទេរ ("បោះពុម្ពឡើងវិញ") ទៅលើក្រដាសក្រូម៉ាតត្រូនិចដែលត្រូវបានព្យាបាលជាពិសេស តម្រង nitrocellulose ឬ nylon ហើយម្តងទៀតត្រូវបានទទួលរងនូវការបំបែកដោយ electrophoretic ។ កាត់ចេញនូវទីកន្លែងនៃ electropherograms ដែលត្រូវគ្នាទៅនឹងប្រភាគនីមួយៗ និងមានប្រភេទដូចគ្នានៃបំណែក DNA ។ ផ្នែកកាត់នៃ electrophoregrams ត្រូវបាន incubated ជាមួយហ្សែនដែលបានក្លូនពីមុន ឬផ្នែករបស់វា ឬជាមួយនឹងធាតុគីមីដែលទទួលបាន។ ការសំយោគដោយលំដាប់នុយក្លេអូទីតដែលមានស្លាកសញ្ញាវិទ្យុសកម្ម។ DNA ដែលត្រូវបានសម្គាល់ទាក់ទងតែបំណែកនៃ DNA កោសិកាដែលបានវិភាគប៉ុណ្ណោះ ដែល to-rye មានលំដាប់នៃ nucleotides បំពេញបន្ថែមវា។ ការផ្លាស់ប្តូរនៃការចែកចាយ និងបរិមាណនៃស្លាកថេរបើប្រៀបធៀបទៅនឹងបទដ្ឋានធ្វើឱ្យវាអាចវិនិច្ឆ័យការរៀបចំឡើងវិញនៅក្នុងលំដាប់ហ្សែនដែលបានវិភាគ ឬនុយក្លេអូទីតដែលនៅជាប់នឹងវា។
ទីតាំងនៃ "ការទទួលស្គាល់" នៃការកំណត់ជាក់លាក់នៅក្នុងម៉ូលេគុល DNA ត្រូវបានចែកចាយមិនស្មើគ្នា ដូច្នេះក្នុងអំឡុងពេល hydrolysis ដោយអង់ស៊ីមទាំងនេះ ម៉ូលេគុល DNA ត្រូវបានបំបែកទៅជាបំណែកជាច្រើននៃប្រវែងផ្សេងៗ។ ការរៀបចំឡើងវិញនៃរចនាសម្ព័ន្ធ DNA ដែលជាលទ្ធផលដែលគេហទំព័រ "ការទទួលស្គាល់" ដែលមានស្រាប់បាត់ ឬលេចឡើង នាំឱ្យមានការផ្លាស់ប្តូរនៅក្នុងសំណុំនៃបំណែកទាំងនេះ (ហៅថាបំណែកដាក់កម្រិត) ពោលគឺចំពោះរូបរាងនៃប្រវែងបំណែកដាក់កម្រិត។ polymorphism (GVDRF) ។ ការរៀបចំឡើងវិញនៅក្នុងម៉ូលេគុល DNA អាចឬមិនបណ្តាលឱ្យមានការផ្លាស់ប្តូរកំឡុងពេលសំយោគ ឬនៅក្នុងរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីនដែលបានអ៊ិនកូដ។ ការរៀបចំឡើងវិញដែលមិនបង្កឱ្យមានការផ្លាស់ប្តូរគឺភាគច្រើន ហើយវាបណ្តាលឱ្យមាន RFLP ធម្មតា។ វាបានប្រែក្លាយថា RFLP គឺជាលក្ខណៈហ្សែនច្បាស់លាស់។ បច្ចុប្បន្ននេះ ការវិភាគ RFLP បានក្លាយជាវិធីសាស្រ្តដ៏ត្រឹមត្រូវបំផុតមួយដែលត្រូវបានប្រើប្រាស់ក្នុងពន្ធុវិទ្យារបស់មនុស្ស និងពន្ធុវិទ្យាវេជ្ជសាស្រ្ត។ សម្រាប់ជំងឺតំណពូជមួយចំនួន ទម្រង់នៃ RFLP ត្រូវបានពិពណ៌នាដែលបង្ហាញដោយផ្ទាល់នូវវត្តមាននៃជំងឺ ឬការដឹកជញ្ជូនហ្សែនដែលផ្លាស់ប្តូររោគសាស្ត្រ។
វិស្វកម្មហ្សែនបានសម្គាល់ការចាប់ផ្តើមនៃទិសដៅថ្មីនៃការស្រាវជ្រាវដែលហៅថា "ហ្សែនបញ្ច្រាស" ។ ការវិភាគហ្សែនតាមបែបប្រពៃណី (សូមមើល) ត្រូវបានអនុវត្តតាមលំដាប់លំដោយ៖ សញ្ញាត្រូវបានជ្រើសរើស តំណភ្ជាប់នៃសញ្ញាដែលមានកត្តាកំណត់ហ្សែន និងការធ្វើមូលដ្ឋានីយកម្មនៃកត្តាកំណត់នេះទាក់ទងនឹងការស្គាល់រួចហើយត្រូវបានបង្កើតឡើង។ នៅក្នុងហ្សែនបញ្ច្រាស អ្វីគ្រប់យ៉ាងកើតឡើងក្នុងលំដាប់បញ្ច្រាស៖ បំណែក DNA ដែលមានមុខងារមិនស្គាល់ត្រូវបានជ្រើសរើស ការភ្ជាប់នៃបំណែក DNA នេះជាមួយតំបន់ផ្សេងទៀតនៃហ្សែន និងការតភ្ជាប់របស់វាជាមួយនឹងលក្ខណៈជាក់លាក់ត្រូវបានបង្កើតឡើង។ វិធីសាស្រ្តនេះបានធ្វើឱ្យវាអាចធ្វើទៅបានដើម្បីបង្កើតវិធីសាស្រ្តសម្រាប់ការធ្វើរោគវិនិច្ឆ័យដំបូងនិងការរកឃើញនៃអ្នកដឹកជញ្ជូននៃជំងឺដូចជា Huntington's chorea, ជំងឺ Duchenne, cystic fibrosis, លក្ខណៈជីវគីមីនៃពិការភាពតំណពូជដែលមិនទាន់ត្រូវបានគេដឹង។ ដោយប្រើវិធីសាស្ត្រពង្សាវតារសម្រាប់បង្កើតគំរូនៃការបញ្ជូនតំណពូជនៃ chorea របស់ Huntington វាត្រូវបានបង្ហាញថាបំណែក G8 DNA ដែលដាច់ចេញពីហ្សែនរបស់មនុស្សត្រូវបានភ្ជាប់យ៉ាងជិតស្និទ្ធទៅនឹងហ្សែនដែលកំណត់ជំងឺ និងរូបរាងនៃបំណែក RFLP G8 នៅក្នុងប្រជាជននេះ អាចធ្វើរោគវិនិច្ឆ័យជំងឺនេះ និងកំណត់អត្តសញ្ញាណអ្នកផ្ទុកហ្សែនដែលមានបញ្ហា។
វានៅតែមានការលំបាកផ្នែកបច្ចេកទេសជាច្រើននៅលើវិធីនៃការណែនាំវិធីសាស្រ្តដែលប្រើក្នុងវិស្វកម្មហ្សែនទៅក្នុងការអនុវត្តផ្នែកវេជ្ជសាស្រ្ត។ មន្ទីរពិសោធន៍ជាច្រើននៅជុំវិញពិភពលោកកំពុងអភិវឌ្ឍយ៉ាងសកម្មនូវវិធីសាស្ត្រវិនិច្ឆ័យវិស្វកម្មហ្សែនដែលសមស្រប ហើយគេសង្ឃឹមថាវិធីសាស្ត្របែបនេះនឹងអាចរកឃើញបាននៅពេលអនាគតដ៏ខ្លីខាងមុខនេះ ប្រសិនបើមិនមែនសម្រាប់ការពិនិត្យហ្សែន (ការពិនិត្យ) អំឡុងពេលពិនិត្យសុខភាពប្រជាជនទេនោះ នៅ យ៉ាងហោចណាស់ សម្រាប់ការស្ទង់មតិគំរូនៃក្រុមដែលមានហានិភ័យខ្ពស់ចំពោះជំងឺតំណពូជ។
វិស្វកម្មហ្សែនធ្វើឱ្យវាមិនត្រឹមតែអាចចម្លងសមាសធាតុធម្មជាតិ និងដំណើរការប៉ុណ្ណោះទេ ប៉ុន្តែថែមទាំងអាចកែប្រែ និងធ្វើឱ្យពួកវាមានប្រសិទ្ធភាពថែមទៀត។ ឧទាហរណ៍នៃការសិក្សានេះគឺជាខ្សែស្រាវជ្រាវថ្មីមួយដែលហៅថាវិស្វកម្មប្រូតេអ៊ីន។ ការគណនាដែលបានធ្វើឡើងដោយផ្អែកលើទិន្នន័យនៃលំដាប់អាស៊ីតអាមីណូ និងការរៀបចំលំហនៃម៉ូលេគុលប្រូតេអ៊ីនបង្ហាញថា ជាមួយនឹងការជំនួសសំណល់អាស៊ីតអាមីណូមួយចំនួននៅក្នុងម៉ូលេគុលនៃអង់ស៊ីមមួយចំនួន ការកើនឡើងយ៉ាងខ្លាំងនៃសកម្មភាពអង់ស៊ីមរបស់ពួកគេគឺអាចធ្វើទៅបាន។ នៅក្នុងហ្សែនដាច់ស្រយាលដែលបំប្លែងការសំយោគអង់ស៊ីមជាក់លាក់មួយ វិធីសាស្ត្រវិស្វកម្មហ្សែនត្រូវបានប្រើដើម្បីអនុវត្តការជំនួសនុយក្លេអូទីតមួយចំនួនដែលគ្រប់គ្រងយ៉ាងតឹងរ៉ឹង។ ក្នុងអំឡុងពេលនៃការសំយោគប្រូតេអ៊ីនអង់ស៊ីមក្រោមការគ្រប់គ្រងនៃហ្សែនដែលបានកែប្រែបែបនេះ ការជំនួសដែលបានគ្រោងទុកជាមុននៃសំណល់អាស៊ីតអាមីណូដែលបានកំណត់យ៉ាងតឹងរ៉ឹងនៅក្នុងខ្សែសង្វាក់ polypeptide កើតឡើង ដែលបណ្តាលឱ្យមានការកើនឡើងនៃសកម្មភាពអង់ស៊ីមច្រើនដងធៀបនឹងសកម្មភាពរបស់ធម្មជាតិ។ គំរូ។
នៅក្នុងវិស័យកសិកម្ម វិស្វកម្មហ្សែនត្រូវបានគេរំពឹងថានឹងរួមចំណែកយ៉ាងសំខាន់ក្នុងការជ្រើសរើសពូជរុក្ខជាតិថ្មីដែលផ្តល់ទិន្នផលខ្ពស់ដែលធន់នឹងគ្រោះរាំងស្ងួត ជំងឺ និងសត្វល្អិត ព្រមទាំងការអភិវឌ្ឍន៍ពូជដំណាំដែលមានផលិតភាពខ្ពស់ផងដែរ។ សត្វ។
ដូចជាសមិទ្ធិផលនៃវិទ្យាសាស្រ្តណាមួយ ភាពជោគជ័យនៃវិស្វកម្មហ្សែនអាចត្រូវបានប្រើមិនត្រឹមតែសម្រាប់ផលប្រយោជន៍ប៉ុណ្ណោះទេ ប៉ុន្តែថែមទាំងប៉ះពាល់ដល់មនុស្សជាតិទៀតផង។ ការសិក្សាដែលបានធ្វើឡើងជាពិសេសបានបង្ហាញថាគ្រោះថ្នាក់នៃការរីករាលដាលដែលមិនអាចគ្រប់គ្រងបាននៃ DNA ផ្សំឡើងវិញគឺមិនអស្ចារ្យដូចការគិតពីមុននោះទេ។ DNA និងបាក់តេរីដែលផ្សំគ្នាដែលផ្ទុកពួកវាបានប្រែទៅជាមិនស្ថិតស្ថេរខ្លាំងចំពោះឥទ្ធិពលបរិស្ថាន មិនអាចប្រើបានចំពោះមនុស្ស និងសត្វ។ វាត្រូវបានគេដឹងថានៅក្នុងធម្មជាតិនិងដោយគ្មានអន្តរាគមន៍របស់មនុស្សមានលក្ខខណ្ឌដែលផ្តល់នូវការផ្លាស់ប្តូរសកម្មនៃព័ត៌មានហ្សែននេះគឺជាអ្វីដែលគេហៅថា។ លំហូរហ្សែន។ ទោះជាយ៉ាងណាក៏ដោយ ធម្មជាតិបានបង្កើតរបាំងដ៏មានប្រសិទ្ធភាពជាច្រើនចំពោះការជ្រៀតចូលនៃព័ត៌មានហ្សែនរបស់ជនបរទេសចូលទៅក្នុងខ្លួន។ នាពេលបច្ចុប្បន្ននេះ វាច្បាស់ណាស់ថា នៅពេលធ្វើការជាមួយម៉ូលេគុល DNA ដែលផ្សំឡើងវិញភាគច្រើន ការប្រុងប្រយ័ត្នធម្មតាគឺគ្រប់គ្រាន់ណាស់ ការប្រើប្រាស់ to-rye ជាឧទាហរណ៍ ដោយមីក្រូជីវវិទូ នៅពេលធ្វើការជាមួយសម្ភារៈឆ្លង។ សម្រាប់ករណីពិសេស វិធីសាស្រ្តដ៏មានប្រសិទ្ធភាពត្រូវបានបង្កើតឡើងសម្រាប់ទាំងការការពារជីវសាស្ត្រ និងការញែករូបរាងកាយនៃវត្ថុពិសោធន៍ពីមនុស្ស និងបរិស្ថាន។ ដូច្នេះ កំណែដំបូងដ៏តឹងរឹងបំផុតនៃច្បាប់សម្រាប់ធ្វើការជាមួយ DNA ដែលផ្សំឡើងវិញត្រូវបានកែសម្រួល និងបន្ទន់យ៉ាងខ្លាំង។ ចំពោះការប្រើប្រាស់ដោយចេតនានូវសមិទ្ធិផលនៃវិស្វកម្មហ្សែនក្នុងការបំផ្លាញមនុស្ស ទាំងអ្នកវិទ្យាសាស្ត្រ និងសាធារណជនត្រូវតែប្រយុទ្ធយ៉ាងសកម្ម ដើម្បីធានាថាគ្រោះថ្នាក់នេះនៅតែអាចកើតមានតាមទ្រឹស្តីប៉ុណ្ណោះ។
សូមមើលជីវបច្ចេកវិទ្យាផងដែរ។
គន្ថនិទ្ទេស៖ Alikhanyan S. I. ជោគជ័យ និងការរំពឹងទុកនៃវិស្វកម្មហ្សែន, ហ្សែន, លេខ 12, Jvft 7, ទំ។ 150, 1976, គន្ថនិទ្ទេស; អាលីខាន់យ៉ានអេស។ I. et al. ការទទួលបានម៉ូលេគុល DNA recombinants (កូនកាត់) ដែលមានមុខងារ, in vitro, ibid., vol. I, no. 11, p. ៣៤, ១៩៧៥, គន្ថនិទ្ទេស; Baev A.A. វិស្វកម្មហ្សែន, Priroda, M1, ទំ។ 8, 1976; Tikhomirova L.P. និងអ្នកដទៃ។ ម៉ូលេគុល DNA កូនកាត់នៃ phage X និង plasmids ColEl, Dokl ។ បណ្ឌិត្យសភាវិទ្យាសាស្ត្រសហភាពសូវៀត, លេខ ២២៣, លេខ ៤, ទំ។ ៩៩៥, ១៩៧៥, គន្ថនិទ្ទេស; ប្រោន D.D.a. S t e r n R. វិធីសាស្រ្តនៃការបែងចែកហ្សែន, Ann ។ Rev. ជីវគីមី។, v ។ 43, ទំ។ ៦៦៧, ១៩៧៤, គន្ថនិទ្ទេស; C h a n g A. C. Y. ក. o ការសិក្សាអំពី DNA mitochondrial របស់កណ្តុរនៅក្នុង Escherichia coli, Cell, v. 6, ទំ។ 231.1975, គន្ថនិទ្ទេស; Hedgpeth J., Goodman H.M. a. B o y e r H. W. DNA nucleotide sequence ដាក់កម្រិតដោយ R1 endonuclease, Proc ។ ណាត អាកាដ។ វិទ្យាសាស្ត្រ ( វ. ) វ. 69, ទំ។ ៣៤៤៨, ១៩៧២, គន្ថនិទ្ទេស; Hershfield V. a. o Plasmid ColEl ជាយានម៉ូលេគុលសម្រាប់ការក្លូន និងការពង្រីក DNA, ibid., v. 71, ទំ។ ៣៤៥៥, ១៩៧៤; ថ្ងៃស្អែក J.F. a. o ការចម្លង និងការចម្លងនៃ DNA eukaryotic នៅក្នុង Escherichia coli, ibid., p. ១៧៤៣; T e m i n H. M. a. Mizu-tani S. RNA-dependent DNA polymerase in virions of Rous sarcoma virus, Nature (Lond.), v. ២២៦, ទំ. ១២១១, ១៩៧០។
ជីវបច្ចេកវិទ្យា, ed ។ A. A. Baeva, Moscow, 1984; B អំពី h ដល់អំពីនៅក្នុង N. P., Zakharov A. F. និង Ivanov V. I. Medical ពន្ធុវិទ្យា, M., 1984; M a n i a-tis G., FrichE ។ និង Sambrook J. វិធីសាស្រ្តនៃវិស្វកម្មហ្សែន។ ការក្លូនម៉ូលេគុល, trans ។ ពីភាសាអង់គ្លេស M. , 1984; A n t o n a r a k i s S. E. a. o DNA polymorphism និងរោគវិទ្យាម៉ូលេគុលនៃចង្កោមហ្សែន globin របស់មនុស្ស, Hum ។ ហ្សែន។, v ។ 69, ទំ។ 1, 1985; Beaudet A.L. គន្ថនិទ្ទេសនៃមនុស្សដែលបានក្លូន និង DNA ដែលបានជ្រើសរើសផ្សេងទៀត Amer ។ J. ហ៊ឹម។ ហ្សែន។, v ។ ៣៧, ទំ។ ៣៨៦, ១៩៨៥; នៅក្នុង o t s t e i n D. ក។ o ការសាងសង់ផែនទីតំណហ្សែនចំពោះបុរសដោយប្រើការរឹតត្បិតប្រវែងបំណែក polymorphisms, ibid., v. 32, ទំ។ ៣១៤, ១៩៨០; G u s e 1 1 a J. E. ក. o សញ្ញាសម្គាល់ DNA សម្រាប់ជំងឺប្រព័ន្ធប្រសាទ, វិទ្យាសាស្រ្ត, v. ២២៥, ទំ. ១៣២០, ១៩៨៤; Motulsky A.G. ផលប៉ះពាល់នៃឧបាយកលហ្សែនលើសង្គម និងឱសថ, ibid., v. ២១៩, ទំ. ១៣៥, ១៩៨៣; ស R. a. o សញ្ញាសម្គាល់ហ្សែនដែលទាក់ទងយ៉ាងជិតស្និទ្ធសម្រាប់ជំងឺ cystic fibrosis, ធម្មជាតិ (ទីក្រុងឡុងដ៍), v. 318, ទំ។ ៣៨២, ១៩៨៥; Wo o S. L. C., L i d s ទៅ y A. S. a. Guttler F. ការធ្វើរោគវិនិច្ឆ័យមុនពេលសម្រាលនៃ phenylketonuria បុរាណដោយការគូសផែនទីហ្សែន J. Amer ។ ពេទ្យ Ass., v ។ 251, ទំ។ ឆ្នាំ 1998, 1984 ។
L. S. Chernin, V. H. Kalinin ។
វិស្វកម្មហ្សែន
ជីវវិទ្យាទំនើបមានមូលដ្ឋានខុសគ្នាពីជីវវិទ្យាប្រពៃណី មិនត្រឹមតែនៅក្នុងជម្រៅកាន់តែច្រើននៃការអភិវឌ្ឍន៍នៃគំនិតយល់ដឹងប៉ុណ្ណោះទេ ប៉ុន្តែថែមទាំងមានទំនាក់ទំនងជិតស្និទ្ធជាមួយនឹងជីវិតនៃសង្គមជាមួយនឹងការអនុវត្តផងដែរ។ យើងអាចនិយាយបានថា ក្នុងសម័យកាលរបស់យើង ជីវវិទ្យាបានក្លាយទៅជាមធ្យោបាយមួយក្នុងការផ្លាស់ប្តូរពិភពលោករស់នៅ ដើម្បីបំពេញតម្រូវការសម្ភារៈរបស់សង្គម។ ការសន្និដ្ឋាននេះត្រូវបានបង្ហាញជាដំបូងដោយទំនាក់ទំនងជិតស្និទ្ធរវាងជីវវិទ្យា និងបច្ចេកវិទ្យាជីវសាស្រ្ត ដែលបានក្លាយជាតំបន់ដ៏សំខាន់បំផុតនៃការផលិតសម្ភារៈ ដែលជាដៃគូស្មើគ្នានៃបច្ចេកវិទ្យាមេកានិច និងគីមីដែលផលិតដោយមនុស្ស ក៏ដូចជាឱសថផងដែរ។
តាំងពីចាប់ផ្តើមដំបូងមក ជីវវិទ្យា និងជីវបច្ចេកវិទ្យាតែងតែមានការអភិវឌ្ឍន៍រួមគ្នា ហើយតាំងពីដើមដំបូងមក ជីវវិទ្យាគឺជាមូលដ្ឋានវិទ្យាសាស្ត្រនៃជីវបច្ចេកវិទ្យា។ ទោះជាយ៉ាងណាក៏ដោយ អស់រយៈពេលជាយូរមក ការខ្វះខាតទិន្នន័យផ្ទាល់ខ្លួនមិនបានអនុញ្ញាតឱ្យជីវវិទ្យាមានផលប៉ះពាល់យ៉ាងខ្លាំងដល់បច្ចេកវិទ្យាជីវសាស្ត្រនោះទេ។ ស្ថានភាពបានផ្លាស់ប្តូរយ៉ាងខ្លាំងជាមួយនឹងការបង្កើតនៅពាក់កណ្តាលទីពីរនៃសតវត្សទី 20 ។ វិធីសាស្រ្តវិស្វកម្មហ្សែន,ដែលត្រូវបានយល់ថាជាការរៀបចំហ្សែនក្នុងគោលបំណងបង្កើតថ្មី និងបង្កើតឡើងវិញនូវប្រភេទហ្សែនដែលមានស្រាប់។ ក្នុងនាមជាសមិទ្ធិផលវិធីសាស្រ្តដោយធម្មជាតិរបស់វា វិស្វកម្មហ្សែនមិនបាននាំទៅរកការបំបែកនៃគំនិតដែលមានស្រាប់អំពីបាតុភូតជីវសាស្រ្ត មិនប៉ះពាល់ដល់បទប្បញ្ញត្តិជាមូលដ្ឋាននៃជីវវិទ្យា ដូចតារាវិទ្យាវិទ្យុមិនបានធ្វើឱ្យញ័របទប្បញ្ញត្តិជាមូលដ្ឋាននៃរូបវិទ្យាតារាសាស្ត្រ ការបង្កើតនៃ "សមមូលមេកានិកនៃកំដៅ" មិនបាននាំឱ្យមានការផ្លាស់ប្តូរច្បាប់នៃចរន្តកំដៅទេហើយភស្តុតាងទ្រឹស្តីអាតូមិចនៃរូបធាតុមិនបានផ្លាស់ប្តូរទំនាក់ទំនងនៃទែរម៉ូឌីណាមិកធារាសាស្ត្រនិងទ្រឹស្តីនៃការបត់បែន (A.A. Baev) ទេ។
ទោះជាយ៉ាងណាក៏ដោយ វិស្វកម្មហ្សែនបានបើកយុគសម័យថ្មីនៃជីវវិទ្យាសម្រាប់ហេតុផលដែលឱកាសថ្មីបានលេចឡើងសម្រាប់ការជ្រៀតចូលទៅក្នុងជម្រៅនៃបាតុភូតជីវសាស្រ្ត ដើម្បីកំណត់លក្ខណៈបន្ថែមទៀតនៃទម្រង់នៃអត្ថិភាពនៃសារធាតុរស់នៅ សិក្សារចនាសម្ព័ន្ធ និងមុខងាររបស់ហ្សែនឱ្យកាន់តែមានប្រសិទ្ធភាព។ កម្រិតម៉ូលេគុល និងស្វែងយល់ពីយន្តការដ៏កម្រនៃការងារ។ ឧបករណ៍ហ្សែន។ ភាពជឿនលឿននៃវិស្វកម្មហ្សែនមានន័យថាជាបដិវត្តន៍ក្នុងសម័យទំនើប
វិទ្យាសាស្រ្តធម្មជាតិ។ ពួកគេកំណត់លក្ខណៈវិនិច្ឆ័យសម្រាប់តម្លៃនៃគំនិតទំនើបអំពីលក្ខណៈរចនាសម្ព័ន្ធ និងមុខងារនៃកម្រិតម៉ូលេគុល និងកោសិកានៃសារធាតុរស់នៅ។ ទិន្នន័យទំនើបអំពីភាវៈមានជីវិតមានសារៈសំខាន់ក្នុងការយល់ដឹងដ៏មហិមា ព្រោះវាផ្តល់នូវការយល់ដឹងអំពីទិដ្ឋភាពដ៏សំខាន់បំផុតមួយនៃពិភពសរីរាង្គ ហើយដូច្នេះបានរួមចំណែកដែលមិនអាចកាត់ថ្លៃបានដល់ការបង្កើតរូបភាពវិទ្យាសាស្ត្រនៃពិភពលោក។ ដូច្នេះ ដោយបានពង្រីកមូលដ្ឋានការយល់ដឹងរបស់ខ្លួនយ៉ាងខ្លាំង ជីវវិទ្យាតាមរយៈវិស្វកម្មហ្សែនក៏មានឥទ្ធិពលនាំមុខគេលើការកើនឡើងនៃបច្ចេកវិទ្យាជីវសាស្ត្រផងដែរ។
វិស្វកម្មហ្សែនបង្កើតមូលដ្ឋានគ្រឹះនៃការយល់ដឹងអំពីវិធីសាស្រ្ត និងវិធីនៃ "ការរចនា" ថ្មី ឬកែលម្អសារពាង្គកាយដែលមានស្រាប់ ដោយផ្តល់ឱ្យពួកគេនូវតម្លៃសេដ្ឋកិច្ចដ៏អស្ចារ្យ និងសមត្ថភាពក្នុងការបង្កើនផលិតភាពនៃដំណើរការជីវបច្ចេកវិទ្យា។ ទោះជាយ៉ាងណាក៏ដោយ វិស្វកម្មហ្សែនបានបង្កើតការយល់ដឹងថ្មីសម្រាប់ឱសថក្នុងវិស័យធ្វើរោគវិនិច្ឆ័យ និងព្យាបាលជំងឺជាច្រើន ទាំងមិនមែនតំណពូជ និងតំណពូជ។ នាងបានបើកផ្លូវថ្មីក្នុងការស្វែងរកថ្នាំថ្មី និងសម្ភារៈប្រើប្រាស់ក្នុងថ្នាំ។ វិស្វកម្មហ្សែន និងបច្ចេកវិជ្ជាជីវសាស្រ្តបានជំរុញការអភិវឌ្ឍវិធីសាស្រ្ត bionanotechnology ។
នៅក្នុងក្របខ័ណ្ឌនៃវិស្វកម្មហ្សែនមាន ហ្សែននិង កោសិកាវិស្វកម្ម។ វិស្វកម្មហ្សែនគឺជាឧបាយកលដើម្បីបង្កើតម៉ូលេគុល DNA បញ្ចូលគ្នា។ វិធីសាស្រ្តនេះត្រូវបានគេសំដៅជាញឹកញាប់ថាជាការក្លូនម៉ូលេគុល ការក្លូនហ្សែន បច្ចេកវិទ្យា DNA ដែលផ្សំឡើងវិញ ឬគ្រាន់តែជាការកែច្នៃហ្សែន។ វាមានសារៈសំខាន់ណាស់ក្នុងការបញ្ជាក់ថាវត្ថុនៃវិស្វកម្មហ្សែនគឺម៉ូលេគុល DNA ដែលជាហ្សែនបុគ្គល។ ផ្ទុយទៅវិញ វិស្វកម្មកោសិកាត្រូវបានគេយល់ថាជាការរៀបចំហ្សែនជាមួយកោសិកាបុគ្គលដាច់ដោយឡែក ឬក្រុមនៃកោសិការុក្ខជាតិ និងសត្វ។
វិស្វកម្មហ្សែន និងឧបករណ៍របស់វា។
វិស្វកម្មហ្សែនគឺជាសំណុំនៃវិធីសាស្រ្តពិសោធន៍ផ្សេងៗ (បច្ចេកទេស) ដែលផ្តល់នូវការសាងសង់ (ការកសាងឡើងវិញ) ការក្លូនម៉ូលេគុល DNA និងហ្សែនជាមួយនឹងគោលដៅជាក់លាក់។
វិធីសាស្រ្តវិស្វកម្មហ្សែនត្រូវបានប្រើក្នុងលំដាប់ជាក់លាក់មួយ (រូបភាព 127) ហើយដំណាក់កាលជាច្រើនត្រូវបានសម្គាល់នៅក្នុងការប្រតិបត្តិ
ការពិសោធន៍វិស្វកម្មហ្សែនធម្មតាដែលមានបំណងក្លូនហ្សែនមួយគឺ៖
1. ភាពឯកោនៃ plasmid DNA ពីកោសិកានៃសារពាង្គកាយដែលមានចំណាប់អារម្មណ៍ (ដំបូង) និងឯកោនៃវ៉ិចទ័រ DNA ។
2. ការកាត់ (ការកម្រិត) នៃ DNA នៃសារពាង្គកាយដើមទៅជាបំណែកដែលមានហ្សែនចាប់អារម្មណ៍ ដោយប្រើអង់ស៊ីមកម្រិតមួយ និងការញែកហ្សែនទាំងនេះចេញពីល្បាយរឹតបន្តឹង។ ក្នុងពេលជាមួយគ្នានេះ DNA វ៉ិចទ័រត្រូវបានកាត់ (ដាក់កម្រិត) ដោយបង្វែរវាពីរចនាសម្ព័ន្ធរាងជារង្វង់ទៅជាលីនេអ៊ែរ។
3. ការភ្ជាប់ផ្នែក DNA (ហ្សែន) ចំណាប់អារម្មណ៍ទៅនឹងវ៉ិចទ័រ DNA ដើម្បីទទួលបានម៉ូលេគុល DNA កូនកាត់។
4. ការណែនាំអំពីម៉ូលេគុល DNA ដែលផ្សំឡើងវិញដោយការបំប្លែងទៅជាសារពាង្គកាយមួយចំនួនផ្សេងទៀត ឧទាហរណ៍ ទៅជា E. coliឬកោសិកា somatic ។
5. ការបញ្ចូលបាក់តេរី ដែលនៅក្នុងនោះម៉ូលេគុល DNA កូនកាត់ត្រូវបានណែនាំនៅលើប្រព័ន្ធផ្សព្វផ្សាយសារធាតុចិញ្ចឹមដែលអនុញ្ញាតឱ្យមានការលូតលាស់នៃកោសិកាដែលមានម៉ូលេគុល DNA កូនកាត់ប៉ុណ្ណោះ។
6. ការកំណត់អត្តសញ្ញាណអាណានិគមដែលមានបាក់តេរីដែលមានម៉ូលេគុល DNA កូនកាត់។
7. ភាពឯកោនៃ DNA ក្លូន (ហ្សែនក្លូន) និងលក្ខណៈរបស់វា រួមទាំងការចាត់ថ្នាក់នៃមូលដ្ឋានអាសូតនៅក្នុងបំណែក DNA ដែលក្លូន។
អង្ករ។ ១២៧.ដំណាក់កាលបន្តបន្ទាប់នៃការពិសោធន៍វិស្វកម្មហ្សែន
ក្នុងដំណើរវិវត្តន៍ បាក់តេរីបានបង្កើតសមត្ថភាពក្នុងការសំយោគអង់ស៊ីមដែលហៅថាការរឹតបន្តឹង (endonucleases) ដែលបានក្លាយជាផ្នែកនៃប្រព័ន្ធរឹតបន្តឹងកោសិកា (បាក់តេរី) ។ នៅក្នុងបាក់តេរី ប្រព័ន្ធកំហិត-កែប្រែ គឺជាប្រព័ន្ធការពារភាពស៊ាំខាងក្នុងកោសិកាប្រឆាំងនឹង DNA បរទេស។ មិនដូចសារពាង្គកាយខ្ពស់ទេ ដែលការទទួលស្គាល់ និងការបំផ្លិចបំផ្លាញនៃមេរោគ បាក់តេរី និងភ្នាក់ងារបង្កជំងឺផ្សេងៗកើតឡើងក្រៅកោសិកា នៅក្នុងបាក់តេរី ការការពារពី DNA បរទេស (DNA នៃរុក្ខជាតិ និងសត្វដែលពួកគេរស់នៅ) កើតឡើងក្នុងកោសិកា ពោលគឺឧ។ នៅពេលដែល DNA បរទេសចូលទៅក្នុង cytoplasm នៃបាក់តេរី។ ដើម្បីការពារខ្លួន បាក់តេរីក៏បានវិវឌ្ឍន៍សមត្ថភាពក្នុងការ "ដាក់ស្លាក" DNA របស់ពួកគេជាមួយនឹងមូលដ្ឋានមេទីលឡាងតាមលំដាប់ជាក់លាក់។ សម្រាប់ហេតុផលដូចគ្នា DNA បរទេសដោយសារតែអវត្តមាននៃក្រុមមេទីលនៅក្នុងវានៅលើលំដាប់ដូចគ្នាត្រូវបានរលាយ (កាត់) ទៅជាបំណែកដោយអង់ស៊ីមកម្រិតបាក់តេរីផ្សេងៗ ហើយបន្ទាប់មកត្រូវបានបំផ្លាញដោយ exonucleases បាក់តេរីទៅជា nuleotides ។ យើងអាចនិយាយបានថាតាមរបៀបនេះ បាក់តេរីការពារខ្លួនពី DNA របស់រុក្ខជាតិ និងសត្វ ដែលសារពាង្គកាយរបស់ពួកគេរស់នៅជាបណ្ដោះអាសន្ន (ជាភ្នាក់ងារបង្កជំងឺ) ឬជាអចិន្ត្រៃយ៍ (ជា saprophytes)។
អង់ស៊ីមកំហិតត្រូវបានញែកចេញជាដំបូងពី E. coliនៅឆ្នាំ 1968 វាបានប្រែក្លាយថាពួកគេអាចកាត់ (រលាយ) ម៉ូលេគុល DNA នៅកន្លែងផ្សេងគ្នា (កន្លែង) នៃការរឹតបន្តឹង។ អង់ស៊ីមទាំងនេះត្រូវបានគេហៅថា endonucleases ថ្នាក់ I។ បន្ទាប់មក អង់ដូនុយក្លេសថ្នាក់ទី 2 ត្រូវបានរកឃើញនៅក្នុងបាក់តេរី ដែលទទួលស្គាល់យ៉ាងជាក់លាក់នូវកន្លែងដាក់កម្រិតនៅក្នុង DNA បរទេស ហើយក៏អនុវត្តការរឹតបន្តឹងនៅកន្លែងទាំងនេះផងដែរ។ វាគឺជាអង់ស៊ីមនៃថ្នាក់នេះ ដែលបានចាប់ផ្តើមប្រើក្នុងវិស្វកម្មហ្សែន។ ទន្ទឹមនឹងនេះ អង់ស៊ីមថ្នាក់ទី III ត្រូវបានរកឃើញដែលរលាយ DNA នៅជិតកន្លែងទទួលស្គាល់ ប៉ុន្តែអង់ស៊ីមទាំងនេះមិនមានសារៈសំខាន់ក្នុងវិស្វកម្មហ្សែនទេ។
សកម្មភាពនៃប្រព័ន្ធរឹតបន្តឹង-កែប្រែគឺ "សមហេតុផល" ដោយអ្វីដែលគេហៅថា palindromic (ការទទួលស្គាល់) លំដាប់នៃមូលដ្ឋានអាសូត ដែលជាកន្លែងដាក់កម្រិត DNA ។ លំដាប់ Palindromic គឺជាលំដាប់នៃមូលដ្ឋានដែលអានដូចគ្នាទៅមុខ និងថយក្រោយ ដូចជាលំដាប់អក្សរ រ៉ាដា។ដោយសារខ្សែ DNA មានទិសដៅប្រឆាំងនឹងប៉ារ៉ាឡែល លំដាប់មួយត្រូវបានចាត់ទុកថាជា palindromic ប្រសិនបើវាដូចគ្នាបេះបិទនៅពេលអានក្នុងទិសដៅពី 5" ទៅ 3" នៅផ្នែកខាងលើ និងនៅលើខ្សែខាងក្រោមពី 3" ទៅ 5" ចុងបញ្ចប់គឺ៖

Palindromes អាចមានទំហំប៉ុនណាក៏ដោយ ប៉ុន្តែភាគច្រើននៃ palindromes ដែលត្រូវបានប្រើជាកន្លែងកំណត់ការទទួលស្គាល់អង់ស៊ីមគឺ 4, 5, 6 និងកម្រមាន 8 មូលដ្ឋាន។
Restriction enzymes គឺជាឧបករណ៍ដ៏សំខាន់មួយនៅក្នុងវិស្វកម្មហ្សែនសម្រាប់កាត់បំណែក (ហ្សែន) ចំណាប់អារម្មណ៍ចេញពីម៉ូលេគុល DNA ដ៏ធំ។ ដោយសារអង់ស៊ីមដាក់កម្រិតច្រើនជាង 100 ត្រូវបានគេស្គាល់ នេះអនុញ្ញាតឱ្យជ្រើសរើសអង់ស៊ីមកម្រិត និងការជ្រើសរើសបំណែកចេញពី DNA ដើម។
លក្ខណៈពិសេសគួរឱ្យកត់សម្គាល់នៃការរឹតបន្តឹងគឺថាពួកវាបង្កើតការកាត់នៃម៉ូលេគុលទៅជាបំណែកជាច្រើន (ការរឹតបន្តឹង) នៃ DNA នៅក្នុង ledges ជាលទ្ធផលដែលខ្សែមួយវែងជាងមួយទៀតនៅចុងលទ្ធផលបង្កើតជាកន្ទុយមួយ។ ការបញ្ចប់បែបនេះ (កន្ទុយ) ត្រូវបានគេហៅថា "ស្អិត" ចុងបញ្ចប់ព្រោះវាមានសមត្ថភាពបំពេញបន្ថែមដោយខ្លួនឯង។
ពិចារណាលទ្ធផលនៃការរឹតបន្តឹងលើឧទាហរណ៍នៃការរឹតបន្តឹងដ៏ល្បីល្បាញបំផុតមួយ។ អេកូរីពីប្រព័ន្ធរឹតបន្តឹង-កែប្រែ អ៊ី ខូយ។ជំនួសឱ្យការរលាយ DNA នៅចំកណ្តាលនៃលំដាប់នៃការទទួលស្គាល់ palindromic អង់ស៊ីមនេះរលាយ DNA នៅខាងក្រៅមជ្ឈមណ្ឌល ហើយបង្កើតការបំពេញបន្ថែមដោយខ្លួនឯងចំនួន 4 ("ស្អិត") ដែលមានចំនួននុយក្លេអូទីតខុសៗគ្នាដូចជា៖

ចុង "ស្អិត" ទាំងនេះមានប្រយោជន៍ក្នុងវិស្វកម្មហ្សែន ព្រោះវាអាចត្រូវបានភ្ជាប់ឡើងវិញដោយបន្ថែមនៅសីតុណ្ហភាពទាប ដែលអនុញ្ញាតឱ្យបិទបំណែក DNA ប្រកបដោយប្រសិទ្ធភាព។
កន្លែងទទួលស្គាល់ និងកន្លែងរលាយនៅក្នុងករណីនៃការរឹតបន្តឹងផ្សេងទៀតមានខ្លឹមសារផ្សេងគ្នាដូចជា៖

បន្ទាប់ពីការរឹតបន្តឹង DNA ការរឹតបន្តឹងបំណែក DNA (DNA-restrictions) ត្រូវបានញែកដាច់ពីល្បាយការរឹតបន្តឹង ដែលបន្ទាប់មកត្រូវបានទាមទារសម្រាប់ការភ្ជាប់ជាមួយវ៉ិចទ័រ។ DNA កំហិតត្រូវបានញែកដាច់ពីគេដោយប្រើ electrophoresis ព្រោះវាងាយស្រួលណាស់ក្នុងការបំបែក DNA កំហិតដោយប្រើវិធីនេះ ដោយសារទំហំនៃបំណែកដែលបានដាក់កម្រិត និងសមាមាត្របន្ទុកអគ្គិសនីថេរ។ បំណែកនៅក្នុងវាលអគ្គិសនីធ្វើចំណាកស្រុកកំឡុងពេល electrophoresis នៅប្រេកង់អាស្រ័យលើទំហំ (ម៉ាស) របស់វា។ បំណែកធំជាង (យូរជាង) វាធ្វើចំណាកស្រុកយឺតក្នុងវាលអគ្គីសនី។ សម្ភារៈដែល electrophoresis ត្រូវបានអនុវត្តគឺ agarose ឬ polyacrylamide ដែលមិនអាចសាកបាន។ Ethidium bromide ត្រូវបានប្រើដើម្បីកំណត់អត្តសញ្ញាណបំណែកដែលប្រឡាក់បំណែកដែលនាំទៅដល់ការរកឃើញកាន់តែងាយស្រួលរបស់ពួកគេ។
ប្រសិទ្ធភាពនៃ electrophoresis គឺខ្ពស់ណាស់ព្រោះវាអាចត្រូវបានប្រើដើម្បីបំបែកបំណែកដែលមានទំហំចាប់ពី 2 ទៅ 50,000 មូលដ្ឋាន។
បន្ទាប់ពី electrophoresis បំណែកពី agarose ត្រូវបានដាច់ឆ្ងាយដោយប្រើវិធីសាស្រ្តផ្សេងៗ។ ផ្អែកលើលទ្ធផលប្រៀបធៀបទំហំ
ការដាក់កម្រិតនៃ DNA ដូចគ្នា ដែលទទួលបានដោយប្រើអង់ស៊ីមដាក់កម្រិតផ្សេងៗគ្នា បង្កើតផែនទីរឹតបន្តឹង ដែលបង្ហាញពីកន្លែងដាក់កម្រិតនៃអង់ស៊ីមកម្រិតនីមួយៗដែលបានប្រើ។ ក្នុងន័យជាក់ស្តែង ផែនទីដាក់កំហិតធ្វើឱ្យវាអាចកំណត់មិនត្រឹមតែទំហំនៃការដាក់កម្រិតប៉ុណ្ណោះទេ ប៉ុន្តែថែមទាំងអាចស្វែងរកទីតាំងនៃទីតាំងនៃហ្សែនមួយចំនួននៅក្នុងម៉ូលេគុល DNA ផងដែរ។
ដោយសារនៅក្នុងសារពាង្គកាយខ្ពស់ជាង កំឡុងពេលប្រតិចារិក DNA តំណពូជត្រូវបានសំយោគ កែតម្រូវដោយដំណើរការ ក្នុងវិស្វកម្មហ្សែន ជាធម្មតា DNA បំពេញបន្ថែម (cDNA) ត្រូវបានគេប្រើ ដែលត្រូវបានទទួលដោយប្រើ mRNA ជាគំរូ ដែល transcriptase បញ្ច្រាសសំយោគ DNA តែមួយខ្សែ ( cDNA) ដែលជាច្បាប់ចម្លងនៃ mRNA ។ ក្រោយមក DNA ខ្សែតែមួយទាំងនេះត្រូវបានបំប្លែងទៅជា DNA ខ្សែពីរ។ ពិចារណាថា cDNA មានលំដាប់នុយក្លេអូទីតបន្ត (ចម្លង និងបកប្រែ)។ វាគឺជា cDNA ដែលត្រូវបានប្រើសម្រាប់ការរឹតបន្តឹង។
បំណែក DNA (ការរឹតបន្តឹង) ដាច់ដោយឡែកបន្ទាប់ពី electrophoresis ពី agarose gels អាចត្រូវបានទទួលរងនូវការបន្តបន្ទាប់បន្សំ; កំណត់លំដាប់នុយក្លេអូទីតរបស់ពួកគេ។ សម្រាប់ការនេះ វិធីសាស្រ្តបន្តបន្ទាប់គីមី និងអង់ស៊ីមត្រូវបានប្រើ។ វិធីសាស្រ្តគីមីគឺផ្អែកលើការទទួលបានបំណែកដែលមានស្លាកផូស្វ័រវិទ្យុសកម្ម (32 P) និងយកមូលដ្ឋានមួយចេញពីបំណែកទាំងនេះ បន្ទាប់មកដោយគិតគូរពីលទ្ធផលនៃ autoradiography នៃជែលដែលមានបំណែកទាំងនេះ។ វិធីសាស្ត្រអង់ស៊ីមគឺផ្អែកលើការពិតដែលថានុយក្លេអូទីតត្រូវបានណែនាំនៅចុងបញ្ចប់នៃបំណែកដែលបានវិភាគ ដែលបន្ទាប់មកត្រូវបានប្រើក្នុងការសំយោគនៃបំណែកផ្សេងៗ។ នៅក្នុង vitro,វិភាគសម្រាប់លំដាប់ nucleotide electrophoretically ។ ដើម្បីសិក្សាពីលំដាប់នុយក្លេអូទីតជាក់លាក់នៅក្នុងម៉ូលេគុល DNA សូមប្រើ
ក៏បង្កាត់ DNA-DNA, RNA-RNA, DNA-RNA, ខាងជើង-
និងប្លុកភាគខាងត្បូង។
វ៉ិចទ័រហ្សែន។ ផ្នែក DNA (ហ្សែន) ដែលមានបំណងសម្រាប់ការក្លូនម៉ូលេគុលត្រូវតែអាចចម្លងនៅពេលវាត្រូវបានផ្ទេរទៅក្នុងកោសិកាបាក់តេរី ពោលគឺឧ។ ធ្វើជាអ្នកចម្លង។ ទោះយ៉ាងណាគាត់មិនមានសមត្ថភាពនេះទេ។ ដូច្នេះ ដើម្បីធានាបាននូវការផ្ទេរ និងការរកឃើញហ្សែនក្លូននៅក្នុងកោសិកា ពួកវាត្រូវបានផ្សំជាមួយអ្វីដែលគេហៅថា វ៉ិចទ័រហ្សែន។ ក្រោយមកទៀតត្រូវតែមានទ្រព្យសម្បត្តិយ៉ាងហោចណាស់ពីរ។ ទីមួយ វ៉ិចទ័រត្រូវតែអាចចម្លងបាន។
នៅក្នុងកោសិកា និងនៅចុងជាច្រើន។ ទីពីរ ពួកគេគួរតែអនុញ្ញាតឱ្យជ្រើសរើសកោសិកាដែលមានវ៉ិចទ័រ ពោលគឺឧ។ មានសញ្ញាសម្គាល់ដែលវាអាចប្រឆាំងនឹងការជ្រើសរើសកោសិកាដែលមានវ៉ិចទ័ររួមជាមួយហ្សែនដែលបានក្លូន (ម៉ូលេគុល DNA ដែលផ្សំឡើងវិញ)។ Plasmids និង phages បំពេញតាមតម្រូវការទាំងនេះ។ Plasmids គឺជាវ៉ិចទ័រដ៏ល្អ ព្រោះវាជាប្រភេទចម្លង និងអាចផ្ទុកហ្សែនសម្រាប់ភាពធន់នឹងថ្នាំអង់ទីប៊ីយោទិចណាមួយ ដែលអនុញ្ញាតឱ្យជ្រើសរើសបាក់តេរីសម្រាប់ភាពធន់នឹងថ្នាំអង់ទីប៊ីយោទិចនេះ ហើយដូច្នេះវាងាយស្រួលក្នុងការរកឃើញម៉ូលេគុល DNA ដែលផ្សំឡើងវិញ។
(រូបភាព 128) ។
អង្ករ។ ១២៨.វ៉ិចទ័រ pBRl
ដោយសារមិនមានវ៉ិចទ័រ plasmid ធម្មជាតិទេ វ៉ិចទ័រ plasmid ទាំងអស់ដែលគេស្គាល់រហូតមកដល់ពេលនេះត្រូវបានបង្កើតដោយសិប្បនិម្មិត។ R-plasmids បានបម្រើការជាសម្ភារៈចាប់ផ្តើមសម្រាប់ការបង្កើតវ៉ិចទ័រហ្សែនមួយចំនួន ដែលនៅក្នុងនោះ លំដាប់ DNA ច្រើនហួសប្រមាណ រួមទាំងកន្លែងដាក់កម្រិតច្រើនត្រូវបានដកចេញ ដោយមានជំនួយពីការរឹតបន្តឹង។ ការដកចេញនេះត្រូវបានកំណត់ដោយការពិតដែលថាវ៉ិចទ័រ plasmid គួរតែមានកន្លែងទទួលស្គាល់តែមួយគត់សម្រាប់អង់ស៊ីមកម្រិតមួយ ហើយគេហទំព័រនេះគួរតែស្ថិតនៅក្នុងតំបន់ដែលមិនសំខាន់នៃមុខងារនៃហ្សែនប្លាស្មា។ ឧទាហរណ៍ វ៉ិចទ័រប្លាស្មា pBR 322 ដែលមានហ្សែនធន់ទ្រាំនឹងអាំពីស៊ីលីន និងតេត្រាស៊ីគ្លីន ដែលធ្វើឱ្យវាមានភាពងាយស្រួល
សម្រាប់ការជ្រើសរើសបាក់តេរីដែលមានផ្នែក ADN ដែលត្រូវបានក្លូន វាមានកន្លែងដាក់កម្រិតតែមួយសម្រាប់អង់ស៊ីមដាក់កម្រិតច្រើនជាង 20 រួមទាំងអង់ស៊ីមដាក់កម្រិតល្បីដូចជា Eco RI, Hind III, Pst I, Pva II និង Sal I។
វ៉ិចទ័រ Phage ក៏មានគុណសម្បត្តិមួយចំនួនផងដែរ។ ពួកវាអាចរួមបញ្ចូលបំណែក DNA ដែលបានក្លូនធំជាង (យូរជាង) បើប្រៀបធៀបទៅនឹងវ៉ិចទ័រប្លាស្មា។ លើសពីនេះ ការផ្ទេរបំណែកក្លូនដោយ phages ចូលទៅក្នុងកោសិកាដែលជាលទ្ធផលនៃការឆ្លងមេរោគក្រោយគឺមានប្រសិទ្ធភាពជាងការបំប្លែង DNA ។ ជាចុងក្រោយ វ៉ិចទ័រ phage អនុញ្ញាតឱ្យមានការត្រួតពិនិត្យកាន់តែមានប្រសិទ្ធភាព (ការទទួលស្គាល់) លើផ្ទៃ agar នៃអាណានិគមដែលមានកោសិកាដែលផ្ទុកហ្សែនក្លូន។ វ៉ិចទ័រ phage ជាច្រើនត្រូវបានផ្អែកលើ lambda phage ។
បន្ថែមពីលើ phage វ៉ិចទ័រមេរោគផ្សេងទៀតដែលត្រូវបានសាងសង់នៅលើមូលដ្ឋាននៃវីរុស Herpes ក៏ដូចជាវ៉ិចទ័រដែលត្រូវបានសាងសង់នៅលើមូលដ្ឋាននៃ DNA ផ្សិតក៏ត្រូវបានគេប្រើផងដែរ។
ប្រសិនបើការក្លូនហ្សែនត្រូវបានអនុវត្តដោយប្រើកោសិកាថនិកសត្វ ឬរុក្ខជាតិ នោះតម្រូវការសម្រាប់វ៉ិចទ័រគឺដូចគ្នានឹងករណីនៃការក្លូននៅក្នុងកោសិកាបាក់តេរីដែរ។
ការបង្កើតម៉ូលេគុល DNA ចម្រុះ។ ការសាងសង់ដោយផ្ទាល់នៃម៉ូលេគុល DNA ដែលផ្សំឡើងវិញកើតឡើងបន្ទាប់ពីការរឹតបន្តឹងនៃ DNA ដែលបានសិក្សា និង DNA វ៉ិចទ័រត្រូវបានទទួល។ វាមាននៅក្នុងការបិទផ្នែកនៃការរឹតបន្តឹងនៃ DNA ដែលបានសិក្សាជាមួយនឹងការរឹតបន្តឹង DNA វ៉ិចទ័រ ដែលជាលទ្ធផលនៃការរឹតបន្តឹង ប្រែទៅជា DNA រាងជារង្វង់ទៅលីនេអ៊ែរ។
ដើម្បីបិទបំណែកនៃ DNA ដែលកំពុងសិក្សាជាមួយនឹង DNA នៃវ៉ិចទ័រនោះ DNA ligase ត្រូវបានប្រើ (រូបភាព 129) ។ ការផ្សារភ្ជាប់នឹងទទួលបានជោគជ័យប្រសិនបើរចនាសម្ព័ន្ធដែលត្រូវភ្ជាប់គ្នាមានក្រុម 3'-hydroxyl និង 5'-phosphate ហើយប្រសិនបើក្រុមទាំងនេះមានទីតាំងនៅក្នុងទំនាក់ទំនងសមស្របមួយ។ បំណែកត្រូវបានបញ្ចូលគ្នាតាមរយៈការបញ្ចប់ "ស្អិត" របស់ពួកគេដែលជាលទ្ធផលនៃការបំពេញបន្ថែមដោយខ្លួនឯង។ នៅកំហាប់ខ្ពស់នៃបំណែក, ក្រោយមកទៀតពីពេលមួយទៅពេលមួយនៅក្នុងទីតាំងត្រឹមត្រូវ (ទល់មុខគ្នា) ។ ការដាក់កម្រិតជាច្រើនដូចជា Eco RI បង្កើតការបញ្ចប់ "ស្អិត" បួនមូលដ្ឋាន។ ដំណើរការនៃការភ្ជាប់ចុង "ស្អិត" ដែលមានមូលដ្ឋានចំនួនបួនកើតឡើងនៅសីតុណ្ហភាពទាប (រហូតដល់ 12? C) ។

អង្ករ។ ១២៩.ការភ្ជាប់ DNA
ប្រសិនបើបំណែកដោយគ្មានចុង "ស្អិត" ត្រូវបានបង្កើតឡើងកំឡុងពេលដាក់កម្រិត នោះពួកវាត្រូវបានបំប្លែង "ដោយបង្ខំ" ទៅជាម៉ូលេគុលជាមួយនឹងចុង "ស្អិត" ដោយប្រើអង់ស៊ីម Transferase ។ អង់ស៊ីមនេះបន្ថែមនុយក្លេអូទីតទៅចុង 3" នៃ DNA ។ កន្ទុយ poly-A អាចត្រូវបានបន្ថែមនៅលើបំណែកមួយ កន្ទុយ poly-T នៅម្ខាងទៀត។ ប្រតិកម្មខ្សែសង្វាក់ Polymerase (PCR) ក៏ត្រូវបានគេប្រើដើម្បីបង្កើតចុងបញ្ចប់ DNA ដែលចង់បានផងដែរ។ គោលការណ៍នៃ PCR គឺផ្អែកលើ denaturation នៃ DNA ដាច់ដោយឡែកពីកោសិកា និង "annealing" របស់វាជាមួយនឹងការបន្ថែម DNA oligonucleotides ដែលមាន 15-20 nucleotides នីមួយៗទៅកាន់ច្រវាក់ដែលផ្លាស់ប្តូរ។ 50-2000 nucleotides ការសំយោគ DNA នៅក្នុង vitro,ពួកគេអនុញ្ញាតឱ្យ DNA polymerase ចម្លងតំបន់ទាំងនោះដែលស្ថិតនៅចន្លោះ "គ្រាប់ពូជ" ។ ការចម្លងនេះផ្តល់នូវច្បាប់ចម្លងមួយចំនួនធំនៃបំណែក DNA ដែលបានសិក្សា។
ការណែនាំអំពីម៉ូលេគុល DNA បញ្ចូលគ្នាទៅក្នុងកោសិកា។ បន្ទាប់ពីបំណែក DNA (ហ្សែន) ចំណាប់អារម្មណ៍ត្រូវបានបញ្ចូលគ្នាជាមួយវ៉ិចទ័រហ្សែនដោយប្រើ DNA ligase លទ្ធផលម៉ូលេគុលដែលផ្សំឡើងវិញត្រូវបានបញ្ចូលទៅក្នុងកោសិកាដើម្បីសម្រេចបាននូវការចម្លងរបស់វា (ដោយសារវ៉ិចទ័រហ្សែន) និងបង្កើនចំនួនច្បាប់ចម្លង។ មធ្យោបាយដ៏ពេញនិយមបំផុតដើម្បីណែនាំម៉ូលេគុល DNA ដែលផ្សំឡើងវិញទៅក្នុងកោសិកា ដែលវ៉ិចទ័រជាប្លាស្មាគឺជាការបំប្លែង E. coli ។ចំពោះគោលបំណងនេះ កោសិកាបាក់តេរីត្រូវបានព្យាបាលមុនដោយកាល់ស្យូម ឬ rubidium (អ៊ីយ៉ុង) ក្នុងគោលបំណង
ដូច្នេះពួកគេក្លាយជា "មានសមត្ថកិច្ច" ក្នុងការយល់ឃើញនៃ DNA ដែលផ្សំឡើងវិញ។ ដើម្បីបង្កើនភាពញឹកញាប់នៃការជ្រៀតចូល DNA ទៅក្នុងកោសិកា វិធីសាស្ត្រ electroporation ត្រូវបានប្រើ ដែលមាននៅក្នុងការបញ្ចោញកោសិកាយ៉ាងខ្លីទៅកាន់វាលអគ្គិសនីដ៏ខ្លាំងមួយ។ ការព្យាបាលនេះបង្កើតប្រហោងក្នុងភ្នាសកោសិកា ដែលធ្វើឱ្យវាកាន់តែងាយស្រួលសម្រាប់កោសិកាក្នុងការចាប់យក DNA ។ បន្ទាប់ពីការណែនាំនៃម៉ូលេគុល DNA បញ្ចូលគ្នាទៅក្នុងបាក់តេរី ក្រោយមកទៀតត្រូវបានគេសាបព្រោះនៅលើ MPA (meat-peptone agar) ដែលសំបូរទៅដោយថ្នាំអង់ទីប៊ីយោទិច ដើម្បីជ្រើសរើសកោសិកាដែលចង់បាន ពោលគឺឧ។ កោសិកាដែលមានម៉ូលេគុល DNA បញ្ចូលគ្នា។ ភាពញឹកញាប់នៃការផ្លាស់ប្តូរគឺទាប។ ជាធម្មតា ការផ្លាស់ប្តូរមួយកើតឡើងក្នុងកោសិកាគ្រាប់ពូជចំនួន 10 5 ។ ប្រសិនបើវ៉ិចទ័រគឺ phage នោះកោសិកា (បាក់តេរីឬផ្សិត) ត្រូវបានចម្លងជាមួយ phage ។ ចំពោះកោសិកា somatic សត្វ ពួកគេត្រូវបានចម្លងជាមួយ DNA នៅក្នុងវត្តមាននៃសារធាតុគីមីដែលជួយសម្រួលដល់ការឆ្លងកាត់ DNA តាមរយៈភ្នាសប្លាស្មា។ ការចាក់មីក្រូ DNA ដោយផ្ទាល់ទៅក្នុង oocytes កោសិកា somatic វប្បធម៌ និងអំប្រ៊ីយ៉ុងថនិកសត្វក៏អាចធ្វើទៅបានដែរ។
ចំណុចសំខាន់បំផុតដែលទាក់ទងនឹងការក្លូនម៉ូលេគុលគឺការស្វែងរកវិធីសាស្រ្តដើម្បីកំណត់ថាតើបំណែកក្លូនពិតជាត្រូវបានរួមបញ្ចូលនៅក្នុងវ៉ិចទ័រ ហើយរួមជាមួយនឹងវ៉ិចទ័រដែលបង្កើតជាម៉ូលេគុល DNA ដែលផ្សំឡើងវិញបានចូលទៅក្នុងកោសិកា។ ប្រសិនបើយើងកំពុងនិយាយអំពីកោសិកាបាក់តេរី នោះវិធីសាស្ត្រមួយគឺផ្អែកលើការគិតគូរពីភាពអសកម្មនៃការបញ្ចូលនៃហ្សែនធន់ទ្រាំ plasmid (វ៉ិចទ័រ) ។ ឧទាហរណ៍ នៅក្នុងវ៉ិចទ័រ plasmid pBR 322 ដែលកំណត់ភាពធន់នឹង ampicillin និង tetracycline កន្លែងតែមួយគត់សម្រាប់អង់ស៊ីមកម្រិត Pst I ស្ថិតនៅក្នុងទីតាំងដែលកាន់កាប់ដោយហ្សែនធន់នឹង ampicillin ។ ការរលាយ Pst I នៅកន្លែងនេះបង្កើតចុងស្អិតដែលអនុញ្ញាតឱ្យមានការភ្ជាប់នៃបំណែកក្លូនទៅនឹងវ៉ិចទ័រ DNA ។ ទោះយ៉ាងណាក៏ដោយ ក្នុងករណីនេះ ហ្សែនធន់ទ្រាំនឹងអាំភីស៊ីលីន ប្លាស្មាមីដ (វ៉ិចទ័រ) គឺមិនដំណើរការទេ ខណៈពេលដែលហ្សែនធន់ទ្រាំ តេត្រាស៊ីគ្លីន នៅលើវ៉ិចទ័រនៅតែនៅដដែល។ វាគឺជាហ្សែនធន់ទ្រាំ tetracycline ដែលត្រូវបានប្រើដើម្បីជ្រើសរើសកោសិកាដែលត្រូវបានបំប្លែងដោយម៉ូលេគុល DNA ដែលផ្សំឡើងវិញ។ នេះធ្វើឱ្យវាអាចធ្វើទៅបានដើម្បីផ្ទៀងផ្ទាត់ថាកោសិកានៃអាណានិគមដែលដាំដុះនៅលើឧបករណ៍ផ្ទុកជាមួយ tetracycline ពិតជាមានម៉ូលេគុល DNA ផ្សំឡើងវិញ ពួកគេត្រូវបានត្រួតពិនិត្យដោយប្រើអ្វីដែលគេហៅថា "ការធ្វើតេស្តកន្លែង" នៅលើចានមួយគូជាមួយឧបករណ៍ផ្ទុករឹង ដែលមួយក្នុងចំណោមនោះ។ មានផ្ទុក ampicillin ខណៈពេលដែលមួយទៀតគឺគ្មានអង់ទីប៊ីយ៉ូទិកនេះ។ DNA ដែលត្រូវក្លូនគឺ
មានតែនៅក្នុងសារធាតុបំប្លែងដែលធន់ទ្រាំនឹង tetracycline ប៉ុណ្ណោះ។ ចំពោះសារធាតុបំប្លែងដែលធន់នឹងទាំង ampicillin និង tetracycline (ArTc) ពួកវាផ្ទុកនូវម៉ូលេគុល plasmid (vector) ដែលបានទទួលទម្រង់រាងជារង្វង់ដោយឯកឯង ដោយមិនមានការរួមបញ្ចូល DNA បរទេស (ក្លូន) នៅក្នុងពួកវា។
វិធីសាស្រ្តមួយផ្សេងទៀតសម្រាប់ការរកឃើញការបញ្ចូលបំណែកបរទេស (ក្លូន) ទៅក្នុងវ៉ិចទ័រ plasmid គឺផ្អែកលើការប្រើប្រាស់វ៉ិចទ័រដែលមានហ្សែន β-galactosidase ។ ការបញ្ចូល DNA បរទេសទៅក្នុងហ្សែននេះជៀសមិនរួចធ្វើឱ្យការសំយោគ β-galactosidase អសកម្ម ដែលអាចត្រូវបានរកឃើញដោយការបណ្តុះកោសិកាផ្លាស់ប្តូរនៅលើឧបករណ៍ផ្ទុកដែលមានស្រទាប់ខាងក្រោម β-galactosidase ។ ឧបករណ៍ផ្ទុកនេះអនុញ្ញាតឱ្យជ្រើសរើសអាណានិគមកោសិកាដែលមានស្នាមប្រឡាក់។ មានវិធីសាស្រ្តផ្សេងទៀតផងដែរ។
ដូចដែលបានកត់សម្គាល់រួចមកហើយ បំណែកដាក់កម្រិតលីនេអ៊ែរនៃវ៉ិចទ័រ DNA មានសមត្ថភាពស្ដាររចនាសម្ព័ន្ធរាងជារង្វង់ដោយមិនរាប់បញ្ចូលផ្នែកដែលក្លូននៅក្នុងពួកវា។ ដើម្បីកាត់បន្ថយភាពញឹកញាប់នៃការបង្កើតដោយឯកឯងនៃម៉ូលេគុល DNA វ៉ិចទ័ររាងជារង្វង់ ការរឹតបន្តឹង DNA វ៉ិចទ័រត្រូវបានព្យាបាលដោយ phosphatase ។ ជាលទ្ធផល ការបង្កើតម៉ូលេគុល DNA រាងជារង្វង់មិនអាចទៅរួចនោះទេ ចាប់តាំងពីចុងបញ្ចប់នៃ 5'-PO 4 ដែលចាំបាច់សម្រាប់សកម្មភាពនៃ ligase នឹងអវត្តមាន។
សំណុំនៃអាណានិគមបំប្លែងដែលដាំដុះនៅលើឧបករណ៍ផ្ទុកជ្រើសរើសគឺជាសំណុំនៃកោសិកាដែលមានក្លូននៃបំណែកផ្សេងៗគ្នា (ហ្សែន) នៃហ្សែនដែលបានក្លូន ឬ cDNA ។ ការប្រមូលផ្តុំនៃក្លូនទាំងនេះបង្កើតបានជាបណ្ណាល័យ DNA ដែលត្រូវបានគេប្រើយ៉ាងទូលំទូលាយនៅក្នុងវិស្វកម្មហ្សែន។
ដំណាក់កាលចុងក្រោយនៃការក្លូនហ្សែនគឺការឯកោនិងការសិក្សាអំពី DNA ដែលបានក្លូនរួមទាំងការធ្វើតាមលំដាប់លំដោយ។ ការសន្យានៃបាក់តេរី ឬកោសិកា somatic ដែលមានម៉ូលេគុល DNA ផ្សំឡើងវិញដែលគ្រប់គ្រងការសំយោគប្រូតេអ៊ីនដែលមានតម្លៃពាណិជ្ជកម្មត្រូវបានផ្ទេរទៅឧស្សាហកម្ម។
វិស្វកម្មកោសិកា
ដូចដែលបានកត់សម្គាល់នៅដើមជំពូក វិស្វកម្មកោសិកាសំដៅទៅលើការរៀបចំហ្សែននៃកោសិកាសត្វ និងរុក្ខជាតិដាច់ដោយឡែក។ ឧបាយកលទាំងនេះជាញឹកញាប់ នៅក្នុង vitro,ហើយគោលដៅចម្បងរបស់ពួកគេគឺដើម្បីទទួលបាន genotypes នៃសារពាង្គកាយទាំងនេះជាមួយនឹងលក្ខណៈសម្បត្តិដែលចង់បាន ជាចម្បងដែលមានប្រយោជន៍ខាងសេដ្ឋកិច្ច។ ទាក់ទងនឹង-
បុរស Xia បន្ទាប់មកវិស្វកម្មកោសិកាអាចអនុវត្តបានចំពោះកោសិកាមេរោគរបស់គាត់។
តម្រូវការជាមុនសម្រាប់ការអភិវឌ្ឍន៍វិស្វកម្មកោសិកានៅក្នុងមនុស្ស និងសត្វគឺការបង្កើតវិធីសាស្រ្តសម្រាប់ការបណ្តុះកោសិកា somatic របស់ពួកគេនៅលើប្រព័ន្ធផ្សព្វផ្សាយសារធាតុចិញ្ចឹមសិប្បនិម្មិត ក៏ដូចជាការទទួលបានកូនកាត់នៃកោសិកា somatic រួមទាំងកូនកាត់អន្តរជាក់លាក់ផងដែរ។ ម្យ៉ាងវិញទៀត ភាពជឿនលឿនក្នុងការដាំដុះកោសិកា somatic បានជះឥទ្ធិពលដល់ការសិក្សាអំពីកោសិកាមេរោគ និងការបង្កកំណើតនៅក្នុងមនុស្ស និងសត្វ។ ចាប់តាំងពីទសវត្សរ៍ទី 60 ។ សតវត្សទី 20 ការពិសោធន៍ជាច្រើនត្រូវបានធ្វើឡើងនៅក្នុងមន្ទីរពិសោធន៍ជាច្រើនជុំវិញពិភពលោកលើការប្តូរស្នូលកោសិកា somatic ចូលទៅក្នុងស៊ុតដោយសិប្បនិម្មិតដោយគ្មានស្នូល។ លទ្ធផលនៃការពិសោធន៍ទាំងនេះច្រើនតែមានភាពផ្ទុយគ្នា ប៉ុន្តែជាទូទៅពួកគេនាំទៅដល់ការរកឃើញសមត្ថភាពនៃស្នូលកោសិកាដើម្បីធានាដល់ការវិវត្តន៍ធម្មតានៃស៊ុត (សូមមើលជំពូកទី IV) ។
ផ្អែកលើលទ្ធផលនៃការសិក្សាពីការអភិវឌ្ឍន៍ពងដែលបង្កកំណើតក្នុងទស្សវត្សរ៍ទី ៦០។ សតវត្សទី 20 ការសិក្សាក៏ត្រូវបានចាប់ផ្តើមដើម្បីបញ្ជាក់ពីលទ្ធភាពនៃការបង្កកំណើតនៃស៊ុតនៅខាងក្រៅរាងកាយរបស់ម្តាយ។ យ៉ាងឆាប់រហ័ស ការសិក្សាទាំងនេះបាននាំឱ្យមានការរកឃើញនូវលទ្ធភាពនៃការបង្កកំណើតនៃស៊ុតជាមួយនឹងមេជីវិតឈ្មោលនៅក្នុង vitro និងការវិវឌ្ឍន៍បន្ថែមទៀតនៃអំប្រ៊ីយ៉ុងដែលបានបង្កើតឡើងតាមរបៀបនេះនៅពេលបញ្ចូលទៅក្នុងស្បូនរបស់ស្ត្រី។ ការធ្វើឱ្យប្រសើរឡើងបន្ថែមទៀតនៃវិធីសាស្រ្តដែលបានបង្កើតឡើងនៅក្នុងតំបន់នេះបាននាំឱ្យមានការពិតដែលថាកំណើតនៃ "បំពង់សាកល្បង" កុមារបានក្លាយជាការពិត។ រួចទៅហើយនៅឆ្នាំ 1981 កុមារ 12 នាក់បានកើតនៅក្នុងពិភពលោកដែលជីវិតរបស់ពួកគេត្រូវបានផ្តល់ឱ្យនៅក្នុងមន្ទីរពិសោធន៍នៅក្នុងបំពង់សាកល្បង។ នាពេលបច្ចុប្បន្ននេះ ផ្នែកនៃវិស្វកម្មកោសិកានេះបានរីករាលដាល ហើយចំនួនកុមារ "បំពង់សាកល្បង" គឺរាប់ម៉ឺននាក់រួចទៅហើយ (រូបភាព 130)។ នៅប្រទេសរុស្ស៊ីការងារលើការទទួលបានកុមារ "បំពង់សាកល្បង" ត្រូវបានចាប់ផ្តើមតែនៅក្នុងឆ្នាំ 1986 ប៉ុណ្ណោះ។
នៅឆ្នាំ 1993 បច្ចេកទេសមួយត្រូវបានបង្កើតឡើងសម្រាប់ការទទួលបានកូនភ្លោះរបស់មនុស្ស monozygotic នៅក្នុង vitroដោយបែងចែកអំប្រ៊ីយ៉ុងទៅជា blastomeres និងបណ្តុះកោសិកាក្រោយៗទៀតរហូតដល់ 32 កោសិកា បន្ទាប់មកពួកវាអាចបញ្ចូលទៅក្នុងស្បូនរបស់ស្ត្រី។
សត្វពាហនៈក៏បានបង្កើតបច្ចេកវិទ្យាមួយដែលមានឈ្មោះថា ការប្តូរអំប្រ៊ីយ៉ុង។ វាត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងការអភិវឌ្ឍនៃវិធីសាស្រ្តសម្រាប់ការបង្កកំណើត poliovulation វិធីសាស្រ្តសម្រាប់ការបង្កកំណើតសិប្បនិម្មិតនៃស៊ុតនិងការផ្សាំនៃអំប្រ៊ីយ៉ុងនៅក្នុងរាងកាយរបស់សត្វ - ម្តាយចិញ្ចឹម។ ខ្លឹមសារនៃបច្ចេកវិទ្យានេះមានដូចខាងក្រោម៖
schuschy ។ គោដែលមានផលិតភាពខ្ពស់ត្រូវបានចាក់ដោយអរម៉ូនដែលបណ្តាលឱ្យមាន poliovulation ដែលមាននៅក្នុងភាពចាស់ទុំនៃកោសិកា 10-20 ក្នុងពេលតែមួយ។ បន្ទាប់មកស៊ុតត្រូវបានបង្កកំណើតដោយសិប្បនិម្មិតជាមួយនឹងកោសិកាបន្តពូជរបស់បុរសនៅក្នុងបំពង់ oviduct ។ នៅថ្ងៃទី 7-8 អំប្រ៊ីយ៉ុងត្រូវបានលាងសម្អាតចេញពីស្បូនហើយប្តូរទៅក្នុងស្បូនរបស់សត្វគោដទៃទៀត (ម្តាយចិញ្ចឹម) ដែលបន្ទាប់មកផ្តល់កំណើតដល់កូនគោភ្លោះ។ កូនគោទទួលមរតកពីស្ថានភាពហ្សែនរបស់ឪពុកម្តាយដើមរបស់ពួកគេ។

អង្ករ។ ១៣០.កុមារ "បំពង់"
តំបន់មួយទៀតនៃវិស្វកម្មកោសិកានៅក្នុងសត្វគឺការបង្កើតសត្វឆ្លង។ មធ្យោបាយដ៏សាមញ្ញបំផុតដើម្បីទទួលបានសត្វបែបនេះគឺដើម្បីណែនាំម៉ូលេគុល DNA លីនេអ៊ែរទៅក្នុងស៊ុតរបស់សត្វដើម។ សត្វដែលវិវឌ្ឍន៍ចេញពីស៊ុតដែលបង្កកំណើតនឹងចម្លងហ្សែនដែលបានណែនាំនៅក្នុងក្រូម៉ូសូមមួយរបស់ពួកគេ ហើយលើសពីនេះទៀត ពួកវានឹងបញ្ជូនហ្សែននេះតាមមរតក។ វិធីសាស្រ្តស្មុគ្រស្មាញបន្ថែមទៀតសម្រាប់ការទទួលបានសត្វឆ្លងត្រូវបានបង្កើតឡើងនៅលើសត្វកណ្តុរដែលមានពណ៌ថ្នាំកូតខុសៗគ្នា និងមានដូចខាងក្រោម។ ទីមួយ អំប្រ៊ីយ៉ុងដែលមានអាយុ 4 ថ្ងៃត្រូវបានយកចេញពីរាងកាយរបស់កណ្តុរពណ៌ប្រផេះដែលមានផ្ទៃពោះ ហើយត្រូវបានកំទេចចូលទៅក្នុងកោសិកានីមួយៗ។ បន្ទាប់មកស្នូលត្រូវបានស្រង់ចេញពីកោសិកាអំប្រ៊ីយ៉ុង ពួកគេត្រូវបានផ្ទេរទៅស៊ុតរបស់សត្វកណ្តុរខ្មៅ ដែលពីមុនត្រូវបានដកហូតស្នូល។ ស៊ុតកណ្ដុរខ្មៅដែលមានស្នូលបរទេសត្រូវបានដាក់ក្នុងបំពង់សាកល្បង
ជាមួយនឹងដំណោះស្រាយសារធាតុចិញ្ចឹមសម្រាប់ការអភិវឌ្ឍបន្ថែមទៀត។ អំប្រ៊ីយ៉ុងដែលបង្កើតចេញពីស៊ុតរបស់សត្វកណ្ដុរខ្មៅត្រូវបានបញ្ចូលទៅក្នុងស្បូនរបស់សត្វកណ្តុរស។ ដូច្នេះហើយ នៅក្នុងការពិសោធន៍ទាំងនេះ វាអាចទៅរួចដើម្បីទទួលបានក្លូននៃសត្វកណ្ដុរដែលមានពណ៌ថ្នាំកូតពណ៌ប្រផេះ i.e. ក្លូនកោសិកាអំប្រ៊ីយ៉ុងជាមួយនឹងលក្ខណៈសម្បត្តិដែលចង់បាន។ នៅក្នុងជំពូកទី IV យើងបានពិនិត្យមើលលទ្ធផលនៃការបង្កកំណើតនៃសិប្បនិម្មិតដែលគ្មានស្នូលនៃស៊ុតចៀមជាមួយនឹងសារធាតុនុយក្លេអ៊ែរនៃកោសិកា somatic នៃសត្វដែលមានប្រភេទដូចគ្នា។ ជាពិសេស ស្នូលត្រូវបានយកចេញពីស៊ុតរបស់ចៀម ហើយបន្ទាប់មកស្នូលនៃកោសិកា somatic (អំប្រ៊ីយ៉ុង ផ្លែឈើ ឬកោសិការបស់សត្វពេញវ័យ) ត្រូវបានបញ្ចូលទៅក្នុងស៊ុតបែបនេះ បន្ទាប់មកស៊ុតដែលបង្កកំណើតតាមរបៀបនេះត្រូវបានបញ្ចូលទៅក្នុងស្បូនរបស់ ចៀមពេញវ័យ។ កូនចៀមដែលកើតមកបានប្រែជាដូចគ្នាបេះបិទទៅនឹងម្ចាស់ជំនួយចៀម។ ឧទាហរណ៍មួយគឺ Dolly the sheep ។ កូនគោក្លូន កណ្ដុរ ទន្សាយ ឆ្មា មេ និងសត្វផ្សេងៗទៀតក៏ត្រូវបានទទួលផងដែរ។ ការសាងសង់សត្វដែលប្តូរហ្សែនបែបនេះគឺជាវិធីផ្ទាល់នៃការក្លូនសត្វដែលមានលក្ខណៈមានប្រយោជន៍ខាងសេដ្ឋកិច្ច រួមទាំងបុគ្គលនៃភេទជាក់លាក់មួយ។
សត្វប្តូរហ្សែនក៏ត្រូវបានទទួលដោយប្រើសម្ភារៈប្រភពដែលជាកម្មសិទ្ធិរបស់ប្រភេទផ្សេងៗគ្នា។ ជាពិសេស វិធីសាស្រ្តមួយត្រូវបានគេស្គាល់ថាសម្រាប់ការផ្ទេរហ្សែនដែលគ្រប់គ្រងអ័រម៉ូនលូតលាស់ពីសត្វកណ្តុរទៅស៊ុតកណ្ដុរ ក៏ដូចជាវិធីសាស្រ្តសម្រាប់ការរួមបញ្ចូលគ្នារវាង blastomeres ចៀមជាមួយនឹង blastomeres ពពែ ដែលនាំទៅដល់ការកើតនៃសត្វកូនកាត់ (គោ)។ ការពិសោធន៍ទាំងនេះបង្ហាញពីលទ្ធភាពនៃការយកឈ្នះលើភាពមិនស៊ីគ្នានៃប្រភេទសត្វនៅដំណាក់កាលដំបូងនៃការអភិវឌ្ឍន៍។ ជាពិសេសការរំពឹងទុកដ៏គួរឱ្យទាក់ទាញបានបើកចំហ (ប្រសិនបើភាពមិនស៊ីគ្នានៃប្រភេទសត្វត្រូវបានយកឈ្នះទាំងស្រុង) នៅក្នុងវិធីនៃការបង្កកំណើតនៃស៊ុតនៃប្រភេទមួយដោយស្នូលនៃកោសិកា somatic នៃប្រភេទមួយផ្សេងទៀត។ យើងកំពុងនិយាយអំពីការរំពឹងទុកពិតប្រាកដនៃការបង្កើតកូនកាត់សត្វដែលមានតម្លៃសេដ្ឋកិច្ចដែលមិនអាចទទួលបានដោយការឆ្លងកាត់។
គួរកត់សម្គាល់ថា ការងារប្តូរនុយក្លេអ៊ែរមិនទាន់មានប្រសិទ្ធភាពនៅឡើយទេ។ ការពិសោធន៍ដែលបានធ្វើឡើងលើសត្វពាហនៈ និងថនិកសត្វ ជាទូទៅបានបង្ហាញថាប្រសិទ្ធភាពរបស់វាទាប ហើយវាអាស្រ័យទៅលើភាពមិនស៊ីគ្នារវាងស្នូលអ្នកបរិច្ចាគ និង oocytes អ្នកទទួល។ លើសពីនេះ លទ្ធផលនៃភាពមិនប្រក្រតីនៃក្រូម៉ូសូមនៅក្នុងស្នូលដែលបានប្តូរនៅក្នុងដំណើរការនៃការអភិវឌ្ឍបន្ថែមទៀត ដែលត្រូវបានអមដោយការស្លាប់របស់សត្វប្តូរហ្សែនក៏ជាឧបសគ្គដល់ភាពជោគជ័យផងដែរ។
នៅចំណុចប្រសព្វនៃការងារលើការសិក្សានៃការបង្កាត់កោសិកា និងការសិក្សាអំពីភាពស៊ាំ បញ្ហាមួយបានកើតឡើងទាក់ទងនឹងការផលិត និងការសិក្សានៃអង្គបដិប្រាណ monoclonal ដែលគេហៅថា។ ដូចដែលបានកត់សម្គាល់ខាងលើ អង្គបដិប្រាណដែលផលិតដោយរាងកាយក្នុងការឆ្លើយតបទៅនឹងការណែនាំនៃអង់ទីហ្សែន (បាក់តេរី មេរោគ កោសិកាឈាមក្រហម។ ប៉ុន្តែរាងកាយបរទេសណាមួយដែលត្រូវបានណែនាំទៅក្នុងខ្លួនគឺជាល្បាយនៃអង់ទីហ្សែនផ្សេងៗគ្នាដែលនឹងជំរុញការផលិតអង្គបដិប្រាណផ្សេងៗគ្នា។ ឧទាហរណ៍ erythrocytes របស់មនុស្សមាន antigens មិនត្រឹមតែសម្រាប់ក្រុមឈាម A (II) និង B (III) ប៉ុណ្ណោះទេ ប៉ុន្តែក៏មាន antigens ជាច្រើនផ្សេងទៀត រួមទាំងកត្តា Rh ផងដែរ។ លើសពីនេះ ប្រូតេអ៊ីនជញ្ជាំងកោសិកាបាក់តេរី ឬ capsid នៃមេរោគ ក៏អាចដើរតួជាអង់ទីហ្សែនផ្សេងៗ ដែលបណ្តាលឱ្យមានការបង្កើតអង្គបដិប្រាណផ្សេងៗគ្នា។ ក្នុងពេលជាមួយគ្នានេះកោសិកា lymphoid នៃប្រព័ន្ធភាពស៊ាំរបស់រាងកាយជាធម្មតាត្រូវបានតំណាងដោយក្លូន។ នេះមានន័យថាសូម្បីតែសម្រាប់ហេតុផលនេះតែម្នាក់ឯងក៏ដោយ នៅក្នុងសេរ៉ូមឈាមរបស់សត្វដែលមានភាពស៊ាំ អង្គបដិប្រាណតែងតែជាល្បាយដែលមានអង្គបដិប្រាណដែលផលិតដោយកោសិកានៃក្លូនផ្សេងៗគ្នា។ ទន្ទឹមនឹងនេះដែរ សម្រាប់គោលបំណងជាក់ស្តែង អង្គបដិប្រាណនៃប្រភេទតែមួយគឺត្រូវការជាចាំបាច់។ ដែលគេហៅថា monospecific sera ដែលមានអង្គបដិប្រាណតែមួយប្រភេទ ឬដូចដែលពួកគេត្រូវបានគេហៅថា អង្គបដិប្រាណ monoclonal ។
ក្នុងការស្វែងរកវិធីសាស្រ្តដើម្បីទទួលបានអង្គបដិប្រាណ monoclonal អ្នកស្រាវជ្រាវជនជាតិស្វីសក្នុងឆ្នាំ 1975 បានរកឃើញវិធីសាស្រ្តនៃការបង្កាត់រវាងកោសិកា lymphocytes របស់កណ្តុរដែលត្រូវបានចាក់ថ្នាំបង្ការជាមួយនឹងអង់ទីហ្សែនមួយ ឬមួយផ្សេងទៀត និងកោសិកាដុំសាច់ខួរឆ្អឹងដែលត្រូវបានដាំដុះ។ កូនកាត់បែបនេះត្រូវបានគេហៅថា "hybridoma" ។ ពីផ្នែក "lymphocytic" តំណាងដោយ lymphocyte នៃក្លូនតែមួយ hybridoma តែមួយទទួលមរតកនូវសមត្ថភាពក្នុងការបង្កើតអង្គបដិប្រាណចាំបាច់និងប្រភេទដូចគ្នាហើយអរគុណចំពោះផ្នែក "ដុំសាច់ (myeloma)" វាក្លាយជា មានសមត្ថភាពដូចជាកោសិកាដុំសាច់ទាំងអស់ ក្នុងការគុណដោយគ្មានកំណត់នៅលើប្រព័ន្ធផ្សព្វផ្សាយសារធាតុចិញ្ចឹមសិប្បនិម្មិត ដែលផ្តល់ឱ្យចំនួនប្រជាជនកូនកាត់យ៉ាងច្រើន។ នៅលើរូបភព។ 131 បង្ហាញពីគ្រោងការណ៍សម្រាប់ភាពឯកោនៃខ្សែកោសិកាដែលសំយោគអង្គបដិប្រាណ monoclonal ។ ខ្សែកោសិកាកណ្តុរដែលផលិតអង្គបដិប្រាណ Monoclonal ត្រូវបានញែកដាច់ពីគ្នាដោយការបញ្ចូលគ្នានៃកោសិកា myeloma ជាមួយនឹង lymphocytes ពីលំពែងរបស់សត្វកណ្តុរដែលត្រូវបានចាក់វ៉ាក់សាំងកាលពីប្រាំថ្ងៃមុន។
antigen ដែលចង់បាន។ ការលាយកោសិកាត្រូវបានសម្រេចដោយការលាយពួកវានៅក្នុងវត្តមាននៃសារធាតុ polyethylene glycol ដែលបណ្តាលឱ្យមានការលាយបញ្ចូលគ្នានៃភ្នាសកោសិកា ហើយបន្ទាប់មកបញ្ចូលពួកវានៅលើឧបករណ៍ផ្ទុកសារធាតុចិញ្ចឹមដែលអនុញ្ញាតឱ្យមានការលូតលាស់ និងបន្តពូជនៃកោសិកាកូនកាត់ (hybridoma) ។ ការបន្តពូជនៃ hybridomas ត្រូវបានអនុវត្តនៅក្នុងឧបករណ៍ផ្ទុករាវ ដែលពួកវាលូតលាស់បន្ថែមទៀត និងបញ្ចេញអង្គបដិប្រាណទៅក្នុងសារធាតុរាវវប្បធម៌ ហើយមានតែប្រភេទមួយប៉ុណ្ណោះ លើសពីនេះទៀត ក្នុងបរិមាណគ្មានដែនកំណត់។ អង្គបដិប្រាណទាំងនេះត្រូវបានគេហៅថា monoclonal ។ ដើម្បីបង្កើនភាពញឹកញាប់នៃការបង្កើតអង្គបដិប្រាណ ការក្លូន hybridoma ត្រូវបានគេប្រើប្រាស់ ពោលគឺឧ។ ចំពោះការជ្រើសរើសអាណានិគមនីមួយៗនៃ hybridomas ដែលមានសមត្ថភាពផលិតអង្គបដិប្រាណច្រើនបំផុតនៃប្រភេទដែលចង់បាន។ អង្គបដិបក្ខ Monoclonal បានរកឃើញកម្មវិធីទូលំទូលាយនៅក្នុងឱសថសម្រាប់ការធ្វើរោគវិនិច្ឆ័យ និងការព្យាបាលនៃជំងឺមួយចំនួន។ ទន្ទឹមនឹងនេះ អត្ថប្រយោជន៍ដ៏សំខាន់បំផុតនៃបច្ចេកវិទ្យា monoclonal គឺថាវាអាចត្រូវបានប្រើដើម្បីបង្កើតអង្គបដិប្រាណប្រឆាំងនឹងវត្ថុធាតុដែលមិនអាចបន្សុតបាន។ ផ្ទុយទៅវិញ វាអាចទទួលបានអង្គបដិប្រាណ monoclonal ប្រឆាំងនឹងភ្នាសកោសិកា (ប្លាស្មា) នៃសរសៃប្រសាទសត្វ។ ដើម្បីធ្វើដូច្នេះ សត្វកណ្តុរត្រូវបានចាក់ថ្នាំការពារដោយភ្នាសសរសៃប្រសាទដាច់ស្រយាល បន្ទាប់ពីនោះ lymphocytes splenic របស់វាត្រូវបានផ្សំជាមួយកោសិកា myeloma ហើយបន្ទាប់មកបន្តដូចដែលបានពិពណ៌នាខាងលើ។

អង្ករ។ 131. ការទទួលបានអង្គបដិប្រាណ monoclonal
វិស្វកម្មហ្សែន និងថ្នាំពេទ្យ
វិស្វកម្មហ្សែនបានប្រែក្លាយទៅជាការសន្យាយ៉ាងខ្លាំងសម្រាប់ឱសថ ជាចម្បងក្នុងការបង្កើតបច្ចេកវិទ្យាថ្មីសម្រាប់ការទទួលបានប្រូតេអ៊ីនសកម្មសរីរវិទ្យាដែលប្រើជាថ្នាំ (អាំងស៊ុយលីន, somatostatin, interferons, somatotropin ជាដើម)។
អាំងស៊ុយលីនត្រូវបានប្រើដើម្បីព្យាបាលអ្នកជំងឺទឹកនោមផ្អែម ដែលជាមូលហេតុទូទៅទីបីនៃការស្លាប់បន្ទាប់ពីជំងឺបេះដូង និងមហារីក។ តម្រូវការអាំងស៊ុយលីនរបស់ពិភពលោកគឺរាប់សិបគីឡូក្រាម។ ជាប្រពៃណី វាត្រូវបានទទួលពីក្រពេញលំពែងរបស់ជ្រូក និងគោ ប៉ុន្តែអ័រម៉ូនរបស់សត្វទាំងនេះគឺខុសគ្នាបន្តិចបន្តួចពីអាំងស៊ុយលីនរបស់មនុស្ស។ អាំងស៊ុយលីនជ្រូកមានភាពខុសគ្នានៅក្នុងអាស៊ីតអាមីណូមួយខណៈពេលដែលអាំងស៊ុយលីន bovine ខុសគ្នាជាបី។ វាត្រូវបានគេជឿថាអាំងស៊ុយលីនសត្វជាញឹកញាប់បណ្តាលឱ្យមានផលប៉ះពាល់។ ទោះបីជាការសំយោគគីមីនៃអាំងស៊ុយលីនត្រូវបានអនុវត្តជាយូរណាស់មកហើយ ប៉ុន្តែរហូតមកដល់ពេលនេះការផលិតអរម៉ូនក្នុងឧស្សាហកម្មនៅតែមានតម្លៃថ្លៃខ្លាំង។ ឥឡូវនេះ អាំងស៊ុយលីនថោកត្រូវបានទទួលដោយប្រើវិធីសាស្ត្រវិស្វកម្មហ្សែនដោយការសំយោគអង់ស៊ីមគីមីនៃហ្សែនអាំងស៊ុយលីន បន្ទាប់មកដោយការណែនាំហ្សែននេះទៅក្នុង E. coli ដែលបន្ទាប់មកសំយោគអរម៉ូន។ អាំងស៊ុយលីនបែបនេះគឺមានលក្ខណៈ "ជីវសាស្ត្រ" ព្រោះវាមានលក្ខណៈគីមីដូចគ្នាទៅនឹងអាំងស៊ុយលីនដែលផលិតដោយកោសិកានៃលំពែងរបស់មនុស្ស។
Interferons គឺជាប្រូតេអ៊ីនដែលត្រូវបានសំយោគដោយកោសិកាជាចម្បងក្នុងការឆ្លើយតបទៅនឹងការឆ្លងមេរោគនៃរាងកាយដោយមេរោគ។ Interferons គឺជាប្រភេទជាក់លាក់។ ឧទាហរណ៍នៅក្នុងមនុស្សមានបីក្រុមនៃ interferon ដែលផលិតដោយកោសិកាផ្សេងៗដែលស្ថិតនៅក្រោមការគ្រប់គ្រងនៃហ្សែនដែលត្រូវគ្នា។ ចំណាប់អារម្មណ៍លើ interferons ត្រូវបានកំណត់ដោយការពិតដែលថាពួកគេត្រូវបានគេប្រើយ៉ាងទូលំទូលាយនៅក្នុងការអនុវត្តគ្លីនិកសម្រាប់ការព្យាបាលនៃជំងឺជាច្រើនរបស់មនុស្សជាពិសេសវីរុស។
ដោយមានទំហំធំ ម៉ូលេគុល interferon ស្ទើរតែមានសម្រាប់ការសំយោគ។ ដូច្នេះឥឡូវនេះ interferon ភាគច្រើនត្រូវបានទទួលពីឈាមរបស់មនុស្សប៉ុន្តែទិន្នផលជាមួយនឹងវិធីសាស្រ្តនៃការទទួលបាននេះគឺតូច។ ទន្ទឹមនឹងនេះតម្រូវការសម្រាប់ interferon គឺខ្ពស់ណាស់។ នេះបានបង្កឱ្យមានបញ្ហាប្រឈមក្នុងការស្វែងរកវិធីសាស្រ្តដ៏មានប្រសិទ្ធភាពមួយសម្រាប់ការផលិត interferon ក្នុងបរិមាណឧស្សាហកម្ម។ វិស្វកម្មហ្សែនបញ្ជាក់ពីការផលិតទំនើបនៃ interferon "បាក់តេរី" ។
ឥទ្ធិពលនៃវិស្វកម្មហ្សែនលើបច្ចេកវិទ្យានៃសារធាតុឱសថទាំងនោះដែលត្រូវបានបង្កើតឡើងជាយូរមកហើយដោយប្រើបច្ចេកវិទ្យាជីវសាស្រ្តបានកើនឡើង។ ត្រលប់ទៅទសវត្សរ៍ទី 40 និង 50 ។ សតវត្សទី 20 ត្រូវបានបង្កើតឡើង
ឧស្សាហកម្មជីវសាស្រ្តសម្រាប់ការផលិតថ្នាំអង់ទីប៊ីយោទិច ដែលជាផ្នែកដ៏មានប្រសិទ្ធភាពបំផុតនៃឃ្លាំងឱសថនៃឱសថទំនើប។ ទោះជាយ៉ាងណាក៏ដោយ ក្នុងប៉ុន្មានឆ្នាំថ្មីៗនេះ មានការកើនឡើងគួរឱ្យកត់សម្គាល់នូវភាពធន់នឹងថ្នាំរបស់បាក់តេរី ជាពិសេសចំពោះថ្នាំអង់ទីប៊ីយោទិច។ ហេតុផលស្ថិតនៅក្នុងការចែកចាយយ៉ាងទូលំទូលាយនៅក្នុងពិភពអតិសុខុមប្រាណនៃ plasmids ដែលកំណត់ភាពធន់នឹងថ្នាំរបស់បាក់តេរី។ នោះហើយជាមូលហេតុដែលថ្នាំអង់ទីប៊ីយោទិចល្បីៗជាច្រើនពីមុនបានបាត់បង់ប្រសិទ្ធភាពពីមុន។ រហូតមកដល់ពេលនេះ មធ្យោបាយតែមួយគត់ដើម្បីយកឈ្នះលើភាពធន់នឹងបាក់តេរីចំពោះថ្នាំអង់ទីប៊ីយោទិច គឺការស្វែងរកថ្នាំអង់ទីប៊ីយោទិចថ្មី។ យោងតាមអ្នកជំនាញ អង់ទីប៊ីយ៉ូទិកថ្មីប្រហែល 300 ត្រូវបានបង្កើតឡើងជារៀងរាល់ឆ្នាំនៅលើពិភពលោក។ ទោះជាយ៉ាងណាក៏ដោយ ភាគច្រើននៃពួកវាគឺគ្មានប្រសិទ្ធភាព ឬពុល។ មានតែថ្នាំអង់ទីប៊ីយោទិចមួយចំនួនប៉ុណ្ណោះដែលត្រូវបានណែនាំទៅក្នុងការអនុវត្តជារៀងរាល់ឆ្នាំ ដែលធ្វើឱ្យវាចាំបាច់មិនត្រឹមតែដើម្បីរក្សាប៉ុណ្ណោះទេ ប៉ុន្តែថែមទាំងបង្កើនសមត្ថភាពនៃឧស្សាហកម្មថ្នាំអង់ទីប៊ីយោទិចដោយផ្អែកលើការអភិវឌ្ឍន៍វិស្វកម្មហ្សែនផងដែរ។
ភារកិច្ចចម្បងនៃវិស្វកម្មហ្សែននៅក្នុងបច្ចេកវិជ្ជាទាំងនោះនៃសារធាតុឱសថដែលមីក្រូសរីរាង្គជាអ្នកផលិតថ្នាំត្រូវបានកំណត់ដោយតម្រូវការសម្រាប់ការបង្កើតឡើងវិញនូវវិស្វកម្មហ្សែននៃជំនាន់ក្រោយដើម្បីបង្កើនសកម្មភាពរបស់ពួកគេ។ នៅដដែល
នៅពេលជាមួយគ្នានោះគំនិតនៃការបង្កើតថ្នាំក្នុងទម្រង់នៃម៉ូលេគុលតូចៗបានចាប់ផ្តើមត្រូវបានដឹងដែលរួមចំណែកដល់ប្រសិទ្ធភាពកាន់តែច្រើនរបស់ពួកគេ។
បច្ចេកវិទ្យាជីវសាស្ត្រនៃប្រព័ន្ធភាពស៊ាំត្រូវបានផ្សារភ្ជាប់ជាចម្បងជាមួយនឹងការផលិតវ៉ាក់សាំងជំនាន់ថ្មីសម្រាប់ការការពារជំងឺឆ្លងចំពោះមនុស្ស និងសត្វ។ ផលិតផលពាណិជ្ជកម្មដំបូងគេដែលបង្កើតឡើងដោយប្រើប្រាស់វិស្វកម្មហ្សែនគឺវ៉ាក់សាំងប្រឆាំងនឹងជំងឺរលាកថ្លើមរបស់មនុស្ស ជំងឺពងបែកមាត់សត្វ និងមួយចំនួនផ្សេងទៀត។ ទិសដៅសំខាន់ខ្លាំងណាស់នៅក្នុងតំបន់នេះត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងការផលិតអង្គបដិប្រាណ monoclonal សារធាតុ reagents ចាំបាច់សម្រាប់ការធ្វើរោគវិនិច្ឆ័យនៃធាតុបង្កជំងឺក៏ដូចជាសម្រាប់ការបន្សុតអរម៉ូនវីតាមីនប្រូតេអ៊ីននៃធម្មជាតិផ្សេងៗ (អង់ស៊ីមជាតិពុល។ ល។ ) ។
ចំណាប់អារម្មណ៍ជាក់ស្តែងគួរឱ្យកត់សម្គាល់គឺវិធីសាស្រ្តនៃការទទួលបានអេម៉ូក្លូប៊ីនសិប្បនិម្មិតដោយការណែនាំហ្សែនអេម៉ូក្លូប៊ីនទៅក្នុងរុក្ខជាតិថ្នាំជក់ ដែលខ្សែសង្វាក់ α- និង β-globin ត្រូវបានផលិតក្រោមការគ្រប់គ្រងនៃហ្សែនទាំងនេះ ដែលត្រូវបានបញ្ចូលគ្នាទៅជាអេម៉ូក្លូប៊ីន។ អេម៉ូក្លូប៊ីនសំយោគនៅក្នុងកោសិការបស់រុក្ខជាតិថ្នាំជក់មានមុខងារពេញលេញ (ភ្ជាប់អុកស៊ីហ្សែន)។ វិស្វកម្មកោសិកាដូចដែលបានអនុវត្តចំពោះមនុស្សគឺត្រូវបានផ្សារភ្ជាប់មិនត្រឹមតែជាមួយនឹងដំណោះស្រាយនៃបញ្ហាជាមូលដ្ឋាននៃជីវវិទ្យារបស់មនុស្សប៉ុណ្ណោះទេ ប៉ុន្តែថែមទាំងជាមួយនឹងការយកឈ្នះលើភាពគ្មានកូនរបស់ស្ត្រីផងដែរ។ ចាប់តាំងពីភាពញឹកញាប់នៃករណីវិជ្ជមាននៃការផ្សាំក្នុងស្បូនរបស់ស្ត្រីនៃអំប្រ៊ីយ៉ុងដែលទទួលបាន នៅក្នុង vitro,គឺតូច បន្ទាប់មកទទួលបានអំប្រ៊ីយ៉ុងភ្លោះ monozygotic នៅក្នុង vitroក៏សំខាន់ផងដែរ ដោយសារលទ្ធភាពនៃការផ្សាំឡើងវិញកើនឡើង ដោយសារអំប្រ៊ីយ៉ុង "បម្រុង" ។ ការចាប់អារម្មណ៍ជាពិសេសគឺការរំពឹងទុកសម្រាប់ការប្រើប្រាស់កោសិកាដើមជាប្រភពនៃការជំនួសកោសិកា និងជាលិកាក្នុងការព្យាបាលជំងឺដូចជាជំងឺទឹកនោមផ្អែម របួសឆ្អឹងខ្នង ការឈឺចាប់បេះដូង ជំងឺរលាកសន្លាក់ឆ្អឹង និងជំងឺផាកឃីនសុន។ ប៉ុន្តែដើម្បីដឹងពីលទ្ធភាពទាំងនេះ ការសិក្សាស៊ីជម្រៅអំពីជីវវិទ្យានៃកោសិកាដើមគឺត្រូវការជាចាំបាច់។
នៅក្នុងការប្រើប្រាស់វិស្វកម្មហ្សែនទាក់ទងទៅនឹងបញ្ហានៃឱសថ ភារកិច្ចនៃការបង្កើតវិធីសាស្រ្តវិស្វកម្មហ្សែនសម្រាប់ការព្យាបាលរ៉ាឌីកាល់នៃជំងឺតំណពូជដែលជាអកុសលមិនទាន់អាចព្យាបាលបានដោយវិធីសាស្រ្តដែលមានស្រាប់បានទទួលនូវសារៈសំខាន់ជាពិសេស។ ខ្លឹមសារនៃភារកិច្ចនេះគឺដើម្បីបង្កើតវិធីដើម្បីកែតម្រូវ (ធ្វើឱ្យមានលក្ខណៈធម្មតា) ការផ្លាស់ប្តូរដែលនាំឱ្យមានជំងឺតំណពូជ និងដើម្បីធានាបាននូវការបញ្ជូននៃ "ការកែតម្រូវ" ដោយមរតក។ វាត្រូវបានគេជឿថាការវិវឌ្ឍន៍ជោគជ័យនៃវិធីសាស្ត្រហ្សែនសម្រាប់ការព្យាបាលជម្ងឺតំណពូជនឹងមាន
រួមចំណែកដល់ទិន្នន័យអំពីហ្សែនរបស់មនុស្សដែលទទួលបានជាលទ្ធផលនៃការអនុវត្តកម្មវិធីវិទ្យាសាស្ត្រអន្តរជាតិ "ហ្សែនមនុស្ស" ។
បញ្ហាបរិស្ថាននៃវិស្វកម្មហ្សែន
ការលើកកំពស់បច្ចេកវិទ្យាជីវសាស្រ្តដល់កម្រិតថ្មីមួយ វិស្វកម្មហ្សែនក៏បានរកឃើញកម្មវិធីក្នុងការអភិវឌ្ឍន៍វិធីសាស្រ្តសម្រាប់កំណត់ និងលុបបំបាត់ការបំពុលបរិស្ថាន។ ជាពិសេស បាក់តេរីត្រូវបានបង្កើតឡើង ដែលជាប្រភេទសូចនាករនៃសកម្មភាពផ្លាស់ប្តូរនៃសារធាតុគីមី។ ម្យ៉ាងវិញទៀត ពពួកបាក់តេរីដែលមាន plasmids ត្រូវបានបង្កើតហ្សែន ដើម្បីគ្រប់គ្រងការសំយោគអង់ស៊ីម ដែលមានសមត្ថភាពបំផ្លាញសមាសធាតុគីមីជាច្រើន ដែលបំពុលបរិស្ថាន។ ជាពិសេស បាក់តេរីដែលមានផ្ទុកប្លាស្មាមួយចំនួន មានសមត្ថភាពបំផ្លាញប្រេង និងផលិតផលប្រេងទៅក្នុងបរិស្ថាន ដែលជាលទ្ធផលនៃគ្រោះថ្នាក់ផ្សេងៗ ឬមូលហេតុមិនអំណោយផលផ្សេងទៀតចំពោះសមាសធាតុដែលមិនបង្កគ្រោះថ្នាក់។
ទោះជាយ៉ាងណាក៏ដោយ វិស្វកម្មហ្សែនគឺជាការបំប្លែងសារធាតុហ្សែនដែលមិនមាននៅក្នុងធម្មជាតិ។ ដូច្នេះហើយ ផលិតផលវិស្វកម្មហ្សែនគឺជាផលិតផលថ្មីពិតប្រាកដដែលមិនមាននៅក្នុងធម្មជាតិ។ ដូច្នេះ ដោយសារភាពមិនស្គាល់នៃផលិតផលរបស់វា វាបង្កគ្រោះថ្នាក់ដល់ធម្មជាតិ និងបរិស្ថាន ក៏ដូចជាបុគ្គលិកដែលធ្វើការក្នុងមន្ទីរពិសោធន៍ ដែលប្រើវិធីសាស្ត្រវិស្វកម្មហ្សែន ឬធ្វើការជាមួយរចនាសម្ព័ន្ធដែលបានបង្កើតឡើងក្នុងវគ្គនៃការងារវិស្វកម្មហ្សែន។
ដោយសារលទ្ធភាពនៃការក្លូនហ្សែនគឺគ្មានទីបញ្ចប់ សូម្បីតែនៅដើមដំបូងនៃការសិក្សាទាំងនេះ សំណួរបានកើតឡើងក្នុងចំណោមអ្នកវិទ្យាសាស្ត្រអំពីធម្មជាតិនៃសារពាង្គកាយដែលបានបង្កើត។ ទន្ទឹមនឹងនោះ មានការផ្ដល់យោបល់អំពីផលវិបាកដែលមិនចង់បានមួយចំនួននៃវិធីសាស្ត្រនេះ ហើយការផ្ដល់យោបល់ទាំងនេះក៏បានរកឃើញការគាំទ្រក្នុងចំណោមសាធារណជនទូទៅផងដែរ។ ជាពិសេស ការខ្វែងគំនិតគ្នាបានកើតឡើងអំពីលក្ខណៈសម្បត្តិរបស់បាក់តេរីដែលបានទទួលហ្សែនសត្វនៅក្នុងការពិសោធន៍វិស្វកម្មហ្សែន។ ឧទាហរណ៍ៈ តើបាក់តេរីរក្សា E. coliភាពជាប់ទាក់ទងនៃប្រភេទសត្វរបស់ពួកគេដោយសារតែខ្លឹមសារនៃហ្សែនសត្វដែលបានណែនាំទៅក្នុងពួកវា (ឧទាហរណ៍ ហ្សែនអាំងស៊ុយលីន) ឬតើពួកគេគួរត្រូវបានចាត់ទុកថាជាប្រភេទសត្វថ្មីដែរឬទេ? លើសពីនេះ ថាតើបាក់តេរីបែបនេះមានភាពជាប់លាប់ប៉ុណ្ណា នៅក្នុងទីផ្សារអេកូឡូស៊ីដែលពួកគេអាចធ្វើបាន
មាន? ប៉ុន្តែអ្វីដែលសំខាន់បំផុតនោះគឺការលេចឡើងនៃការភ័យខ្លាចថាក្នុងអំឡុងពេលនៃការផលិត និងការរៀបចំនៃម៉ូលេគុល DNA ដែលផ្សំឡើងវិញ រចនាសម្ព័ន្ធហ្សែនដែលមានលក្ខណៈសម្បត្តិដែលមិននឹកស្មានដល់ និងគ្រោះថ្នាក់សម្រាប់សុខភាពមនុស្ស សម្រាប់តុល្យភាពអេកូឡូស៊ីដែលបានបង្កើតឡើងជាប្រវត្តិសាស្ត្រអាចត្រូវបានបង្កើតឡើង។ ក្នុងពេលជាមួយគ្នានោះ ការអំពាវនាវបានចាប់ផ្តើមសម្រាប់ការផ្អាកលើវិស្វកម្មហ្សែន។ ការអំពាវនាវទាំងនេះបានបង្កឱ្យមានការតវ៉ាជាអន្តរជាតិ ហើយបាននាំឱ្យមានសន្និសីទអន្តរជាតិមួយដែលបានធ្វើឡើងនៅឆ្នាំ 1975 នៅសហរដ្ឋអាមេរិក ដែលលទ្ធផលដែលអាចកើតមាននៃការស្រាវជ្រាវនៅក្នុងតំបន់នេះត្រូវបានពិភាក្សាយ៉ាងទូលំទូលាយ។ បន្ទាប់មក នៅក្នុងបណ្តាប្រទេសដែលវិស្វកម្មហ្សែនបានចាប់ផ្តើមបង្កើត ច្បាប់ត្រូវបានបង្កើតឡើងសម្រាប់ធ្វើការជាមួយម៉ូលេគុល DNA ដែលផ្សំឡើងវិញ។ ច្បាប់ទាំងនេះមានគោលបំណងការពារផលិតផលនៃសកម្មភាពនៃមន្ទីរពិសោធន៍វិស្វកម្មហ្សែនពីការចូលទៅក្នុងទីជម្រក។
ទិដ្ឋភាពមួយទៀតនៃផលវិបាកដែលមិនចង់បាននៃការងារវិស្វកម្មហ្សែនគឺទាក់ទងទៅនឹងគ្រោះថ្នាក់ដល់សុខភាពរបស់បុគ្គលិកដែលធ្វើការក្នុងមន្ទីរពិសោធន៍ ដែលវិធីសាស្ត្រវិស្វកម្មហ្សែនត្រូវបានប្រើប្រាស់ ដោយសារមន្ទីរពិសោធន៍បែបនេះប្រើប្រាស់សារធាតុ phenol, ethidium bromide, វិទ្យុសកម្ម UV ដែលជាកត្តាបង្កគ្រោះថ្នាក់ដល់សុខភាព។ លើសពីនេះទៀតនៅក្នុងមន្ទីរពិសោធន៍ទាំងនេះមានលទ្ធភាពនៃការចម្លងរោគជាមួយបាក់តេរីដែលមានម៉ូលេគុល DNA ផ្សំឡើងវិញដែលគ្រប់គ្រងលក្ខណៈសម្បត្តិដែលមិនចង់បានដូចជាភាពធន់នឹងថ្នាំនៃបាក់តេរី។ ចំណុចទាំងនេះ និងចំណុចផ្សេងទៀតកំណត់ពីតម្រូវការក្នុងការធ្វើឱ្យប្រសើរឡើងនូវកម្រិតសុវត្ថិភាពនៅក្នុងការងារវិស្វកម្មហ្សែន។
ជាចុងក្រោយ បញ្ហាគ្រោះថ្នាក់នៃផលិតផលកែប្រែហ្សែន (ប៉េងប៉ោះ ដំឡូង ពោត សណ្តែកសៀង) ក៏ដូចជាផលិតផលដូចជា នំបុ័ង ប៉ាស្តា បង្អែម ការ៉េម ឈីស ប្រេងបន្លែ ផលិតផលសាច់ ដែលក្នុងចំនួនមួយចំនួន ប្រទេសនានា ជាពិសេសនៅសហរដ្ឋអាមេរិក បានរីករាលដាល។ សម្រាប់រយៈពេល 12,000 ឆ្នាំនៃកសិកម្មមនុស្សបានប្រើប្រាស់ផលិតផលធម្មជាតិ។ ដូច្នេះវាត្រូវបានគេសន្មត់ថាជាមួយនឹងអាហារដែលបានកែប្រែហ្សែនជាតិពុលថ្មីអាឡែហ្ស៊ីបាក់តេរីសារធាតុបង្កមហារីកនឹងចូលទៅក្នុងខ្លួនមនុស្សដែលនឹងនាំឱ្យមានជំងឺថ្មីទាំងស្រុងនៃមនុស្សជំនាន់ក្រោយ។ នេះជាសំណួរនៃការវាយតម្លៃតាមបែបវិទ្យាសាស្ត្រនៃអាហារកែប្រែហ្សែន។
បញ្ហាសម្រាប់ការពិភាក្សា
1. តើវិស្វកម្មហ្សែន កោសិកា និងហ្សែនមានន័យដូចម្តេច? តើមានភាពខុសគ្នារវាងគោលគំនិតទាំងនេះ និងការក្លូនម៉ូលេគុលដែរឬទេ?
2. តើអ្វីជាលក្ខណៈរីកចម្រើននៃវិស្វកម្មហ្សែនបើប្រៀបធៀបទៅនឹងវិធីសាស្រ្តផ្សេងទៀតដែលប្រើក្នុងជីវវិទ្យា?
3. រាយបញ្ជី "ឧបករណ៍" សំខាន់នៃវិស្វកម្មហ្សែន។
4. តើអង់ស៊ីមកំហិតមានអ្វីខ្លះ លក្ខណៈសម្បត្តិ និងតួនាទីរបស់វាក្នុងវិស្វកម្មហ្សែន?
5. តើការរឹតបន្តឹងទាំងអស់បង្កើតបានជា "ស្អិត" ចុងនៃ DNA ដែលបានសិក្សា ហើយតើរចនាសម្ព័ន្ធនៃ "ស្អិត" បញ្ចប់អាស្រ័យលើប្រភេទនៃ restrictase ដែរឬទេ?
6. កំណត់វ៉ិចទ័រហ្សែន។ តើមានវ៉ិចទ័រធម្មជាតិទេ?
7. តើវ៉ិចទ័រហ្សែនទទួលបាននៅក្នុងមន្ទីរពិសោធន៍យ៉ាងដូចម្តេច? តើវត្ថុជីវសាស្ត្រអ្វីខ្លះដែលជាប្រភពសម្ភារៈសម្រាប់ទទួលវ៉ិចទ័រ?
8. តើប្រវែងអតិបរមានៃលំដាប់មូលដ្ឋានអាសូត DNA ដែលនៅតែអាចបញ្ចូលក្នុងវ៉ិចទ័រហ្សែនគឺជាអ្វី? តើវ៉ិចទ័រខុសគ្នានៅក្នុង "អំណាច" ទេ?
9. ពិពណ៌នាអំពីលក្ខណៈសម្បត្តិរបស់ DNA ligase និងកំណត់តួនាទីរបស់វានៅក្នុងវិស្វកម្មហ្សែន។
10. តើផ្នែក DNA ដែលក្លូន (ហ្សែន) មានទំនាក់ទំនងជាមួយវ៉ិចទ័រហ្សែនយ៉ាងដូចម្តេច?
11. តើភាពញឹកញាប់នៃការបញ្ចូលម៉ូលេគុល DNA ដែលផ្សំគ្នាចូលទៅក្នុងកោសិកាបាក់តេរីគឺជាអ្វី?
12. តើការជ្រើសរើសកោសិកាបាក់តេរីដែលមានម៉ូលេគុល DNA ផ្សំឡើងវិញផ្អែកលើគោលការណ៍អ្វី? សូមលើកឧទាហរណ៍មួយនៃការជ្រើសរើសបែបនេះ។
14. បាក់តេរីជាច្រើនប្រភេទមានអង់ស៊ីមដូចគ្នា ដែលផ្តល់ការរំលាយអាហារស្ទើរតែដូចគ្នា។ ទន្ទឹមនឹងនេះ ភាពជាក់លាក់នៃនុយក្លេអូទីតនៃប្រព័ន្ធបំរែបំរួលបាក់តេរីគឺខុសគ្នា។ តើអ្នកអាចពន្យល់ពីបាតុភូតនេះបានទេ?
15. ហេតុអ្វីបានជាមិនអាចបន្ត DNA ដែលតំណាងឱ្យកន្លែងសម្គាល់អង់ស៊ីមកម្រិតដែលមានគូមូលដ្ឋានច្រើនជាងប្រាំបី?
16. តើលំដាប់ HHCC ប៉ុន្មានដងដែលទទួលស្គាល់ដោយអង់ស៊ីមកម្រិត Hae III កើតឡើងនៅក្នុងផ្នែក DNA 50,000 bp ដែលមានមាតិកា HC 30, 50 និង 70 ភាគរយ?
17. អង់ស៊ីមកម្រិត Bam HI និង Bgl I រលាយលំដាប់ G GATCC និង T GATCA រៀងគ្នា។ តើបំណែក DNA ដែលផលិតដោយការរឹតបន្តឹង Bgl I អាចបញ្ចូលទៅក្នុងគេហទំព័រ Bam HI បានទេ? បើបាទ ហេតុអ្វី? ប្រសិនបើ plasmid (វ៉ិចទ័រ) ដែលប្រើមានកន្លែងដាក់កម្រិត Bgl I មួយនោះ តើពពួកបាក់តេរីប្រភេទណាដែលអាចជ្រើសរើសបាន plasmid នេះ?
18. គណនាប្រេកង់នៃការផ្លាស់ប្តូរបាក់តេរីក្នុងមួយម៉ូលេគុល DNA ប្រសិនបើ 5-10 5 transformants ត្រូវបានបង្កើតឡើងក្នុង 5000 plasmid base pairs?
19. តើវាអាចទៅរួចទេក្នុងការក្លូន 0-point នៃការចម្លង DNA E. coliហើយបើដូច្នេះ តើយ៉ាងម៉េច?
20. តើវាអាចទៅរួចទេក្នុងការកំណត់ថាតើត្រូវការម៉ូលេគុល DNA ប៉ុន្មានដើម្បីបំប្លែងកោសិកាមួយ។ អ៊ី កូលី?
21. តើវាអាចធ្វើទៅបានដើម្បីកំណត់កន្លែងភ្ជាប់នៅលើ mRNA ដោយប្រើប្រតិកម្មខ្សែសង្វាក់ polymerase ដែរឬទេ?
22. តើប្រតិកម្មខ្សែសង្វាក់វត្ថុធាតុ polymerase អាចត្រូវបានប្រើប្រាស់យ៉ាងដូចម្តេច ដើម្បីណែនាំកន្លែងដាក់កម្រិតដែលចង់បាននៅកន្លែងដែលចាប់អារម្មណ៍លើបំណែក DNA ដែលនឹងត្រូវបានក្លូន?
23. ដាក់ឈ្មោះវិធីសាស្រ្តនៃវិស្វកម្មកោសិកាដូចដែលបានអនុវត្តចំពោះសត្វ។ តើតម្លៃសេដ្ឋកិច្ចរបស់សត្វដែលផលិតដោយវិធីសាស្រ្តទាំងនេះគឺជាអ្វី?
24. កំណត់ពាក្យថា "រុក្ខជាតិប្តូរហ្សែន" និង "សត្វប្តូរហ្សែន" ។ តើសារពាង្គកាយកែភេទរក្សាប្រភេទរបស់វា ឬអាចចាត់ទុកថាជាសារពាង្គកាយនៃប្រភេទថ្មី?
25. តើអ្វីជា hybridomas និង monoclonal antibodies? តើគេទទួលដោយរបៀបណា?
26. តើវិស្វកម្មកោសិកាអាចអនុវត្តបានចំពោះមនុស្សទេ?
27. ឧបមាថា ការចាក់ DNA បរទេសទៅក្នុងស៊ុតកណ្ដុរ និងការផ្សាំនៃស៊ុតដែលបង្កកំណើតដោយវិធីនេះទៅក្នុងខ្លួនរបស់កណ្ដុរ បានបញ្ចប់ក្នុងការមានផ្ទៃពោះរបស់នាង និងកំណើតនៃសត្វកណ្តុរដែលមានចម្លង DNA ដែលត្រូវបានចាក់បញ្ចូលក្នុងហ្សែន។ ទោះជាយ៉ាងណា, សត្វកណ្តុរបានប្រែទៅជា mosaics; កោសិកាខ្លះរបស់ពួកគេមានច្បាប់ចម្លងនៃ DNA ដែលត្រូវបានចាក់ ហើយខ្លះទៀតខ្វះ DNA នេះ។ តើអ្នកអាចពន្យល់ពីធម្មជាតិនៃបាតុភូតនេះបានទេ?
28. តើអ្នកចាត់ទុកអាហារដែលបានរៀបចំពីអាហារកែប្រែហ្សែនថាមានគ្រោះថ្នាក់ហ្សែនដែរឬទេ?
29. តើការពិនិត្យឡើងវិញតាមបែបវិទ្យាសាស្ត្រអំពីអាហារដែលកែប្រែហ្សែនចាំបាច់ឬ?
ការយល់ដឹងត្រូវបានកំណត់ដោយអ្វីដែលយើងបញ្ជាក់ថាជាការពិត។
P.A. Florensky ឆ្នាំ 1923
នៅពេលអនុវត្តចំពោះមនុស្ស វិស្វកម្មហ្សែនអាចត្រូវបានប្រើដើម្បីព្យាបាលជំងឺតំណពូជ។ ទោះបីជាយ៉ាងណាក៏ដោយ តាមបច្ចេកទេស វាមានភាពខុសគ្នាខ្លាំងរវាងការព្យាបាលអ្នកជំងឺខ្លួនឯង និងការផ្លាស់ប្តូរហ្សែននៃកូនចៅរបស់គាត់។
ភារកិច្ចនៃការផ្លាស់ប្តូរហ្សែនរបស់មនុស្សពេញវ័យគឺពិបាកជាងការបង្កាត់ពូជសត្វដែលកែច្នៃហ្សែនថ្មី ព្រោះក្នុងករណីនេះ ចាំបាច់ត្រូវផ្លាស់ប្តូរហ្សែននៃកោសិកាជាច្រើននៃសារពាង្គកាយដែលបានបង្កើតរួចហើយ ហើយមិនមែនត្រឹមតែស៊ុតបង្កកំណើតតែមួយនោះទេ។ ចំពោះបញ្ហានេះវាត្រូវបានស្នើឱ្យប្រើភាគល្អិតមេរោគជាវ៉ិចទ័រ។ ភាគល្អិតមេរោគអាចជ្រាបចូលទៅក្នុងកោសិកាពេញវ័យយ៉ាងច្រើន ដោយបង្កប់ព័ត៌មានតំណពូជរបស់ពួកគេទៅក្នុងពួកវា។ ការបន្តពូជដែលអាចគ្រប់គ្រងបាននៃភាគល្អិតមេរោគនៅក្នុងខ្លួន។ ក្នុងពេលជាមួយគ្នានេះ ដើម្បីកាត់បន្ថយផលប៉ះពាល់ អ្នកវិទ្យាសាស្ត្រកំពុងព្យាយាមជៀសវាងការដាក់បញ្ចូល DNA ដែលបានកែច្នៃហ្សែនទៅក្នុងកោសិកានៃសរីរាង្គប្រដាប់បន្តពូជ ដោយហេតុនេះជៀសវាងការប៉ះពាល់ជាមួយកូនចៅនាពេលអនាគតរបស់អ្នកជំងឺ។ វាក៏គួរកត់សម្គាល់ផងដែរចំពោះការរិះគន់យ៉ាងសំខាន់នៃបច្ចេកវិទ្យានេះនៅក្នុងប្រព័ន្ធផ្សព្វផ្សាយ៖ ការអភិវឌ្ឍន៍នៃមេរោគដែលបានកែច្នៃហ្សែនត្រូវបានមនុស្សជាច្រើនយល់ថាជាការគំរាមកំហែងដល់មនុស្សជាតិទាំងអស់។
ដោយមានជំនួយពីការព្យាបាលដោយហ្សែននាពេលអនាគតវាអាចទៅរួចក្នុងការផ្លាស់ប្តូរហ្សែនរបស់មនុស្ស។ បច្ចុប្បន្ននេះ វិធីសាស្ត្រដ៏មានប្រសិទ្ធភាពសម្រាប់ការកែប្រែហ្សែនរបស់មនុស្សកំពុងស្ថិតក្រោមការអភិវឌ្ឍន៍ និងការធ្វើតេស្តលើសត្វព្រូន។ អស់រយៈពេលជាយូរមកហើយ វិស្វកម្មហ្សែនរបស់សត្វស្វាប្រឈមមុខនឹងការលំបាកយ៉ាងខ្លាំង ប៉ុន្តែក្នុងឆ្នាំ 2009 ការពិសោធន៍ត្រូវបានទទួលជោគជ័យ៖ ការបោះពុម្ពផ្សាយមួយបានលេចចេញនៅក្នុងទស្សនាវដ្តី Nature អំពីការប្រើប្រាស់ជោគជ័យនៃមេរោគវិស្វកម្មហ្សែនដើម្បីព្យាបាលស្វាឈ្មោលពេញវ័យពីការខ្វាក់ពណ៌។ ក្នុងឆ្នាំដដែលនោះ primate ដែលត្រូវបានកែប្រែហ្សែនដំបូង (លូតលាស់ពីស៊ុតដែលបានកែប្រែ) បានផ្តល់កូនចៅ - marmoset ធម្មតា។
ទោះបីជាក្នុងកម្រិតតូចក៏ដោយ វិស្វកម្មហ្សែនត្រូវបានប្រើប្រាស់រួចហើយ ដើម្បីផ្តល់ឱ្យស្ត្រីដែលមានភាពគ្មានកូនមួយចំនួនមានឱកាសមានផ្ទៃពោះ។ ដើម្បីធ្វើដូចនេះត្រូវប្រើស៊ុតរបស់ស្ត្រីដែលមានសុខភាពល្អ។ ជាលទ្ធផល កូនបានទទួលមរតកហ្សែនពីឪពុកមួយ និងម្តាយពីរនាក់។
ទោះជាយ៉ាងណាក៏ដោយ លទ្ធភាពនៃការណែនាំការផ្លាស់ប្តូរសំខាន់ៗបន្ថែមទៀតនៅក្នុងហ្សែនរបស់មនុស្សប្រឈមមុខនឹងបញ្ហាសីលធម៌ធ្ងន់ធ្ងរមួយចំនួន។
_____________________________________________________________________________________________
វិស្វកម្មហ្សែន (genetic engineering)
នេះគឺជាសំណុំនៃបច្ចេកទេស វិធីសាស្រ្ត និងបច្ចេកវិជ្ជាសម្រាប់ការទទួលបាន RNA និង DNA ដែលផ្សំឡើងវិញដោយញែកហ្សែនចេញពីសារពាង្គកាយ (កោសិកា) រៀបចំហ្សែន និងណែនាំពួកវាទៅក្នុងសារពាង្គកាយផ្សេងទៀត។
វិស្វកម្មហ្សែនមិនមែនជាវិទ្យាសាស្ត្រក្នុងន័យទូលំទូលាយបំផុតនោះទេ ប៉ុន្តែជាឧបករណ៍ ជីវបច្ចេកវិទ្យាដោយប្រើវិធីសាស្រ្តនៃវិទ្យាសាស្រ្តជីវសាស្រ្តដូចជាជីវវិទ្យាម៉ូលេគុលនិងកោសិកា, cytology, ហ្សែន, មីក្រូជីវវិទ្យា, មេរោគ។
សមាសធាតុសំខាន់នៃជីវបច្ចេកវិទ្យាគឺវិស្វកម្មហ្សែន។ កើតនៅដើមទសវត្សរ៍ទី 70 នាងបានទទួលជោគជ័យយ៉ាងខ្លាំងនៅថ្ងៃនេះ។ បច្ចេកទេសវិស្វកម្មហ្សែនបំប្លែងកោសិកាបាក់តេរី ផ្សិត និងថនិកសត្វទៅជា "រោងចក្រ" សម្រាប់ការផលិតទ្រង់ទ្រាយធំនៃប្រូតេអ៊ីនណាមួយ។ នេះធ្វើឱ្យវាអាចធ្វើការវិភាគលម្អិតអំពីរចនាសម្ព័ន្ធ និងមុខងាររបស់ប្រូតេអ៊ីន ហើយប្រើវាជាថ្នាំ។
បច្ចុប្បន្ននេះ Escherichia coli (E. coli) បានក្លាយជាអ្នកផ្គត់ផ្គង់អរម៉ូនសំខាន់ៗដូចជា អាំងស៊ុយលីន និងសូម៉ាតូត្រូពីន។ ពីមុនអាំងស៊ុយលីនត្រូវបានទទួលពីកោសិកាលំពែងរបស់សត្វដូច្នេះការចំណាយគឺខ្ពស់ណាស់។ ដើម្បីទទួលបានអាំងស៊ុយលីនគ្រីស្តាល់ 100 ក្រាម លំពែង 800-1000 គីឡូក្រាមត្រូវបានទាមទារ ហើយក្រពេញមួយរបស់គោមានទម្ងន់ 200-250 ក្រាម។ នេះបានធ្វើឱ្យអាំងស៊ុយលីនមានតម្លៃថ្លៃ និងពិបាកក្នុងការប្រើប្រាស់សម្រាប់អ្នកជំងឺទឹកនោមផ្អែម។ នៅឆ្នាំ 1978 អ្នកស្រាវជ្រាវនៅ Genentech បានបង្កើតអាំងស៊ុយលីនដំបូងបង្អស់នៅក្នុងប្រភេទ Escherichia coli ដែលត្រូវបានបង្កើតឡើងដោយវិស្វកម្មពិសេស។ អាំងស៊ុយលីនមានខ្សែសង្វាក់ polypeptide ពីរ A និង B, 20 និង 30 អាមីណូអាស៊ីតវែង។ នៅពេលដែលពួកវាត្រូវបានភ្ជាប់ដោយចំណង disulfide អាំងស៊ុយលីនពីរខ្សែដើមត្រូវបានបង្កើតឡើង។ វាត្រូវបានបង្ហាញថាវាមិនមានប្រូតេអ៊ីន E. coli, endotoxins និងសារធាតុមិនបរិសុទ្ធផ្សេងទៀត មិនមានផលប៉ះពាល់ដូចអាំងស៊ុយលីនសត្វទេ និងមិនខុសពីវានៅក្នុងសកម្មភាពជីវសាស្ត្រ។ ក្រោយមកទៀត proinsulin ត្រូវបានសំយោគនៅក្នុងកោសិកា E. coli ដែលច្បាប់ចម្លង DNA ត្រូវបានសំយោគនៅលើគំរូ RNA ដោយប្រើ reverse transcriptase ។ បន្ទាប់ពីការបន្សុត proinsulin ដែលទទួលបាន វាត្រូវបានបំបែក ហើយអាំងស៊ុយលីនដើមត្រូវបានទទួល ខណៈពេលដែលដំណាក់កាលនៃការស្រង់ចេញ និងការញែកអរម៉ូនត្រូវបានបង្រួមអប្បបរមា។ ពី 1000 លីត្រនៃសារធាតុរាវវប្បធម៌អាចទទួលបានរហូតដល់ 200 ក្រាមនៃអរម៉ូនដែលស្មើនឹងបរិមាណអាំងស៊ុយលីនដែលលាក់ពី 1600 គីឡូក្រាមនៃលំពែងរបស់ជ្រូកឬគោ។
Somatotropin គឺជាអរម៉ូនលូតលាស់របស់មនុស្សដែលលាក់ដោយក្រពេញភីតូរីស។ កង្វះអ័រម៉ូននេះនាំឱ្យមនុស្សតឿ pituitary ។ ប្រសិនបើ somatotropin ត្រូវបានគ្រប់គ្រងក្នុងកម្រិត 10 mg ក្នុងមួយគីឡូក្រាមនៃទំងន់រាងកាយ 3 ដងក្នុងមួយសប្តាហ៍ នោះក្នុងមួយឆ្នាំកុមារដែលទទួលរងពីកង្វះរបស់វាអាចលូតលាស់បាន 6 សង់ទីម៉ែត្រ។ ផលិតផលឱសថចុងក្រោយ។ ដូច្នេះហើយ បរិមាណអរម៉ូនដែលមាននៅមានកម្រិត លើសពីនេះទៅទៀត អរម៉ូនដែលផលិតដោយវិធីសាស្ត្រនេះគឺមានលក្ខណៈខុសៗគ្នា ហើយអាចមានផ្ទុកមេរោគដែលវិវត្តយឺតៗ។ ក្រុមហ៊ុន "Genentec" ក្នុងឆ្នាំ 1980 បានបង្កើតបច្ចេកវិទ្យាសម្រាប់ការផលិត somatotropin ដោយប្រើបាក់តេរីដែលមិនមានកង្វះខាតទាំងនេះ។ នៅឆ្នាំ 1982 អ័រម៉ូនលូតលាស់របស់មនុស្សត្រូវបានគេទទួលបាននៅក្នុងវប្បធម៌ E. coli និងកោសិកាសត្វនៅវិទ្យាស្ថានប៉ាស្ទ័រក្នុងប្រទេសបារាំងហើយចាប់តាំងពីឆ្នាំ 1984 ការផលិតអាំងស៊ុយលីនឧស្សាហកម្មបានចាប់ផ្តើមនៅក្នុងសហភាពសូវៀត។ នៅក្នុងការផលិត interferon ទាំង E. coli, S. cerevisae (yeast) និងវប្បធម៌នៃ fibroblasts ឬ leukocytes ដែលត្រូវបានបំលែងត្រូវបានប្រើ។ វ៉ាក់សាំងដែលមានសុវត្ថិភាព និងថោកក៏ទទួលបានដោយវិធីសាស្ត្រស្រដៀងគ្នាដែរ។
ការផលិតការស៊ើបអង្កេត DNA ជាក់លាក់ខ្ពស់គឺផ្អែកលើបច្ចេកវិទ្យានៃ DNA ផ្សំឡើងវិញ ដោយមានជំនួយពីពួកគេសិក្សាពីការបញ្ចេញហ្សែននៅក្នុងជាលិកា ការធ្វើមូលដ្ឋានីយកម្មនៃហ្សែននៅក្នុងក្រូម៉ូសូម និងកំណត់អត្តសញ្ញាណហ្សែនដែលមានមុខងារពាក់ព័ន្ធ (ឧទាហរណ៍នៅក្នុងមនុស្ស និងសត្វមាន់។ ) ការស៊ើបអង្កេត DNA ក៏ត្រូវបានប្រើក្នុងការធ្វើរោគវិនិច្ឆ័យជំងឺផ្សេងៗផងដែរ។
បច្ចេកវិទ្យា DNA ផ្សំឡើងវិញបានធ្វើឱ្យមានវិធីសាស្រ្តហ្សែនប្រូតេអ៊ីនមិនធម្មតាហៅថា ហ្សែនបញ្ច្រាស។ ជាមួយនឹងវិធីសាស្រ្តនេះ ប្រូតេអ៊ីនមួយត្រូវបានញែកចេញពីកោសិកា ហ្សែននៃប្រូតេអ៊ីននេះត្រូវបានក្លូន ហើយវាត្រូវបានកែប្រែ បង្កើតហ្សែនផ្លាស់ប្តូរដែលបំលែងទៅជាទម្រង់ប្រូតេអ៊ីនដែលផ្លាស់ប្តូរ។ ហ្សែនលទ្ធផលត្រូវបានបញ្ចូលទៅក្នុងកោសិកា។ ប្រសិនបើវាត្រូវបានបង្ហាញ កោសិកាដែលផ្ទុកវា និងកូនចៅរបស់វានឹងសំយោគប្រូតេអ៊ីនដែលបានផ្លាស់ប្តូរ។ តាមរបៀបនេះ ហ្សែនដែលខូចអាចត្រូវបានកែដំរូវ និងជំងឺតំណពូជត្រូវបានព្យាបាល។
ប្រសិនបើ DNA កូនកាត់ត្រូវបានបញ្ចូលទៅក្នុងស៊ុតបង្កកំណើតនោះ សារពាង្គកាយប្តូរហ្សែនអាចទទួលបាន ដែលបង្ហាញពីហ្សែនដែលផ្លាស់ប្តូរ និងបញ្ជូនវាទៅកូនចៅ។ ការផ្លាស់ប្តូរហ្សែនរបស់សត្វធ្វើឱ្យវាអាចធ្វើទៅបានដើម្បីបង្កើតតួនាទីនៃហ្សែនបុគ្គលនិងផលិតផលប្រូតេអ៊ីនរបស់ពួកគេទាំងនៅក្នុងបទប្បញ្ញត្តិនៃសកម្មភាពនៃហ្សែនផ្សេងទៀតនិងនៅក្នុងដំណើរការ pathological ផ្សេងៗ។ ដោយមានជំនួយពីវិស្វកម្មហ្សែន ខ្សែសត្វដែលធន់នឹងជំងឺមេរោគ ក៏ដូចជាពូជសត្វដែលមានលក្ខណៈមានប្រយោជន៍សម្រាប់មនុស្សត្រូវបានបង្កើតឡើង។ ឧទាហរណ៍ ការចាក់ microinjection នៃ DNA recombinant ដែលមានហ្សែន somatotropin bovine ចូលទៅក្នុង zygote ទន្សាយបានធ្វើឱ្យវាអាចទទួលបានសត្វដែលប្តូរហ្សែនជាមួយនឹងការផលិតអរម៉ូននេះ។ សត្វដែលជាលទ្ធផលបានបញ្ចេញសម្លេង acromegaly ។
ឥឡូវនេះ វារឹតតែពិបាកក្នុងការទស្សន៍ទាយឱកាសទាំងអស់ដែលនឹងអាចសម្រេចបានក្នុងប៉ុន្មានទសវត្សរ៍ខាងមុខនេះ។
វិស្វកម្មហ្សែនគឺជាវិស័យនៃបច្ចេកវិទ្យាជីវសាស្រ្តដែលរួមបញ្ចូលសកម្មភាពនៃការរៀបចំហ្សែនឡើងវិញ។ សូម្បីតែសព្វថ្ងៃនេះ វិស្វកម្មហ្សែនធ្វើឱ្យវាអាចបើក និងបិទហ្សែននីមួយៗ គ្រប់គ្រងសកម្មភាពរបស់សារពាង្គកាយ និងក៏អាចផ្ទេរការណែនាំហ្សែនពីសារពាង្គកាយមួយទៅសារពាង្គកាយមួយទៀត រួមទាំងសារពាង្គកាយនៃប្រភេទសត្វមួយទៀត។ នៅពេលដែលអ្នកជំនាញខាងពន្ធុវិទ្យាសិក្សាកាន់តែច្រើនឡើងអំពីការងាររបស់ហ្សែន និងប្រូតេអ៊ីន វាកាន់តែក្លាយជាការពិតដើម្បីអាចរៀបចំកម្មវិធីហ្សែន (ជាចម្បងរបស់មនុស្ស) ដោយងាយទទួលបានលទ្ធផលណាមួយដូចជា៖ ភាពធន់នឹងវិទ្យុសកម្ម សមត្ថភាពក្នុងការរស់នៅក្រោមទឹក។ , សមត្ថភាពក្នុងការបង្កើតឡើងវិញនៃសរីរាង្គដែលខូចនិងសូម្បីតែអមតៈ។
សព្វវចនាធិប្បាយ YouTube
-
1 / 5
វិស្វកម្មហ្សែនបម្រើដើម្បីទទួលបាននូវគុណភាពដែលចង់បាននៃសារពាង្គកាយដែលបានកែប្រែ ឬកែប្រែហ្សែន។ មិនដូចការបង្កាត់ពូជបែបប្រពៃណីទេ ក្នុងអំឡុងពេលដែលហ្សែនត្រូវបានផ្លាស់ប្តូរដោយប្រយោល វិស្វកម្មហ្សែនអនុញ្ញាតឱ្យអ្នកជ្រៀតជ្រែកដោយផ្ទាល់ជាមួយឧបករណ៍ហ្សែនដោយប្រើបច្ចេកទេសនៃការក្លូនម៉ូលេគុល។ ឧទាហរណ៍នៃកម្មវិធីនៃវិស្វកម្មហ្សែនគឺការផលិតនៃពូជដែលបានកែប្រែហ្សែនថ្មីនៃដំណាំ ការផលិតអាំងស៊ុយលីនរបស់មនុស្សដោយប្រើបាក់តេរីកែប្រែហ្សែន ការផលិតអេរីត្រូប៉ូអ៊ីទីនក្នុងកោសិកាវប្បធម៌ ឬពូជកណ្តុរពិសោធន៍ថ្មីសម្រាប់ការស្រាវជ្រាវវិទ្យាសាស្ត្រ។
មូលដ្ឋាននៃមីក្រូជីវសាស្រ្ត ឧស្សាហកម្មជីវសំយោគ គឺជាកោសិកាបាក់តេរី។ កោសិកាដែលចាំបាច់សម្រាប់ផលិតកម្មឧស្សាហកម្មត្រូវបានជ្រើសរើសតាមលក្ខណៈវិនិច្ឆ័យជាក់លាក់ ដែលសំខាន់បំផុតគឺសមត្ថភាពក្នុងការផលិត សំយោគក្នុងបរិមាណអតិបរមាដែលអាចធ្វើបាន សមាសធាតុជាក់លាក់មួយ - អាស៊ីតអាមីណូ ឬអង់ទីប៊ីយ៉ូទិក អរម៉ូនស្តេរ៉ូអ៊ីត ឬអាស៊ីតសរីរាង្គ។ . ជួនកាលវាចាំបាច់ដើម្បីឱ្យមានមីក្រូសរីរាង្គដែលអាចប្រើប្រេង ឬទឹកសំណល់ជា "អាហារ" ហើយកែច្នៃវាទៅជាជីវម៉ាស ឬសូម្បីតែប្រូតេអ៊ីនដែលសមរម្យសម្រាប់សារធាតុបន្ថែមចំណី។ ជួនកាលសារពាង្គកាយត្រូវការជាចាំបាច់ ដែលអាចលូតលាស់នៅសីតុណ្ហភាពខ្ពស់ ឬនៅក្នុងវត្តមាននៃសារធាតុដែលអាចសម្លាប់មេរោគដល់ប្រភេទអតិសុខុមប្រាណដទៃទៀត។
ភារកិច្ចនៃការទទួលបានប្រភេទឧស្សាហកម្មបែបនេះគឺមានសារៈសំខាន់ខ្លាំងណាស់ សម្រាប់ការកែប្រែ និងការជ្រើសរើសរបស់ពួកគេ វិធីសាស្រ្តជាច្រើននៃឥទ្ធិពលសកម្មលើកោសិកាត្រូវបានបង្កើតឡើង - ពីការព្យាបាលជាមួយនឹងសារធាតុពុលដ៏ខ្លាំងក្លារហូតដល់វិទ្យុសកម្មវិទ្យុសកម្ម។ គោលបំណងនៃបច្ចេកទេសទាំងនេះគឺដូចគ្នា - ដើម្បីសម្រេចបាននូវការផ្លាស់ប្តូរតំណពូជ បរិធានហ្សែននៃកោសិកា។ លទ្ធផលរបស់ពួកគេគឺការផលិតអតិសុខុមប្រាណដែលផ្លាស់ប្តូរជាច្រើនពីរាប់រយទៅរាប់ពាន់ដែលអ្នកវិទ្យាសាស្ត្រព្យាយាមជ្រើសរើសដែលសមស្របបំផុតសម្រាប់គោលបំណងជាក់លាក់មួយ។ ការបង្កើតបច្ចេកទេសសម្រាប់ការផ្លាស់ប្តូរគីមី ឬវិទ្យុសកម្ម គឺជាសមិទ្ធិផលដ៏ល្អមួយនៅក្នុងជីវវិទ្យា ហើយត្រូវបានប្រើប្រាស់យ៉ាងទូលំទូលាយនៅក្នុងបច្ចេកវិទ្យាជីវសាស្ត្រទំនើប។
ប៉ុន្តែសមត្ថភាពរបស់ពួកគេត្រូវបានកំណត់ដោយធម្មជាតិនៃ microorganisms ខ្លួនឯង។ ពួកគេមិនអាចសំយោគសារធាតុដ៏មានតម្លៃមួយចំនួនដែលកកកុញនៅក្នុងរុក្ខជាតិ ជាចម្បងជាឱសថ និងប្រេងសំខាន់ៗ។ ពួកវាមិនអាចសំយោគសារធាតុដែលមានសារៈសំខាន់សម្រាប់ជីវិតសត្វ និងមនុស្ស អង់ស៊ីមមួយចំនួន អរម៉ូន peptide ប្រូតេអ៊ីនភាពស៊ាំ សារធាតុ interferon និងសមាសធាតុផ្សំសាមញ្ញជាច្រើនទៀតដែលត្រូវបានសំយោគនៅក្នុងសត្វ និងមនុស្ស។ ជាការពិតណាស់លទ្ធភាពនៃ microorganisms គឺនៅឆ្ងាយពីការអស់កម្លាំង។ ក្នុងចំណោមអតិសុខុមប្រាណដ៏សម្បូរបែប មានតែផ្នែកតូចមួយប៉ុណ្ណោះដែលត្រូវបានប្រើប្រាស់ដោយវិទ្យាសាស្ត្រ និងជាពិសេសដោយឧស្សាហកម្ម។ សម្រាប់គោលបំណងនៃការជ្រើសរើសអតិសុខុមប្រាណ ការចាប់អារម្មណ៍ខ្លាំងគឺឧទាហរណ៍ បាក់តេរី anaerobic ដែលអាចរស់នៅក្នុងអវត្ដមាននៃអុកស៊ីសែន សារធាតុ phototrophs ដែលប្រើប្រាស់ថាមពលពន្លឺដូចជារុក្ខជាតិ គីមីវិទ្យា បាក់តេរី thermophilic ដែលអាចរស់នៅបាននៅសីតុណ្ហភាព ដូចដែលវាត្រូវបានគេរកឃើញថ្មីៗនេះ។ ប្រហែល 110 ° C ។ល។
ហើយដែនកំណត់នៃ "សម្ភារៈធម្មជាតិ" គឺជាក់ស្តែង។ ពួកគេបានព្យាយាម និងកំពុងព្យាយាមគេចពីការរឹតបន្តឹង ដោយមានជំនួយពីវប្បធម៌កោសិកា និងជាលិកានៃរុក្ខជាតិ និងសត្វ។ នេះគឺជាមធ្យោបាយដ៏សំខាន់ និងជោគជ័យ ដែលត្រូវបានអនុវត្តនៅក្នុងបច្ចេកវិទ្យាជីវសាស្ត្រផងដែរ។ ក្នុងរយៈពេលប៉ុន្មានទស្សវត្សកន្លងមកនេះ អ្នកវិទ្យាសាស្ត្របានបង្កើតវិធីសាស្រ្តដែលកោសិកាតែមួយរបស់រុក្ខជាតិ ឬជាលិកាសត្វអាចបង្កើតបានដើម្បីលូតលាស់ និងគុណដោយឡែកពីរាងកាយ ដូចជាកោសិកាបាក់តេរី។ នេះគឺជាសមិទ្ធិផលដ៏សំខាន់មួយ - លទ្ធផលនៃវប្បធម៌កោសិកាត្រូវបានប្រើប្រាស់សម្រាប់ការពិសោធន៍ និងសម្រាប់ផលិតកម្មឧស្សាហកម្មនៃសារធាតុមួយចំនួនដែលមិនអាចទទួលបានដោយប្រើវប្បធម៌បាក់តេរី។
ទិសដៅមួយទៀតនៃការស្រាវជ្រាវគឺការដកចេញពី DNA នៃហ្សែនដែលមិនចាំបាច់សម្រាប់ការសរសេរកូដប្រូតេអ៊ីន និងដំណើរការនៃសារពាង្គកាយ និងការបង្កើតសារពាង្គកាយសិប្បនិម្មិតដោយផ្អែកលើ DNA បែបនេះជាមួយនឹង "សំណុំកាត់ខ្លី" នៃហ្សែន។ នេះធ្វើឱ្យវាអាចបង្កើនភាពធន់នៃសារពាង្គកាយដែលបានកែប្រែទៅនឹងមេរោគយ៉ាងខ្លាំង។
ប្រវត្តិនៃការអភិវឌ្ឍន៍ និងសម្រេចបានកម្រិតបច្ចេកវិទ្យា
នៅពាក់កណ្តាលទីពីរនៃសតវត្សទី 20 ការរកឃើញ និងការច្នៃប្រឌិតសំខាន់ៗជាច្រើនត្រូវបានបង្កើតឡើង វិស្វកម្មហ្សែន. ការប៉ុនប៉ងជាច្រើនឆ្នាំដើម្បី "អាន" ព័ត៌មានជីវសាស្រ្តដែលត្រូវបាន "កត់ត្រា" នៅក្នុងហ្សែនត្រូវបានបញ្ចប់ដោយជោគជ័យ។ ការងារនេះត្រូវបានចាប់ផ្តើមដោយអ្នកវិទ្យាសាស្ត្រអង់គ្លេស Frederick Senger និងអ្នកវិទ្យាសាស្ត្រអាមេរិក Walter Gilbert (រង្វាន់ណូបែលគីមីវិទ្យាក្នុងឆ្នាំ 1980) ។ ដូចដែលអ្នកបានដឹងហើយថាហ្សែនមានព័ត៌មានណែនាំសម្រាប់ការសំយោគម៉ូលេគុល RNA និងប្រូតេអ៊ីននៅក្នុងខ្លួនរួមទាំងអង់ស៊ីមផងដែរ។ ដើម្បីបង្ខំកោសិកាមួយឱ្យសំយោគសារធាតុមិនធម្មតាថ្មីសម្រាប់វា វាចាំបាច់ដែលសំណុំអង់ស៊ីមដែលត្រូវគ្នាត្រូវបានសំយោគនៅក្នុងវា។ ហើយសម្រាប់រឿងនេះ វាចាំបាច់ក្នុងការផ្លាស់ប្តូរហ្សែននៅក្នុងវាដោយចេតនា ឬដើម្បីណែនាំហ្សែនថ្មីដែលអវត្តមានពីមុនចូលទៅក្នុងវា។ ការផ្លាស់ប្តូរហ្សែននៅក្នុងកោសិការស់គឺជាការផ្លាស់ប្តូរ។ ពួកវាកើតឡើងក្រោមឥទិ្ធពលនៃឧទាហរណ៍ mutagens - សារធាតុពុលគីមីឬវិទ្យុសកម្ម។ ប៉ុន្តែការផ្លាស់ប្តូរបែបនេះមិនអាចគ្រប់គ្រង ឬដឹកនាំបានទេ។ ដូច្នេះហើយ អ្នកវិទ្យាសាស្ត្របានផ្តោតការខិតខំប្រឹងប្រែងរបស់ពួកគេលើការព្យាយាមបង្កើតវិធីសាស្រ្តសម្រាប់បញ្ចូលទៅក្នុងកោសិកាថ្មី ហ្សែនជាក់លាក់ដែលមនុស្សម្នាក់ត្រូវការ។
ដំណាក់កាលសំខាន់នៃការដោះស្រាយបញ្ហាវិស្វកម្មហ្សែនមានដូចខាងក្រោម៖
- ការទទួលបានហ្សែនដាច់ដោយឡែក។
- ការណែនាំនៃហ្សែនមួយចូលទៅក្នុងវ៉ិចទ័រសម្រាប់ការផ្ទេរចូលទៅក្នុងសារពាង្គកាយមួយ។
- ការផ្ទេរវ៉ិចទ័រជាមួយហ្សែនទៅជាសារពាង្គកាយដែលបានកែប្រែ។
- ការផ្លាស់ប្តូរកោសិការាងកាយ។
- ការជ្រើសរើសសារពាង្គកាយកែប្រែហ្សែន ( GMO) និងលុបបំបាត់ចោលនូវអ្វីដែលមិនត្រូវបានកែប្រែដោយជោគជ័យ។
ដំណើរការនៃការសំយោគហ្សែនបច្ចុប្បន្នត្រូវបានអភិវឌ្ឍយ៉ាងល្អ ហើយសូម្បីតែភាគច្រើនដោយស្វ័យប្រវត្តិ។ មានឧបករណ៍ពិសេសៗដែលបំពាក់ដោយកុំព្យូទ័រ ដែលនៅក្នុងអង្គចងចាំដែលកម្មវិធីសម្រាប់ការសំយោគនៃលំដាប់នុយក្លេអូទីតផ្សេងៗត្រូវបានរក្សាទុក។ ឧបករណ៍បែបនេះសំយោគផ្នែក DNA រហូតដល់ 100-120 មូលដ្ឋានអាសូតនៅក្នុងប្រវែង (oligonucleotides) ។ បច្ចេកទេសមួយបានរីករាលដាលដែលអនុញ្ញាតឱ្យប្រើប្រតិកម្មខ្សែសង្វាក់ polymerase សម្រាប់ការសំយោគ DNA រួមទាំង DNA ដែលផ្លាស់ប្តូរផងដែរ។ អង់ស៊ីមដែលអាចទប់កម្តៅបានគឺ DNA polymerase ត្រូវបានប្រើនៅក្នុងវាសម្រាប់ការសំយោគគំរូនៃ DNA ដែលត្រូវបានប្រើជាគ្រាប់ពូជសម្រាប់បំណែកនៃអាស៊ីត nucleic ដែលសំយោគដោយសិប្បនិម្មិត - oligonucleotides ។ អង់ស៊ីម transcriptase បញ្ច្រាសធ្វើឱ្យវាអាចសំយោគ DNA ដោយប្រើ primers (primers) បែបនេះនៅលើម៉ាទ្រីសនៃ RNA ដែលដាច់ចេញពីកោសិកា។ DNA ដែលសំយោគតាមរបៀបនេះត្រូវបានគេហៅថា បំពេញបន្ថែម (RNA) ឬ cDNA ។ ហ្សែន "សុទ្ធគីមី" ដាច់ដោយឡែកក៏អាចទទួលបានពីបណ្ណាល័យ phage ផងដែរ។ នេះគឺជាឈ្មោះនៃការរៀបចំ bacteriophage ដែលបំណែកចៃដន្យនៃហ្សែនពីហ្សែន ឬ cDNA ត្រូវបានបញ្ចូល បង្កើតឡើងវិញដោយ phage រួមជាមួយនឹង DNA របស់វាទាំងអស់។
បច្ចេកទេសនៃការណែនាំហ្សែនទៅជាបាក់តេរីត្រូវបានបង្កើតឡើងបន្ទាប់ពី Frederick Griffith បានរកឃើញបាតុភូតនៃការផ្លាស់ប្តូរបាក់តេរី។ បាតុភូតនេះត្រូវបានផ្អែកលើដំណើរការផ្លូវភេទបឋមដែលនៅក្នុងបាក់តេរីត្រូវបានអមដោយការផ្លាស់ប្តូរបំណែកតូចៗនៃ DNA ដែលមិនមែនជាក្រូម៉ូសូម plasmids ។ បច្ចេកវិជ្ជា Plasmid បានបង្កើតមូលដ្ឋានសម្រាប់ការណែនាំហ្សែនសិប្បនិម្មិតទៅក្នុងកោសិកាបាក់តេរី។
ការលំបាកសំខាន់ៗត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងការណែនាំហ្សែនដែលត្រៀមរួចជាស្រេចទៅក្នុងឧបករណ៍តំណពូជនៃកោសិការុក្ខជាតិ និងសត្វ។ ទោះយ៉ាងណាក៏ដោយនៅក្នុងធម្មជាតិមានករណីនៅពេលដែល DNA បរទេស (នៃមេរោគឬបាក់តេរី) ត្រូវបានរួមបញ្ចូលនៅក្នុងឧបករណ៍ហ្សែននៃកោសិកាមួយហើយដោយមានជំនួយពីយន្តការមេតាប៉ូលីសរបស់វាចាប់ផ្តើមសំយោគប្រូតេអ៊ីន "របស់វាផ្ទាល់" ។ អ្នកវិទ្យាសាស្ត្របានសិក្សាពីលក្ខណៈពិសេសនៃការបញ្ចូល DNA បរទេស ហើយបានប្រើវាជាគោលការណ៍សម្រាប់ដាក់បញ្ចូលហ្សែនទៅក្នុងកោសិកាមួយ។ ដំណើរការនេះត្រូវបានគេហៅថា transfection ។
ប្រសិនបើសារពាង្គកាយឯកតា ឬវប្បធម៌នៃកោសិកាពហុកោសិកាត្រូវបានកែប្រែ នោះការក្លូនចាប់ផ្តើមនៅដំណាក់កាលនេះ ពោលគឺការជ្រើសរើសសារពាង្គកាយទាំងនោះ និងកូនចៅរបស់ពួកគេ (ក្លូន) ដែលបានទទួលការកែប្រែ។ នៅពេលដែលភារកិច្ចគឺដើម្បីទទួលបានសារពាង្គកាយពហុកោសិកា នោះកោសិកាដែលមានហ្សែនដែលបានផ្លាស់ប្តូរត្រូវបានប្រើសម្រាប់ការបន្តពូជលូតលាស់របស់រុក្ខជាតិ ឬចាក់ចូលទៅក្នុង blastocysts របស់ម្តាយពពោះជំនួសនៅពេលវាមកដល់សត្វ។ ជាលទ្ធផល កូនគោដែលមានហ្សែនផ្លាស់ប្តូរ ឬមិនផ្លាស់ប្តូរត្រូវបានកើត ដែលក្នុងនោះមានតែកូនដែលបង្ហាញពីការផ្លាស់ប្តូរដែលរំពឹងទុកប៉ុណ្ណោះដែលត្រូវបានជ្រើសរើស និងឆ្លងកាត់គ្នាទៅវិញទៅមក។
ការអនុវត្តក្នុងការស្រាវជ្រាវវិទ្យាសាស្ត្រ
ទោះបីជាក្នុងកម្រិតតូចក៏ដោយ វិស្វកម្មហ្សែនត្រូវបានប្រើប្រាស់រួចហើយ ដើម្បីផ្តល់ឱ្យស្ត្រីដែលមានភាពគ្មានកូនមួយចំនួនមានឱកាសមានផ្ទៃពោះ។ ដើម្បីធ្វើដូចនេះត្រូវប្រើស៊ុតរបស់ស្ត្រីដែលមានសុខភាពល្អ។ ជាលទ្ធផល កូនបានទទួលមរតកហ្សែនពីឪពុកមួយ និងម្តាយពីរនាក់។
ទោះជាយ៉ាងណាក៏ដោយ លទ្ធភាពនៃការផ្លាស់ប្តូរដ៏សំខាន់បន្ថែមទៀតចំពោះហ្សែនរបស់មនុស្សប្រឈមមុខនឹងបញ្ហាសីលធម៌ធ្ងន់ធ្ងរមួយចំនួន។ ក្នុងឆ្នាំ 2016 អ្នកវិទ្យាសាស្ត្រមួយក្រុមនៅសហរដ្ឋអាមេរិកបានទទួលការយល់ព្រមសម្រាប់ការសាកល្បងព្យាបាលនៃវិធីសាស្ត្រព្យាបាលជំងឺមហារីកដោយប្រើកោសិកាភាពស៊ាំផ្ទាល់របស់អ្នកជំងឺ ដោយទទួលរងនូវការកែប្រែហ្សែនដោយប្រើបច្ចេកវិទ្យា CRISPR/Cas9 ។
វិស្វកម្មកោសិកា
វិស្វកម្មកោសិកាគឺផ្អែកលើការដាំដុះនៃកោសិការុក្ខជាតិ និងសត្វ និងជាលិកាដែលមានសមត្ថភាពផលិតសារធាតុចាំបាច់សម្រាប់មនុស្សនៅខាងក្រៅរាងកាយ។ វិធីសាស្រ្តនេះត្រូវបានប្រើសម្រាប់ការបន្តពូជ clonal (ភេទដូចគ្នា) នៃទម្រង់រុក្ខជាតិដ៏មានតម្លៃ; ដើម្បីទទួលបានកោសិកាកូនកាត់ដែលរួមបញ្ចូលគ្នានូវលក្ខណៈសម្បត្តិនៃឧទាហរណ៍ lymphocytes ឈាម និងកោសិកាដុំសាច់ ដែលអនុញ្ញាតឱ្យអ្នកទទួលបានអង្គបដិប្រាណយ៉ាងឆាប់រហ័ស។
វិស្វកម្មហ្សែននៅប្រទេសរុស្ស៊ី
វាត្រូវបានកត់សម្គាល់ថាបន្ទាប់ពីការណែនាំនៃការចុះបញ្ជីរដ្ឋនៃ GMOs សកម្មភាពរបស់អង្គការសាធារណៈមួយចំនួននិងអ្នកតំណាងបុគ្គលនៃរដ្ឋឌូម៉ាដែលកំពុងព្យាយាមការពារការបញ្ចូលបច្ចេកវិទ្យាជីវសាស្ត្រប្រកបដោយភាពច្នៃប្រឌិតទៅក្នុងកសិកម្មរុស្ស៊ីបានកើនឡើងគួរឱ្យកត់សម្គាល់។ អ្នកវិទ្យាសាស្ត្ររុស្ស៊ីជាង 350 នាក់បានចុះហត្ថលេខាលើលិខិតចំហមួយពីសមាគមអ្នកវិទ្យាសាស្ត្រក្នុងការគាំទ្រការអភិវឌ្ឍន៍វិស្វកម្មហ្សែននៅសហព័ន្ធរុស្ស៊ី។ លិខិតចំហបានកត់សម្គាល់ថា ការហាមប្រាមលើ GMOs នៅក្នុងប្រទេសរុស្ស៊ីនឹងមិនត្រឹមតែប៉ះពាល់ដល់ការប្រកួតប្រជែងដែលមានសុខភាពល្អនៅក្នុងទីផ្សារកសិកម្មប៉ុណ្ណោះទេ ប៉ុន្តែនឹងនាំឱ្យមានភាពយឺតយ៉ាវក្នុងបច្ចេកវិទ្យាផលិតកម្មអាហារ ការបង្កើនការពឹងផ្អែកលើការនាំចូលអាហារ និងធ្វើឱ្យខូចកិត្យានុភាពរបស់ប្រទេសរុស្ស៊ីក្នុងនាមជារដ្ឋនៅក្នុង ដែលវគ្គសិក្សាសម្រាប់ការអភិវឌ្ឍន៍ប្រកបដោយភាពច្នៃប្រឌិតត្រូវបានប្រកាសជាផ្លូវការ [ សារៈសំខាន់នៃការពិត? ] .
សូមមើលផងដែរ
កំណត់ចំណាំ
- លោក Alexander Panchinការវាយដំព្រះ // យន្តការពេញនិយម។ - 2017. - លេខ 3. - S. 32-35 ។ - URL៖ http://www.popmech.ru/magazine/2017/173-issue/
- នៅក្នុងជីវិត o ការកើនឡើង genomeediting យើងកំពុងដំណើរការប្រព័ន្ធ TALEN ប្រសិទ្ធភាពខ្ពស់។(ភាសាអង់គ្លេស)។ ធម្មជាតិ។ បានយកមកវិញ 10 មករា 2017 ។
- ធាតុ - ព័ត៌មានវិទ្យាសាស្ត្រ៖ សត្វស្វាព្យាបាលពិការភ្នែកពណ៌ជាមួយនឹងការព្យាបាលដោយហ្សែន (មិនកំណត់) (ថ្ងៃទី១៨ ខែកញ្ញា ឆ្នាំ២០០៩)។ បានយកមកវិញ 10 មករា 2017 ។
