នៅពាក់កណ្តាលទីមួយនៃសតវត្សទី 19 អ្នកគីមីវិទ្យាជាច្រើន ហើយក្នុងចំណោមពួកគេ ជាចម្បង J. von Liebig បានសន្និដ្ឋានជាបណ្តើរៗថា ប្រូតេអ៊ីនគឺជាថ្នាក់ពិសេសនៃសមាសធាតុអាសូត។ ឈ្មោះ "ប្រូតេអ៊ីន" (ពីភាសាក្រិក។
ប្រូតូស- ទីមួយ) ត្រូវបានស្នើឡើងនៅឆ្នាំ 1840 ដោយអ្នកគីមីវិទ្យាជនជាតិហូឡង់ G. Mulder ។ លក្ខណៈសម្បត្តិរូបវន្ត ប្រូតេអ៊ីនមានពណ៌សក្នុងសភាពរឹង ប៉ុន្តែគ្មានពណ៌នៅក្នុងសូលុយស្យុង លុះត្រាតែពួកវាផ្ទុកក្រុមក្រូម៉ូសូម (ពណ៌) ដូចជាអេម៉ូក្លូប៊ីន។ ភាពរលាយក្នុងទឹកនៃប្រូតេអ៊ីនផ្សេងៗគ្នាប្រែប្រួលយ៉ាងខ្លាំង។ វាក៏ប្រែប្រួលជាមួយនឹង pH និងជាមួយនឹងការប្រមូលផ្តុំអំបិលនៅក្នុងដំណោះស្រាយ ដូច្នេះមនុស្សម្នាក់អាចជ្រើសរើសលក្ខខណ្ឌដែលប្រូតេអ៊ីនមួយនឹងជ្រើសរើស precipitate នៅក្នុងវត្តមាននៃប្រូតេអ៊ីនផ្សេងទៀត។ វិធីសាស្រ្ត "អំបិលចេញ" នេះត្រូវបានគេប្រើយ៉ាងទូលំទូលាយដើម្បីញែក និងបន្សុទ្ធប្រូតេអ៊ីន។ ប្រូតេអ៊ីនដែលបានបន្សុតច្រើនតែហូរចេញពីដំណោះស្រាយជាគ្រីស្តាល់។នៅក្នុងការប្រៀបធៀបជាមួយនឹងសមាសធាតុផ្សេងទៀតទម្ងន់ម៉ូលេគុលនៃប្រូតេអ៊ីនគឺធំណាស់ - ពីជាច្រើនពាន់ទៅជាច្រើនលាននៃ daltons ។ ដូច្នេះក្នុងអំឡុងពេល ultracentrifugation ប្រូតេអ៊ីនត្រូវបាន precipitated ហើយលើសពីនេះទៅទៀតក្នុងអត្រាផ្សេងគ្នា។ ដោយសារតែវត្តមានក្រុមវិជ្ជមាន និងអវិជ្ជមាននៅក្នុងម៉ូលេគុលប្រូតេអ៊ីន ពួកវាផ្លាស់ទីក្នុងល្បឿនខុសៗគ្នានៅក្នុងវាលអគ្គិសនី។ នេះគឺជាមូលដ្ឋាននៃ electrophoresis ដែលជាវិធីសាស្រ្តមួយដែលត្រូវបានប្រើដើម្បីញែកប្រូតេអ៊ីនបុគ្គលចេញពីល្បាយស្មុគស្មាញ។ ការបន្សុតប្រូតេអ៊ីនក៏ត្រូវបានអនុវត្តដោយ chromatography ។
ទ្រព្យសម្បត្តិគីមី រចនាសម្ព័ន្ធ។ ប្រូតេអ៊ីនគឺជាប៉ូលីមែរ, i.e. ម៉ូលេគុលដែលបានបង្កើតឡើងដូចជាខ្សែសង្វាក់ពីឯកតា monomeric ដដែលៗ ឬអនុunits តួនាទីដែលពួកគេលេង ក - អាស៊ីតអាមីណូ។ រូបមន្តទូទៅនៃអាស៊ីតអាមីណូដែលជាកន្លែងដែល R - អាតូមអ៊ីដ្រូសែន ឬក្រុមសរីរាង្គមួយចំនួន។ម៉ូលេគុលប្រូតេអ៊ីន (ខ្សែសង្វាក់ polypeptide) អាចមានអាស៊ីដអាមីណូមួយចំនួនតូច ឬច្រើនពាន់ឯកតា monomer ។ ការភ្ជាប់អាស៊ីតអាមីណូនៅក្នុងខ្សែសង្វាក់គឺអាចធ្វើទៅបានពីព្រោះពួកវានីមួយៗមានក្រុមគីមីពីរផ្សេងគ្នា៖ ក្រុមអាមីណូដែលមានលក្ខណៈសម្បត្តិជាមូលដ្ឋាន។
NH2 និងក្រុម carboxyl អាស៊ីត COOH ។ ក្រុមទាំងពីរនេះមានទំនាក់ទំនងជាមួយ ក - អាតូមកាបូន។ ក្រុម carboxyl នៃអាស៊ីតអាមីណូមួយអាចបង្កើតចំណងអាមីដ (peptide) ជាមួយក្រុមអាមីណូនៃអាស៊ីតអាមីណូមួយទៀត៖ បន្ទាប់ពីអាស៊ីតអាមីណូពីរត្រូវបានតភ្ជាប់តាមរបៀបនេះ ខ្សែសង្វាក់អាចត្រូវបានពង្រីកដោយបន្ថែមមួយភាគបីទៅអាស៊ីតអាមីណូទីពីរ ហើយដូច្នេះនៅលើ។ ដូចដែលអាចមើលឃើញពីសមីការខាងលើ នៅពេលដែលចំណង peptide ត្រូវបានបង្កើតឡើង ម៉ូលេគុលទឹកត្រូវបានបញ្ចេញ។ នៅក្នុងវត្តមាននៃអាស៊ីតអាល់កាឡាំងឬអង់ស៊ីម proteolytic ប្រតិកម្មកើតឡើងក្នុងទិសដៅផ្ទុយ: ខ្សែសង្វាក់ polypeptide ត្រូវបានបំបែកទៅជាអាស៊ីតអាមីណូជាមួយនឹងការបន្ថែមទឹក។ ប្រតិកម្មនេះត្រូវបានគេហៅថា hydrolysis ។ Hydrolysis ដំណើរការដោយឯកឯង ហើយថាមពលត្រូវបានទាមទារដើម្បីបញ្ចូលគ្នានូវអាស៊ីតអាមីណូចូលទៅក្នុងខ្សែសង្វាក់ polypeptide ។
បន្ទាប់ពីអាស៊ីតអាមីណូពីរត្រូវបានតភ្ជាប់តាមរបៀបនេះ ខ្សែសង្វាក់អាចត្រូវបានពង្រីកដោយបន្ថែមមួយភាគបីទៅអាស៊ីតអាមីណូទីពីរ ហើយដូច្នេះនៅលើ។ ដូចដែលអាចមើលឃើញពីសមីការខាងលើ នៅពេលដែលចំណង peptide ត្រូវបានបង្កើតឡើង ម៉ូលេគុលទឹកត្រូវបានបញ្ចេញ។ នៅក្នុងវត្តមាននៃអាស៊ីតអាល់កាឡាំងឬអង់ស៊ីម proteolytic ប្រតិកម្មកើតឡើងក្នុងទិសដៅផ្ទុយ: ខ្សែសង្វាក់ polypeptide ត្រូវបានបំបែកទៅជាអាស៊ីតអាមីណូជាមួយនឹងការបន្ថែមទឹក។ ប្រតិកម្មនេះត្រូវបានគេហៅថា hydrolysis ។ Hydrolysis ដំណើរការដោយឯកឯង ហើយថាមពលត្រូវបានទាមទារដើម្បីបញ្ចូលគ្នានូវអាស៊ីតអាមីណូចូលទៅក្នុងខ្សែសង្វាក់ polypeptide ។ ក្រុម carboxyl និងក្រុម amide (ឬក្រុម imide ស្រដៀងនឹងវា - ក្នុងករណីអាស៊ីតអាមីណូប្រូលីន) មាននៅក្នុងអាស៊ីតអាមីណូទាំងអស់ខណៈពេលដែលភាពខុសគ្នារវាងអាស៊ីតអាមីណូត្រូវបានកំណត់ដោយធម្មជាតិនៃក្រុមនោះឬ "ចំហៀង ខ្សែសង្វាក់” ដែលត្រូវបានចង្អុលបង្ហាញខាងលើដោយអក្សរ
រ . តួនាទីនៃខ្សែសង្វាក់ចំហៀងអាចត្រូវបានលេងដោយអាតូមអ៊ីដ្រូសែនមួយ ដូចជានៅក្នុងអាស៊ីតអាមីណូ glycine ឬដោយក្រុមសំពីងសំពោងមួយចំនួន ដូចជានៅក្នុង histidine និង tryptophan ។ ខ្សែសង្វាក់ចំហៀងខ្លះមានភាពអសកម្មគីមី ខណៈពេលដែលខ្សែសង្វាក់ផ្សេងទៀតមានប្រតិកម្មខ្លាំង។អាស៊ីដអាមីណូផ្សេងៗគ្នាជាច្រើនពាន់អាចត្រូវបានសំយោគ ហើយអាស៊ីតអាមីណូផ្សេងៗគ្នាជាច្រើនកើតឡើងនៅក្នុងធម្មជាតិ ប៉ុន្តែមានតែអាស៊ីដអាមីណូចំនួន 20 ប្រភេទប៉ុណ្ណោះដែលត្រូវបានប្រើប្រាស់សម្រាប់ការសំយោគប្រូតេអ៊ីន៖ អាឡានីន អាហ្គីនីន អាស្ប៉ារ៉ាជីន អាស៊ីត aspartic វ៉ាលីន អ៊ីស្ទីឌីន គ្លីស៊ីន គ្លូតាមីន អាស៊ីត, isoleucine, leucine, lysine, methionine, proline, serine, tyrosine, threonine, tryptophan, phenylalanine, និង cysteine (នៅក្នុងប្រូតេអ៊ីន cysteine អាចមានវត្តមានជា dimer
cystine) ។ ពិត មានអាស៊ីតអាមីណូផ្សេងទៀតនៅក្នុងប្រូតេអ៊ីនមួយចំនួន បន្ថែមពីលើសារធាតុដែលកើតឡើងជាទៀងទាត់ចំនួនម្ភៃ ប៉ុន្តែពួកវាត្រូវបានបង្កើតឡើងជាលទ្ធផលនៃការកែប្រែណាមួយក្នុងចំណោម 20 ដែលបានរាយបញ្ជីបន្ទាប់ពីវាត្រូវបានបញ្ចូលទៅក្នុងប្រូតេអ៊ីន។សកម្មភាពអុបទិក។ អាស៊ីតអាមីណូទាំងអស់លើកលែងតែ glycine ។ ក អាតូមកាបូនមានក្រុមបួនផ្សេងគ្នាភ្ជាប់។ នៅក្នុងលក្ខខណ្ឌនៃធរណីមាត្រ ក្រុមបួនផ្សេងគ្នាអាចត្រូវបានភ្ជាប់តាមពីរវិធី ហើយស្របគ្នានោះមានការកំណត់រចនាសម្ព័ន្ធដែលអាចមានពីរ ឬ isomers ពីរដែលទាក់ទងគ្នាទៅវិញទៅមកជាវត្ថុទៅនឹងរូបភាពកញ្ចក់របស់វា i.e. ដូចជាដៃឆ្វេងទៅស្តាំ។ ការកំណត់រចនាសម្ព័ន្ធមួយត្រូវបានគេហៅថាខាងឆ្វេង ឬដៃឆ្វេង (អិល ) និងមួយទៀត - ស្តាំ ឬ dextrorotatory (ឃ ) ចាប់តាំងពីអ៊ីសូមឺរពីរបែបនេះខុសគ្នាក្នុងទិសដៅនៃការបង្វិលយន្តហោះនៃពន្លឺប៉ូល។ រកឃើញតែនៅក្នុងប្រូតេអ៊ីនអិល អាស៊ីតអាមីណូ (ករណីលើកលែងគឺ glycine វាអាចត្រូវបានតំណាងតែក្នុងទម្រង់មួយចាប់តាំងពីក្រុមពីរក្នុងចំណោមបួនក្រុមរបស់វាដូចគ្នា) ហើយពួកវាទាំងអស់មានសកម្មភាពអុបទិក (ចាប់តាំងពីមានអ៊ីសូមឺរតែមួយ) ។ឃ អាស៊ីតអាមីណូគឺកម្រមាននៅក្នុងធម្មជាតិ; ពួកវាត្រូវបានរកឃើញនៅក្នុងថ្នាំអង់ទីប៊ីយោទិចមួយចំនួន និងជញ្ជាំងកោសិកានៃបាក់តេរី។លំដាប់នៃអាស៊ីតអាមីណូ។ អាស៊ីតអាមីណូនៅក្នុងខ្សែសង្វាក់ polypeptide មិនត្រូវបានរៀបចំដោយចៃដន្យនោះទេប៉ុន្តែនៅក្នុងលំដាប់ថេរជាក់លាក់មួយហើយវាគឺជាលំដាប់នេះដែលកំណត់មុខងារនិងលក្ខណៈសម្បត្តិនៃប្រូតេអ៊ីន។ ដោយការផ្លាស់ប្តូរលំដាប់នៃអាស៊ីដអាមីណូទាំង 20 ប្រភេទ អ្នកអាចទទួលបានប្រូតេអ៊ីនផ្សេងៗគ្នាជាច្រើន ដូចជាអ្នកអាចបង្កើតអត្ថបទផ្សេងៗគ្នាជាច្រើនពីអក្សរនៃអក្ខរក្រម។កាលពីមុន ការកំណត់លំដាប់អាស៊ីតអាមីណូនៃប្រូតេអ៊ីន ច្រើនតែចំណាយពេលច្រើនឆ្នាំ។ ការកំណត់ដោយផ្ទាល់នៅតែជាកិច្ចការដ៏លំបាកមួយ ទោះបីជាឧបករណ៍ត្រូវបានបង្កើតឡើងដែលអនុញ្ញាតឱ្យវាត្រូវបានអនុវត្តដោយស្វ័យប្រវត្តិក៏ដោយ។ ជាធម្មតាវាងាយស្រួលក្នុងការកំណត់លំដាប់នុយក្លេអូទីតនៃហ្សែនដែលត្រូវគ្នា និងទទួលបានលំដាប់អាស៊ីតអាមីណូនៃប្រូតេអ៊ីនពីវា។ រហូតមកដល់បច្ចុប្បន្ន លំដាប់អាស៊ីតអាមីណូនៃប្រូតេអ៊ីនរាប់រយត្រូវបានគេកំណត់រួចហើយ។ មុខងារនៃប្រូតេអ៊ីនដែលបានឌិកូដត្រូវបានគេស្គាល់ជាធម្មតា ហើយនេះជួយឱ្យស្រមៃមើលមុខងារដែលអាចកើតមាននៃប្រូតេអ៊ីនស្រដៀងគ្នាដែលបានបង្កើតឡើង ឧទាហរណ៍នៅក្នុង neoplasms សាហាវ។
ប្រូតេអ៊ីនស្មុគស្មាញ។ ប្រូតេអ៊ីនដែលមានតែអាស៊ីតអាមីណូត្រូវបានគេហៅថាសាមញ្ញ។ ទោះជាយ៉ាងណាក៏ដោយ ជាញឹកញយ អាតូមដែក ឬសមាសធាតុគីមីមួយចំនួនដែលមិនមែនជាអាស៊ីតអាមីណូត្រូវបានភ្ជាប់ទៅខ្សែសង្វាក់ polypeptide ។ ប្រូតេអ៊ីនបែបនេះត្រូវបានគេហៅថាស្មុគស្មាញ។ ឧទាហរណ៍មួយគឺអេម៉ូក្លូប៊ីន៖ វាមានជាតិដែក porphyrin ដែលផ្តល់ឱ្យវានូវពណ៌ក្រហម និងអនុញ្ញាតឱ្យវាដើរតួជាអ្នកដឹកជញ្ជូនអុកស៊ីហ្សែន។ឈ្មោះនៃប្រូតេអ៊ីនស្មុគស្មាញបំផុតមានការបង្ហាញពីលក្ខណៈនៃក្រុមដែលភ្ជាប់មកជាមួយ៖ ស្ករមានក្នុង glycoproteins ខ្លាញ់ក្នុង lipoproteins។ ប្រសិនបើសកម្មភាពកាតាលីករនៃអង់ស៊ីមអាស្រ័យលើក្រុមដែលបានភ្ជាប់នោះវាត្រូវបានគេហៅថាក្រុមសិប្បនិម្មិត។ ជារឿយៗ វីតាមីនខ្លះដើរតួជាក្រុមសិប្បនិម្មិត ឬជាផ្នែកមួយនៃវា។ ជាឧទាហរណ៍ វីតាមីន A ភ្ជាប់ទៅនឹងប្រូតេអ៊ីនមួយនៃរីទីណា កំណត់ភាពប្រែប្រួលរបស់វាចំពោះពន្លឺ។
រចនាសម្ព័ន្ធទីបី។ អ្វីដែលសំខាន់គឺមិនច្រើនទេ លំដាប់អាស៊ីតអាមីណូនៃប្រូតេអ៊ីន (រចនាសម្ព័ន្ធបឋម) ប៉ុន្តែរបៀបដែលវាត្រូវបានដាក់ក្នុងលំហ។ នៅតាមបណ្តោយប្រវែងទាំងមូលនៃខ្សែសង្វាក់ polypeptide អ៊ីយ៉ុងអ៊ីដ្រូសែនបង្កើតជាចំណងអ៊ីដ្រូសែនធម្មតា ដែលផ្តល់ឱ្យវានូវរូបរាងនៃវង់ ឬស្រទាប់ (រចនាសម្ព័ន្ធបន្ទាប់បន្សំ)។ ពីការរួមបញ្ចូលគ្នានៃ helices និងស្រទាប់បែបនេះទម្រង់បង្រួមនៃលំដាប់បន្ទាប់កើតឡើង - រចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីន។ នៅជុំវិញចំណងដែលផ្ទុកតំណភ្ជាប់ monomeric នៃខ្សែសង្វាក់ ការបង្វិលតាមមុំតូចអាចធ្វើទៅបាន។ ដូច្នេះតាមទស្សនៈធរណីមាត្រសុទ្ធសាធ ចំនួននៃការកំណត់ដែលអាចកើតមានសម្រាប់ខ្សែសង្វាក់ polypeptide ណាមួយគឺមានទំហំធំគ្មានកំណត់។ តាមការពិត ប្រូតេអ៊ីននីមួយៗជាធម្មតាមាននៅក្នុងការកំណត់រចនាសម្ព័ន្ធតែមួយ ដែលកំណត់ដោយលំដាប់អាស៊ីតអាមីណូរបស់វា។ រចនាសម្ព័ន្ធនេះមិនរឹងមាំដូចជា « ដកដង្ហើម” - ញ័រជុំវិញការកំណត់មធ្យមជាក់លាក់មួយ។ ខ្សែសង្វាក់ត្រូវបានបត់ចូលទៅក្នុងការកំណត់រចនាសម្ព័ន្ធដែលថាមពលទំនេរ (សមត្ថភាពក្នុងការធ្វើការងារ) មានតិចតួច ដូចគ្នានឹងនិទាឃរដូវដែលបានបញ្ចេញត្រូវបានបង្ហាប់ទៅរដ្ឋដែលត្រូវនឹងអប្បបរមានៃថាមពលឥតគិតថ្លៃ។ ជាញឹកញាប់ផ្នែកមួយនៃខ្សែសង្វាក់ត្រូវបានភ្ជាប់យ៉ាងតឹងរឹងទៅនឹង disulfide មួយផ្សេងទៀត (-ស-ស-) ចំណងរវាងសំណល់ cysteine ពីរ។ នេះជាមូលហេតុមួយផ្នែកដែល cysteine ក្នុងចំនោមអាស៊ីតអាមីណូដើរតួយ៉ាងសំខាន់។ភាពស្មុគស្មាញនៃរចនាសម្ព័ន្ធប្រូតេអ៊ីនគឺអស្ចារ្យណាស់ដែលវាមិនទាន់អាចគណនារចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីនបានទេ ទោះបីជាលំដាប់អាស៊ីតអាមីណូរបស់វាត្រូវបានគេស្គាល់ក៏ដោយ។ ប៉ុន្តែប្រសិនបើអាចទទួលបានគ្រីស្តាល់ប្រូតេអ៊ីន នោះរចនាសម្ព័ន្ធទីបីរបស់វាអាចត្រូវបានកំណត់ដោយការបំភាយកាំរស្មីអ៊ិច។
នៅក្នុងរចនាសម្ព័ន្ធ, contractile, និងប្រូតេអ៊ីនមួយចំនួនផ្សេងទៀត, ច្រវាក់ត្រូវបានពន្លូតនិងច្រវាក់បត់បន្តិចមួយចំនួនដេកនៅចំហៀងបង្កើត fibrils; fibrils, នៅក្នុងវេន, បត់ចូលទៅក្នុងទ្រង់ទ្រាយធំ - សរសៃ។ ទោះជាយ៉ាងណាក៏ដោយ ប្រូតេអ៊ីនភាគច្រើននៅក្នុងសូលុយស្យុងគឺមានរាងជារង្វង់៖ ច្រវាក់ត្រូវបានរុំជារាងមូល ដូចជាអំបោះនៅក្នុងបាល់។ ថាមពលឥតគិតថ្លៃនៅក្នុងការកំណត់នេះគឺមានតិចតួច ដោយសារអាស៊ីតអាមីណូ hydrophobic ("ជ្រាបទឹក") ត្រូវបានលាក់នៅខាងក្នុងពិភពលោក ខណៈដែលអាស៊ីតអាមីណូ hydrophilic ("ទាក់ទាញទឹក") ស្ថិតនៅលើផ្ទៃរបស់វា។
ប្រូតេអ៊ីនជាច្រើនគឺជាស្មុគស្មាញនៃខ្សែសង្វាក់ polypeptide ជាច្រើន។ រចនាសម្ព័ន្ធនេះត្រូវបានគេហៅថារចនាសម្ព័ន្ធ quaternary នៃប្រូតេអ៊ីន។ ជាឧទាហរណ៍ ម៉ូលេគុលអេម៉ូក្លូប៊ីនត្រូវបានបង្កើតឡើងដោយផ្នែករងចំនួន 4 ដែលនីមួយៗជាប្រូតេអ៊ីន globular ។
ប្រូតេអ៊ីនតាមរចនាសម្ព័ន្ធ ដោយសារការកំណត់រចនាសម្ព័ន្ធលីនេអ៊ែរ បង្កើតជាសរសៃដែលកម្លាំង tensile ខ្ពស់ណាស់ ខណៈពេលដែលការកំណត់រចនាសម្ព័ន្ធ globular អនុញ្ញាតឱ្យប្រូតេអ៊ីនចូលទៅក្នុងអន្តរកម្មជាក់លាក់ជាមួយសមាសធាតុផ្សេងទៀត។ នៅលើផ្ទៃនៃ globule ជាមួយនឹងការដាក់ត្រឹមត្រូវនៃច្រវាក់ បែហោងធ្មែញនៃរូបរាងជាក់លាក់មួយលេចឡើង ដែលក្នុងនោះក្រុមគីមីប្រតិកម្មមានទីតាំងនៅ។ ប្រសិនបើប្រូតេអ៊ីននេះគឺជាអង់ស៊ីមមួយ នោះម៉ូលេគុលនៃសារធាតុមួយចំនួនដែលជាធម្មតាតូចជាងនេះចូលទៅក្នុងបែហោងធ្មែញ ដូចជាសោមួយចូលទៅក្នុងសោ។ ក្នុងករណីនេះ ការកំណត់រចនាសម្ព័ន្ធនៃពពកអេឡិចត្រុងនៃម៉ូលេគុលបានផ្លាស់ប្តូរនៅក្រោមឥទ្ធិពលនៃក្រុមគីមីដែលមានទីតាំងនៅក្នុងបែហោងធ្មែញ ហើយនេះបង្ខំឱ្យវាមានប្រតិកម្មតាមរបៀបជាក់លាក់មួយ។ តាមរបៀបនេះ អង់ស៊ីមបំប្លែងប្រតិកម្ម។ ម៉ូលេគុលអង់ទីគ័រក៏មានប្រហោងដែលសារធាតុបរទេសជាច្រើនចង ហើយត្រូវបានធ្វើឱ្យគ្មានគ្រោះថ្នាក់។ គំរូ "គន្លឹះ និងសោ" ដែលពន្យល់ពីអន្តរកម្មនៃប្រូតេអ៊ីនជាមួយសមាសធាតុផ្សេងទៀត ធ្វើឱ្យវាអាចយល់បានអំពីភាពជាក់លាក់នៃអង់ស៊ីម និងអង្គបដិបក្ខ i.e. សមត្ថភាពរបស់ពួកគេក្នុងប្រតិកម្មបានតែជាមួយសមាសធាតុជាក់លាក់។
ប្រូតេអ៊ីននៅក្នុងប្រភេទផ្សេងៗនៃសារពាង្គកាយ។ ប្រូតេអ៊ីនដែលអនុវត្តមុខងារដូចគ្នានៅក្នុងប្រភេទរុក្ខជាតិ និងសត្វផ្សេងៗគ្នា ហើយដូច្នេះមានឈ្មោះដូចគ្នាក៏មានការកំណត់ស្រដៀងគ្នាដែរ។ ទោះជាយ៉ាងណាក៏ដោយ ពួកវាមានភាពខុសគ្នាខ្លះនៅក្នុងលំដាប់អាស៊ីតអាមីណូរបស់ពួកគេ។ ដោយសារប្រភេទសត្វខុសគ្នាពីបុព្វបុរសធម្មតា អាស៊ីតអាមីណូមួយចំនួននៅក្នុងមុខតំណែងជាក់លាក់ត្រូវបានជំនួសដោយការផ្លាស់ប្តូរជាមួយអ្នកដទៃ។ បំរែបំរួលដែលបង្កគ្រោះថ្នាក់ដែលបង្កឱ្យមានជំងឺតំណពូជត្រូវបានបោះបង់ចោលដោយការជ្រើសរើសធម្មជាតិ ប៉ុន្តែអត្ថប្រយោជន៍ ឬយ៉ាងហោចណាស់អព្យាក្រឹតអាចត្រូវបានរក្សាទុក។ ប្រភេទជីវសាស្រ្តពីរដែលនៅជិតគ្នាទៅវិញទៅមក ភាពខុសគ្នាតិចត្រូវបានរកឃើញនៅក្នុងប្រូតេអ៊ីនរបស់វា។ប្រូតេអ៊ីនខ្លះផ្លាស់ប្តូរយ៉ាងឆាប់រហ័ស ខ្លះទៀតមានលក្ខណៈអភិរក្ស។ ក្រោយមកទៀតរួមមានឧទាហរណ៍ cytochrome ជាមួយ- អង់ស៊ីមផ្លូវដង្ហើមដែលមាននៅក្នុងភាវៈរស់ភាគច្រើន។ នៅក្នុងមនុស្ស និងសត្វស្វា លំដាប់អាស៊ីតអាមីណូរបស់វាគឺដូចគ្នាបេះបិទ ហើយនៅក្នុង cytochrome ជាមួយស្រូវសាលីមានតែ 38% នៃអាស៊ីតអាមីណូប្រែទៅជាខុសគ្នា។ សូម្បីតែការប្រៀបធៀបមនុស្ស និងបាក់តេរី ភាពស្រដៀងគ្នានៃ cytochromes ជាមួយ(ភាពខុសគ្នាប៉ះពាល់ដល់ 65% នៃអាស៊ីតអាមីណូនៅទីនេះ) នៅតែអាចមើលឃើញ ទោះបីជាបុព្វបុរសទូទៅនៃបាក់តេរី និងមនុស្សបានរស់នៅលើផែនដីប្រហែលពីរពាន់លានឆ្នាំមុនក៏ដោយ។ សព្វថ្ងៃនេះការប្រៀបធៀបនៃលំដាប់អាស៊ីតអាមីណូត្រូវបានគេប្រើជាញឹកញាប់ដើម្បីបង្កើតមែកធាង phylogenetic (ហ្សែន) ដែលឆ្លុះបញ្ចាំងពីទំនាក់ទំនងវិវត្តន៍រវាងសារពាង្គកាយផ្សេងៗគ្នា។
ការប្រែពណ៌។ ម៉ូលេគុលប្រូតេអ៊ីនសំយោគ, បត់, ទទួលបានការកំណត់ផ្ទាល់ខ្លួនរបស់វា។ ទោះជាយ៉ាងណាក៏ដោយ ការកំណត់រចនាសម្ព័ន្ធនេះអាចត្រូវបានបំផ្លាញដោយការឡើងកំដៅ ដោយការផ្លាស់ប្តូរ pH ដោយសកម្មភាពនៃសារធាតុរំលាយសរីរាង្គ និងសូម្បីតែដោយគ្រាន់តែធ្វើឱ្យសូលុយស្យុងរំជើបរំជួលរហូតដល់ពពុះលេចឡើងនៅលើផ្ទៃរបស់វា។ ប្រូតេអ៊ីនដែលផ្លាស់ប្តូរតាមរបៀបនេះត្រូវបានគេហៅថា denatured; វាបាត់បង់សកម្មភាពជីវសាស្រ្តរបស់វា ហើយជាធម្មតាក្លាយទៅជាមិនរលាយ។ ឧទាហរណ៍ដ៏ល្បីនៃប្រូតេអ៊ីន denatured គឺស៊ុតឆ្អិន ឬ whipped cream ។ ប្រូតេអ៊ីនតូចៗដែលមានអាស៊ីដអាមីណូប្រហែលមួយរយអាចបង្កើតឡើងវិញបាន ពោលគឺឧ។ ទទួលបានការកំណត់រចនាសម្ព័ន្ធដើមឡើងវិញ។ ប៉ុន្តែប្រូតេអ៊ីនភាគច្រើនត្រូវបានបំប្លែងទៅជាខ្សែសង្វាក់ polypeptide ដ៏ច្របូកច្របល់ ហើយមិនស្តារការកំណត់ពីមុនរបស់វាឡើងវិញទេ។ការលំបាកចម្បងមួយក្នុងការបែងចែកប្រូតេអ៊ីនសកម្មគឺភាពរសើបខ្លាំងរបស់ពួកគេចំពោះការប្រែពណ៌។ ទ្រព្យសម្បត្តិនៃប្រូតេអ៊ីននេះរកឃើញនូវកម្មវិធីមានប្រយោជន៍ក្នុងការរក្សាទុកផលិតផលអាហារ៖ សីតុណ្ហភាពខ្ពស់ធ្វើឱ្យអង់ស៊ីមរបស់មីក្រូសរីរាង្គមិនប្រែប្រួល ហើយអតិសុខុមប្រាណស្លាប់។
សំយោគប្រូតេអ៊ីន សម្រាប់ការសំយោគប្រូតេអ៊ីន សារពាង្គកាយមានជីវិតត្រូវតែមានប្រព័ន្ធអង់ស៊ីមដែលមានសមត្ថភាពភ្ជាប់អាស៊ីតអាមីណូមួយទៅមួយទៀត។ ប្រភពនៃព័ត៌មានក៏ត្រូវការផងដែរ ដែលនឹងកំណត់ថាតើអាស៊ីតអាមីណូមួយណាគួរត្រូវបានភ្ជាប់។ ដោយសារមានប្រូតេអ៊ីនរាប់ពាន់ប្រភេទនៅក្នុងខ្លួន ហើយពួកវានីមួយៗមានអាស៊ីដអាមីណូជាមធ្យមរាប់រយ នោះព័ត៌មានដែលត្រូវការគឺពិតជាធំសម្បើមណាស់។ វាត្រូវបានរក្សាទុក (ស្រដៀងទៅនឹងរបៀបដែលកំណត់ត្រាត្រូវបានរក្សាទុកនៅលើកាសែតម៉ាញ៉េទិច) នៅក្នុងម៉ូលេគុលអាស៊ីតនុយក្លេអ៊ីកដែលបង្កើតហ្សែន។ សង់ទីម៉ែត . HEREDITY ផងដែរ; អាស៊ីត NUCLEIC ។ការធ្វើឱ្យអង់ស៊ីមសកម្ម។ ខ្សែសង្វាក់ polypeptide ដែលសំយោគពីអាស៊ីតអាមីណូមិនតែងតែជាប្រូតេអ៊ីននៅក្នុងទម្រង់ចុងក្រោយរបស់វានោះទេ។ អង់ស៊ីមជាច្រើនត្រូវបានសំយោគជាលើកដំបូងថាជាបុព្វកថាអសកម្ម ហើយក្លាយជាសកម្មតែបន្ទាប់ពីអង់ស៊ីមមួយផ្សេងទៀតដកអាស៊ីដអាមីណូមួយចំនួនចេញពីចុងម្ខាងនៃសង្វាក់។ អង់ស៊ីមរំលាយអាហារមួយចំនួនដូចជា trypsin ត្រូវបានសំយោគក្នុងទម្រង់អសកម្មនេះ; អង់ស៊ីមទាំងនេះត្រូវបានធ្វើឱ្យសកម្មនៅក្នុងបំពង់រំលាយអាហារ ជាលទ្ធផលនៃការយកចេញនៃបំណែកស្ថានីយនៃខ្សែសង្វាក់។ អរម៉ូនអាំងស៊ុយលីនដែលម៉ូលេគុលក្នុងទម្រង់សកម្មរបស់វាមានខ្សែសង្វាក់ខ្លីពីរត្រូវបានសំយោគក្នុងទម្រង់ជាខ្សែសង្វាក់តែមួយដែលហៅថា។ ប្រូស៊ុលលីន។ បន្ទាប់មកផ្នែកកណ្តាលនៃខ្សែសង្វាក់នេះត្រូវបានយកចេញ ហើយបំណែកដែលនៅសេសសល់ចងភ្ជាប់គ្នាទៅវិញទៅមក បង្កើតបានជាម៉ូលេគុលអរម៉ូនសកម្ម។ ប្រូតេអ៊ីនស្មុគស្មាញត្រូវបានបង្កើតឡើងតែបន្ទាប់ពីក្រុមគីមីជាក់លាក់មួយត្រូវបានភ្ជាប់ទៅនឹងប្រូតេអ៊ីន ហើយការភ្ជាប់នេះច្រើនតែត្រូវការអង់ស៊ីមផងដែរ។ឈាមរត់មេតាប៉ូលីស។ បន្ទាប់ពីការផ្តល់អាហារដល់សត្វជាមួយនឹងអាស៊ីតអាមីណូដែលមានស្លាកអ៊ីសូតូបវិទ្យុសកម្មនៃកាបូន អាសូត ឬអ៊ីដ្រូសែន ស្លាកត្រូវបានបញ្ចូលទៅក្នុងប្រូតេអ៊ីនរបស់វាយ៉ាងឆាប់រហ័ស។ ប្រសិនបើអាស៊ីតអាមីណូដែលមានស្លាកសញ្ញាឈប់ចូលទៅក្នុងខ្លួន នោះបរិមាណនៃស្លាកនៅក្នុងប្រូតេអ៊ីនចាប់ផ្តើមថយចុះ។ ការពិសោធន៍ទាំងនេះបង្ហាញថាប្រូតេអ៊ីនលទ្ធផលមិនត្រូវបានរក្សាទុកនៅក្នុងខ្លួនរហូតដល់ចុងបញ្ចប់នៃជីវិត។ ពួកវាទាំងអស់ដោយមានករណីលើកលែងមួយចំនួនស្ថិតក្នុងស្ថានភាពថាមវន្ត រលួយឥតឈប់ឈរទៅជាអាស៊ីតអាមីណូ ហើយបន្ទាប់មកសំយោគឡើងវិញ។ប្រូតេអ៊ីនខ្លះបំបែកនៅពេលដែលកោសិកាស្លាប់ និងត្រូវបានបំផ្លាញ។ រឿងនេះកើតឡើងគ្រប់ពេលវេលា ជាឧទាហរណ៍ ជាមួយនឹងកោសិកាឈាមក្រហម និងកោសិកា epithelial ស្រទាប់ខាងក្នុងនៃពោះវៀន។ លើសពីនេះ ការបំបែក និងសំយោគឡើងវិញនៃប្រូតេអ៊ីនក៏កើតមាននៅក្នុងកោសិការស់នៅផងដែរ។ ចម្លែកគ្រប់គ្រាន់ មិនសូវត្រូវបានគេដឹងអំពីការបំបែកប្រូតេអ៊ីនជាជាងការសំយោគរបស់វា។ ទោះជាយ៉ាងណាក៏ដោយ អ្វីដែលច្បាស់នោះគឺថា អង់ស៊ីម proteolytic ពាក់ព័ន្ធនឹងការបំបែក ស្រដៀងទៅនឹងសារធាតុដែលបំបែកប្រូតេអ៊ីនទៅជាអាស៊ីតអាមីណូនៅក្នុងបំពង់រំលាយអាហារ។
ពាក់កណ្តាលជីវិតនៃប្រូតេអ៊ីនផ្សេងៗគ្នាគឺខុសគ្នា - ពីច្រើនម៉ោងទៅច្រើនខែ។ ករណីលើកលែងតែមួយគត់គឺម៉ូលេគុលកូឡាជែន។ នៅពេលដែលបង្កើតឡើង ពួកវានៅតែមានស្ថេរភាព ហើយមិនត្រូវបានបន្ត ឬជំនួសឡើយ។ ទោះជាយ៉ាងណាក៏ដោយ យូរៗទៅ លក្ខណៈសម្បត្តិមួយចំនួនរបស់ពួកគេ ជាពិសេសការបត់បែន ការផ្លាស់ប្តូរ ហើយចាប់តាំងពីពួកវាមិនត្រូវបានបន្ត ការផ្លាស់ប្តូរទាក់ទងនឹងអាយុមួយចំនួន ដូចជារូបរាងនៃស្នាមជ្រួញនៅលើស្បែក គឺជាលទ្ធផលនៃបញ្ហានេះ។
ប្រូតេអ៊ីនសំយោគ។ តាំងពីយូរយារណាស់មកហើយ អ្នកគីមីវិទ្យាបានរៀនពីរបៀបធ្វើវត្ថុធាតុ polymerize អាស៊ីតអាមីណូ ប៉ុន្តែអាស៊ីតអាមីណូរួមបញ្ចូលគ្នាដោយចៃដន្យ ដូច្នេះផលិតផលនៃវត្ថុធាតុ polymerization មានលក្ខណៈស្រដៀងនឹងធម្មជាតិតិចតួច។ ពិត វាអាចទៅរួចក្នុងការផ្សំអាស៊ីតអាមីណូតាមលំដាប់លំដោយ ដែលធ្វើឱ្យវាអាចទទួលបានប្រូតេអ៊ីនសកម្មជីវសាស្រ្តមួយចំនួន ជាពិសេសអាំងស៊ុយលីន។ ដំណើរការនេះគឺមានភាពស្មុគស្មាញណាស់ ហើយតាមរបៀបនេះវាអាចទៅរួចដើម្បីទទួលបានតែប្រូតេអ៊ីនទាំងនោះដែលម៉ូលេគុលមានអាស៊ីតអាមីណូប្រហែលមួយរយ។ វាជាការប្រសើរជំនួសក្នុងការសំយោគ ឬញែកលំដាប់នុយក្លេអូទីតនៃហ្សែនមួយដែលត្រូវនឹងលំដាប់អាស៊ីតអាមីណូដែលចង់បាន ហើយបន្ទាប់មកណែនាំហ្សែននេះទៅជាបាក់តេរី ដែលនឹងផលិតដោយការចម្លងបរិមាណដ៏ច្រើននៃផលិតផលដែលចង់បាន។ ទោះជាយ៉ាងណាក៏ដោយវិធីសាស្ត្រនេះក៏មានគុណវិបត្តិរបស់វាដែរ។ សង់ទីម៉ែត . សូមមើលផងដែរ GENETIC ENGINEERING ។ ប្រូតេអ៊ីន និងអាហារូបត្ថម្ភ នៅពេលដែលប្រូតេអ៊ីននៅក្នុងខ្លួនត្រូវបានបំបែកទៅជាអាស៊ីតអាមីណូ អាស៊ីតអាមីណូទាំងនេះអាចត្រូវបានប្រើឡើងវិញសម្រាប់ការសំយោគប្រូតេអ៊ីន។ ក្នុងពេលជាមួយគ្នានេះអាស៊ីតអាមីណូខ្លួនឯងងាយនឹងពុកផុយដូច្នេះវាមិនត្រូវបានគេប្រើប្រាស់ពេញលេញទេ។ វាក៏ច្បាស់ដែរថាក្នុងអំឡុងពេលលូតលាស់ មានផ្ទៃពោះ និងការព្យាបាលមុខរបួស ការសំយោគប្រូតេអ៊ីនត្រូវតែលើសពីការរិចរិល។ រាងកាយបាត់បង់ប្រូតេអ៊ីនមួយចំនួនជាបន្តបន្ទាប់; ទាំងនេះគឺជាប្រូតេអ៊ីននៃសក់ ក្រចក និងស្រទាប់ផ្ទៃនៃស្បែក។ ដូច្នេះសម្រាប់ការសំយោគប្រូតេអ៊ីន សារពាង្គកាយនីមួយៗត្រូវតែទទួលអាស៊ីតអាមីណូពីអាហារ។ រុក្ខជាតិបៃតងត្រូវបានសំយោគពី CO 2 ទឹក និងអាម៉ូញាក់ ឬនីត្រាត គឺជាអាស៊ីតអាមីណូទាំង 20 ដែលមាននៅក្នុងប្រូតេអ៊ីន។ បាក់តេរីជាច្រើនក៏អាចសំយោគអាស៊ីតអាមីណូនៅក្នុងវត្តមាននៃជាតិស្ករ (ឬសមមូលមួយចំនួន) និងអាសូតថេរ ប៉ុន្តែស្ករត្រូវបានផ្គត់ផ្គង់ដោយរុក្ខជាតិបៃតង។ នៅក្នុងសត្វ, សមត្ថភាពក្នុងការសំយោគអាស៊ីតអាមីណូត្រូវបានកំណត់; ពួកគេទទួលបានអាស៊ីតអាមីណូដោយការបរិភោគរុក្ខជាតិបៃតង ឬសត្វដទៃទៀត។ នៅក្នុងបំពង់រំលាយអាហារ ប្រូតេអ៊ីនដែលស្រូបចូលត្រូវបានបំបែកទៅជាអាស៊ីតអាមីណូ ក្រោយមកទៀតត្រូវបានស្រូបយក ហើយប្រូតេអ៊ីនលក្ខណៈនៃសារពាង្គកាយដែលបានផ្តល់ឱ្យត្រូវបានបង្កើតឡើងពីពួកវា។ គ្មានប្រូតេអ៊ីនដែលស្រូបបញ្ចូលទៅក្នុងរចនាសម្ព័ន្ធរាងកាយដូចនោះទេ។ ករណីលើកលែងតែមួយគត់គឺថានៅក្នុងថនិកសត្វជាច្រើនផ្នែកនៃអង្គបដិប្រាណរបស់មាតាអាចឆ្លងកាត់សុកចូលទៅក្នុងចរន្តឈាមរបស់ទារកហើយតាមរយៈទឹកដោះម្តាយ (ជាពិសេសនៅក្នុងសត្វចៃ) ត្រូវបានផ្ទេរទៅទារកទើបនឹងកើតភ្លាមៗបន្ទាប់ពីកំណើត។ត្រូវការប្រូតេអ៊ីន។ វាច្បាស់ណាស់ថា ដើម្បីរក្សាជីវិត រាងកាយត្រូវតែទទួលបានបរិមាណជាក់លាក់នៃប្រូតេអ៊ីនពីអាហារ។ ទោះជាយ៉ាងណាក៏ដោយទំហំនៃតម្រូវការនេះអាស្រ័យលើកត្តាមួយចំនួន។ រាងកាយត្រូវការអាហារទាំងជាប្រភពថាមពល (កាឡូរី) និងជាសម្ភារៈសម្រាប់កសាងរចនាសម្ព័ន្ធរបស់វា។ នៅកន្លែងដំបូងគឺតម្រូវការថាមពល។ នេះមានន័យថានៅពេលដែលមានកាបូអ៊ីដ្រាត និងខ្លាញ់តិចតួចនៅក្នុងរបបអាហារ ប្រូតេអ៊ីនក្នុងរបបអាហារមិនត្រូវបានប្រើសម្រាប់ការសំយោគប្រូតេអ៊ីនផ្ទាល់របស់ពួកគេទេ ប៉ុន្តែជាប្រភពនៃកាឡូរី។ ជាមួយនឹងការតមអាហារយូរ សូម្បីតែប្រូតេអ៊ីនផ្ទាល់ខ្លួនរបស់អ្នកត្រូវបានចំណាយដើម្បីបំពេញតម្រូវការថាមពល។ ប្រសិនបើមានកាបូអ៊ីដ្រាតគ្រប់គ្រាន់នៅក្នុងរបបអាហារនោះការទទួលទានប្រូតេអ៊ីនអាចត្រូវបានកាត់បន្ថយ។តុល្យភាពអាសូត។ ជាមធ្យមប្រហែល។ 16% នៃម៉ាសប្រូតេអ៊ីនសរុបគឺអាសូត។ នៅពេលដែលអាស៊ីតអាមីណូដែលបង្កើតជាប្រូតេអ៊ីនត្រូវបានបំបែក នោះអាសូតដែលមាននៅក្នុងពួកវាត្រូវបានបញ្ចេញចេញពីរាងកាយក្នុងទឹកនោម និង (ក្នុងកម្រិតតិចជាង) នៅក្នុងលាមកក្នុងទម្រង់ជាសមាសធាតុអាសូតផ្សេងៗ។ ដូច្នេះវាជាការងាយស្រួលក្នុងការប្រើសូចនាករដូចជាតុល្យភាពអាសូតដើម្បីវាយតម្លៃគុណភាពនៃអាហាររូបត្ថម្ភប្រូតេអ៊ីន i.e. ភាពខុសគ្នា (គិតជាក្រាម) រវាងបរិមាណអាសូតដែលយកទៅក្នុងខ្លួន និងបរិមាណអាសូតដែលត្រូវបានបញ្ចេញក្នុងមួយថ្ងៃ។ ជាមួយនឹងអាហាររូបត្ថម្ភធម្មតាក្នុងមនុស្សពេញវ័យបរិមាណទាំងនេះគឺស្មើគ្នា។ នៅក្នុងសារពាង្គកាយដែលកំពុងលូតលាស់ បរិមាណអាសូតដែលត្រូវបានបញ្ចេញគឺតិចជាងបរិមាណចូល ពោលគឺឧ។ តុល្យភាពគឺវិជ្ជមាន។ ជាមួយនឹងកង្វះប្រូតេអ៊ីននៅក្នុងរបបអាហារតុល្យភាពគឺអវិជ្ជមាន។ ប្រសិនបើមានកាឡូរីគ្រប់គ្រាន់នៅក្នុងរបបអាហារប៉ុន្តែប្រូតេអ៊ីនគឺអវត្តមានទាំងស្រុងនៅក្នុងវារាងកាយនឹងរក្សាទុកប្រូតេអ៊ីន។ ទន្ទឹមនឹងនេះ ការរំលាយអាហារប្រូតេអ៊ីនថយចុះ ហើយការប្រើប្រាស់ឡើងវិញនៃអាស៊ីតអាមីណូក្នុងការសំយោគប្រូតេអ៊ីនដំណើរការប្រកបដោយប្រសិទ្ធភាពតាមដែលអាចធ្វើទៅបាន។ ទោះជាយ៉ាងណាក៏ដោយ ការបាត់បង់គឺជៀសមិនរួច ហើយសមាសធាតុអាសូតនៅតែត្រូវបានបញ្ចេញនៅក្នុងទឹកនោម និងមួយផ្នែកនៅក្នុងលាមក។ បរិមាណអាសូតដែលបញ្ចេញពីរាងកាយក្នុងមួយថ្ងៃអំឡុងពេលអត់អាហារប្រូតេអ៊ីនអាចជារង្វាស់នៃការខ្វះប្រូតេអ៊ីនប្រចាំថ្ងៃ។ វាជាការធម្មតាក្នុងការសន្មត់ថាតាមរយៈការបញ្ចូលទៅក្នុងរបបអាហារបរិមាណប្រូតេអ៊ីនដែលស្មើនឹងកង្វះនេះ វាគឺអាចធ្វើទៅបានដើម្បីស្ដារតុល្យភាពអាសូត។ ទោះយ៉ាងណាក៏ដោយវាមិនមែនទេ។ ដោយបានទទួលបរិមាណប្រូតេអ៊ីននេះ រាងកាយចាប់ផ្តើមប្រើប្រាស់អាស៊ីតអាមីណូកាន់តែមានប្រសិទ្ធភាព ដូច្នេះប្រូតេអ៊ីនបន្ថែមមួយចំនួនត្រូវបានទាមទារដើម្បីស្ដារតុល្យភាពអាសូត។ប្រសិនបើបរិមាណប្រូតេអ៊ីននៅក្នុងរបបអាហារលើសពីអ្វីដែលចាំបាច់ដើម្បីរក្សាតុល្យភាពអាសូត នោះវាហាក់ដូចជាគ្មានគ្រោះថ្នាក់អ្វីពីនេះទេ។ អាស៊ីតអាមីណូលើសត្រូវបានប្រើជាធម្មតាជាប្រភពថាមពល។ ឧទាហរណ៍ដ៏គួរឱ្យចាប់អារម្មណ៍មួយគឺ Eskimo ដែលទទួលទានកាបូអ៊ីដ្រាតតិចតួចនិងប្រូតេអ៊ីនប្រហែលដប់ដងច្រើនជាងតម្រូវការដើម្បីរក្សាតុល្យភាពអាសូត។ ទោះយ៉ាងណាក៏ដោយ ក្នុងករណីភាគច្រើន ការប្រើប្រូតេអ៊ីនជាប្រភពថាមពលគឺមិនមានអត្ថប្រយោជន៍ទេ ព្រោះអ្នកអាចទទួលបានកាឡូរីច្រើនពីបរិមាណកាបូអ៊ីដ្រាតដែលបានផ្តល់ឱ្យជាងបរិមាណប្រូតេអ៊ីនដូចគ្នា។ នៅក្នុងប្រទេសក្រីក្រ ប្រជាជនទទួលបានកាឡូរីចាំបាច់ពីកាបូអ៊ីដ្រាត ហើយប្រើប្រាស់បរិមាណប្រូតេអ៊ីនអប្បបរមា។
ប្រសិនបើរាងកាយទទួលបានចំនួនកាឡូរីដែលត្រូវការក្នុងទម្រង់ជាអាហារដែលមិនមានប្រូតេអ៊ីន នោះបរិមាណប្រូតេអ៊ីនអប្បបរមាដែលរក្សាតុល្យភាពអាសូតគឺប្រហាក់ប្រហែល។ 30 ក្រាមក្នុងមួយថ្ងៃ។ ប្រូតេអ៊ីនប្រហែលជាច្រើនមានក្នុងនំប៉័ងបួនបន្ទះ ឬទឹកដោះគោ ០.៥ លីត្រ។ បរិមាណធំជាងបន្តិចត្រូវបានចាត់ទុកថាល្អបំផុត។ ណែនាំពី ៥០ ទៅ ៧០ ក្រាម។
អាស៊ីតអាមីណូសំខាន់ៗ។ រហូតមកដល់ពេលនេះប្រូតេអ៊ីនត្រូវបានគេចាត់ទុកថាទាំងមូល។ ទន្ទឹមនឹងនេះ ដើម្បីឱ្យការសំយោគប្រូតេអ៊ីនប្រព្រឹត្តទៅ អាស៊ីតអាមីណូចាំបាច់ទាំងអស់ត្រូវតែមានវត្តមាននៅក្នុងខ្លួន។ អាស៊ីតអាមីណូមួយចំនួនដែលរាងកាយរបស់សត្វអាចសំយោគបាន។ ពួកគេត្រូវបានគេហៅថាអាចផ្លាស់ប្តូរបានព្រោះវាមិនចាំបាច់មានវត្តមាននៅក្នុងរបបអាហារទេ - វាមានសារៈសំខាន់តែមួយគត់ដែលជាទូទៅការទទួលទានប្រូតេអ៊ីនជាប្រភពនៃអាសូតគឺគ្រប់គ្រាន់។ បន្ទាប់មក ដោយមានការខ្វះខាតអាស៊ីតអាមីណូដែលមិនមានសារសំខាន់ រាងកាយអាចសំយោគពួកវាដោយចំណាយលើសចំនួនដែលមានវត្តមាន។ អាស៊ីតអាមីណូ "សំខាន់" ដែលនៅសេសសល់មិនអាចសំយោគបានទេ ហើយត្រូវតែបញ្ចូលជាមួយអាហារ។ សារធាតុសំខាន់ៗសម្រាប់មនុស្សគឺ វ៉ាលីន ឡេយូស៊ីន អ៊ីសូលយូស៊ីន ថូរនីន មេតូនីន ហ្វីនីឡាឡានីន ទ្រីបតូផាន អ៊ីស្ទីឌីន លីស៊ីន និងអាហ្គីនីន។ (ទោះបីជា arginine អាចត្រូវបានសំយោគនៅក្នុងរាងកាយក៏ដោយ វាត្រូវបានគេចាត់ទុកថាជាអាស៊ីតអាមីណូដ៏សំខាន់មួយ ដោយសារតែទារកទើបនឹងកើត និងកុមារដែលកំពុងលូតលាស់ផលិតបរិមាណរបស់វាមិនគ្រប់គ្រាន់។ ម៉្យាងវិញទៀត សម្រាប់មនុស្សដែលមានអាយុពេញវ័យ ការទទួលទានអាស៊ីតអាមីណូមួយចំនួនពីអាហារ។ អាចក្លាយជាជម្រើស។ )បញ្ជីនៃអាស៊ីតអាមីណូសំខាន់ៗនេះគឺប្រហែលដូចគ្នានៅក្នុងសត្វឆ្អឹងកងផ្សេងទៀត និងសូម្បីតែនៅក្នុងសត្វល្អិត។ តម្លៃអាហារូបត្ថម្ភនៃប្រូតេអ៊ីនជាធម្មតាត្រូវបានកំណត់ដោយការផ្តល់អាហារដល់សត្វកណ្តុរដែលកំពុងលូតលាស់ និងតាមដានការឡើងទម្ងន់របស់សត្វ។
តម្លៃអាហារូបត្ថម្ភនៃប្រូតេអ៊ីន។ តម្លៃអាហារូបត្ថម្ភនៃប្រូតេអ៊ីនត្រូវបានកំណត់ដោយអាស៊ីតអាមីណូសំខាន់ៗដែលខ្វះខាតបំផុត។ ចូរយើងបង្ហាញវាជាមួយនឹងឧទាហរណ៍មួយ។ ប្រូតេអ៊ីននៃរាងកាយរបស់យើងមានជាមធ្យមប្រហែល។ 2% tryptophan (ដោយទម្ងន់) ។ ចូរនិយាយថារបបអាហាររួមមានប្រូតេអ៊ីន 10 ក្រាមដែលមាន tryptophan 1% ហើយមានអាស៊ីតអាមីណូសំខាន់ៗផ្សេងទៀតគ្រប់គ្រាន់នៅក្នុងវា។ ក្នុងករណីរបស់យើង 10 ក្រាមនៃប្រូតេអ៊ីនដែលខូចនេះគឺចាំបាច់ស្មើនឹង 5 ក្រាមនៃមួយពេញលេញ។ នៅសល់ 5 ក្រាមអាចបម្រើជាប្រភពថាមពលប៉ុណ្ណោះ។ សូមចំណាំថា ដោយសារអាស៊ីតអាមីណូមិនត្រូវបានរក្សាទុកនៅក្នុងរាងកាយ ហើយដើម្បីឱ្យការសំយោគប្រូតេអ៊ីនប្រព្រឹត្តទៅ អាស៊ីតអាមីណូទាំងអស់ត្រូវតែមានវត្តមានក្នុងពេលដំណាលគ្នា ឥទ្ធិពលនៃការទទួលទានអាស៊ីតអាមីណូសំខាន់ៗអាចត្រូវបានរកឃើញលុះត្រាតែពួកវាចូល។ រាងកាយក្នុងពេលតែមួយ។. សមាសភាពជាមធ្យមនៃប្រូតេអ៊ីនសត្វភាគច្រើនគឺជិតនឹងសមាសធាតុមធ្យមនៃប្រូតេអ៊ីននៅក្នុងខ្លួនមនុស្ស ដូច្នេះហើយយើងទំនងជាមិនប្រឈមមុខនឹងកង្វះអាស៊ីតអាមីណូនោះទេ ប្រសិនបើរបបអាហាររបស់យើងសម្បូរទៅដោយអាហារដូចជាសាច់ ស៊ុត ទឹកដោះគោ និងឈីស។ ទោះយ៉ាងណាក៏ដោយមានប្រូតេអ៊ីនដូចជា gelatin (ផលិតផលនៃ collagen denaturation) ដែលមានអាស៊ីតអាមីណូសំខាន់ៗតិចតួចណាស់។ ប្រូតេអ៊ីនបន្លែទោះបីជាវាល្អប្រសើរជាង gelatin ក្នុងន័យនេះក៏ដោយក៏ខ្សោយនៅក្នុងអាស៊ីតអាមីណូសំខាន់ៗផងដែរ។ ជាពិសេសតិចតួចនៅក្នុងពួកគេ lysine និង tryptophan ។ ទោះជាយ៉ាងណាក៏ដោយ របបអាហារបួសសុទ្ធគឺមិនប៉ះពាល់ដល់សុខភាពនោះទេ លុះត្រាតែវាប្រើប្រាស់ប្រូតេអ៊ីនបន្លែក្នុងបរិមាណច្រើនបន្តិច ទើបគ្រប់គ្រាន់ដើម្បីផ្តល់ឱ្យរាងកាយនូវអាស៊ីតអាមីណូសំខាន់ៗ។ ប្រូតេអ៊ីនភាគច្រើនត្រូវបានរកឃើញនៅក្នុងរុក្ខជាតិនៅក្នុងគ្រាប់ពូជ ជាពិសេសនៅក្នុងគ្រាប់ពូជនៃស្រូវសាលី និង legumes ផ្សេងៗ។ ពន្លកវ័យក្មេងដូចជា asparagus ក៏សម្បូរប្រូតេអ៊ីនផងដែរ។ប្រូតេអ៊ីនសំយោគនៅក្នុងរបបអាហារ។ ដោយការបន្ថែមអាស៊ីតអាមីណូសំខាន់ៗសំយោគក្នុងបរិមាណតិចតួច ឬប្រូតេអ៊ីនដែលសម្បូរទៅដោយពួកវាទៅនឹងប្រូតេអ៊ីនមិនពេញលេញ ដូចជាប្រូតេអ៊ីនពោត វាអាចបង្កើនតម្លៃអាហារូបត្ថម្ភយ៉ាងសំខាន់នៃសារធាតុបន្ទាប់បន្សំ ពោលគឺឧ។ ដោយហេតុនេះបង្កើនបរិមាណប្រូតេអ៊ីនដែលប្រើប្រាស់។ លទ្ធភាពមួយទៀតគឺការរីកលូតលាស់បាក់តេរី ឬផ្សិតនៅលើអ៊ីដ្រូកាបូនប្រេងឥន្ធនៈជាមួយនឹងការបន្ថែមនីត្រាត ឬអាម៉ូញាក់ជាប្រភពនៃអាសូត។ ប្រូតេអ៊ីនអតិសុខុមប្រាណដែលទទួលបានតាមរបៀបនេះអាចបម្រើជាចំណីសម្រាប់បសុបក្សី ឬបសុសត្វ ឬអាចប្រើប្រាស់ដោយផ្ទាល់ដោយមនុស្ស។ វិធីសាស្រ្តទីបីដែលត្រូវបានគេប្រើយ៉ាងទូលំទូលាយប្រើសរីរវិទ្យានៃសត្វចៃ។ នៅក្នុង ruminants, នៅក្នុងផ្នែកដំបូងនៃក្រពះ, អ្វីដែលគេហៅថា។ នៅក្នុង rumen មានទម្រង់ពិសេសនៃបាក់តេរី និងប្រូតូហ្សូអា ដែលបំប្លែងប្រូតេអ៊ីនរុក្ខជាតិដែលមានជម្ងឺទៅជាប្រូតេអ៊ីនអតិសុខុមប្រាណពេញលេញ ហើយទាំងនេះ បន្ទាប់ពីការរំលាយអាហារ និងការស្រូបចូល ប្រែទៅជាប្រូតេអ៊ីនសត្វ។ អ៊ុយ ដែលជាសមាសធាតុដែលមានផ្ទុកអាសូតសំយោគថោក អាចត្រូវបានបន្ថែមទៅក្នុងចំណីបសុសត្វ។ អតិសុខុមប្រាណដែលរស់នៅក្នុង rumen ប្រើអ៊ុយអាសូតដើម្បីបំប្លែងកាបូអ៊ីដ្រាត (ក្នុងនោះមានច្រើននៅក្នុងចំណី) ទៅជាប្រូតេអ៊ីន។ ប្រហែលមួយភាគបីនៃអាសូតទាំងអស់នៅក្នុងចំណីសត្វអាចមកក្នុងទម្រង់ជាអ៊ុយ ដែលន័យសំខាន់គឺការសំយោគប្រូតេអ៊ីនគីមីក្នុងកម្រិតជាក់លាក់មួយ។ នៅសហរដ្ឋអាមេរិក វិធីសាស្ត្រនេះដើរតួនាទីយ៉ាងសំខាន់ជាមធ្យោបាយមួយដើម្បីទទួលបានប្រូតេអ៊ីន។អក្សរសាស្ត្រ Murray R, Grenner D, Meyes P, Rodwell W. ជីវគីមីរបស់មនុស្ស, tt ។ ១–២។ M. , 1993Alberts B., Bray D., Lewis J. et al. ជីវវិទ្យាម៉ូលេគុលនៃកោសិកា, tt ។ ១–៣។ M. , 1994
សំបុត្រ ២. 1. កត្តាអាហារូបត្ថម្ភសំខាន់ៗនៃធម្មជាតិ lipid ។ Lipids មួយចំនួនមិនត្រូវបានសំយោគនៅក្នុងខ្លួនមនុស្សទេ ដូច្នេះហើយគឺជាកត្តាអាហារូបត្ថម្ភដែលមិនអាចខ្វះបាន។ ទាំងនេះរួមមានអាស៊ីតខ្លាញ់ដែលមានចំណងពីរ ឬច្រើន (ប៉ូលីអ៊ីត) - អាស៊ីតខ្លាញ់សំខាន់ៗ។អាស៊ីតទាំងនេះមួយចំនួនគឺជាស្រទាប់ខាងក្រោមសម្រាប់ការសំយោគអរម៉ូនក្នុងតំបន់ - eicosanoids (ប្រធានបទ 8.10) ។
វីតាមីនរលាយជាតិខ្លាញ់អនុវត្តមុខងារផ្សេងៗ៖ វីតាមីន Aចូលរួមក្នុងដំណើរការនៃចក្ខុវិស័យ ក៏ដូចជាការលូតលាស់ និងភាពខុសគ្នានៃកោសិកា។ សមត្ថភាពរបស់វាក្នុងការរារាំងការលូតលាស់នៃប្រភេទដុំសាច់មួយចំនួនត្រូវបានបញ្ជាក់។ វីតាមីន Kចូលរួមក្នុងការកកឈាម; វីតាមីន Dចូលរួមក្នុងបទប្បញ្ញត្តិនៃការរំលាយអាហារកាល់ស្យូម; វីតាមីន E- សារធាតុប្រឆាំងអុកស៊ីតកម្ម រារាំងការបង្កើតរ៉ាឌីកាល់សេរី ហើយដូច្នេះប្រឆាំងនឹងការបំផ្លាញកោសិកាដែលជាលទ្ធផលនៃ lipid peroxidation ។
ឯកសារ
2. រចនាសម្ព័ន្ធនិងកម្រិតនៃការរៀបចំរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីន
មាន 4 កម្រិតនៃការរៀបចំរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីន: បឋម, អនុវិទ្យាល័យ, ទីបីនិង quaternary ។ កម្រិតនីមួយៗមានលក្ខណៈផ្ទាល់ខ្លួនរបស់វា។
រចនាសម្ព័ន្ធបឋមនៃប្រូតេអ៊ីន
រចនាសម្ព័ន្ធចម្បងនៃប្រូតេអ៊ីនគឺជាខ្សែសង្វាក់ polypeptide លីនេអ៊ែរនៃអាស៊ីតអាមីណូដែលភ្ជាប់ដោយចំណង peptide ។ រចនាសម្ព័ន្ធបឋមគឺជាកម្រិតសាមញ្ញបំផុតនៃការរៀបចំរចនាសម្ព័ន្ធនៃម៉ូលេគុលប្រូតេអ៊ីន។ ស្ថេរភាពខ្ពស់ត្រូវបានផ្តល់ឱ្យវាដោយចំណង peptide covalent រវាងក្រុមα-amino នៃអាស៊ីតអាមីណូមួយ និងក្រុមα-carboxyl នៃអាស៊ីតអាមីណូមួយទៀត។ [បង្ហាញ].
ប្រសិនបើក្រុម imino នៃ proline ឬ hydroxyproline ត្រូវបានចូលរួមនៅក្នុងការបង្កើតចំណង peptide នោះវាមានទម្រង់ផ្សេងគ្នា។ [បង្ហាញ].
នៅពេលដែលចំណង peptide ត្រូវបានបង្កើតឡើងនៅក្នុងកោសិកា ក្រុម carboxyl នៃអាស៊ីតអាមីណូមួយត្រូវបានធ្វើឱ្យសកម្មដំបូង ហើយបន្ទាប់មកវារួមបញ្ចូលគ្នាជាមួយក្រុមអាមីណូមួយទៀត។ ស្រដៀងគ្នានេះដែរត្រូវបានអនុវត្តការសំយោគមន្ទីរពិសោធន៍នៃ polypeptides ។
ចំណង peptide គឺជាបំណែកបន្តបន្ទាប់នៃខ្សែសង្វាក់ polypeptide ។ វាមានលក្ខណៈពិសេសមួយចំនួនដែលជះឥទ្ធិពលមិនត្រឹមតែរូបរាងនៃរចនាសម្ព័ន្ធបឋមប៉ុណ្ណោះទេប៉ុន្តែវាក៏មានកម្រិតខ្ពស់បំផុតនៃការរៀបចំខ្សែសង្វាក់ polypeptide ផងដែរ:

coplanarity - អាតូមទាំងអស់នៅក្នុងក្រុម peptide គឺនៅក្នុងយន្តហោះដូចគ្នា;
សមត្ថភាពក្នុងការមាននៅក្នុងទម្រង់ resonant ពីរ (ទម្រង់ keto ឬ enol);
ទីតាំងឆ្លងកាត់នៃអ្នកជំនួសដោយគោរពទៅនឹងចំណង C-N;
សមត្ថភាពក្នុងការបង្កើតចំណងអ៊ីដ្រូសែន ហើយក្រុម peptide នីមួយៗអាចបង្កើតចំណងអ៊ីដ្រូសែនពីរជាមួយក្រុមផ្សេងទៀត រួមទាំង peptide ផងដែរ។
ករណីលើកលែងគឺក្រុម peptide ដែលមានការចូលរួមពីក្រុមអាមីណូនៃ proline ឬ hydroxyproline ។ ពួកគេអាចបង្កើតចំណងអ៊ីដ្រូសែនតែមួយ (សូមមើលខាងលើ)។ នេះប៉ះពាល់ដល់ការបង្កើតរចនាសម្ព័ន្ធបន្ទាប់បន្សំនៃប្រូតេអ៊ីន។ ខ្សែសង្វាក់ polypeptide នៅកន្លែងដែល proline ឬ hydroxyproline ស្ថិតនៅគឺអាចពត់បានយ៉ាងងាយ ព្រោះវាមិនត្រូវបានរក្សាដូចធម្មតាដោយចំណងអ៊ីដ្រូសែនទីពីរ។
នាមត្រកូលនៃ peptides និង polypeptides. ឈ្មោះនៃ peptides ត្រូវបានបង្កើតឡើងពីឈ្មោះនៃអាស៊ីតអាមីណូធាតុផ្សំរបស់វា។ អាស៊ីដអាមីណូពីរបង្កើតជាឌីភីបទីត បីទ្រីបភីទីត បួន តេត្រាប៉េទីត។ល។ ខ្សែសង្វាក់ peptide ឬ polypeptide នីមួយៗនៃប្រវែងណាមួយមានអាស៊ីតអាមីណូស្ថានីយ N ដែលមានក្រុមអាមីណូសេរី និងអាស៊ីតអាមីណូស្ថានីយ C ដែលមានក្រុម carboxyl ឥតគិតថ្លៃ។ នៅពេលដាក់ឈ្មោះ polypeptides អាស៊ីតអាមីណូទាំងអស់ត្រូវបានរាយបញ្ជីជាបន្តបន្ទាប់ ដោយចាប់ផ្តើមពី N-terminal ដោយជំនួសដោយឈ្មោះរបស់វា លើកលែងតែ C-terminal បច្ច័យ -in ទៅ -yl (ចាប់តាំងពីអាស៊ីតអាមីណូនៅក្នុង peptides លែងមានក្រុម carboxyl ទៀតហើយ។ ប៉ុន្តែកាបូនអ៊ីលមួយ) ។ ឧទាហរណ៍ ឈ្មោះដែលបង្ហាញក្នុងរូប។ 1 tripeptide - leuc ដីល្បាប់ភេនឡាឡាន់ ដីល្បាប់បល្ល័ង្ក ក្នុង.
លក្ខណៈពិសេសនៃរចនាសម្ព័ន្ធចម្បងនៃប្រូតេអ៊ីន. នៅក្នុងឆ្អឹងខ្នងនៃខ្សែសង្វាក់ polypeptide រចនាសម្ព័ន្ធរឹង (ក្រុម peptide ផ្ទះល្វែង) ឆ្លាស់គ្នាជាមួយនឹងតំបន់ចល័តដែលទាក់ទងគ្នា (-CHR) ដែលអាចបង្វិលជុំវិញចំណង។ លក្ខណៈពិសេសបែបនេះនៃរចនាសម្ព័ន្ធនៃខ្សែសង្វាក់ polypeptide ប៉ះពាល់ដល់ការវេចខ្ចប់របស់វានៅក្នុងលំហ។
រចនាសម្ព័ន្ធបន្ទាប់បន្សំនៃប្រូតេអ៊ីន
រចនាសម្ព័ន្ធបន្ទាប់បន្សំ គឺជាវិធីនៃការដាក់ខ្សែសង្វាក់ polypeptide ចូលទៅក្នុងរចនាសម្ព័ន្ធលំដាប់មួយ ដោយសារការបង្កើតចំណងអ៊ីដ្រូសែនរវាងក្រុម peptide នៃខ្សែសង្វាក់មួយ ឬខ្សែសង្វាក់ polypeptide ដែលនៅជាប់គ្នា។ តាមការកំណត់រចនាសម្ព័ន្ធបន្ទាប់បន្សំត្រូវបានបែងចែកទៅជា helical (α-helix) និងស្រទាប់-folded (β-structure និង cross-β-form)។


α- Helix. នេះគឺជាប្រភេទនៃរចនាសម្ព័ន្ធបន្ទាប់បន្សំប្រូតេអ៊ីនដែលមានទម្រង់ជា helix ធម្មតាដែលបង្កើតឡើងដោយសារតែចំណងអ៊ីដ្រូសែន interpeptide នៅក្នុងខ្សែសង្វាក់ polypeptide តែមួយ។ គំរូរចនាសម្ព័ន្ធ α-helix (រូបភាពទី 2) ដែលគិតគូរពីលក្ខណៈសម្បត្តិទាំងអស់នៃចំណង peptide ត្រូវបានស្នើឡើងដោយ Pauling និង Corey ។ លក្ខណៈសំខាន់ៗនៃ α-helix៖
ការកំណត់រចនាសម្ព័ន្ធ helical នៃខ្សែសង្វាក់ polypeptide ដែលមានស៊ីមេទ្រី helical;
ការបង្កើតចំណងអ៊ីដ្រូសែនរវាងក្រុម peptide នៃសំណល់អាស៊ីតអាមីណូទីមួយ និងទីបួន;
ភាពទៀងទាត់នៃវេននៃវង់;
សមមូលនៃសំណល់អាស៊ីតអាមីណូទាំងអស់នៅក្នុង α-helix ដោយមិនគិតពីរចនាសម្ព័ន្ធនៃរ៉ាឌីកាល់ចំហៀងរបស់ពួកគេ;
រ៉ាឌីកាល់ចំហៀងនៃអាស៊ីតអាមីណូមិនចូលរួមក្នុងការបង្កើត α-helix ទេ។
ខាងក្រៅ α-helix មើលទៅដូចជា helix លាតសន្ធឹងបន្តិចនៃចង្ក្រានអគ្គិសនី។ ភាពទៀងទាត់នៃចំណងអ៊ីដ្រូសែនរវាងក្រុម peptide ទី 1 និងទី 4 ក៏កំណត់ពីភាពទៀងទាត់នៃវេននៃខ្សែសង្វាក់ polypeptide ផងដែរ។ កម្ពស់នៃវេនមួយឬទីលាននៃα-helix គឺ 0.54 nm; វារួមបញ្ចូលទាំងសំណល់អាស៊ីតអាមីណូ 3.6 ពោលគឺសំណល់អាស៊ីតអាមីណូនីមួយៗផ្លាស់ទីតាមអ័ក្ស (កម្ពស់នៃសំណល់អាស៊ីតអាមីណូមួយ) ដោយ 0.15 nm (0.54:3.6 = 0.15 nm) ដែលអនុញ្ញាតឱ្យយើងនិយាយអំពីសមមូលនៃអាស៊ីតអាមីណូទាំងអស់ សំណល់នៅក្នុង α-helix ។ រយៈពេលទៀងទាត់នៃα-helix គឺ 5 វេនឬ 18 សំណល់អាស៊ីតអាមីណូ; ប្រវែងនៃរយៈពេលមួយគឺ 2.7 nm ។ អង្ករ។ 3. គំរូ Pauling-Corey α-helix
β-រចនាសម្ព័ន្ធ. នេះគឺជាប្រភេទនៃរចនាសម្ព័ន្ធបន្ទាប់បន្សំដែលមានការកំណត់រចនាសម្ព័ន្ធកោងបន្តិចនៃខ្សែសង្វាក់ polypeptide ហើយត្រូវបានបង្កើតឡើងដោយប្រើចំណងអ៊ីដ្រូសែន interpeptide នៅក្នុងផ្នែកនីមួយៗនៃខ្សែសង្វាក់ polypeptide មួយ ឬខ្សែសង្វាក់ polypeptide ដែលនៅជាប់គ្នា។ វាត្រូវបានគេហៅផងដែរថារចនាសម្ព័ន្ធបត់ជាស្រទាប់។ មានរចនាសម្ព័ន្ធ β ជាច្រើនប្រភេទ។ តំបន់ស្រទាប់មានកំណត់ដែលបង្កើតឡើងដោយខ្សែសង្វាក់ polypeptide មួយនៃប្រូតេអ៊ីនត្រូវបានគេហៅថា cross-β-form (ទម្រង់β-ខ្លី) ។ ចំណងអ៊ីដ្រូសែននៅក្នុងទម្រង់ cross-β ត្រូវបានបង្កើតឡើងរវាងក្រុម peptide នៃរង្វិលជុំនៃខ្សែសង្វាក់ polypeptide ។ ប្រភេទមួយទៀត រចនាសម្ព័ន្ធ β-ពេញលេញ គឺជាលក្ខណៈនៃខ្សែសង្វាក់ polypeptide ទាំងមូល ដែលមានរាងពន្លូត និងត្រូវបានរក្សាដោយចំណងអ៊ីដ្រូសែន interpeptide រវាងខ្សែសង្វាក់ polypeptide ប៉ារ៉ាឡែលដែលនៅជាប់គ្នា (រូបភាពទី 3) ។ រចនាសម្ព័ននេះគឺនឹកឃើញដល់ accordion bellows ។ លើសពីនេះទៅទៀតការប្រែប្រួលនៃរចនាសម្ព័ន្ធβគឺអាចធ្វើទៅបាន: ពួកវាអាចត្រូវបានបង្កើតឡើងដោយខ្សែសង្វាក់ប៉ារ៉ាឡែល (ស្ថានីយ N នៃខ្សែសង្វាក់ polypeptide ត្រូវបានដឹកនាំក្នុងទិសដៅដូចគ្នា) និង antiparallel (ស្ថានីយ N ត្រូវបានដឹកនាំក្នុងទិសដៅផ្សេងៗគ្នា) ។ រ៉ាឌីកាល់ចំហៀងនៃស្រទាប់មួយត្រូវបានដាក់នៅចន្លោះរ៉ាឌីកាល់ចំហៀងនៃស្រទាប់មួយទៀត។
នៅក្នុងប្រូតេអ៊ីន ការផ្លាស់ប្តូរពីរចនាសម្ព័ន្ធ α ទៅរចនាសម្ព័ន្ធ β និងច្រាសមកវិញគឺអាចធ្វើទៅបានដោយសារតែការរៀបចំឡើងវិញនៃចំណងអ៊ីដ្រូសែន។ ជំនួសឱ្យចំណងអ៊ីដ្រូសែន interpeptide ទៀងទាត់តាមខ្សែសង្វាក់ (ដោយសារតែពួកវា ខ្សែសង្វាក់ polypeptide ត្រូវបានបង្វិលទៅជាវង់) ផ្នែកដែលខ្ចាត់ខ្ចាយមិនត្រូវបានបង្វិល ហើយចំណងអ៊ីដ្រូសែនត្រូវបានបិទរវាងបំណែកពន្លូតនៃខ្សែសង្វាក់ polypeptide ។ ការផ្លាស់ប្តូរបែបនេះត្រូវបានរកឃើញនៅក្នុង keratin ដែលជាប្រូតេអ៊ីនសក់។ នៅពេលលាងសក់ជាមួយនឹងសារធាតុសាប៊ូអាល់កាឡាំង រចនាសម្ព័ន្ធ helical នៃ β-keratin ត្រូវបានបំផ្លាញយ៉ាងងាយស្រួល ហើយវាចូលទៅក្នុង α-keratin (សក់រួញអង្កាញ់) ។
ការបំផ្លាញរចនាសម្ព័ន្ធបន្ទាប់បន្សំធម្មតានៃប្រូតេអ៊ីន (α-helices និង β-structures) ដោយភាពស្រដៀងគ្នាជាមួយនឹងការរលាយនៃគ្រីស្តាល់ត្រូវបានគេហៅថា "ការរលាយ" នៃ polypeptides ។ ក្នុងករណីនេះចំណងអ៊ីដ្រូសែនត្រូវបានខូច ហើយខ្សែសង្វាក់ polypeptide យកទម្រង់ជារបុំចៃដន្យ។ ដូច្នេះស្ថេរភាពនៃរចនាសម្ព័ន្ធបន្ទាប់បន្សំត្រូវបានកំណត់ដោយចំណងអ៊ីដ្រូសែន interpeptide ។ ប្រភេទផ្សេងទៀតនៃចំណងស្ទើរតែមិនចូលរួមក្នុងរឿងនេះទេ លើកលែងតែចំណង disulfide នៅតាមបណ្តោយខ្សែសង្វាក់ polypeptide នៅទីតាំងនៃសំណល់ cysteine ។ peptides ខ្លីដោយសារតែចំណង disulfide ត្រូវបានបិទនៅក្នុងវដ្ត។ ប្រូតេអ៊ីនជាច្រើនក្នុងពេលដំណាលគ្នាមានតំបន់α-helical និងរចនាសម្ព័ន្ធβ។ ស្ទើរតែមិនមានប្រូតេអ៊ីនធម្មជាតិដែលមាន 100% α-helix (ករណីលើកលែងគឺ paramyosin ដែលជាប្រូតេអ៊ីនសាច់ដុំដែលមាន 96-100% α-helix) ខណៈពេលដែល polypeptides សំយោគមាន helix 100% ។
ប្រូតេអ៊ីនផ្សេងទៀតមានកម្រិតនៃភាពមិនស្មើគ្នា។ ប្រេកង់ខ្ពស់នៃរចនាសម្ព័ន្ធ α-helical ត្រូវបានគេសង្កេតឃើញនៅក្នុង paramyosin, myoglobin និង hemoglobin ។ ផ្ទុយទៅវិញនៅក្នុង trypsin, ribonuclease ដែលជាផ្នែកសំខាន់នៃខ្សែសង្វាក់ polypeptide សមនឹងចូលទៅក្នុងរចនាសម្ព័ន្ធβ-ស្រទាប់។ គាំទ្រប្រូតេអ៊ីនជាលិកា៖ keratin (ប្រូតេអ៊ីនសក់រោមចៀម) កូឡាជែន (ប្រូតេអ៊ីនសរសៃពួរស្បែក) fibroin (ប្រូតេអ៊ីនសូត្រធម្មជាតិ) មានការកំណត់រចនាសម្ព័ន្ធβនៃខ្សែសង្វាក់ polypeptide ។ កម្រិតខុសគ្នានៃការធ្វើចលនារបស់ខ្សែសង្វាក់ polypeptide នៃប្រូតេអ៊ីនបង្ហាញថា ជាក់ស្តែងមានកម្លាំងដែលរំខានផ្នែកខ្លះនៃ helicity ឬ "បំបែក" ការបត់ធម្មតានៃខ្សែសង្វាក់ polypeptide ។ ហេតុផលសម្រាប់ការនេះគឺការវេចខ្ចប់កាន់តែបង្រួមនៃខ្សែសង្វាក់ polypeptide ប្រូតេអ៊ីននៅក្នុងបរិមាណជាក់លាក់មួយពោលគឺនៅក្នុងរចនាសម្ព័ន្ធទីបី។
រចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីន
រចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីនគឺជាវិធីដែលខ្សែសង្វាក់ polypeptide ត្រូវបានបត់នៅក្នុងលំហ។ យោងតាមរូបរាងនៃរចនាសម្ព័ន្ធទីបីប្រូតេអ៊ីនត្រូវបានបែងចែកជាចម្បងទៅជា globular និង fibrillar ។ ប្រូតេអ៊ីន Globular ភាគច្រើនមានរូបរាងរាងអេលីប ហើយប្រូតេអ៊ីន fibrillar (filamentous) ត្រូវបានពន្លូត (រូបរាងរបស់ដំបង និង spindle) ។
ទោះជាយ៉ាងណាក៏ដោយ ការកំណត់រចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីនមិនទាន់ផ្តល់ហេតុផលដើម្បីគិតថាប្រូតេអ៊ីន fibrillar មានតែរចនាសម្ព័ន្ធ β និង globular α-helical ប៉ុណ្ណោះ។ មានប្រូតេអ៊ីន fibrillar ដែលមាន helical ជាជាងរចនាសម្ព័ន្ធបន្ទាប់បន្សំដែលមានស្រទាប់។ ឧទាហរណ៍ α-keratin និង paramyosin (ប្រូតេអ៊ីនសាច់ដុំ mollusk obturator), tropomyosins (ប្រូតេអ៊ីនសាច់ដុំគ្រោងឆ្អឹង) គឺជាប្រូតេអ៊ីន fibrillar (មានទម្រង់ជាដំបង) ហើយរចនាសម្ព័ន្ធបន្ទាប់បន្សំរបស់ពួកគេគឺ α-helix; ផ្ទុយទៅវិញ ប្រូតេអ៊ីន globular អាចមានរចនាសម្ព័ន្ធ β មួយចំនួនធំ។
Spiralization នៃខ្សែសង្វាក់ polypeptide លីនេអ៊ែរកាត់បន្ថយទំហំរបស់វាប្រហែល 4 ដង; ហើយការវេចខ្ចប់ចូលទៅក្នុងរចនាសម្ព័ន្ធទីបីធ្វើឱ្យវាបង្រួមជាងខ្សែសង្វាក់ដើមរាប់សិបដង។
មូលបត្របំណុលដែលរក្សាស្ថិរភាពរចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីន. នៅក្នុងស្ថេរភាពនៃរចនាសម្ព័ន្ធទីបី ចំណងរវាងរ៉ាឌីកាល់ចំហៀងនៃអាស៊ីតអាមីណូដើរតួនាទីមួយ។ ការតភ្ជាប់ទាំងនេះអាចត្រូវបានបែងចែកជាៈ
ខ្លាំង (covalent) [បង្ហាញ].
ខ្សោយ (ប៉ូល និង វ៉ាន ឌឺវ៉ាល់) [បង្ហាញ].
ចំណងជាច្រើនរវាងរ៉ាឌីកាល់ចំហៀងនៃអាស៊ីតអាមីណូកំណត់ការកំណត់រចនាសម្ព័ន្ធលំហនៃម៉ូលេគុលប្រូតេអ៊ីន។
លក្ខណៈពិសេសនៃការរៀបចំរចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីន. ការអនុលោមតាមរចនាសម្ព័ន្ធទីបីនៃខ្សែសង្វាក់ polypeptide ត្រូវបានកំណត់ដោយលក្ខណៈសម្បត្តិនៃរ៉ាឌីកាល់ចំហៀងនៃអាស៊ីតអាមីណូធាតុផ្សំរបស់វា (ដែលមិនមានឥទ្ធិពលគួរឱ្យកត់សម្គាល់លើការបង្កើតរចនាសម្ព័ន្ធបឋមនិងអនុវិទ្យាល័យ) និងមីក្រូបរិស្ថានពោលគឺបរិស្ថាន។ នៅពេលបត់ ខ្សែសង្វាក់ polypeptide នៃប្រូតេអ៊ីនមានទំនោរទៅរកទម្រង់អំណោយផលដ៏ស្វាហាប់ ដែលកំណត់ដោយអប្បបរមានៃថាមពលឥតគិតថ្លៃ។ ដូច្នេះក្រុម R ដែលមិនមែនជាប៉ូល "ជៀសវាង" ទឹកបង្កើតបានជាផ្នែកខាងក្នុងនៃរចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីនដែលផ្នែកសំខាន់នៃសំណល់អ៊ីដ្រូហ្វិកនៃខ្សែសង្វាក់ polypeptide ស្ថិតនៅ។ ស្ទើរតែគ្មានម៉ូលេគុលទឹកនៅកណ្តាលនៃ globule ប្រូតេអ៊ីន។ ប៉ូល (hydrophilic) R-groups នៃអាស៊ីតអាមីណូមានទីតាំងនៅខាងក្រៅស្នូល hydrophobic ហើយត្រូវបានហ៊ុំព័ទ្ធដោយម៉ូលេគុលទឹក។ ខ្សែសង្វាក់ polypeptide ពត់យ៉ាងចម្លែកក្នុងចន្លោះបីវិមាត្រ។ នៅពេលដែលវាពត់ ការអនុលោមតាម helical បន្ទាប់បន្សំត្រូវបានខូច។ ខ្សែសង្វាក់ "បំបែក" នៅចំណុចខ្សោយដែល proline ឬ hydroxyproline ស្ថិតនៅ ដោយសារអាស៊ីតអាមីណូទាំងនេះមានចល័តច្រើនជាងនៅក្នុងខ្សែសង្វាក់ បង្កើតបានជាចំណងអ៊ីដ្រូសែនតែមួយជាមួយក្រុម peptide ផ្សេងទៀត។ កន្លែងមួយទៀតនៃពត់គឺ glycine ដែលក្រុម R តូច (អ៊ីដ្រូសែន) ។ ដូច្នេះក្រុម R នៃអាស៊ីតអាមីណូផ្សេងទៀតនៅពេលដាក់ជង់ មានទំនោរកាន់កាប់កន្លែងទំនេរនៅទីតាំងនៃ glycine ។ អាស៊ីតអាមីណូមួយចំនួន - alanine, leucine, glutamate, histidine - រួមចំណែកដល់ការរក្សារចនាសម្ព័ន្ធ helical មានស្ថេរភាពនៅក្នុងប្រូតេអ៊ីននិងដូចជា methionine, valine, isoleucine, អាស៊ីត aspartic គាំទ្រដល់ការបង្កើតរចនាសម្ព័ន្ធβ។ នៅក្នុងម៉ូលេគុលប្រូតេអ៊ីនដែលមានការកំណត់រចនាសម្ព័ន្ធទីបី មានផ្នែកក្នុងទម្រង់ជា α-helices (spiralized), β-structures (layered) និង coil ចៃដន្យ។ មានតែការបត់ spatial ត្រឹមត្រូវនៃប្រូតេអ៊ីនធ្វើឱ្យវាសកម្ម; ការរំលោភលើវានាំឱ្យមានការផ្លាស់ប្តូរលក្ខណៈសម្បត្តិនៃប្រូតេអ៊ីននិងការបាត់បង់សកម្មភាពជីវសាស្រ្ត។
រចនាសម្ព័ន្ធប្រូតេអ៊ីន Quaternary
ប្រូតេអ៊ីនដែលមានខ្សែសង្វាក់ polypeptide តែមួយមានរចនាសម្ព័ន្ធទីបីប៉ុណ្ណោះ។ ទាំងនេះរួមមាន myoglobin ដែលជាប្រូតេអ៊ីនជាលិកាសាច់ដុំដែលពាក់ព័ន្ធនឹងការភ្ជាប់អុកស៊ីហ្សែន អង់ស៊ីមមួយចំនួន (lysozyme, pepsin, trypsin ជាដើម)។ ទោះជាយ៉ាងណាក៏ដោយ ប្រូតេអ៊ីនមួយចំនួនត្រូវបានបង្កើតឡើងពីខ្សែសង្វាក់ polypeptide ជាច្រើន ដែលនីមួយៗមានរចនាសម្ព័ន្ធទីបី។ សម្រាប់ប្រូតេអ៊ីនបែបនេះ គំនិតនៃរចនាសម្ព័ន្ធ quaternary ត្រូវបានណែនាំ ដែលជាការរៀបចំនៃខ្សែសង្វាក់ polypeptide ជាច្រើនដែលមានរចនាសម្ព័ន្ធទីបីចូលទៅក្នុងម៉ូលេគុលប្រូតេអ៊ីនដែលមានមុខងារតែមួយ។ ប្រូតេអ៊ីនបែបនេះដែលមានរចនាសម្ព័ន្ធ quaternary ត្រូវបានគេហៅថា oligomer ហើយខ្សែសង្វាក់ polypeptide របស់វាជាមួយនឹងរចនាសម្ព័ន្ធទីបីត្រូវបានគេហៅថា protomers ឬ subunits (រូបភាព 4) ។

នៅកម្រិត quaternary នៃអង្គការ ប្រូតេអ៊ីនរក្សានូវការកំណត់រចនាសម្ព័ន្ធមូលដ្ឋាននៃរចនាសម្ព័ន្ធទីបី (globular ឬ fibrillar) ។ ជាឧទាហរណ៍ អេម៉ូក្លូប៊ីនគឺជាប្រូតេអ៊ីនដែលមានរចនាសម្ព័ន្ធបួនជ្រុង និងមានបួនរង។ អនុផ្នែកនីមួយៗគឺជាប្រូតេអ៊ីន globular ហើយជាទូទៅ hemoglobin ក៏មានការកំណត់រចនាសម្ព័ន្ធ globular ផងដែរ។ ប្រូតេអ៊ីននៃសក់និងរោមចៀម - keratins ដែលទាក់ទងនឹងរចនាសម្ព័ន្ធទីបីទៅនឹងប្រូតេអ៊ីន fibrillar មានទម្រង់ fibrillar និងរចនាសម្ព័ន្ធ quaternary ។
ស្ថេរភាពនៃរចនាសម្ព័ន្ធ quaternary នៃប្រូតេអ៊ីន. ប្រូតេអ៊ីនទាំងអស់ដែលមានរចនាសម្ព័ន្ធ quaternary ត្រូវបានញែកដាច់ពីគ្នាជា macromolecules បុគ្គលដែលមិនរលាយទៅជាអនុរង។ ទំនាក់ទំនងរវាងផ្ទៃនៃអនុធាតុគឺអាចធ្វើទៅបានតែដោយសារតែក្រុមប៉ូលនៃសំណល់អាស៊ីតអាមីណូ ចាប់តាំងពីក្នុងអំឡុងពេលនៃការបង្កើតរចនាសម្ព័ន្ធទីបីនៃសង្វាក់ polypeptide នីមួយៗ រ៉ាឌីកាល់ចំហៀងនៃអាស៊ីតអាមីណូដែលមិនមានប៉ូល (ដែលបង្កើតបានភាគច្រើននៃសារធាតុប្រូតេអ៊ីនទាំងអស់ អាស៊ីតអាមីណូ) ត្រូវបានលាក់នៅក្នុងផ្នែករង។ អ៊ីយ៉ុងជាច្រើន (អំបិល) អ៊ីដ្រូសែន និងក្នុងករណីខ្លះ ចំណង disulfide ត្រូវបានបង្កើតឡើងរវាងក្រុមប៉ូលរបស់ពួកគេ ដែលកាន់ផ្នែករងយ៉ាងរឹងមាំក្នុងទម្រង់នៃស្មុគស្មាញដែលបានរៀបចំ។ ការប្រើប្រាស់សារធាតុដែលបំបែកចំណងអ៊ីដ្រូសែន ឬសារធាតុដែលស្ដារស្ពាន disulfide បណ្តាលឱ្យមានការបែកខ្ញែកនៃ protomers និងការបំផ្លាញរចនាសម្ព័ន្ធ quaternary នៃប្រូតេអ៊ីន។ នៅក្នុងតារាង។ 1 សង្ខេបទិន្នន័យស្តីពីចំណងដែលមានស្ថេរភាពកម្រិតផ្សេងគ្នានៃការរៀបចំនៃម៉ូលេគុលប្រូតេអ៊ីន [បង្ហាញ].
លក្ខណៈពិសេសនៃការរៀបចំរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីន fibrillar មួយចំនួន
ការរៀបចំរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីន fibrillar មានលក្ខណៈពិសេសមួយចំនួនបើប្រៀបធៀបទៅនឹងប្រូតេអ៊ីន globular ។ លក្ខណៈពិសេសទាំងនេះអាចត្រូវបានតាមដាននៅលើឧទាហរណ៍នៃ keratin, fibroin និង collagen ។ Keratin មាននៅក្នុងទម្រង់ α- និង β-។ α-Keratins និង fibroin មានរចនាសម្ព័ន្ធបន្ទាប់បន្សំជាស្រទាប់ ប៉ុន្តែនៅក្នុង keratin ខ្សែសង្វាក់គឺស្របគ្នា ហើយនៅក្នុង fibroin ពួកវាជា antiparallel (សូមមើលរូបទី 3); លើសពីនេះទៀតចំណង interchain disulfide មានវត្តមាននៅក្នុង keratin ខណៈពេលដែលវាមិនមាននៅក្នុង fibroin ។ ការដាច់នៃចំណង disulfide នាំទៅដល់ការបំបែកខ្សែសង្វាក់ polypeptide នៅក្នុង keratins ។ ផ្ទុយទៅវិញ ការបង្កើតចំនួនអតិបរមានៃចំណង disulfide នៅក្នុង keratins ដោយសកម្មភាពនៃភ្នាក់ងារអុកស៊ីតកម្ម បង្កើតរចនាសម្ព័ន្ធលំហដ៏រឹងមាំ។ ជាទូទៅនៅក្នុងប្រូតេអ៊ីន fibrillar ផ្ទុយទៅនឹងប្រូតេអ៊ីន globular ជួនកាលវាពិបាកក្នុងការបែងចែកយ៉ាងតឹងរ៉ឹងរវាងកម្រិតផ្សេងៗគ្នានៃអង្គការ។ ប្រសិនបើយើងទទួលយក (សម្រាប់ប្រូតេអ៊ីន globular) ដែលរចនាសម្ព័ន្ធទីបីគួរតែត្រូវបានបង្កើតឡើងដោយការដាក់ខ្សែសង្វាក់ polypeptide មួយនៅក្នុងលំហ ហើយរចនាសម្ព័ន្ធ quaternary គួរតែត្រូវបានបង្កើតឡើងដោយខ្សែសង្វាក់ជាច្រើនបន្ទាប់មកនៅក្នុងប្រូតេអ៊ីន fibrillar ខ្សែសង្វាក់ polypeptide ជាច្រើនត្រូវបានចូលរួមរួចហើយនៅក្នុងការបង្កើត។ រចនាសម្ព័ន្ធបន្ទាប់បន្សំ។ ឧទាហរណ៍ធម្មតានៃប្រូតេអ៊ីន fibrillar គឺ collagen ដែលជាប្រូតេអ៊ីនដែលមានច្រើនបំផុតនៅក្នុងខ្លួនមនុស្ស (ប្រហែល 1/3 នៃម៉ាសនៃប្រូតេអ៊ីនទាំងអស់) ។ វាមាននៅក្នុងជាលិកាដែលមានកម្លាំងខ្ពស់ និងការពង្រីកទាប (ឆ្អឹង សរសៃពួរ ស្បែក ធ្មេញ។ល។)។ នៅក្នុង collagen មួយភាគបីនៃសំណល់អាស៊ីតអាមីណូគឺ glycine ហើយប្រហែលមួយភាគបួនឬបន្តិចទៀតគឺ proline ឬ hydroxyproline ។

ខ្សែសង្វាក់ polypeptide collagen ដាច់ដោយឡែក (រចនាសម្ព័ន្ធបឋម) មើលទៅដូចជាខ្សែដែលខូច។ វាមានអាស៊ីតអាមីណូប្រហែល 1000 និងមានទម្ងន់ម៉ូលេគុលប្រហែល 105 (រូបភាព 5, a, ខ) ។ ខ្សែសង្វាក់ polypeptide ត្រូវបានបង្កើតឡើងពីបីដងនៃអាស៊ីតអាមីណូ (បីដង) នៃសមាសធាតុដូចខាងក្រោមៈ gly-A-B ដែល A និង B គឺជាអាស៊ីតអាមីណូណាមួយ លើកលែងតែ glycine (ភាគច្រើនជាញឹកញាប់ proline និង hydroxyproline) ។ ខ្សែសង្វាក់ polypeptide របស់ Collagen (ឬ α-chains) កំឡុងពេលបង្កើតរចនាសម្ព័ន្ធបន្ទាប់បន្សំ និងទីបី (រូបភាព 5, c និង d) មិនអាចបង្កើតជា α-helices ធម្មតាដែលមានស៊ីមេទ្រី helical បានទេ។ វាត្រូវបានរារាំងដោយ proline, hydroxyproline និង glycine (អាស៊ីតអាមីណូប្រឆាំងនឹង helical) ។ ហេតុដូច្នេះហើយ ខ្សែសង្វាក់ α បីដូចដែលវាមាន វង់រមួល ដូចជាខ្សែស្រឡាយបីដែលរុំជុំវិញស៊ីឡាំង។ ខ្សែសង្វាក់ α-helical បីបង្កើតជារចនាសម្ព័ន្ធកូឡាជែនដែលត្រូវបានគេហៅថា tropocollagen (រូបភាព 5d) ។ Tropocollagen នៅក្នុងអង្គការរបស់វាគឺជារចនាសម្ព័ន្ធទីបីនៃ collagen ។ ចិញ្ចៀនរាបស្មើនៃ proline និង hydroxyproline ដែលឆ្លាស់គ្នាជាទៀងទាត់តាមខ្សែសង្វាក់ ផ្តល់ឱ្យវានូវភាពរឹង ក៏ដូចជាចំណង interchain រវាង tropocollagen α-chains (ដូច្នេះ collagen មានភាពធន់ទ្រាំនឹងការលាតសន្ធឹង) ។ Tropocollagen គឺជាផ្នែករងនៃសរសៃ collagen ។ អនុផ្នែក Tropocollagen ត្រូវបានជង់ក្នុងរចនាសម្ព័ន្ធ quaternary នៃ collagen ក្នុងទម្រង់ជាជំហាន (រូបភាព 5e) ។
ស្ថេរភាពនៃរចនាសម្ព័ន្ធ collagen កើតឡើងដោយសារតែ interchain hydrogen, ionic bonds និង van der Waals និងចំនួនតិចតួចនៃចំណង covalent ។
ខ្សែសង្វាក់ α នៃ collagen មានរចនាសម្ព័ន្ធគីមីខុសៗគ្នា។ មាន α 1 -chains នៃប្រភេទផ្សេងៗគ្នា (I, II, III, IV) និង α 2 -chains ។ អាស្រ័យលើ α 1 - និង α 2 -chains ត្រូវបានចូលរួមនៅក្នុងការបង្កើត helix បីខ្សែនៃ tropocollagen នោះ collagen បួនប្រភេទត្រូវបានសម្គាល់:
ប្រភេទទីមួយ - ពីរ α 1 (I) និងមួយ α 2 -chain;
ប្រភេទទីពីរ - ខ្សែសង្វាក់ α 1 (II) ចំនួនបី;
ប្រភេទទីបី - ខ្សែសង្វាក់ α 1 (III) បី;
ប្រភេទទីបួន - ខ្សែសង្វាក់ α 1 (IV) បី។
Collagen ទូទៅបំផុតនៃប្រភេទទីមួយ: វាត្រូវបានរកឃើញនៅក្នុងជាលិកាឆ្អឹង, ស្បែក, សរសៃពួរ; កូឡាជែនប្រភេទទី 2 ត្រូវបានរកឃើញនៅក្នុងឆ្អឹងខ្ចី។ល។ វាអាចមានប្រភេទផ្សេងគ្នានៃ collagen នៅក្នុងប្រភេទដូចគ្នានៃជាលិកា។
ការប្រមូលផ្តុំរចនាសម្ព័ន្ធកូឡាជែនតាមលំដាប់ ភាពរឹង និងភាពអសកម្មរបស់វាផ្តល់នូវកម្លាំងខ្ពស់នៃសរសៃ collagen ។ ប្រូតេអ៊ីន Collagen ក៏មានសមាសធាតុកាបូអ៊ីដ្រាតផងដែរ ពោលគឺពួកវាជាប្រូតេអ៊ីន-កាបូអ៊ីដ្រាតស្មុគស្មាញ។
Collagen គឺជាប្រូតេអ៊ីនក្រៅកោសិកាដែលត្រូវបានបង្កើតឡើងដោយកោសិកានៃជាលិកាភ្ជាប់ដែលជាផ្នែកមួយនៃសរីរាង្គទាំងអស់។ ដូច្នេះជាមួយនឹងការខូចខាតដល់ collagen (ឬការរំលោភលើការបង្កើតរបស់វា) ការរំលោភលើមុខងារគាំទ្រនៃជាលិកាភ្ជាប់នៃសរីរាង្គកើតឡើង។
ខ្សែសង្វាក់ alpha polypeptide បញ្ចប់ដោយការរួមបញ្ចូលគ្នានៃអាស៊ីតអាមីណូ valine-leucine ហើយខ្សែសង្វាក់ beta polypeptide បញ្ចប់ដោយការរួមផ្សំ valine-histidine-leucine ។ ខ្សែសង្វាក់អាល់ហ្វា និងបេតាប៉ូលីបទីតនៅក្នុងម៉ូលេគុលអេម៉ូក្លូប៊ីនមិនត្រូវបានដាក់ជាជួរទេ នេះគឺជារចនាសម្ព័ន្ធចម្បង។ ដោយសារតែអត្ថិភាពនៃកម្លាំង intramolecular ខ្សែសង្វាក់ polypeptide រមួលក្នុងទម្រង់ជា alpha-helix helix ធម្មតានៃប្រូតេអ៊ីន (រចនាសម្ព័ន្ធបន្ទាប់បន្សំ)។ helix alpha-helix ខ្លួនវាផ្ទាល់សម្រាប់ខ្សែសង្វាក់អាល់ហ្វា- និងបេតា-ប៉ូលីពទីត រុំព័ទ្ធជុំវិញ បង្កើតជា plexuses រាងពងក្រពើ (រចនាសម្ព័ន្ធទីបី) ។ ផ្នែកដាច់ដោយឡែកនៃខ្សែសង្វាក់ alpha-helix នៃខ្សែសង្វាក់ polypeptide ត្រូវបានសម្គាល់ជាអក្សរឡាតាំងពី A ដល់ H ។ ខ្សែសង្វាក់ alpha និង beta polypeptide កម្រិតទីបីគឺស្ថិតនៅចន្លោះក្នុងសមាមាត្រជាក់លាក់មួយ - រចនាសម្ព័ន្ធ quaternary ។ ពួកវាត្រូវបានភ្ជាប់ទៅគ្នាទៅវិញទៅមកមិនមែនដោយចំណងគីមីពិតនោះទេ ប៉ុន្តែដោយកម្លាំងអន្តរម៉ូលេគុល។
វាបានប្រែក្លាយថាមនុស្សម្នាក់មានអេម៉ូក្លូប៊ីនធម្មតាបីប្រភេទ៖ អំប្រ៊ីយ៉ុង - U ទារក - F និងអេម៉ូក្លូប៊ីនមនុស្សពេញវ័យ - A. HbU (ដាក់ឈ្មោះតាមអក្សរដំបូងនៃពាក្យស្បូន) កើតឡើងនៅក្នុងអំប្រ៊ីយ៉ុងរវាង 7 និង 12 សប្តាហ៍នៃជីវិត។ បន្ទាប់មកវាបាត់ ហើយលេចចេញជាអេម៉ូក្លូប៊ីនរបស់ទារក ដែលបន្ទាប់ពីខែទី 3 គឺជាអេម៉ូក្លូប៊ីនសំខាន់របស់គភ៌។ នេះត្រូវបានបន្តដោយអេម៉ូក្លូប៊ីនមនុស្សពេញវ័យធម្មតាបន្តិចម្តង ៗ ដែលហៅថា HbA បន្ទាប់ពីអក្សរដំបូងនៃពាក្យអង់គ្លេស "មនុស្សពេញវ័យ" ។ បរិមាណអេម៉ូក្លូប៊ីនរបស់ទារកមានការថយចុះជាលំដាប់ ដូច្នេះនៅពេលកើត 80% នៃអេម៉ូក្លូប៊ីនគឺ HbA ហើយមានតែ 20% ប៉ុណ្ណោះគឺ HbF ។ បន្ទាប់ពីកំណើត អេម៉ូក្លូប៊ីនរបស់គភ៌បន្តថយចុះ ហើយនៅអាយុ 2-3 ឆ្នាំមានត្រឹមតែ 1-2% ប៉ុណ្ណោះ។ ចំនួនដូចគ្នានៃអេម៉ូក្លូប៊ីនរបស់ទារកក្នុងមនុស្សពេញវ័យ។ បរិមាណ HbF លើសពី 2% ត្រូវបានចាត់ទុកថាជារោគសាស្ត្រសម្រាប់មនុស្សពេញវ័យ និងចំពោះកុមារដែលមានអាយុលើសពី 3 ឆ្នាំ។
បន្ថែមពីលើប្រភេទធម្មតានៃអេម៉ូក្លូប៊ីន វ៉ារ្យ៉ង់រោគសាស្ត្ររបស់វាច្រើនជាង 50 ត្រូវបានគេស្គាល់នាពេលបច្ចុប្បន្ន។ ពួកគេត្រូវបានដាក់ឈ្មោះដំបូងជាអក្សរឡាតាំង។ អក្សរ B គឺអវត្តមានក្នុងការកំណត់ប្រភេទអេម៉ូក្លូប៊ីន ព្រោះវាកំណត់ពីដំបូង HbS ។
អេម៉ូក្លូប៊ីន (Hb)- chromoprotein ដែលមាននៅក្នុង erythrocytes និងចូលរួមក្នុងការដឹកជញ្ជូនអុកស៊ីសែនទៅជាលិកា។ អេម៉ូក្លូប៊ីនមនុស្សពេញវ័យត្រូវបានគេហៅថាអេម៉ូក្លូប៊ីនអេ (HbA) ។ ទំងន់ម៉ូលេគុលរបស់វាគឺប្រហែល 65,000 Da ។ ម៉ូលេគុល Hb A មានរចនាសម្ព័ន្ធ quaternary និងរួមបញ្ចូលទាំងបួនរង - ខ្សែសង្វាក់ polypeptide (តំណាង α1, α2, β1 និង β2) ដែលនីមួយៗត្រូវបានភ្ជាប់ជាមួយ heme ។
ចងចាំថាអេម៉ូក្លូប៊ីនគឺជាប្រូតេអ៊ីន allosteric ម៉ូលេគុលរបស់វាអាចផ្លាស់ប្តូរពីទម្រង់មួយទៅទម្រង់មួយទៀត។ នេះផ្លាស់ប្តូរភាពស្និទ្ធស្នាលនៃប្រូតេអ៊ីនសម្រាប់ ligands ។ ការអនុលោមតាមភាពស្និទ្ធស្នាលតិចបំផុតសម្រាប់លីហ្គែនត្រូវបានគេហៅថា strained ឬ T-conformation ។ ការអនុលោមតាមភាពស្និទ្ធស្នាលខ្ពស់បំផុតសម្រាប់ ligand ត្រូវបានគេហៅថាការបន្ធូរបន្ថយឬ R-conformation ។
ការអនុលោមតាម R- និង T នៃម៉ូលេគុលអេម៉ូក្លូប៊ីនស្ថិតក្នុងស្ថានភាពលំនឹងថាមវន្ត៖
កត្តាបរិស្ថានផ្សេងៗអាចផ្លាស់ប្តូរតុល្យភាពនេះក្នុងទិសដៅមួយឬផ្សេងទៀត។ និយតករ Allosteric ដែលប៉ះពាល់ដល់ទំនាក់ទំនងនៃ Hb សម្រាប់ O2 គឺ: 1) អុកស៊ីសែន; 2) ការផ្តោតអារម្មណ៍ H + (pH នៃមធ្យម); 3) កាបូនឌីអុកស៊ីត (CO2); 4) 2,3-diphosphoglycerate (DPG) ។ ការភ្ជាប់នៃម៉ូលេគុលអុកស៊ីហ៊្សែនទៅនឹងផ្នែករងនៃអេម៉ូក្លូប៊ីនមួយ ជំរុញការផ្លាស់ប្តូរនៃការអនុលោមតាមភាពតានតឹងទៅជាការសម្រាក និងបង្កើនភាពស្និទ្ធស្នាលនៃអុកស៊ីសែននៃផ្នែករងផ្សេងទៀតនៃម៉ូលេគុលអេម៉ូក្លូប៊ីនដូចគ្នា។ បាតុភូតនេះត្រូវបានគេហៅថាឥទ្ធិពលសហករណ៍។ លក្ខណៈស្មុគ្រស្មាញនៃការភ្ជាប់អេម៉ូក្លូប៊ីនទៅនឹងអុកស៊ីហ៊្សែនត្រូវបានឆ្លុះបញ្ចាំងនៅក្នុងខ្សែកោងតិត្ថិភាពអេម៉ូក្លូប៊ីន O2 ដែលមានរាងអក្សរ S (រូបភាព 3.1) ។

រូបភាព 3.1 ។ខ្សែកោងនៃការតិត្ថិភាពនៃ myoglobin (1) និង hemoglobin (2) ជាមួយនឹងអុកស៊ីសែន។
ទម្រង់ម៉ូលេគុលអេម៉ូក្លូប៊ីនខុសគ្នាពីគ្នាទៅវិញទៅមកនៅក្នុងរចនាសម្ព័ន្ធនៃខ្សែសង្វាក់ polypeptide ។ ឧទាហរណ៏នៃប្រភេទអេម៉ូក្លូប៊ីនបែបនេះដែលមាននៅក្រោមលក្ខខណ្ឌសរីរវិទ្យាគឺ អេម៉ូក្លូប៊ីនទារក (HbF)មានវត្តមាននៅក្នុងឈាមក្នុងដំណាក់កាលអំប្រ៊ីយ៉ុងនៃការអភិវឌ្ឍន៍មនុស្ស។ មិនដូច HbA ទេម៉ូលេគុលរបស់វាមាន 2 α- និង 2 γ-chains (នោះគឺ β-chains ត្រូវបានជំនួសដោយ γ-chains) ។ អេម៉ូក្លូប៊ីនបែបនេះមានទំនាក់ទំនងខ្ពស់ជាងសម្រាប់អុកស៊ីសែន។ នេះគឺជាអ្វីដែលអនុញ្ញាតឱ្យអំប្រ៊ីយ៉ុងទទួលបានអុកស៊ីសែនពីឈាមរបស់ម្តាយតាមរយៈសុក។ ភ្លាមៗបន្ទាប់ពីកំណើត HbF នៅក្នុងឈាមរបស់ទារកត្រូវបានជំនួសដោយ HbA ។
ជាឧទាហរណ៍នៃអេម៉ូក្លូប៊ីនមិនធម្មតា ឬរោគសាស្ត្រ យើងអាចដកស្រង់នូវអ្វីដែលបានរៀបរាប់រួចមកហើយ (សូមមើល 2.4 ។) អេម៉ូក្លូប៊ីន S ដែលត្រូវបានរកឃើញនៅក្នុងអ្នកជំងឺដែលមានជំងឺស្លេកស្លាំងកោសិកា។ ដូចដែលអ្នកបានដឹងហើយថាវាខុសគ្នាពីអេម៉ូក្លូប៊ីន A ដោយជំនួស glutamate ជាមួយ valine នៅក្នុងខ្សែβ-chains ។ ការជំនួសអាស៊ីតអាមីណូនេះបណ្តាលឱ្យមានការថយចុះនៃការរលាយ HbS នៅក្នុងទឹក និងការថយចុះនៃទំនាក់ទំនងរបស់វាចំពោះ O2 ។
1. ហេតុអ្វីបានជាប្រូតេអ៊ីនត្រូវបានគេចាត់ទុកថាជាប៉ូលីម៊ែរ?
ចម្លើយ។ ប្រូតេអ៊ីនគឺជាសារធាតុប៉ូលីម៊ែរ ពោលគឺម៉ូលេគុលដែលបង្កើតឡើងដូចជាខ្សែសង្វាក់ពីឯកតា monomer ដដែលៗ ឬអនុunits ដែលមានអាស៊ីតអាមីណូតភ្ជាប់ក្នុងលំដាប់ជាក់លាក់ដោយចំណង peptide ។ ពួកវាជាធាតុផ្សំជាមូលដ្ឋាន និងចាំបាច់នៃសារពាង្គកាយទាំងអស់។
មានប្រូតេអ៊ីនសាមញ្ញ (ប្រូតេអ៊ីន) និងប្រូតេអ៊ីនស្មុគស្មាញ (ប្រូតេអ៊ីន) ។ ប្រូតេអ៊ីនគឺជាប្រូតេអ៊ីនដែលម៉ូលេគុលរបស់វាមានសមាសធាតុប្រូតេអ៊ីនប៉ុណ្ណោះ។ ជាមួយនឹង hydrolysis ពេញលេញរបស់ពួកគេអាស៊ីតអាមីណូត្រូវបានបង្កើតឡើង។
ប្រូតេអ៊ីនត្រូវបានគេហៅថាប្រូតេអ៊ីនស្មុគស្មាញដែលម៉ូលេគុលដែលខុសគ្នាយ៉ាងខ្លាំងពីម៉ូលេគុលប្រូតេអ៊ីននៅក្នុងនោះបន្ថែមលើសមាសធាតុប្រូតេអ៊ីនខ្លួនវាមានសមាសធាតុទម្ងន់ម៉ូលេគុលទាបនៃធម្មជាតិដែលមិនមែនជាប្រូតេអ៊ីន។
2. តើប្រូតេអ៊ីនមានមុខងារអ្វីខ្លះដែលអ្នកដឹង?
ចម្លើយ។ ប្រូតេអ៊ីនអនុវត្តមុខងារដូចខាងក្រោមៈ ការកសាងថាមពល កាតាលីករ ការការពារ ការដឹកជញ្ជូន ការចុះកិច្ចសន្យា សញ្ញា និងផ្សេងៗទៀត។
សំណួរបន្ទាប់ពី § 11
1. តើសារធាតុអ្វីហៅថាប្រូតេអ៊ីន?
ចម្លើយ។ ប្រូតេអ៊ីន ឬប្រូតេអ៊ីន គឺជាសារធាតុប៉ូលីម៊ែរជីវសាស្រ្ត ដែលម៉ូណូមឺរជាអាស៊ីតអាមីណូ។ អាស៊ីតអាមីណូទាំងអស់មានក្រុមអាមីណូ (-NH2) និងក្រុម carboxyl (-COOH) ហើយខុសគ្នានៅក្នុងរចនាសម្ព័ន្ធ និងលក្ខណៈសម្បត្តិរបស់រ៉ាឌីកាល់។ អាស៊ីតអាមីណូត្រូវបានភ្ជាប់ជាមួយគ្នាដោយចំណង peptide ដូច្នេះប្រូតេអ៊ីនត្រូវបានគេហៅថា polypeptides ផងដែរ។
ចម្លើយ។ ម៉ូលេគុលប្រូតេអ៊ីនអាចទទួលយកទម្រង់លំហផ្សេងៗគ្នា - ទម្រង់ដែលតំណាងឱ្យកម្រិតបួននៃអង្គការរបស់ពួកគេ។ លំដាប់លីនេអ៊ែរនៃអាស៊ីតអាមីណូនៅក្នុងសមាសភាពនៃខ្សែសង្វាក់ polypeptide តំណាងឱ្យរចនាសម្ព័ន្ធចម្បងនៃប្រូតេអ៊ីន។ វាមានលក្ខណៈពិសេសចំពោះប្រូតេអ៊ីនណាមួយ ហើយកំណត់រូបរាង លក្ខណៈសម្បត្តិ និងមុខងាររបស់វា។
3. តើរចនាសម្ព័ន្ធប្រូតេអ៊ីនបន្ទាប់បន្សំ ទីបី និងត្រីមាសត្រូវបានបង្កើតឡើងយ៉ាងដូចម្តេច?
ចម្លើយ។ រចនាសម្ព័ន្ធបន្ទាប់បន្សំនៃប្រូតេអ៊ីនត្រូវបានបង្កើតឡើងដោយការបង្កើតចំណងអ៊ីដ្រូសែនរវាងក្រុម -CO- និង -NH- ។ ក្នុងករណីនេះខ្សែសង្វាក់ polypeptide ត្រូវបានរមួលទៅជាវង់។ helix អាចទទួលបានការកំណត់រចនាសម្ព័ន្ធនៃ globule ចាប់តាំងពីចំណងផ្សេងៗកើតឡើងរវាងរ៉ាឌីកាល់អាស៊ីតអាមីណូនៅក្នុង helix ។ Globule គឺជារចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីន។ ប្រសិនបើ globules ជាច្រើនត្រូវបានបញ្ចូលគ្នាទៅក្នុងស្មុគស្មាញតែមួយ នោះរចនាសម្ព័ន្ធ quaternary កើតឡើង។ ឧទាហរណ៍ អេម៉ូក្លូប៊ីនក្នុងឈាមរបស់មនុស្សត្រូវបានបង្កើតឡើងដោយកោសិកាចំនួនបួន។
4. អ្វីទៅជាប្រូតេអ៊ីន denaturation?
ចម្លើយ។ ការរំលោភលើរចនាសម្ព័ន្ធធម្មជាតិនៃប្រូតេអ៊ីនត្រូវបានគេហៅថា denaturation ។ នៅក្រោមឥទ្ធិពលនៃកត្តាមួយចំនួន (គីមី វិទ្យុសកម្ម សីតុណ្ហភាព។ល។) រចនាសម្ព័ន្ធ quaternary ទីបី និងទីពីរនៃប្រូតេអ៊ីនអាចត្រូវបានបំផ្លាញ។ ប្រសិនបើសកម្មភាពនៃកត្តាឈប់នោះប្រូតេអ៊ីនអាចស្តាររចនាសម្ព័ន្ធរបស់វា។ ប្រសិនបើសកម្មភាពនៃកត្តាកើនឡើងនោះរចនាសម្ព័ន្ធចម្បងនៃប្រូតេអ៊ីនដែលជាខ្សែសង្វាក់ polypeptide ក៏ត្រូវបានបំផ្លាញផងដែរ។ នេះគឺជាដំណើរការដែលមិនអាចត្រឡប់វិញបានរួចទៅហើយ - ប្រូតេអ៊ីនមិនអាចស្តាររចនាសម្ព័ន្ធឡើងវិញបានទេ។
5. តើប្រូតេអ៊ីនត្រូវបានបែងចែកទៅជាសាមញ្ញ និងស្មុគស្មាញនៅលើមូលដ្ឋានអ្វី?
ចម្លើយ។ ប្រូតេអ៊ីនសាមញ្ញត្រូវបានផ្សំឡើងដោយអាស៊ីដអាមីណូ។ ប្រូតេអ៊ីនស្មុគស្មាញអាចរួមបញ្ចូលសារធាតុសរីរាង្គផ្សេងទៀត: កាបូអ៊ីដ្រាត (បន្ទាប់មកពួកគេត្រូវបានគេហៅថា glycoproteins) ខ្លាញ់ (lipoproteins) អាស៊ីត nucleic (nucleoproteins) ។
6. តើប្រូតេអ៊ីនមានមុខងារអ្វីខ្លះដែលអ្នកដឹង?
ចម្លើយ។ មុខងារសំណង់ (ប្លាស្ទិក) ។ ប្រូតេអ៊ីនគឺជាធាតុផ្សំនៃរចនាសម្ព័ន្ធនៃភ្នាសជីវសាស្រ្ត និងសរីរាង្គកោសិកា ហើយក៏ជាផ្នែកនៃរចនាសម្ព័ន្ធទ្រទ្រង់រាងកាយ សក់ ក្រចក សរសៃឈាមផងដែរ។ មុខងារអង់ស៊ីម។ ប្រូតេអ៊ីនបម្រើជាអង់ស៊ីម ពោលគឺកាតាលីករជីវសាស្រ្តដែលបង្កើនល្បឿននៃប្រតិកម្មគីមីជីវៈរាប់សិបលានដង។ ឧទាហរណ៍មួយគឺអាមីឡាសដែលបំបែកម្សៅទៅជា monosaccharides ។ មុខងារកុងតាក់ (ម៉ូទ័រ) ។ វាត្រូវបានអនុវត្តដោយប្រូតេអ៊ីន contractile ពិសេសដែលធានាចលនានៃកោសិកានិងរចនាសម្ព័ន្ធ intracellular ។ អរគុណចំពោះពួកគេ ក្រូម៉ូសូមផ្លាស់ទីកំឡុងពេលបែងចែកកោសិកា ហើយ flagella និង cilia កំណត់កោសិកាប្រូតូហ្សូអាក្នុងចលនា។ លក្ខណៈសម្បត្តិ contractile នៃប្រូតេអ៊ីន actin និង myosin ស្ថិតនៅក្រោមមុខងារសាច់ដុំ។ មុខងារដឹកជញ្ជូន។ ប្រូតេអ៊ីនត្រូវបានចូលរួមនៅក្នុងការដឹកជញ្ជូនម៉ូលេគុលនិងអ៊ីយ៉ុងនៅក្នុងខ្លួន (អេម៉ូក្លូប៊ីនដឹកអុកស៊ីសែនពីសួតទៅសរីរាង្គនិងជាលិកា សេរ៉ូមអាល់ប៊ុយមីនពាក់ព័ន្ធនឹងការដឹកជញ្ជូនអាស៊ីតខ្លាញ់) ។ មុខងារការពារ។ វាមាននៅក្នុងការការពាររាងកាយពីការខូចខាត និងការលុកលុយរបស់ប្រូតេអ៊ីន និងបាក់តេរីបរទេស។ ប្រូតេអ៊ីនអង្គបដិប្រាណដែលផលិតដោយ lymphocytes បង្កើតការការពាររបស់រាងកាយប្រឆាំងនឹងការឆ្លងមេរោគបរទេស thrombin និង fibrin ត្រូវបានចូលរួមនៅក្នុងការបង្កើតកំណកឈាមដោយហេតុនេះជួយឱ្យរាងកាយជៀសវាងការបាត់បង់ឈាមច្រើន។ មុខងារបទប្បញ្ញត្តិ។ វាត្រូវបានអនុវត្តដោយប្រូតេអ៊ីនអ័រម៉ូន។ ពួកគេត្រូវបានចូលរួមនៅក្នុងបទប្បញ្ញត្តិនៃសកម្មភាពកោសិកានិងដំណើរការសំខាន់ទាំងអស់នៃរាងកាយ។ ដូច្នេះ អាំងស៊ុយលីនធ្វើនិយ័តកម្មជាតិស្ករក្នុងឈាម និងរក្សាវានៅកម្រិតជាក់លាក់មួយ។ មុខងារសញ្ញា។ ប្រូតេអ៊ីនដែលបង្កប់ក្នុងភ្នាសកោសិកាអាចផ្លាស់ប្តូររចនាសម្ព័ន្ធរបស់វាក្នុងការឆ្លើយតបនឹងការរលាក។ ដូច្នេះសញ្ញាត្រូវបានបញ្ជូនពីបរិយាកាសខាងក្រៅចូលទៅក្នុងកោសិកា។ មុខងារថាមពល។ វាកម្រណាស់នៅក្នុងប្រូតេអ៊ីន។ ជាមួយនឹងការវិភាគពេញលេញនៃប្រូតេអ៊ីន 1 ក្រាមថាមពល 17.6 kJ អាចត្រូវបានបញ្ចេញ។ ទោះជាយ៉ាងណាក៏ដោយ ប្រូតេអ៊ីនគឺជាសមាសធាតុដ៏មានតម្លៃសម្រាប់រាងកាយ។ ដូច្នេះ ការបំបែកប្រូតេអ៊ីនជាធម្មតាកើតឡើងចំពោះអាស៊ីតអាមីណូ ដែលខ្សែសង្វាក់ polypeptide ថ្មីត្រូវបានបង្កើតឡើង។ អរម៉ូនប្រូតេអ៊ីនគ្រប់គ្រងសកម្មភាពរបស់កោសិកា និងដំណើរការសំខាន់ៗទាំងអស់នៃរាងកាយ។ ដូច្នេះនៅក្នុងខ្លួនមនុស្ស somatotropin ត្រូវបានចូលរួមនៅក្នុងបទប្បញ្ញត្តិនៃការលូតលាស់រាងកាយ អាំងស៊ុយលីនរក្សាកម្រិតជាតិស្ករក្នុងឈាមថេរ។
7. តើប្រូតេអ៊ីនអរម៉ូនមានតួនាទីអ្វី?
ចម្លើយ។ មុខងារនិយតកម្មមាននៅក្នុងប្រូតេអ៊ីនអរម៉ូន (និយតករ) ។ ពួកគេគ្រប់គ្រងដំណើរការសរីរវិទ្យាផ្សេងៗ។ ជាឧទាហរណ៍ អ័រម៉ូនដែលគេស្គាល់ជាងគេគឺអាំងស៊ុយលីន ដែលគ្រប់គ្រងកម្រិតជាតិស្ករក្នុងឈាម។ ជាមួយនឹងកង្វះអាំងស៊ុយលីននៅក្នុងខ្លួន ជំងឺដែលគេស្គាល់ថាជាជំងឺទឹកនោមផ្អែមកើតឡើង។
8. តើប្រូតេអ៊ីនអង់ស៊ីមមានមុខងារអ្វីខ្លះ?
ចម្លើយ។ អង់ស៊ីមគឺជាកាតាលីករជីវសាស្រ្ត ពោលគឺបង្កើនល្បឿននៃប្រតិកម្មគីមីរាប់រយលានដង។ អង់ស៊ីមមានភាពជាក់លាក់យ៉ាងតឹងរឹងទាក់ទងនឹងសារធាតុដែលមានប្រតិកម្ម។ ប្រតិកម្មនីមួយៗត្រូវបានបំប្លែងដោយអង់ស៊ីមរបស់វា។
9. ហេតុអ្វីបានជាប្រូតេអ៊ីនកម្រប្រើជាប្រភពថាមពល?
ចម្លើយ។ អាមីណូអាស៊ីតប្រូតេអ៊ីន monomers គឺជាវត្ថុធាតុដើមដ៏មានតម្លៃសម្រាប់បង្កើតម៉ូលេគុលប្រូតេអ៊ីនថ្មី។ ដូច្នេះ ការបំបែកសារធាតុ polypeptides ទាំងស្រុងទៅនឹងសារធាតុអសរីរាង្គគឺកម្រណាស់។ អាស្រ័យហេតុនេះ មុខងារថាមពលដែលមាននៅក្នុងការបញ្ចេញថាមពលកំឡុងពេលបំបែកពេញលេញ ត្រូវបានអនុវត្តដោយប្រូតេអ៊ីនកម្រណាស់។
ស៊ុតពណ៌សគឺជាប្រូតេអ៊ីនធម្មតា។ ស្វែងយល់ថាតើនឹងមានអ្វីកើតឡើងចំពោះវា ប្រសិនបើវាត្រូវបានប៉ះពាល់នឹងទឹក ជាតិអាល់កុល អាសេតូន អាស៊ីត អាល់កាឡាំង ប្រេងបន្លែ សីតុណ្ហភាពខ្ពស់ ។ល។
ចម្លើយ។ ជាលទ្ធផលនៃសកម្មភាពនៃសីតុណ្ហភាពខ្ពស់នៅលើប្រូតេអ៊ីននៃស៊ុត, denaturation នៃប្រូតេអ៊ីននឹងកើតឡើង។ នៅក្រោមសកម្មភាពនៃជាតិអាល់កុលអាសេតូនអាស៊ីតឬអាល់កាឡាំងប្រហែលរឿងដូចគ្នាកើតឡើង: ប្រូតេអ៊ីនបត់។ នេះគឺជាដំណើរការមួយដែលមានការរំលោភលើរចនាសម្ព័ន្ធទីបី និង quaternary នៃប្រូតេអ៊ីនដោយសារតែការបំបែកនៃចំណងអ៊ីដ្រូសែន និងអ៊ីយ៉ុង។
នៅក្នុងទឹកនិងប្រេងបន្លែប្រូតេអ៊ីនរក្សារចនាសម្ព័ន្ធរបស់វា។
កិនមើមដំឡូងឆៅមួយដុំ។ យកបំពង់សាកល្បងចំនួនបី ហើយដាក់ដំឡូងបំពងក្នុងចំនួនតិចតួច។
ដាក់បំពង់សាកល្បងទីមួយនៅក្នុងទូរទឹកកកនៃទូទឹកកក, ទីពីរ - នៅលើធ្នើខាងក្រោមនៃទូទឹកកក, និងទីបី - នៅក្នុងពាងទឹកក្តៅ (t = 40 ° C) ។ បន្ទាប់ពី 30 នាទី, យកបំពង់សាកល្បងហើយទម្លាក់បរិមាណអ៊ីដ្រូសែន peroxide តិចតួចចូលទៅក្នុងនីមួយៗ។ សង្កេតមើលអ្វីដែលនឹងកើតឡើងនៅក្នុងបំពង់សាកល្បងនីមួយៗ។ ពន្យល់ពីលទ្ធផលរបស់អ្នក។
ចម្លើយ។ ការពិសោធន៍នេះបង្ហាញពីសកម្មភាពនៃអង់ស៊ីម catalase កោសិការស់នៅលើអ៊ីដ្រូសែន peroxide ។ ជាលទ្ធផលនៃប្រតិកម្មអុកស៊ីហ្សែនត្រូវបានបញ្ចេញ។ ថាមវន្តនៃការសំងាត់ vesicle អាចត្រូវបានប្រើដើម្បីវិនិច្ឆ័យសកម្មភាពរបស់អង់ស៊ីម។
បទពិសោធន៍បានអនុញ្ញាតឱ្យយើងជួសជុលលទ្ធផលដូចខាងក្រោម:
សកម្មភាពរបស់ catalase អាស្រ័យលើសីតុណ្ហភាព៖
1. បំពង់សាកល្បង 1: មិនមានពពុះទេ - នេះគឺដោយសារតែកោសិកាដំឡូងត្រូវបានបំផ្លាញនៅសីតុណ្ហភាពទាប។
2. បំពង់ទី 2: មានពពុះតិចតួច - ដោយសារតែសកម្មភាពរបស់អង់ស៊ីមនៅសីតុណ្ហភាពទាប។
3. បំពង់ទី 3: ពពុះច្រើន សីតុណ្ហភាពល្អបំផុត កាតាឡាសសកម្មណាស់។
ចាក់ទឹកពីរបីដំណក់ចូលក្នុងបំពង់សាកល្បងទីមួយជាមួយដំឡូង ទឹកអាស៊ីតពីរបីតំណក់ (ទឹកខ្មេះតុ) ចូលទៅក្នុងទីពីរ និងអាល់កាឡាំងចូលទៅក្នុងទីបី។
សង្កេតមើលអ្វីដែលនឹងកើតឡើងនៅក្នុងបំពង់សាកល្បងនីមួយៗ។ ពន្យល់ពីលទ្ធផលរបស់អ្នក។ គូរការសន្និដ្ឋានដោយខ្លួនឯង។
ចម្លើយ។ នៅពេលបន្ថែមទឹកគ្មានអ្វីកើតឡើងទេនៅពេលបន្ថែមអាស៊ីតការងងឹតខ្លះកើតឡើងនៅពេលបន្ថែមអាល់កាឡាំង "ពពុះ" - អាល់កាឡាំង hydrolysis ។
ការពិពណ៌នាសង្ខេប៖
បំណែកនៃសៀវភៅសិក្សា៖ គីមីវិទ្យាជីវសាស្រ្តជាមួយលំហាត់ និងកិច្ចការ៖ សៀវភៅសិក្សា / ed. សមាជិកដែលត្រូវគ្នា។ RAMN S.E. សេវើរិន។ M.: GEOTAR-Media, 2011. - 624 p.: ill. ម៉ូឌុលទី១៖ រចនាសម្ព័ន្ធ លក្ខណៈសម្បត្តិ និងមុខងារនៃប្រូតេអ៊ីន
ម៉ូឌុលទី១៖ រចនាសម្ព័ន្ធ លក្ខណៈសម្បត្តិ និងមុខងារនៃប្រូតេអ៊ីន
រចនាសម្ព័ន្ធម៉ូឌុល | ស្បែក |
ឯកតាម៉ូឌុល 1 | ១.១. ការរៀបចំរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីន។ ដំណាក់កាលនៃការបង្កើតការអនុលោមតាមប្រភពដើមនៃប្រូតេអ៊ីន ១.២. មូលដ្ឋានគ្រឹះនៃដំណើរការប្រូតេអ៊ីន។ ថ្នាំដូចជា ligands ប៉ះពាល់ដល់មុខងារប្រូតេអ៊ីន ១.៣. ប្រូតេអ៊ីន Denaturation និងលទ្ធភាពនៃការបង្កើតឡើងវិញដោយឯកឯងរបស់ពួកគេ។ |
ឯកតាម៉ូឌុល 2 | ១.៤. លក្ខណៈពិសេសនៃរចនាសម្ព័ន្ធនិងមុខងារនៃប្រូតេអ៊ីន oligomeric នៅលើឧទាហរណ៍នៃអេម៉ូក្លូប៊ីន ១.៥. រក្សាការអនុលោមតាមប្រភពដើមនៃប្រូតេអ៊ីននៅក្នុងកោសិកា ១.៦. ភាពខុសគ្នានៃប្រូតេអ៊ីន។ គ្រួសារប្រូតេអ៊ីននៅលើឧទាហរណ៍នៃ immunoglobulins ១.៧. លក្ខណៈសម្បត្តិរូបវិទ្យា - គីមីនៃប្រូតេអ៊ីននិងវិធីសាស្រ្តសម្រាប់ការបំបែករបស់ពួកគេ។ |
ឯកតាម៉ូឌុល 1 ការរៀបចំរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីន MONOMERIC និងមូលដ្ឋាននៃមុខងាររបស់ពួកគេ
គោលបំណងនៃការសិក្សា ដើម្បីអាច៖
1. ប្រើប្រាស់ចំណេះដឹងអំពីលក្ខណៈរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីន និងការពឹងផ្អែកនៃមុខងារប្រូតេអ៊ីនលើរចនាសម្ព័ន្ធរបស់វា ដើម្បីយល់ពីយន្តការនៃការអភិវឌ្ឍនៃជំងឺប្រូតេអ៊ីនពីតំណពូជ និងដែលទទួលបាន។
2. ពន្យល់ពីយន្តការនៃសកម្មភាពព្យាបាលនៃឱសថមួយចំនួនដូចជា ligands ដែលមានអន្តរកម្មជាមួយប្រូតេអ៊ីន និងផ្លាស់ប្តូរសកម្មភាពរបស់វា។
3. ប្រើប្រាស់ចំនេះដឹងអំពីរចនាសម្ព័ន្ធ និងការកំណត់រចនាសម្ព័ន្ធនៃប្រូតេអ៊ីន ដើម្បីយល់ពីអស្ថិរភាពនៃរចនាសម្ព័ន្ធ និងមុខងារ និងទំនោរទៅរកការប្រែពណ៌នៅក្រោមលក្ខខណ្ឌផ្លាស់ប្តូរ។
4. ពន្យល់ពីការប្រើប្រាស់សារធាតុ denaturing ជាមធ្យោបាយសម្រាប់ការក្រៀវសម្ភារៈ និងឧបករណ៍វេជ្ជសាស្ត្រ ក៏ដូចជាថ្នាំសំលាប់មេរោគ។
ដឹង៖
1. កម្រិតនៃការរៀបចំរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីន។
2. សារៈសំខាន់នៃរចនាសម្ព័ន្ធចម្បងនៃប្រូតេអ៊ីនដែលកំណត់ភាពចម្រុះនៃរចនាសម្ព័ន្ធនិងមុខងាររបស់ពួកគេ។
3. យន្តការនៃការបង្កើតមជ្ឈមណ្ឌលសកម្មនៅក្នុងប្រូតេអ៊ីន និងអន្តរកម្មជាក់លាក់របស់វាជាមួយ ligand ដែលបង្កប់ន័យមុខងាររបស់ប្រូតេអ៊ីន។
4. ឧទាហរណ៏នៃឥទ្ធិពលនៃ ligands exogenous (ថ្នាំ, ជាតិពុល, សារធាតុពុល) លើការអនុលោមតាមនិងសកម្មភាពមុខងារនៃប្រូតេអ៊ីន។
5. មូលហេតុ និងផលប៉ះពាល់នៃប្រូតេអ៊ីន denaturation កត្តាដែលបណ្តាលឱ្យ denaturation ។
6. ឧទាហរណ៍នៃការប្រើប្រាស់កត្តា denaturing ក្នុងឱសថជាថ្នាំសំលាប់មេរោគ និងមធ្យោបាយសម្រាប់ការក្រៀវឧបករណ៍វេជ្ជសាស្ត្រ។
ប្រធានបទ ១.១. ការរៀបចំរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីន។ ដំណាក់កាលបង្កើតជនជាតិដើម
ការអនុលោមតាមប្រូតេអ៊ីន
កំប្រុក គឺជា heteropolymers ។ ម៉ូលេគុល (ឧ. រួមមានម៉ូណូមឺរផ្សេងៗ)។ ប្រូតេអ៊ីន monomers គឺជាអាស៊ីតអាមីណូ 20 ប្រភេទដែលទាក់ទងគ្នាទៅវិញទៅមកដោយចំណង peptide ។
សំណុំនិងលំដាប់នៃការតភ្ជាប់នៃអាស៊ីតអាមីណូនៅក្នុងប្រូតេអ៊ីនត្រូវបានកំណត់ដោយរចនាសម្ព័ន្ធនៃហ្សែនដែលត្រូវគ្នានៅក្នុង DNA របស់បុគ្គល។ ប្រូតេអ៊ីននីមួយៗស្របតាមរចនាសម្ព័ន្ធជាក់លាក់របស់វាអនុវត្តមុខងារផ្ទាល់ខ្លួនរបស់វា។ សំណុំនៃប្រូតេអ៊ីននៃសារពាង្គកាយដែលបានផ្តល់ឱ្យ ( proteome) កំណត់លក្ខណៈ phenotypic របស់វា ក៏ដូចជាវត្តមាននៃជំងឺតំណពូជ ឬ predisposition ចំពោះការអភិវឌ្ឍន៍របស់វា។
1. អាស៊ីតអាមីណូដែលបង្កើតជាប្រូតេអ៊ីន។ ចំណង peptide ។
ប្រូតេអ៊ីនគឺជា heteropolymer ដែលត្រូវបានបង្កើតឡើងពី monomers - អាស៊ីតអាមីណូ 20 ។
រូបមន្តទូទៅនៃអាស៊ីតអាមីណូត្រូវបានបង្ហាញខាងក្រោម។

អាស៊ីតអាមីណូមានភាពខុសប្លែកគ្នានៅក្នុងរចនាសម្ព័ន្ធ ទំហំ លក្ខណៈសម្បត្តិរូបវិទ្យានៃរ៉ាឌីកាល់ដែលភ្ជាប់ទៅនឹងអាតូម α-កាបូន។ ក្រុមមុខងារនៃអាស៊ីតអាមីណូកំណត់លក្ខណៈនៃលក្ខណៈសម្បត្តិនៃអាស៊ីតអាមីណូផ្សេងៗគ្នា។ រ៉ាឌីកាល់ដែលមាននៅក្នុងអាស៊ីតអាមីណូអាចបែងចែកជាក្រុមជាច្រើន៖
ប្រូលីនមិនដូចប្រូតេអ៊ីន monomers ផ្សេងទៀត 19 មិនមែនជាអាស៊ីតអាមីណូទេប៉ុន្តែជាអាស៊ីត imino រ៉ាឌីកាល់នៅក្នុង proline ត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងអាតូមα-carbon និងក្រុម imino ។

អាស៊ីតអាមីណូខុសគ្នាក្នុងភាពរលាយរបស់វានៅក្នុងទឹក។នេះគឺដោយសារតែសមត្ថភាពនៃរ៉ាឌីកាល់ដើម្បីធ្វើអន្តរកម្មជាមួយនឹងទឹក (ដើម្បីឱ្យមានជាតិទឹក)។
ទៅ hydrophilicរួមបញ្ចូលរ៉ាឌីកាល់ដែលមានក្រុមមុខងារ anionic, cationic និង polar uncharged ។
ទៅ hydrophobicរួមបញ្ចូលរ៉ាឌីកាល់ដែលមានក្រុមមេទីល ខ្សែសង្វាក់ aliphatic ឬវដ្ត។
2. ចំណង Peptide ភ្ជាប់អាស៊ីតអាមីណូទៅជា peptides ។កំឡុងពេលសំយោគ peptide ក្រុម α-carboxyl នៃអាស៊ីតអាមីណូមួយធ្វើអន្តរកម្មជាមួយក្រុម α-amino នៃអាស៊ីតអាមីណូមួយទៀតដើម្បីបង្កើត ចំណង peptide៖
ប្រូតេអ៊ីនគឺជា polypeptides, i.e. ប៉ូលីមែរលីនេអ៊ែរនៃអាស៊ីតអាមីណូដែលតភ្ជាប់ដោយចំណង peptide (រូបភាព 1.1 ។ )
 អង្ករ។ ១.១. ពាក្យដែលប្រើក្នុងការពិពណ៌នាអំពីរចនាសម្ព័ន្ធនៃ peptides
អង្ករ។ ១.១. ពាក្យដែលប្រើក្នុងការពិពណ៌នាអំពីរចនាសម្ព័ន្ធនៃ peptides
អាស៊ីតអាមីណូ monomers ដែលបង្កើតជា polypeptides ត្រូវបានគេហៅថា សំណល់អាស៊ីតអាមីណូ។ខ្សែសង្វាក់នៃក្រុមដដែលៗ - NH-CH-CO- ទម្រង់ ឆ្អឹងខ្នង peptide ។សំណល់អាស៊ីតអាមីណូដែលមានក្រុម α-amino ឥតគិតថ្លៃត្រូវបានគេហៅថា N-terminal ហើយមួយមានក្រុម α-carboxyl ឥតគិតថ្លៃត្រូវបានគេហៅថា C-terminal ។ Peptides ត្រូវបានសរសេរ និងអានពី N-terminus ទៅ C-terminus ។
ចំណង peptide ដែលបង្កើតឡើងដោយក្រុម imino នៃ proline ខុសពីចំណង peptide ផ្សេងទៀត៖ អាតូមអាសូតនៃក្រុម peptide ខ្វះអ៊ីដ្រូសែន
ផ្ទុយទៅវិញ មានចំណងជាមួយរ៉ាឌីកាល់ ជាលទ្ធផល មួយចំហៀងនៃវដ្តត្រូវបានរួមបញ្ចូលនៅក្នុងឆ្អឹងខ្នង peptide៖

Peptides មានភាពខុសប្លែកគ្នានៅក្នុងសមាសភាពអាស៊ីតអាមីណូ ចំនួននៃអាស៊ីតអាមីណូ និងលំដាប់នៃអាស៊ីតអាមីណូ ឧទាហរណ៍ Ser-Ala-Glu-Gis និង His-Glu-Ala-Ser គឺជា peptides ពីរផ្សេងគ្នា។
ចំណង Peptide គឺខ្លាំង ហើយលក្ខខណ្ឌដ៏អាក្រក់គឺត្រូវបានទាមទារសម្រាប់អ៊ីដ្រូលីស៊ីតដែលមិនមែនជាអង់ស៊ីមគីមីរបស់ពួកគេ៖ ប្រូតេអ៊ីនដែលបានវិភាគត្រូវបាន hydrolyzed នៅក្នុងអាស៊ីត hydrochloric ប្រមូលផ្តុំនៅសីតុណ្ហភាពប្រហែល 110 ° C សម្រាប់រយៈពេល 24 ម៉ោង។ នៅក្នុងកោសិការស់មួយ ចំណង peptide អាចត្រូវបានបំបែកដោយ អង់ស៊ីម proteolytic,បានហៅ ប្រូតេអ៊ីនឬ peptide hydrolases ។
3. រចនាសម្ព័ន្ធបឋមនៃប្រូតេអ៊ីន។សំណល់អាស៊ីតអាមីណូនៅក្នុងខ្សែសង្វាក់ peptide នៃប្រូតេអ៊ីនផ្សេងៗគ្នាមិនឆ្លាស់គ្នាដោយចៃដន្យទេ ប៉ុន្តែត្រូវបានរៀបចំតាមលំដាប់ជាក់លាក់មួយ។ លំដាប់លីនេអ៊ែរ ឬលំដាប់នៃសំណល់អាស៊ីតអាមីណូនៅក្នុងខ្សែសង្វាក់ polypeptide ត្រូវបានគេហៅថា រចនាសម្ព័ន្ធចម្បងនៃប្រូតេអ៊ីន។
រចនាសម្ព័ន្ធចម្បងនៃប្រូតេអ៊ីនបុគ្គលនីមួយៗត្រូវបានអ៊ិនកូដនៅក្នុងម៉ូលេគុល DNA (ក្នុងតំបន់ហៅថាហ្សែន) ហើយត្រូវបានអនុវត្តក្នុងអំឡុងពេលប្រតិចារិក (ការសរសេរព័ត៌មានឡើងវិញនៅលើ mRNA) និងការបកប្រែ (ការសំយោគរចនាសម្ព័ន្ធចម្បងរបស់ប្រូតេអ៊ីន)។ ដូច្នេះរចនាសម្ព័ន្ធចម្បងនៃប្រូតេអ៊ីនរបស់មនុស្សម្នាក់ៗគឺជាព័ត៌មានដែលទទួលបានពីឪពុកម្តាយទៅកូនដែលកំណត់លក្ខណៈរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីននៃសារពាង្គកាយដែលបានផ្តល់ឱ្យដែលមុខងារនៃប្រូតេអ៊ីនដែលមានស្រាប់អាស្រ័យ (រូបភាព 1.2 ។ ) ។
 អង្ករ។ ១.២. ទំនាក់ទំនងរវាង genotype និងការអនុលោមតាមប្រូតេអ៊ីនដែលត្រូវបានសំយោគនៅក្នុងរាងកាយរបស់បុគ្គល
អង្ករ។ ១.២. ទំនាក់ទំនងរវាង genotype និងការអនុលោមតាមប្រូតេអ៊ីនដែលត្រូវបានសំយោគនៅក្នុងរាងកាយរបស់បុគ្គល
ប្រូតេអ៊ីននីមួយៗមានប្រហែល 100,000 នៅក្នុងខ្លួនមនុស្ស ប្លែករចនាសម្ព័ន្ធបឋម។ ម៉ូលេគុលនៃប្រូតេអ៊ីនមួយប្រភេទ (ឧទាហរណ៍ អាល់ប៊ុយមីន) មានការជំនួសដូចគ្នានៃសំណល់អាស៊ីតអាមីណូ ដែលបែងចែកអាល់ប៊ុមប៊ីនពីប្រូតេអ៊ីននីមួយៗ។
លំដាប់នៃសំណល់អាស៊ីតអាមីណូនៅក្នុងខ្សែសង្វាក់ peptide អាចត្រូវបានចាត់ទុកថាជាទម្រង់នៃការកត់ត្រាព័ត៌មាន។ ព័ត៌មាននេះកំណត់ការបត់ជាលំហនៃខ្សែសង្វាក់ peptide លីនេអ៊ែរ ទៅជារចនាសម្ព័ន្ធបីវិមាត្រដែលតូចជាងមុនហៅថា ការអនុលោមតាមកំប្រុក។ ដំណើរការនៃការបង្កើតការអនុលោមតាមប្រូតេអ៊ីនដែលមានមុខងារត្រូវបានគេហៅថា បត់។
4. ការអនុលោមតាមប្រូតេអ៊ីន។ការបង្វិលដោយឥតគិតថ្លៃនៅក្នុងឆ្អឹងខ្នង peptide គឺអាចធ្វើទៅបានរវាងអាតូមអាសូតនៃក្រុម peptide និងអាតូមα-carbon ដែលនៅជិតខាង ក៏ដូចជារវាងអាតូម α-carbon និង carbonyl group carbon ។ ដោយសារតែអន្តរកម្មនៃក្រុមមុខងារនៃសំណល់អាស៊ីតអាមីណូ រចនាសម្ព័ន្ធចម្បងនៃប្រូតេអ៊ីនអាចទទួលបានរចនាសម្ព័ន្ធលំហដ៏ស្មុគស្មាញ។ នៅក្នុងប្រូតេអ៊ីន globular កម្រិតសំខាន់ពីរនៃការបត់នៃការអនុលោមតាមខ្សែសង្វាក់ peptide ត្រូវបានសម្គាល់: អនុវិទ្យាល័យនិង រចនាសម្ព័ន្ធទីបី។
រចនាសម្ព័ន្ធបន្ទាប់បន្សំនៃប្រូតេអ៊ីន- នេះគឺជារចនាសម្ព័ន្ធលំហដែលបង្កើតឡើងជាលទ្ធផលនៃការបង្កើតចំណងអ៊ីដ្រូសែនរវាងក្រុមមុខងារ -C = O និង -NH- នៃឆ្អឹងខ្នង peptide ។ ក្នុងករណីនេះខ្សែសង្វាក់ peptide អាចទទួលបានរចនាសម្ព័ន្ធធម្មតានៃពីរប្រភេទ: α-helicesនិង រចនាសម្ព័ន្ធ β ។
អេ α-helicesចំណងអ៊ីដ្រូសែនត្រូវបានបង្កើតឡើងរវាងអាតូមអុកស៊ីសែននៃក្រុម carbonyl និងអ៊ីដ្រូសែននៃអាមីតអាសូតនៃអាស៊ីតអាមីណូទី 4 ពីវា; ខ្សែសង្វាក់ចំហៀងនៃសំណល់អាស៊ីតអាមីណូ
ដែលមានទីតាំងនៅតាមបរិវេណនៃ helix មិនចូលរួមក្នុងការបង្កើតរចនាសម្ព័ន្ធបន្ទាប់បន្សំ (រូបភាព 1.3 ។ ) ។
រ៉ាឌីកាល់សំពីងសំពោង ឬរ៉ាឌីកាល់ដែលផ្ទុកបន្ទុកដូចគ្នារារាំងការបង្កើត α-helix ។ សំណល់ប្រូលីនដែលមានរចនាសម្ព័ន្ធចិញ្ចៀនរំខាន α-helix ចាប់តាំងពីដោយសារតែកង្វះអ៊ីដ្រូសែននៅអាតូមអាសូតនៅក្នុងខ្សែសង្វាក់ peptide វាមិនអាចទៅរួចទេក្នុងការបង្កើតចំណងអ៊ីដ្រូសែន។ ចំណងរវាងអាសូត និងអាតូម α-កាបូនគឺជាផ្នែកមួយនៃវដ្តប្រូលីន ដូច្នេះឆ្អឹងខ្នង peptide ទទួលបានពត់នៅកន្លែងនេះ។
β-រចនាសម្ព័ន្ធត្រូវបានបង្កើតឡើងរវាងតំបន់លីនេអ៊ែរនៃឆ្អឹងខ្នង peptide នៃខ្សែសង្វាក់ polypeptide មួយ ដូច្នេះបង្កើតបានជារចនាសម្ព័ន្ធបត់។ ខ្សែសង្វាក់ Polypeptide ឬផ្នែករបស់វាអាចបង្កើតបាន។ ប៉ារ៉ាឡែលឬ រចនាសម្ព័ន្ធប្រឆាំងប៉ារ៉ាឡែលក្នុងករណីទី 1 ស្ថានីយ N- និង C នៃខ្សែសង្វាក់ peptide អន្តរកម្មស្របគ្នាហើយក្នុងករណីទីពីរពួកគេមានទិសដៅផ្ទុយ (រូបភាព 1.4) ។
អង្ករ។ ១.៣. រចនាសម្ព័ន្ធទីពីរនៃប្រូតេអ៊ីន - α-helix
 អង្ករ។ ១.៤. រចនាសម្ព័ន្ធ β-pleated ប៉ារ៉ាឡែល និងប្រឆាំងប៉ារ៉ាឡែល
អង្ករ។ ១.៤. រចនាសម្ព័ន្ធ β-pleated ប៉ារ៉ាឡែល និងប្រឆាំងប៉ារ៉ាឡែល
រចនាសម្ព័ន្ធ β ត្រូវបានចង្អុលបង្ហាញដោយព្រួញធំទូលាយ: A - រចនាសម្ព័ន្ធ β-ប្រឆាំងប៉ារ៉ាឡែល។ ខ - រចនាសម្ព័ន្ធ β-pleated ប៉ារ៉ាឡែល
នៅក្នុងប្រូតេអ៊ីនមួយចំនួន រចនាសម្ព័ន្ធ β អាចត្រូវបានបង្កើតឡើងដោយសារតែការបង្កើតចំណងអ៊ីដ្រូសែនរវាងអាតូមនៃឆ្អឹងខ្នង peptide នៃខ្សែសង្វាក់ polypeptide ផ្សេងៗគ្នា។
ត្រូវបានរកឃើញផងដែរនៅក្នុងប្រូតេអ៊ីន តំបន់ដែលមានអនុវិទ្យាល័យមិនទៀងទាត់រចនាសម្ព័ន្ធ ដែលរួមមាន ពត់ រង្វិលជុំ វេននៃឆ្អឹងខ្នង polypeptide ។ ជារឿយៗពួកវាមានទីតាំងនៅកន្លែងដែលទិសដៅនៃខ្សែសង្វាក់ peptide ផ្លាស់ប្តូរឧទាហរណ៍ក្នុងអំឡុងពេលនៃការបង្កើតរចនាសម្ព័ន្ធសន្លឹកបេតាប៉ារ៉ាឡែល។
ដោយវត្តមានរបស់ α-helices និង β-structures ប្រូតេអ៊ីន globular អាចបែងចែកជាបួនប្រភេទ។
អង្ករ។ ១.៥. រចនាសម្ព័ន្ធបន្ទាប់បន្សំនៃ myoglobin (A) និង hemoglobin β-chain (B) ដែលមាន α-helices ចំនួនប្រាំបី
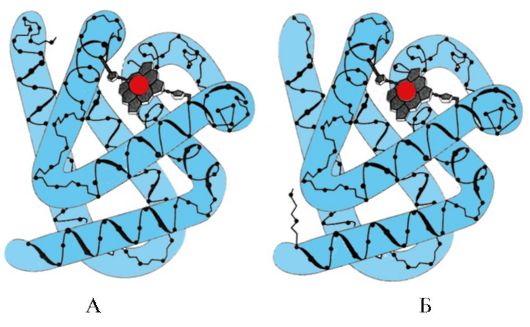
 អង្ករ។ ១.៦. រចនាសម្ព័ន្ធបន្ទាប់បន្សំនៃ triose phosphate isomerase និងដែន pyruvate kinase
អង្ករ។ ១.៦. រចនាសម្ព័ន្ធបន្ទាប់បន្សំនៃ triose phosphate isomerase និងដែន pyruvate kinase
 អង្ករ។ ១.៧. រចនាសម្ព័ន្ធបន្ទាប់បន្សំនៃដែនថេរ immunoglobulin (A) និងអង់ស៊ីម superoxide dismutase (B)
អង្ករ។ ១.៧. រចនាសម្ព័ន្ធបន្ទាប់បន្សំនៃដែនថេរ immunoglobulin (A) និងអង់ស៊ីម superoxide dismutase (B)
អេ ប្រភេទទីបួនរួមបញ្ចូលប្រូតេអ៊ីនដែលមាននៅក្នុងសមាសភាពរបស់ពួកគេចំនួនតូចមួយនៃរចនាសម្ព័ន្ធបន្ទាប់បន្សំធម្មតា។ ប្រូតេអ៊ីនទាំងនេះរួមមានប្រូតេអ៊ីនតូច ប្រូតេអ៊ីនសម្បូរទៅដោយ cysteine ឬ metalloproteins ។
រចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីន- ប្រភេទនៃការអនុលោមតាមទម្រង់ដែលត្រូវបានបង្កើតឡើងដោយសារតែអន្តរកម្មរវាងរ៉ាឌីកាល់អាស៊ីតអាមីណូដែលអាចមានទីតាំងនៅចម្ងាយសន្ធឹកសន្ធាប់ពីគ្នាទៅវិញទៅមកនៅក្នុងខ្សែសង្វាក់ peptide ។ ក្នុងករណីនេះ ប្រូតេអ៊ីនភាគច្រើនបង្កើតបានជារចនាសម្ព័ន្ធលំហដែលស្រដៀងទៅនឹង globule (ប្រូតេអ៊ីន globular)។
ចាប់តាំងពីរ៉ាឌីកាល់ hydrophobic នៃអាស៊ីដអាមីណូមានទំនោរទៅបញ្ចូលគ្នាដោយមានជំនួយពីអ្វីដែលគេហៅថា អន្តរកម្ម hydrophobicនិងកម្លាំង van der Waals អន្តរម៉ូលេគុល ស្នូល hydrophobic ក្រាស់ត្រូវបានបង្កើតឡើងនៅខាងក្នុងប្រូតេអ៊ីន globule ។ រ៉ាឌីកាល់អ៊ីយ៉ូដ hydrophilic និងមិនអ៊ីយ៉ូដ ភាគច្រើនមានទីតាំងនៅលើផ្ទៃប្រូតេអ៊ីន និងកំណត់ភាពរលាយរបស់វានៅក្នុងទឹក។
 អង្ករ។ ១.៨. ប្រភេទនៃចំណងដែលកើតឡើងរវាងរ៉ាឌីកាល់អាស៊ីតអាមីណូអំឡុងពេលបង្កើតរចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីន
អង្ករ។ ១.៨. ប្រភេទនៃចំណងដែលកើតឡើងរវាងរ៉ាឌីកាល់អាស៊ីតអាមីណូអំឡុងពេលបង្កើតរចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីន
1 - ចំណងអ៊ីយ៉ូដ- កើតឡើងរវាងក្រុមមុខងារវិជ្ជមាន និងអវិជ្ជមាន។
2 - ចំណងអ៊ីដ្រូសែន- កើតឡើងរវាង hydrophilic uncharged និងក្រុម hydrophilic ផ្សេងទៀតណាមួយ;
3 - អន្តរកម្ម hydrophobic- កើតឡើងរវាងរ៉ាឌីកាល់ hydrophobic;
4 - ចំណង disulfide- ត្រូវបានបង្កើតឡើងដោយសារតែការកត់សុីនៃក្រុម SH នៃសំណល់ cysteine និងអន្តរកម្មរបស់ពួកគេជាមួយគ្នាទៅវិញទៅមក
សំណល់អាស៊ីតអាមីណូអ៊ីដ្រូហ្វីលីកនៅខាងក្នុងស្នូលអ៊ីដ្រូហ្វិកអាចធ្វើអន្តរកម្មជាមួយគ្នាដោយប្រើ អ៊ីយ៉ុងនិង ចំណងអ៊ីដ្រូសែន(រូបភាព 1.8) ។
ចំណងអ៊ីយ៉ុង និងអ៊ីដ្រូសែន ក៏ដូចជាអន្តរកម្ម hydrophobic ស្ថិតក្នុងចំណោមចំណុចខ្សោយ៖ ថាមពលរបស់វាលើសពីថាមពលនៃចលនាកម្ដៅនៃម៉ូលេគុលនៅសីតុណ្ហភាពបន្ទប់បន្តិច។ ការអនុលោមតាមប្រូតេអ៊ីនត្រូវបានរក្សាដោយការកើតឡើងនៃចំណងខ្សោយបែបនេះជាច្រើន។ ដោយសារអាតូមដែលបង្កើតជាប្រូតេអ៊ីនមានចលនាថេរ វាអាចបំបែកចំណងខ្សោយមួយចំនួន និងបង្កើតជាធាតុផ្សេងទៀត ដែលនាំទៅដល់ចលនាតូចៗនៃផ្នែកនីមួយៗនៃខ្សែសង្វាក់ polypeptide ។ ទ្រព្យសម្បត្តិនៃប្រូតេអ៊ីននេះដើម្បីផ្លាស់ប្តូរការអនុលោមតាមលទ្ធផលនៃការបំបែកមួយចំនួននិងបង្កើតចំណងខ្សោយផ្សេងទៀតត្រូវបានគេហៅថា lability អនុលោមភាព។
រាងកាយរបស់មនុស្សមានប្រព័ន្ធដែលគាំទ្រ homeostasis- ភាពស្ថិតស្ថេរនៃបរិយាកាសខាងក្នុងនៅក្នុងដែនកំណត់ជាក់លាក់ដែលអាចទទួលយកបានសម្រាប់សារពាង្គកាយដែលមានសុខភាពល្អ។ នៅក្រោមលក្ខខណ្ឌនៃ homeostasis ការផ្លាស់ប្តូរតិចតួចក្នុងការអនុលោមភាពមិនរំខានដល់រចនាសម្ព័ន្ធនិងមុខងារទាំងមូលនៃប្រូតេអ៊ីនទេ។ ការអនុលោមតាមមុខងារនៃប្រូតេអ៊ីនត្រូវបានគេហៅថា ការអនុលោមតាមជនជាតិដើម។ការផ្លាស់ប្តូរបរិយាកាសខាងក្នុង (ឧទាហរណ៍ កំហាប់គ្លុយកូស Ca អ៊ីយ៉ុង ប្រូតុង។
រចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីនមួយចំនួនមានស្ថេរភាព ចំណង disulfide,បង្កើតឡើងដោយអន្តរកម្មនៃក្រុម -SH នៃសំណល់ពីរ
 អង្ករ។ ១.៩. ការបង្កើតចំណង disulfide នៅក្នុងម៉ូលេគុលប្រូតេអ៊ីន
អង្ករ។ ១.៩. ការបង្កើតចំណង disulfide នៅក្នុងម៉ូលេគុលប្រូតេអ៊ីន
cysteine (រូបភាព 1.9) ។ ប្រូតេអ៊ីនក្នុងកោសិកាភាគច្រើនមិនមានចំណង disulfide covalent នៅក្នុងរចនាសម្ព័ន្ធទីបីរបស់ពួកគេទេ។ វត្តមានរបស់ពួកគេគឺជាលក្ខណៈនៃប្រូតេអ៊ីនដែលលាក់ដោយកោសិកាដែលធានានូវស្ថេរភាពកាន់តែច្រើនរបស់ពួកគេនៅក្នុងលក្ខខណ្ឌក្រៅកោសិកា។ ដូច្នេះចំណង disulfide មាននៅក្នុងម៉ូលេគុលនៃអាំងស៊ុយលីន និង immunoglobulins ។
អាំងស៊ុយលីន- អរម៉ូនប្រូតេអ៊ីនសំយោគនៅក្នុងកោសិកា β-កោសិកានៃលំពែង ហើយសម្ងាត់ចូលទៅក្នុងឈាម ដើម្បីឆ្លើយតបទៅនឹងការកើនឡើងនៃកំហាប់គ្លុយកូសក្នុងឈាម។ នៅក្នុងរចនាសម្ព័ន្ធនៃអាំងស៊ុយលីន មានចំណង disulfide ពីរដែលតភ្ជាប់ខ្សែសង្វាក់ polypeptide A- និង B និងចំណង disulfide មួយនៅខាងក្នុងខ្សែ A (រូបភាព 1.10) ។
 អង្ករ។ ១.១០. ចំណង disulfide នៅក្នុងរចនាសម្ព័ន្ធនៃអាំងស៊ុយលីន
អង្ករ។ ១.១០. ចំណង disulfide នៅក្នុងរចនាសម្ព័ន្ធនៃអាំងស៊ុយលីន
5. រចនាសម្ព័ន្ធអនុវិទ្យាល័យជាន់ខ្ពស់នៃប្រូតេអ៊ីន។នៅក្នុងប្រូតេអ៊ីនខុសគ្នានៅក្នុងរចនាសម្ព័ន្ធនិងមុខងារបឋមជួនកាល បន្សំស្រដៀងគ្នានិងអន្តរទីតាំងនៃរចនាសម្ព័ន្ធបន្ទាប់បន្សំ,ដែលត្រូវបានគេហៅថារចនាសម្ព័ន្ធអនុវិទ្យាល័យ។ វាកាន់កាប់ទីតាំងមធ្យមរវាងរចនាសម្ព័ន្ធអនុវិទ្យាល័យ និងទីបី ចាប់តាំងពីវាគឺជាការរួមបញ្ចូលគ្នាជាក់លាក់នៃធាតុរចនាសម្ព័ន្ធបន្ទាប់បន្សំក្នុងអំឡុងពេលនៃការបង្កើតរចនាសម្ព័ន្ធទីបីនៃប្រូតេអ៊ីនមួយ។ រចនាសម្ព័ន្ធអនុវិទ្យាល័យមានឈ្មោះជាក់លាក់ដូចជា "α-helix-turn-a-helix", "leucine zipper", "zinc fingers" ជាដើម។ រចនាសម្ព័ន្ធអនុវិទ្យាល័យបែបនេះគឺជាលក្ខណៈនៃប្រូតេអ៊ីនភ្ជាប់ DNA ។
"ខ្សែរ៉ូត Leucine" ។ប្រភេទនៃរចនាសម្ព័ន្ធអនុវិទ្យាល័យនេះត្រូវបានប្រើដើម្បីភ្ជាប់ប្រូតេអ៊ីនពីរ។ នៅលើផ្ទៃនៃប្រូតេអ៊ីនអន្តរកម្មមានតំបន់ α-helical ដែលមានសំណល់ leucine យ៉ាងតិចបួន។ សំណល់ Leucine នៅក្នុង α-helix មានទីតាំងនៅអាស៊ីតអាមីណូចំនួនប្រាំមួយដាច់ពីគ្នាទៅវិញទៅមក។ ចាប់តាំងពីវេននីមួយៗនៃ α-helix មានសំណល់អាស៊ីតអាមីណូ 3.6 រ៉ាឌីកាល់ leucine ត្រូវបានរកឃើញនៅលើផ្ទៃនៃវេនផ្សេងទៀត។ សំណល់ leucine នៃ α-helix នៃប្រូតេអ៊ីនមួយអាចធ្វើអន្តរកម្មជាមួយនឹងសំណល់ leucine នៃប្រូតេអ៊ីនមួយផ្សេងទៀត (អន្តរកម្ម hydrophobic) ដោយភ្ជាប់ពួកវាជាមួយគ្នា (រូបភាព 1.11 ។ ) ។ ប្រូតេអ៊ីនភ្ជាប់ DNA ជាច្រើនមានមុខងារជាផ្នែកមួយនៃស្មុគស្មាញ oligomeric ដែលផ្នែករងនីមួយៗត្រូវបានភ្ជាប់ទៅគ្នាទៅវិញទៅមកដោយ "leucine zippers" ។
 អង្ករ។ ១.១១. "Leucine zipper" រវាងតំបន់α-helical នៃប្រូតេអ៊ីនពីរ
អង្ករ។ ១.១១. "Leucine zipper" រវាងតំបន់α-helical នៃប្រូតេអ៊ីនពីរ
Histones គឺជាឧទាហរណ៍នៃប្រូតេអ៊ីនបែបនេះ។ អ៊ីស្តូន- ប្រូតេអ៊ីននុយក្លេអ៊ែរ ដែលរួមមានអាស៊ីតអាមីណូមួយចំនួនធំដែលមានបន្ទុកវិជ្ជមាន - arginine និង lysine (រហូតដល់ 80%) ។ ម៉ូលេគុល Histone ត្រូវបានផ្សំចូលទៅក្នុងស្មុគស្មាញ oligomeric ដែលមាន monomers ចំនួនប្រាំបី ដោយមានជំនួយពី "leucine fasteners" ទោះបីជាមានការចោទប្រកាន់ដូចគ្នាយ៉ាងសំខាន់នៃម៉ូលេគុលទាំងនេះក៏ដោយ។
"ម្រាមដៃស័ង្កសី"- បំរែបំរួលនៃរចនាសម្ព័ន្ធអនុវិទ្យាល័យ លក្ខណៈនៃប្រូតេអ៊ីនភ្ជាប់ DNA មានទម្រង់ជាបំណែកពន្លូតនៅលើផ្ទៃប្រូតេអ៊ីន និងមានសំណល់អាស៊ីតអាមីណូប្រហែល 20 (រូបភាព 1.12) ។ រូបរាងនៃ "ម្រាមដៃលាតសន្ធឹង" ត្រូវបានគាំទ្រដោយអាតូមស័ង្កសីដែលត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងរ៉ាឌីកាល់អាស៊ីតអាមីណូចំនួនបួន - សំណល់ cysteine ពីរនិងសំណល់ histidine ពីរ។ ក្នុងករណីខ្លះជំនួសឱ្យសំណល់ histidine មានសំណល់ cysteine ។ សំណល់ cysteine ដែលមានគម្លាតជិតគ្នាពីរត្រូវបានបំបែកពីសំណល់ Gisili ពីរផ្សេងទៀតដោយលំដាប់ Cys នៃសំណល់អាស៊ីតអាមីណូប្រហែល 12 ។ តំបន់នៃប្រូតេអ៊ីននេះបង្កើតបានជា α-helix ដែលជារ៉ាឌីកាល់ដែលអាចភ្ជាប់យ៉ាងជាក់លាក់ទៅនឹងតំបន់និយតកម្មនៃចង្អូរធំ DNA ។ ភាពជាក់លាក់នៃការចងបុគ្គល
 អង្ករ។ ១.១២. រចនាសម្ព័ន្ធចម្បងនៃផ្នែកនៃប្រូតេអ៊ីនភ្ជាប់ DNA ដែលបង្កើតជារចនាសម្ព័ន្ធ "ម្រាមដៃស័ង្កសី" (អក្សរបង្ហាញពីអាស៊ីតអាមីណូដែលបង្កើតរចនាសម្ព័ន្ធនេះ)
អង្ករ។ ១.១២. រចនាសម្ព័ន្ធចម្បងនៃផ្នែកនៃប្រូតេអ៊ីនភ្ជាប់ DNA ដែលបង្កើតជារចនាសម្ព័ន្ធ "ម្រាមដៃស័ង្កសី" (អក្សរបង្ហាញពីអាស៊ីតអាមីណូដែលបង្កើតរចនាសម្ព័ន្ធនេះ)
និយតកម្មប្រូតេអ៊ីនចង DNA អាស្រ័យលើលំដាប់នៃសំណល់អាស៊ីតអាមីណូដែលមានទីតាំងនៅ "ម្រាមដៃស័ង្កសី" ។ រចនាសម្ព័ន្ធបែបនេះមានជាពិសេសអ្នកទទួលសម្រាប់អរម៉ូនស្តេរ៉ូអ៊ីតដែលពាក់ព័ន្ធនឹងបទប្បញ្ញត្តិនៃការចម្លង (អានព័ត៌មានពី DNA ទៅ RNA) ។
ប្រធានបទ 1.2 ។ មូលដ្ឋាននៃមុខងារប្រូតេអ៊ីន។ គ្រឿងញៀនដែលប៉ះពាល់ដល់មុខងារប្រូតេអ៊ីន
1. មជ្ឈមណ្ឌលសកម្មនៃប្រូតេអ៊ីននិងអន្តរកម្មរបស់វាជាមួយ ligand ។ក្នុងអំឡុងពេលនៃការបង្កើតរចនាសម្ព័ន្ធទី 3 នៅលើផ្ទៃនៃប្រូតេអ៊ីនដែលមានមុខងារជាធម្មតានៅក្នុងកន្លែងសម្រាកកន្លែងមួយត្រូវបានបង្កើតឡើងដោយរ៉ាឌីកាល់អាស៊ីតអាមីណូដែលនៅឆ្ងាយពីគ្នានៅក្នុងរចនាសម្ព័ន្ធបឋម។ គេហទំព័រនេះដែលមានរចនាសម្ព័ន្ធពិសេសសម្រាប់ប្រូតេអ៊ីនដែលបានផ្តល់ឱ្យ និងអាចធ្វើអន្តរកម្មជាពិសេសជាមួយម៉ូលេគុលជាក់លាក់មួយ ឬក្រុមនៃម៉ូលេគុលស្រដៀងគ្នា ត្រូវបានគេហៅថាកន្លែងភ្ជាប់ប្រូតេអ៊ីនជាមួយនឹង ligand ឬកន្លែងសកម្ម។ Ligands គឺជាម៉ូលេគុលដែលមានអន្តរកម្មជាមួយប្រូតេអ៊ីន។
ភាពជាក់លាក់ខ្ពស់។អន្តរកម្មនៃប្រូតេអ៊ីនជាមួយ ligand ត្រូវបានធានាដោយការបំពេញបន្ថែមនៃរចនាសម្ព័ន្ធនៃមជ្ឈមណ្ឌលសកម្មជាមួយនឹងរចនាសម្ព័ន្ធនៃ ligand នេះ។
ការបំពេញបន្ថែមគឺជាការឆ្លើយឆ្លងតាមលំហ និងគីមីនៃផ្ទៃអន្តរកម្ម។ មជ្ឈមណ្ឌលសកម្មមិនត្រឹមតែត្រូវគ្នានឹងលំនឹងទៅនឹង ligand ដែលរួមបញ្ចូលនៅក្នុងវាប៉ុណ្ណោះទេ ប៉ុន្តែចំណង (អន្តរកម្មអ៊ីយ៉ុង អ៊ីដ្រូសែន និងអ៊ីដ្រូហ្វូប) ក៏ត្រូវតែបង្កើតរវាងក្រុមមុខងារនៃរ៉ាឌីកាល់ដែលរួមបញ្ចូលនៅក្នុងមជ្ឈមណ្ឌលសកម្ម និងលីហ្គែន ដែលរក្សាលីហ្គែននៅក្នុង មជ្ឈមណ្ឌលសកម្ម (រូបភាព 1.13) ។
 អង្ករ។ ១.១៣. អន្តរកម្មបំពេញបន្ថែមនៃប្រូតេអ៊ីនជាមួយ ligand មួយ។
អង្ករ។ ១.១៣. អន្តរកម្មបំពេញបន្ថែមនៃប្រូតេអ៊ីនជាមួយ ligand មួយ។
លីហ្គែនមួយចំនួននៅពេលដែលភ្ជាប់ទៅនឹងកណ្តាលសកម្មនៃប្រូតេអ៊ីនដើរតួនាទីជំនួយក្នុងដំណើរការនៃប្រូតេអ៊ីន។ លីហ្គែនបែបនេះត្រូវបានគេហៅថា cofactors ហើយប្រូតេអ៊ីនដែលមានផ្នែកមិនប្រូតេអ៊ីននៅក្នុងសមាសភាពរបស់ពួកគេត្រូវបានគេហៅថា ប្រូតេអ៊ីនស្មុគស្មាញ(ផ្ទុយទៅនឹងប្រូតេអ៊ីនសាមញ្ញដែលមានតែផ្នែកប្រូតេអ៊ីន) ។ ផ្នែកដែលមិនមានប្រូតេអ៊ីនដែលត្រូវបានភ្ជាប់យ៉ាងរឹងមាំទៅនឹងប្រូតេអ៊ីនត្រូវបានគេហៅថា ក្រុមសិប្បនិម្មិត។ឧទាហរណ៍ សមាសភាពនៃ myoglobin, hemoglobin និង cytochromes មានក្រុមសិប្បនិម្មិតដែលភ្ជាប់យ៉ាងរឹងមាំទៅនឹងមជ្ឈមណ្ឌលសកម្ម - heme ដែលមានអ៊ីយ៉ុងដែក។ ប្រូតេអ៊ីនស្មុគស្មាញដែលមាន heme ត្រូវបានគេហៅថា hemoproteins ។
នៅពេលដែល ligands ជាក់លាក់ត្រូវបានភ្ជាប់ទៅនឹងប្រូតេអ៊ីនមុខងារនៃប្រូតេអ៊ីនទាំងនេះត្រូវបានបង្ហាញ។ ដូច្នេះ អាល់ប៊ុយមីន ដែលជាប្រូតេអ៊ីនដ៏សំខាន់បំផុតនៅក្នុងប្លាស្មាឈាម បង្ហាញមុខងារដឹកជញ្ជូនរបស់វា ដោយភ្ជាប់លីហ្គែនអ៊ីដ្រូហ្វិក ទៅនឹងមជ្ឈមណ្ឌលសកម្ម ដូចជាអាស៊ីតខ្លាញ់ ប៊ីលីរុយប៊ីន ថ្នាំមួយចំនួនជាដើម (រូបភាព 1.14)។
Ligands អន្តរកម្មជាមួយរចនាសម្ព័ន្ធបីវិមាត្រនៃខ្សែសង្វាក់ peptide អាចមិនត្រឹមតែមានទម្ងន់ម៉ូលេគុលទាបនៃម៉ូលេគុលសរីរាង្គ និងអសរីរាង្គប៉ុណ្ណោះទេ ប៉ុន្តែក៏មានម៉ាក្រូម៉ូលេគុលផងដែរ៖
DNA (ឧទាហរណ៍ដែលបានពិភាក្សាខាងលើជាមួយនឹងប្រូតេអ៊ីនភ្ជាប់ DNA);
ប៉ូលីសាចការីត;
 អង្ករ។ ១.១៤. ទំនាក់ទំនងរវាង genotype និង phenotype
អង្ករ។ ១.១៤. ទំនាក់ទំនងរវាង genotype និង phenotype
រចនាសម្ព័ន្ធចម្បងតែមួយគត់នៃប្រូតេអ៊ីនរបស់មនុស្សដែលត្រូវបានអ៊ិនកូដនៅក្នុងម៉ូលេគុល DNA ត្រូវបានដឹងនៅក្នុងកោសិកាក្នុងទម្រង់នៃការអនុលោមភាពតែមួយគត់ រចនាសម្ព័ន្ធទីតាំងសកម្ម និងមុខងារប្រូតេអ៊ីន។
នៅក្នុងករណីទាំងនេះ ប្រូតេអ៊ីនទទួលស្គាល់តំបន់ជាក់លាក់មួយនៃ ligand ដែលសមស្រប និងបំពេញបន្ថែមទៅនឹងកន្លែងចង។ ដូច្នេះនៅលើផ្ទៃនៃ hepatocytes មានប្រូតេអ៊ីន receptor សម្រាប់អរម៉ូនអាំងស៊ុយលីនដែលមានរចនាសម្ព័ន្ធប្រូតេអ៊ីនផងដែរ។ អន្តរកម្មនៃអាំងស៊ុយលីនជាមួយអ្នកទទួលបណ្តាលឱ្យមានការផ្លាស់ប្តូរនៅក្នុងការអនុលោមភាពនិងការធ្វើឱ្យសកម្មនៃប្រព័ន្ធសញ្ញារបស់វាដែលនាំឱ្យមានការប្រមូលផ្តុំសារធាតុចិញ្ចឹមនៅក្នុង hepatocytes បន្ទាប់ពីបរិភោគ។
ដូច្នេះ ដំណើរការនៃប្រូតេអ៊ីនគឺផ្អែកលើអន្តរកម្មជាក់លាក់នៃមជ្ឈមណ្ឌលសកម្មនៃប្រូតេអ៊ីនជាមួយ ligand ។
2. រចនាសម្ព័ន្ធដែន និងតួនាទីរបស់វាក្នុងដំណើរការនៃប្រូតេអ៊ីន។ខ្សែសង្វាក់ polypeptide វែងនៃប្រូតេអ៊ីន globular ច្រើនតែបត់ចូលទៅក្នុងតំបន់បង្រួម និងឯករាជ្យមួយចំនួន។ ពួកវាមានរចនាសម្ព័ន្ធទីបីឯករាជ្យ ស្រដៀងទៅនឹងប្រូតេអ៊ីន globular ហើយត្រូវបានគេហៅថា ដែន។ដោយសារតែរចនាសម្ព័ន្ធដែននៃប្រូតេអ៊ីន រចនាសម្ព័ន្ធទីបីរបស់ពួកគេគឺកាន់តែងាយស្រួលក្នុងការបង្កើត។
នៅក្នុង domain proteins ទីតាំងចង ligand ជាញឹកញាប់ស្ថិតនៅចន្លោះដែន។ ដូច្នេះ trypsin គឺជាអង់ស៊ីម proteolytic ដែលត្រូវបានផលិតដោយផ្នែក exocrine នៃលំពែង ហើយចាំបាច់សម្រាប់ការរំលាយអាហារប្រូតេអ៊ីនអាហារ។ វាមានរចនាសម្ព័ន្ធដែនពីរ ហើយកន្លែងភ្ជាប់នៃ trypsin ជាមួយ ligand របស់វា - ប្រូតេអ៊ីនអាហារ - មានទីតាំងនៅក្នុងចង្អូររវាងដែនទាំងពីរ។ នៅក្នុងមជ្ឈមណ្ឌលសកម្មលក្ខខណ្ឌចាំបាច់សម្រាប់ការផ្សារភ្ជាប់ប្រកបដោយប្រសិទ្ធភាពនៃកន្លែងជាក់លាក់នៃប្រូតេអ៊ីនអាហារនិងអ៊ីដ្រូលីស៊ីនៃចំណង peptide របស់វាត្រូវបានបង្កើតឡើង។
ដែនផ្សេងគ្នានៅក្នុងប្រូតេអ៊ីនអាចផ្លាស់ទីទាក់ទងគ្នាទៅវិញទៅមកនៅពេលដែលមជ្ឈមណ្ឌលសកម្មមានអន្តរកម្មជាមួយ ligand (រូបភាព 1.15) ។
Hexokinase- អង់ស៊ីមដែលជំរុញ phosphorylation នៃជាតិស្ករដោយមានជំនួយពី ATP ។ ទីតាំងសកម្មនៃអង់ស៊ីម មានទីតាំងនៅចន្លោះប្រហោងទាំងពីរ។ នៅពេលដែល hexokinase ភ្ជាប់ទៅនឹងគ្លុយកូស ដែនជុំវិញនោះបិទ ហើយស្រទាប់ខាងក្រោមត្រូវបានជាប់ ដែលផូស្វ័រកើតឡើង (សូមមើលរូប 1.15)។
 អង្ករ។ ១.១៥. ការភ្ជាប់ដែន hexokinase ទៅនឹងគ្លុយកូស
អង្ករ។ ១.១៥. ការភ្ជាប់ដែន hexokinase ទៅនឹងគ្លុយកូស
នៅក្នុងប្រូតេអ៊ីនមួយចំនួន domains អនុវត្តមុខងារឯករាជ្យដោយភ្ជាប់ទៅនឹង ligands ផ្សេងៗ។ ប្រូតេអ៊ីនបែបនេះត្រូវបានគេហៅថាពហុមុខងារ។
3. ថ្នាំ - លីហ្គែនដែលប៉ះពាល់ដល់មុខងាររបស់ប្រូតេអ៊ីន។អន្តរកម្មនៃប្រូតេអ៊ីនជាមួយ ligands គឺជាក់លាក់។ ទោះបីជាយ៉ាងណាក៏ដោយ ដោយសារតែភាពស៊ីសង្វាក់គ្នានៃប្រូតេអ៊ីន និងទីតាំងសកម្មរបស់វា វាអាចជ្រើសរើសសារធាតុមួយផ្សេងទៀតដែលអាចធ្វើអន្តរកម្មជាមួយប្រូតេអ៊ីននៅក្នុងទីតាំងសកម្ម ឬផ្នែកផ្សេងទៀតនៃម៉ូលេគុលផងដែរ។
សារធាតុដែលមានរចនាសម្ព័ន្ធស្រដៀងទៅនឹង ligand ធម្មជាតិត្រូវបានគេហៅថា analogue រចនាសម្ព័ន្ធនៃ ligandឬ ligand ខុសពីធម្មជាតិ។ វាក៏មានអន្តរកម្មជាមួយប្រូតេអ៊ីននៅក្នុងទីតាំងសកម្មផងដែរ។ អាណាឡូករចនាសម្ព័ន្ធនៃ ligand អាចបង្កើនមុខងារប្រូតេអ៊ីន (agonist)និងកាត់បន្ថយវា។ (អ្នកប្រឆាំង) ។លីហ្គែន និងអាណាឡូកនៃរចនាសម្ព័ន្ធរបស់វាប្រកួតប្រជែងគ្នាសម្រាប់ការភ្ជាប់ប្រូតេអ៊ីននៅកន្លែងតែមួយ។ សារធាតុបែបនេះត្រូវបានគេហៅថា ម៉ូឌុលប្រកួតប្រជែង(និយតករ) នៃមុខងារប្រូតេអ៊ីន។ ថ្នាំជាច្រើនដើរតួជាអ្នកទប់ស្កាត់ប្រូតេអ៊ីន។ ពួកគេមួយចំនួនត្រូវបានទទួលដោយការកែប្រែគីមីនៃ ligands ធម្មជាតិ។ ថ្នាំទប់ស្កាត់មុខងារប្រូតេអ៊ីនអាចជាថ្នាំ និងសារធាតុពុល។
Atropine គឺជាអ្នកទប់ស្កាត់ការប្រកួតប្រជែងនៃអ្នកទទួល M-cholinergic ។ Acetylcholine គឺជាសារធាតុបញ្ជូនសរសៃប្រសាទសម្រាប់ការបញ្ជូនសរសៃប្រសាទតាមរយៈ cholinergic synapses ។ ដើម្បីធ្វើការរំភើបចិត្ត acetylcholine ដែលត្រូវបានបញ្ចេញទៅក្នុងប្រហោង synaptic ត្រូវតែមានអន្តរកម្មជាមួយប្រូតេអ៊ីន - receptor នៃភ្នាស postsynaptic ។ រកឃើញពីរប្រភេទ អ្នកទទួល cholinergic៖
M-receptorបន្ថែមពីលើ acetylcholine វាជ្រើសរើសអន្តរកម្មជាមួយ muscarine (fly agaric toxin) ។ M - cholinergic receptors មានវត្តមាននៅលើសាច់ដុំរលោងហើយនៅពេលដែលមានអន្តរកម្មជាមួយ acetylcholine បណ្តាលឱ្យមានការកន្ត្រាក់របស់ពួកគេ;
H-receptorភ្ជាប់ជាពិសេសទៅនឹងជាតិនីកូទីន។ អ្នកទទួល N-cholinergic ត្រូវបានរកឃើញនៅក្នុង synapses នៃសាច់ដុំគ្រោងឆ្អឹង។
ថ្នាំទប់ស្កាត់ជាក់លាក់ អ្នកទទួល M-cholinergicគឺ atropine ។ វាត្រូវបានរកឃើញនៅក្នុងរុក្ខជាតិ belladonna និង henbane ។
 Atropine មាននៅក្នុងក្រុមមុខងាររចនាសម្ព័ន្ធរបស់វាស្រដៀងទៅនឹង acetylcholine និងការរៀបចំលំហរបស់ពួកគេ ដូច្នេះវាជាកម្មសិទ្ធិរបស់អ្នកទប់ស្កាត់ការប្រកួតប្រជែងនៃ M-cholinergic receptors ។ ដោយសារការភ្ជាប់នៃ acetylcholine ទៅនឹងអ្នកទទួល M-cholinergic បណ្តាលឱ្យមានការកន្ត្រាក់នៃសាច់ដុំរលោងនោះ atropine ត្រូវបានគេប្រើជាថ្នាំដែលបន្ថយការស្ពឹករបស់ពួកគេ។ (ថ្នាំ antispasmodic) ។ដូច្នេះវាត្រូវបានគេស្គាល់ថាការប្រើប្រាស់ atropine ដើម្បីបន្ធូរសាច់ដុំភ្នែកនៅពេលមើល fundus ក៏ដូចជាដើម្បីបំបាត់ការកន្ត្រាក់នៅក្នុងក្រពះពោះវៀន។ អ្នកទទួល M-cholinergic ក៏មានវត្តមាននៅក្នុងប្រព័ន្ធសរសៃប្រសាទកណ្តាល (CNS) ផងដែរ ដូច្នេះបរិមាណដ៏ច្រើននៃ atropine អាចបណ្តាលឱ្យមានប្រតិកម្មដែលមិនចង់បានពីប្រព័ន្ធសរសៃប្រសាទកណ្តាល៖ ការរំជើបរំជួល និងផ្លូវចិត្ត ការយល់ច្រឡំ ការប្រកាច់។
Atropine មាននៅក្នុងក្រុមមុខងាររចនាសម្ព័ន្ធរបស់វាស្រដៀងទៅនឹង acetylcholine និងការរៀបចំលំហរបស់ពួកគេ ដូច្នេះវាជាកម្មសិទ្ធិរបស់អ្នកទប់ស្កាត់ការប្រកួតប្រជែងនៃ M-cholinergic receptors ។ ដោយសារការភ្ជាប់នៃ acetylcholine ទៅនឹងអ្នកទទួល M-cholinergic បណ្តាលឱ្យមានការកន្ត្រាក់នៃសាច់ដុំរលោងនោះ atropine ត្រូវបានគេប្រើជាថ្នាំដែលបន្ថយការស្ពឹករបស់ពួកគេ។ (ថ្នាំ antispasmodic) ។ដូច្នេះវាត្រូវបានគេស្គាល់ថាការប្រើប្រាស់ atropine ដើម្បីបន្ធូរសាច់ដុំភ្នែកនៅពេលមើល fundus ក៏ដូចជាដើម្បីបំបាត់ការកន្ត្រាក់នៅក្នុងក្រពះពោះវៀន។ អ្នកទទួល M-cholinergic ក៏មានវត្តមាននៅក្នុងប្រព័ន្ធសរសៃប្រសាទកណ្តាល (CNS) ផងដែរ ដូច្នេះបរិមាណដ៏ច្រើននៃ atropine អាចបណ្តាលឱ្យមានប្រតិកម្មដែលមិនចង់បានពីប្រព័ន្ធសរសៃប្រសាទកណ្តាល៖ ការរំជើបរំជួល និងផ្លូវចិត្ត ការយល់ច្រឡំ ការប្រកាច់។
Ditilin គឺជា agonist ប្រកួតប្រជែងនៃ H-cholinergic receptors ដែលរារាំងមុខងារនៃ neuromuscular synapses ។
 ការសំយោគសរសៃប្រសាទនៃសាច់ដុំគ្រោងឆ្អឹងមានអ្នកទទួល H-cholinergic ។ អន្តរកម្មរបស់ពួកគេជាមួយ acetylcholine នាំឱ្យមានការកន្ត្រាក់សាច់ដុំ។ នៅក្នុងប្រតិបត្តិការវះកាត់មួយចំនួន ក៏ដូចជានៅក្នុងការសិក្សា endoscopic ថ្នាំត្រូវបានគេប្រើដែលបណ្តាលឱ្យសម្រាកសាច់ដុំគ្រោងឆ្អឹង។ (ថ្នាំបន្ធូរសាច់ដុំ) ។ទាំងនេះរួមមាន dithylin ដែលជា analogue រចនាសម្ព័ន្ធនៃ acetylcholine ។ វាភ្ជាប់ទៅនឹង H-cholinergic receptors ប៉ុន្តែមិនដូច acetylcholine វាត្រូវបានបំផ្លាញយឺតណាស់ដោយអង់ស៊ីម acetylcholinesterase ។ ជាលទ្ធផលនៃការបើកយូរនៃឆានែលអ៊ីយ៉ុងនិងការ depolarization ជាប់លាប់នៃភ្នាស, ដំណើរការនៃកម្លាំងសរសៃប្រសាទត្រូវបានរំខានហើយការសម្រាកសាច់ដុំកើតឡើង។ ដំបូង លក្ខណៈសម្បត្តិទាំងនេះត្រូវបានរកឃើញនៅក្នុងថ្នាំពុល curare ដូច្នេះថ្នាំបែបនេះត្រូវបានគេហៅថា curariform ។
ការសំយោគសរសៃប្រសាទនៃសាច់ដុំគ្រោងឆ្អឹងមានអ្នកទទួល H-cholinergic ។ អន្តរកម្មរបស់ពួកគេជាមួយ acetylcholine នាំឱ្យមានការកន្ត្រាក់សាច់ដុំ។ នៅក្នុងប្រតិបត្តិការវះកាត់មួយចំនួន ក៏ដូចជានៅក្នុងការសិក្សា endoscopic ថ្នាំត្រូវបានគេប្រើដែលបណ្តាលឱ្យសម្រាកសាច់ដុំគ្រោងឆ្អឹង។ (ថ្នាំបន្ធូរសាច់ដុំ) ។ទាំងនេះរួមមាន dithylin ដែលជា analogue រចនាសម្ព័ន្ធនៃ acetylcholine ។ វាភ្ជាប់ទៅនឹង H-cholinergic receptors ប៉ុន្តែមិនដូច acetylcholine វាត្រូវបានបំផ្លាញយឺតណាស់ដោយអង់ស៊ីម acetylcholinesterase ។ ជាលទ្ធផលនៃការបើកយូរនៃឆានែលអ៊ីយ៉ុងនិងការ depolarization ជាប់លាប់នៃភ្នាស, ដំណើរការនៃកម្លាំងសរសៃប្រសាទត្រូវបានរំខានហើយការសម្រាកសាច់ដុំកើតឡើង។ ដំបូង លក្ខណៈសម្បត្តិទាំងនេះត្រូវបានរកឃើញនៅក្នុងថ្នាំពុល curare ដូច្នេះថ្នាំបែបនេះត្រូវបានគេហៅថា curariform ។
ប្រធានបទ ១.៣. ភាពប្រែប្រួលនៃប្រូតេអ៊ីន និងលទ្ធភាពនៃការបង្កើតឡើងវិញដោយឯកឯងរបស់ពួកគេ
1. ចាប់តាំងពីការអនុលោមតាមប្រភពដើមនៃប្រូតេអ៊ីនត្រូវបានរក្សាដោយសារតែអន្តរកម្មខ្សោយ ការផ្លាស់ប្តូរសមាសភាព និងលក្ខណៈសម្បត្តិនៃបរិស្ថានជុំវិញប្រូតេអ៊ីន ផលប៉ះពាល់នៃសារធាតុគីមី និងកត្តារាងកាយបណ្តាលឱ្យមានការផ្លាស់ប្តូរការអនុលោមតាមរបស់វា (ទ្រព្យសម្បត្តិនៃការអនុលោមតាមលក្ខខណ្ឌ) ។ ការដាច់នៃចំណងមួយចំនួនធំនាំទៅដល់ការបំផ្លិចបំផ្លាញនៃការអនុលោមតាមកំណើត និងការបង្ខូចទ្រង់ទ្រាយប្រូតេអ៊ីន។
ការប្រែពណ៌ប្រូតេអ៊ីន- នេះគឺជាការបំផ្លិចបំផ្លាញនៃការអនុលោមតាមប្រភពដើមរបស់ពួកគេនៅក្រោមសកម្មភាពនៃភ្នាក់ងារ denaturing ដែលបណ្តាលមកពីការបំបែកចំណងខ្សោយដែលធ្វើឱ្យមានស្ថេរភាពរចនាសម្ព័ន្ធលំហនៃប្រូតេអ៊ីន។ Denaturation ត្រូវបានអមដោយការបំផ្លិចបំផ្លាញនៃរចនាសម្ព័ន្ធបីវិមាត្រតែមួយគត់ និងមជ្ឈមណ្ឌលសកម្មនៃប្រូតេអ៊ីន និងការបាត់បង់សកម្មភាពជីវសាស្រ្តរបស់វា (រូបភាព 1.16) ។
រាល់ម៉ូលេគុលដែលមិនមានលក្ខណៈធម្មតានៃប្រូតេអ៊ីនមួយទទួលបានទម្រង់ចៃដន្យដែលខុសពីម៉ូលេគុលផ្សេងទៀតនៃប្រូតេអ៊ីនដូចគ្នា។ រ៉ាឌីកាល់អាស៊ីតអាមីណូដែលបង្កើតជាមជ្ឈមណ្ឌលសកម្ម ប្រែទៅជាឆ្ងាយពីគ្នាទៅវិញទៅមក ពោលគឺឧ។ កន្លែងភ្ជាប់ជាក់លាក់នៃប្រូតេអ៊ីនជាមួយ ligand ត្រូវបានបំផ្លាញ។ ក្នុងអំឡុងពេល denaturation រចនាសម្ព័ន្ធចម្បងនៃប្រូតេអ៊ីននៅតែមិនផ្លាស់ប្តូរ។
ការប្រើប្រាស់ភ្នាក់ងារ denaturing ក្នុងការស្រាវជ្រាវជីវសាស្រ្ត និងឱសថ។នៅក្នុងការសិក្សាជីវគីមី មុនពេលកំណត់សមាសធាតុទម្ងន់ម៉ូលេគុលទាបនៅក្នុងសម្ភារៈជីវសាស្រ្ត ប្រូតេអ៊ីនជាធម្មតាត្រូវបានយកចេញពីដំណោះស្រាយជាមុនសិន។ ចំពោះគោលបំណងនេះអាស៊ីត trichloroacetic (TCA) ត្រូវបានគេប្រើញឹកញាប់បំផុត។ បន្ទាប់ពីបន្ថែម TCA ទៅក្នុងដំណោះស្រាយ ប្រូតេអ៊ីន denatured precipitate និងត្រូវបានយកចេញបានយ៉ាងងាយស្រួលដោយការច្រោះ (តារាង 1.1 ។ )
នៅក្នុងវេជ្ជសាស្ត្រ ភ្នាក់ងារបន្សាបជាតិពុលត្រូវបានគេប្រើជាញឹកញាប់ក្នុងការក្រៀវឧបករណ៍ និងសម្ភារៈវេជ្ជសាស្ត្រនៅក្នុង autoclaves (ភ្នាក់ងារបន្សាបសីតុណ្ហភាពខ្ពស់) និងជាថ្នាំសំលាប់មេរោគ (ជាតិអាល់កុល phenol chloramine) ដើម្បីព្យាបាលផ្ទៃកខ្វក់ដែលមាន microflora បង្កជំងឺ។
2. ការបង្កើតឡើងវិញប្រូតេអ៊ីនដោយឯកឯង- ភស្តុតាងនៃការកំណត់រចនាសម្ព័ន្ធបឋម ការអនុលោមតាម និងមុខងារនៃប្រូតេអ៊ីន។ ប្រូតេអ៊ីនបុគ្គលគឺជាផលិតផលនៃហ្សែនមួយដែលមានលំដាប់អាស៊ីតអាមីណូដូចគ្នាបេះបិទ និងទទួលបានទម្រង់ដូចគ្នានៅក្នុងកោសិកា។ ការសន្និដ្ឋានជាមូលដ្ឋានថារចនាសម្ព័ន្ធចម្បងនៃប្រូតេអ៊ីនមានព័ត៌មានអំពីការអនុលោមតាមនិងមុខងាររបស់វារួចហើយដោយផ្អែកលើសមត្ថភាពនៃប្រូតេអ៊ីនមួយចំនួន (ជាពិសេស ribonuclease និង myoglobin) ក្នុងការបង្កើតឡើងវិញដោយឯកឯង - ការស្ដារឡើងវិញនូវទម្រង់ដើមរបស់ពួកគេបន្ទាប់ពីការប្រែពណ៌។
ការបង្កើតរចនាសម្ព័ន្ធលំហនៃប្រូតេអ៊ីនត្រូវបានអនុវត្តដោយវិធីសាស្រ្តនៃការប្រមូលផ្តុំដោយខ្លួនឯង - ដំណើរការដោយឯកឯងដែលខ្សែសង្វាក់ polypeptide ដែលមានរចនាសម្ព័ន្ធបឋមតែមួយគត់មានទំនោរទៅនឹងការអនុលោមតាមថាមពលឥតគិតថ្លៃទាបបំផុតនៅក្នុងដំណោះស្រាយ។ សមត្ថភាពក្នុងការបង្កើតឡើងវិញនូវប្រូតេអ៊ីនដែលរក្សារចនាសម្ព័ន្ធចម្បងរបស់ពួកគេបន្ទាប់ពីការ denaturation ត្រូវបានពិពណ៌នានៅក្នុងការពិសោធន៍ជាមួយអង់ស៊ីម ribonuclease ។
Ribonuclease គឺជាអង់ស៊ីមដែលបំបែកចំណងរវាងនុយក្លេអូទីតនីមួយៗនៅក្នុងម៉ូលេគុល RNA ។ ប្រូតេអ៊ីន globular នេះមានខ្សែសង្វាក់ polypeptide មួយ រចនាសម្ព័ន្ធទីបី ដែលត្រូវបានរក្សាលំនឹងដោយចំណងខ្សោយជាច្រើន និង disulfide បួន។
ការព្យាបាល ribonuclease ជាមួយអ៊ុយដែលបំបែកចំណងអ៊ីដ្រូសែននៅក្នុងម៉ូលេគុល និងភ្នាក់ងារកាត់បន្ថយដែលបំបែកចំណង disulfide នាំឱ្យអង់ស៊ីម denaturation និងបាត់បង់សកម្មភាពរបស់វា។
ការយកចេញនៃភ្នាក់ងារ denaturing ដោយការលាងឈាមនាំឱ្យមានការស្ដារឡើងវិញនៃការអនុលោមតាមប្រូតេអ៊ីននិងមុខងារ, i.e. ដើម្បី reanimation ។ (រូបភាព 1.17) ។
 អង្ករ។ ១.១៧. ការប្រែពណ៌ និងការបង្កើតឡើងវិញនៃ ribonuclease
អង្ករ។ ១.១៧. ការប្រែពណ៌ និងការបង្កើតឡើងវិញនៃ ribonuclease
ក - ការអនុលោមតាមប្រភពដើមនៃ ribonuclease នៅក្នុងរចនាសម្ព័ន្ធទីបីដែលមានចំណង disulfide បួន; ខ - ម៉ូលេគុល ribonuclease denatured;
ខ - ម៉ូលេគុល ribonuclease renative ជាមួយនឹងរចនាសម្ព័ន្ធនិងមុខងារដែលបានស្ដារឡើងវិញ
1. តារាងពេញលេញ 1.2 ។
តារាង 1.2 ។ ការចាត់ថ្នាក់នៃអាស៊ីតអាមីណូយោងទៅតាមប៉ូលនៃរ៉ាឌីកាល់
2. សរសេររូបមន្តនៃ tetrapeptide៖
Asp - Pro - Fen - Liz
ក) ញែកក្រុមដដែលៗនៅក្នុង peptide ដែលបង្កើតជាឆ្អឹងខ្នង peptide និងក្រុមអថេរតំណាងដោយរ៉ាឌីកាល់អាស៊ីតអាមីណូ។
ខ) កំណត់ N- និង C-termini;
គ) គូសបញ្ជាក់ចំណង peptide;
ឃ) សរសេរ peptide មួយផ្សេងទៀតដែលមានអាស៊ីតអាមីណូដូចគ្នា;
ង) រាប់ចំនួននៃវ៉ារ្យ៉ង់ tetrapeptide ដែលអាចមានជាមួយនឹងសមាសធាតុអាស៊ីតអាមីណូស្រដៀងគ្នា។
3. ពន្យល់ពីតួនាទីនៃរចនាសម្ព័ន្ធចម្បងនៃប្រូតេអ៊ីន ដោយប្រើឧទាហរណ៍នៃការវិភាគប្រៀបធៀបនៃរចនាសម្ព័ន្ធស្រដៀងគ្នា និងការវិវត្តនៃអរម៉ូន peptide ជិតស្និទ្ធនៃថនិកសត្វ neurohypophysis - អុកស៊ីតូស៊ីន និង vasopressin (តារាង 1.3) ។
តារាង 1.3 ។ រចនាសម្ព័ន្ធនិងមុខងារនៃអុកស៊ីតូស៊ីននិង vasopressin
 សម្រាប់ការនេះ:
សម្រាប់ការនេះ:
ក) ប្រៀបធៀបសមាសភាពនិងលំដាប់អាស៊ីតអាមីណូនៃ peptides ទាំងពីរ;
ខ) ស្វែងរកភាពស្រដៀងគ្នានៃរចនាសម្ព័ន្ធចម្បងនៃ peptides ទាំងពីរនិងភាពស្រដៀងគ្នានៃសកម្មភាពជីវសាស្រ្តរបស់ពួកគេ;
គ) រកឃើញភាពខុសគ្នានៅក្នុងរចនាសម្ព័ន្ធនៃ peptides ទាំងពីរនិងភាពខុសគ្នានៅក្នុងមុខងាររបស់ពួកគេ;
ឃ) ធ្វើការសន្និដ្ឋានអំពីឥទ្ធិពលនៃរចនាសម្ព័ន្ធចម្បងនៃ peptides លើមុខងាររបស់វា។
4. ពិពណ៌នាអំពីដំណាក់កាលសំខាន់ៗក្នុងការបង្កើតការអនុលោមនៃប្រូតេអ៊ីន globular (រចនាសម្ព័ន្ធបន្ទាប់បន្សំ, ទីបី, គំនិតនៃរចនាសម្ព័ន្ធអនុវិទ្យាល័យ) ។ បញ្ជាក់ប្រភេទនៃចំណងដែលពាក់ព័ន្ធនឹងការបង្កើតរចនាសម្ព័ន្ធប្រូតេអ៊ីន។ ដែលរ៉ាឌីកាល់អាស៊ីតអាមីណូអាចចូលរួមក្នុងការបង្កើតអន្តរកម្ម hydrophobic, អ៊ីយ៉ុង, ចំណងអ៊ីដ្រូសែន។
ផ្តល់ឧទាហរណ៍។
5. កំណត់គំនិតនៃ "ភាពទន់ខ្សោយនៃប្រូតេអ៊ីន" បង្ហាញពីហេតុផលសម្រាប់អត្ថិភាព និងសារៈសំខាន់របស់វា។
6. ពន្យល់ពីអត្ថន័យនៃឃ្លាខាងក្រោម៖ “មុខងារប្រូតេអ៊ីនផ្អែកលើអន្តរកម្មជាក់លាក់របស់វាជាមួយ ligand” ដោយប្រើពាក្យ និងពន្យល់អត្ថន័យរបស់វា៖ ការអនុលោមតាមប្រូតេអ៊ីន កន្លែងសកម្ម លីហ្គែន ការបំពេញបន្ថែម មុខងារប្រូតេអ៊ីន។
7. ដោយប្រើឧទាហរណ៍មួយ ពន្យល់ពីអ្វីដែលដែនមាន និងតួនាទីរបស់វានៅក្នុងដំណើរការនៃប្រូតេអ៊ីន។
កិច្ចការសម្រាប់ការគ្រប់គ្រងខ្លួនឯង
1. កំណត់ការប្រកួត។
ក្រុមមុខងារនៅក្នុងរ៉ាឌីកាល់អាស៊ីតអាមីណូ៖
A. ក្រុម Carboxyl B. Hydroxyl ក្រុម C Guanidine ក្រុម D. Thiol ក្រុម E. Amino ក្រុម
2. ជ្រើសរើសចម្លើយដែលត្រឹមត្រូវ។
អាស៊ីតអាមីណូដែលមានប៉ូលរ៉ាឌីកាល់ដែលមិនមានផ្ទុកគឺ៖
A. Non B. Asn
B. Glu G. បី
3. ជ្រើសរើសចម្លើយដែលត្រឹមត្រូវ។
រ៉ាឌីកាល់អាស៊ីតអាមីណូ៖
A. ផ្តល់ភាពជាក់លាក់នៃរចនាសម្ព័ន្ធបឋម B. ចូលរួមក្នុងការបង្កើតរចនាសម្ព័ន្ធទីបី
B. ស្ថិតនៅលើផ្ទៃនៃប្រូតេអ៊ីន ពួកវាប៉ះពាល់ដល់ការរលាយរបស់វា ឃ. បង្កើតជាមជ្ឈមណ្ឌលសកម្ម
ឃ. ចូលរួមក្នុងការបង្កើតចំណង peptide
4. ជ្រើសរើសចម្លើយដែលត្រឹមត្រូវ។
អន្តរកម្ម Hydrophobic អាចបង្កើតរវាងរ៉ាឌីកាល់អាស៊ីតអាមីណូ៖
A. Tre Lay B. Pro បី
B. បានជួប Ile G. Tir Ala D. Val Fen
5. ជ្រើសរើសចម្លើយដែលត្រឹមត្រូវ។
ចំណងអ៊ីយ៉ុងអាចបង្កើតរវាងរ៉ាឌីកាល់អាស៊ីតអាមីណូ៖
A. Gln Asp B. Apr Liz
B. Liz Glu G. Geese Asp D. Asn Apr
6. ជ្រើសរើសចម្លើយដែលត្រឹមត្រូវ។
ចំណងអ៊ីដ្រូសែនអាចបង្កើតបានរវាងរ៉ាឌីកាល់អាស៊ីតអាមីណូ៖
A. Ser Gln B. Cis Tre
B. Asp Liz G. Glu Asp D. Asn Tre
7. កំណត់ការប្រកួត។
ប្រភេទនៃចំណងដែលពាក់ព័ន្ធនឹងការបង្កើតរចនាសម្ព័ន្ធប្រូតេអ៊ីន៖
A. រចនាសម្ព័ន្ធបឋម B. រចនាសម្ព័ន្ធបន្ទាប់បន្សំ
ខ- រចនាសម្ព័ន្ធថ្នាក់ឧត្តមសិក្សា
ឃ. រចនាសម្ព័ន្ធអនុវិទ្យាល័យ E. អនុលោមភាព។
1. ចំណងអ៊ីដ្រូសែនរវាងអាតូមនៃឆ្អឹងខ្នង peptide
2. ចំណងខ្សោយរវាងក្រុមមុខងារនៃរ៉ាឌីកាល់អាស៊ីតអាមីណូ
3. ចំណងរវាងក្រុម α-amino និង α-carboxyl នៃអាស៊ីតអាមីណូ
8. ជ្រើសរើសចម្លើយដែលត្រឹមត្រូវ។ ទ្រីបស៊ីន៖
A. អង់ស៊ីម Proteolytic B. មានដែនពីរ
ខ. Hydrolyzes ម្សៅ
ឃ. មជ្ឈមណ្ឌលសកម្មមានទីតាំងនៅចន្លោះដែន។ ឃ. មានខ្សែសង្វាក់ polypeptide ពីរ។
9. ជ្រើសរើសចម្លើយដែលត្រឹមត្រូវ។ Atropine៖
A. សារធាតុបញ្ជូនសរសៃប្រសាទ
ខ. រចនាសម្ព័ន្ធ analogue នៃ acetylcholine
B. អន្តរកម្មជាមួយអ្នកទទួល H-cholinergic
G. ធ្វើអោយប្រសើរឡើងនូវដំណើរការនៃសរសៃប្រសាទតាមរយៈ cholinergic synapses
ឃ. អ្នករារាំងការប្រកួតប្រជែងនៃអ្នកទទួល M-cholinergic
10. ជ្រើសរើសសេចក្តីថ្លែងការណ៍ត្រឹមត្រូវ។ នៅក្នុងប្រូតេអ៊ីន៖
A. រចនាសម្ព័ន្ធចម្បងមានព័ត៌មានអំពីរចនាសម្ព័ន្ធនៃគេហទំព័រសកម្មរបស់វា។
ខ.មជ្ឈមណ្ឌលសកម្មត្រូវបានបង្កើតឡើងនៅកម្រិតនៃរចនាសម្ព័ន្ធបឋម
ខ. ការអនុលោមភាពត្រូវបានជួសជុលយ៉ាងតឹងរ៉ឹងដោយចំណង covalent
D. គេហទំព័រសកម្មអាចធ្វើអន្តរកម្មជាមួយក្រុមនៃ ligands ស្រដៀងគ្នា
ដោយសារតែភាពមិនចុះសម្រុងគ្នានៃប្រូតេអ៊ីន D. ការផ្លាស់ប្តូរបរិយាកាសអាចប៉ះពាល់ដល់ភាពស្និទ្ធស្នាលរបស់សកម្ម
កណ្តាលទៅ ligand
1. 1-C, 2-D, 3-B ។
3. A, B, C, D ។
7. 1-B, 2-D, 3-A ។
8. A, B, C, D ។
លក្ខខណ្ឌមូលដ្ឋាន និងគោលគំនិត
1. ប្រូតេអ៊ីន polypeptide អាស៊ីតអាមីណូ
2. រចនាសម្ព័ន្ធប្រូតេអ៊ីនបឋម, អនុវិទ្យាល័យ, ទីបី
3. ការអនុលោមតាមប្រូតេអ៊ីនកំណើត
4. ចំណង covalent និងខ្សោយនៅក្នុងប្រូតេអ៊ីនមួយ។
5. ការអនុលោមភាព lability
6. កន្លែងសកម្មប្រូតេអ៊ីន
7. លីហ្គែន
8. ផ្នត់ប្រូតេអ៊ីន
9. analogues រចនាសម្ព័ន្ធនៃ ligands
10. ប្រូតេអ៊ីនដែន
11. ប្រូតេអ៊ីនសាមញ្ញនិងស្មុគស្មាញ
12. ប្រូតេអ៊ីន denaturation ភ្នាក់ងារ denaturing
13. ការបង្កើតឡើងវិញនូវប្រូតេអ៊ីន
ដោះស្រាយបញ្ហា
"ការរៀបចំរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីននិងមូលដ្ឋាននៃមុខងាររបស់ពួកគេ"
1. មុខងារសំខាន់នៃប្រូតេអ៊ីន - អេម៉ូក្លូប៊ីន A (HbA) - គឺជាការដឹកជញ្ជូនអុកស៊ីសែនទៅជាលិកា។ នៅក្នុងមនុស្ស ទម្រង់ជាច្រើននៃប្រូតេអ៊ីននេះដែលមានលក្ខណៈសម្បត្តិ និងមុខងារផ្លាស់ប្តូរត្រូវបានគេស្គាល់ - អ្វីដែលគេហៅថា អេម៉ូក្លូប៊ីនមិនធម្មតា។ ឧទាហរណ៍ អេម៉ូក្លូប៊ីន S ត្រូវបានរកឃើញនៅក្នុងកោសិកាឈាមក្រហមរបស់អ្នកជំងឺដែលមានជំងឺស្លេកស្លាំងជំងឺ (HbS) ត្រូវបានគេរកឃើញថាមានភាពរលាយទាបក្រោមលក្ខខណ្ឌនៃសម្ពាធផ្នែកអុកស៊ីសែនទាប (ដូចដែលកើតឡើងនៅក្នុងឈាមសរសៃឈាមវ៉ែន)។ នេះនាំឱ្យមានការបង្កើតការប្រមូលផ្តុំនៃប្រូតេអ៊ីននេះ។ ប្រូតេអ៊ីនបាត់បង់មុខងាររបស់វា precipitates ហើយកោសិកាឈាមក្រហមក្លាយទៅជាមិនទៀងទាត់នៅក្នុងរូបរាង (ពួកវាខ្លះបង្កើតជារាងដូចសត្វកណ្ដុរ) ហើយត្រូវបានបំផ្លាញលឿនជាងធម្មតានៅក្នុងលំពែង។ ជាលទ្ធផល ភាពស្លេកស្លាំងក្នុងកោសិកាមានការរីកចម្រើន។
ភាពខុសគ្នាតែមួយគត់នៅក្នុងរចនាសម្ព័ន្ធបឋមនៃ HvA ត្រូវបានរកឃើញនៅក្នុងតំបន់ N-terminal នៃខ្សែβ-chain នៃអេម៉ូក្លូប៊ីន។ ប្រៀបធៀបតំបន់ N-terminal នៃ β-chain ហើយបង្ហាញពីរបៀបដែលការផ្លាស់ប្តូររចនាសម្ព័ន្ធចម្បងនៃប្រូតេអ៊ីនប៉ះពាល់ដល់លក្ខណៈសម្បត្តិ និងមុខងាររបស់វា។
 សម្រាប់ការនេះ:
សម្រាប់ការនេះ:
ក) សរសេររូបមន្តអាស៊ីតអាមីណូដែល HvA ខុសគ្នា ហើយប្រៀបធៀបលក្ខណៈសម្បត្តិនៃអាស៊ីតអាមីណូទាំងនេះ (ប៉ូល, បន្ទុក) ។
ខ) ធ្វើការសន្និដ្ឋានអំពីហេតុផលនៃការថយចុះនៃការរលាយ និងការរំលោភលើការដឹកជញ្ជូនអុកស៊ីសែននៅក្នុងជាលិកា។
2. តួរលេខបង្ហាញពីដ្យាក្រាមនៃរចនាសម្ព័ន្ធប្រូតេអ៊ីនដែលមានមជ្ឈមណ្ឌលភ្ជាប់ ligand (មជ្ឈមណ្ឌលសកម្ម)។ ពន្យល់ពីមូលហេតុដែលប្រូតេអ៊ីនជ្រើសរើសក្នុងការជ្រើសរើស ligand ។ សម្រាប់ការនេះ:
ក) ចងចាំពីអ្វីដែលជាមជ្ឈមណ្ឌលសកម្មនៃប្រូតេអ៊ីន ហើយពិចារណាពីរចនាសម្ព័ន្ធនៃមជ្ឈមណ្ឌលសកម្មនៃប្រូតេអ៊ីនដែលបង្ហាញក្នុងរូប។
ខ) សរសេររូបមន្តនៃរ៉ាឌីកាល់អាស៊ីតអាមីណូដែលបង្កើតជាមជ្ឈមណ្ឌលសកម្ម។
គ) គូរ ligand ដែលអាចធ្វើអន្តរកម្មជាពិសេសជាមួយទីតាំងសកម្មនៃប្រូតេអ៊ីន។ ចង្អុលបង្ហាញនៅលើវាក្រុមមុខងារដែលមានសមត្ថភាពបង្កើតចំណងជាមួយរ៉ាឌីកាល់អាស៊ីតអាមីណូដែលបង្កើតជាមជ្ឈមណ្ឌលសកម្ម។
ឃ) បង្ហាញពីប្រភេទនៃចំណងដែលកើតឡើងរវាង ligand និងរ៉ាឌីកាល់អាស៊ីតអាមីណូនៃមជ្ឈមណ្ឌលសកម្ម;
ង) ពន្យល់ពីមូលដ្ឋានសម្រាប់ភាពជាក់លាក់នៃអន្តរកម្មនៃប្រូតេអ៊ីនជាមួយ ligand មួយ។
 3.
តួលេខបង្ហាញពីទីតាំងសកម្មនៃប្រូតេអ៊ីន និងលីហ្គែនមួយចំនួន។
3.
តួលេខបង្ហាញពីទីតាំងសកម្មនៃប្រូតេអ៊ីន និងលីហ្គែនមួយចំនួន។
កំណត់ថាតើលីហ្គែនមួយណាទំនងជាមានអន្តរកម្មជាមួយទីតាំងសកម្មនៃប្រូតេអ៊ីន ហើយហេតុអ្វី។
 តើមូលបត្របំណុលប្រភេទណាខ្លះដែលកើតឡើងក្នុងអំឡុងពេលបង្កើតប្រូតេអ៊ីន-លីហ្គែន?
តើមូលបត្របំណុលប្រភេទណាខ្លះដែលកើតឡើងក្នុងអំឡុងពេលបង្កើតប្រូតេអ៊ីន-លីហ្គែន?
4. អាណាឡូកនៃរចនាសម្ព័ន្ធនៃលីហ្គែនប្រូតេអ៊ីនធម្មជាតិអាចត្រូវបានប្រើជាថ្នាំដើម្បីផ្លាស់ប្តូរសកម្មភាពរបស់ប្រូតេអ៊ីន។
Acetylcholine គឺជាអ្នកសម្រុះសម្រួលនៃការបញ្ជូនរំភើបនៅក្នុង synapses neuromuscular ។ នៅពេលដែល acetylcholine ធ្វើអន្តរកម្មជាមួយប្រូតេអ៊ីន - អ្នកទទួលភ្នាស postsynaptic នៃសាច់ដុំគ្រោងឆ្អឹង បណ្តាញអ៊ីយ៉ុងបើក ហើយការកន្ត្រាក់សាច់ដុំកើតឡើង។ Dithylin គឺជាថ្នាំដែលប្រើក្នុងប្រតិបត្តិការមួយចំនួនដើម្បីបន្ធូរសាច់ដុំព្រោះវារំខានដល់ការបញ្ជូនសរសៃប្រសាទតាមរយៈសរសៃប្រសាទសាច់ដុំ។ ពន្យល់ពីយន្តការនៃសកម្មភាពរបស់ឌីទីលីន ជាថ្នាំបន្ធូរសាច់ដុំ។ សម្រាប់ការនេះ:
ក) សរសេររូបមន្តនៃ acetylcholine និង dithyline ហើយប្រៀបធៀបរចនាសម្ព័ន្ធរបស់ពួកគេ;
ខ) ពិពណ៌នាអំពីយន្តការនៃសកម្មភាពបន្ធូរបន្ថយនៃឌីទីលីន។
5. នៅក្នុងជំងឺមួយចំនួនសីតុណ្ហភាពរាងកាយរបស់អ្នកជំងឺកើនឡើងដែលត្រូវបានគេចាត់ទុកថាជាប្រតិកម្មការពារនៃរាងកាយ។ ទោះជាយ៉ាងណាក៏ដោយ សីតុណ្ហភាពខ្ពស់គឺបង្អាក់ដល់ប្រូតេអ៊ីនរាងកាយ។ ពន្យល់ពីមូលហេតុដែលនៅសីតុណ្ហភាពលើសពី 40 °C មុខងាររបស់ប្រូតេអ៊ីនត្រូវបានរំខាន ហើយការគំរាមកំហែងដល់ជីវិតមនុស្សកើតឡើង។ ដើម្បីធ្វើដូចនេះសូមចាំថា:
1) រចនាសម្ព័ន្ធនៃប្រូតេអ៊ីននិងចំណងដែលរក្សារចនាសម្ព័ន្ធរបស់វានៅក្នុងការអនុលោមតាមប្រភពដើម;
2) តើរចនាសម្ព័ន្ធ និងមុខងាររបស់ប្រូតេអ៊ីនប្រែប្រួលយ៉ាងដូចម្តេច ជាមួយនឹងការកើនឡើងសីតុណ្ហភាព?
3) តើ homeostasis ជាអ្វី ហើយហេតុអ្វីបានជាវាសំខាន់ក្នុងការថែរក្សាសុខភាពមនុស្ស។
ឯកតាម៉ូឌុល 2 OLIGOMERIC PROTEINS ជាគោលដៅសម្រាប់ឥទ្ធិពលនិយតកម្ម។ រចនាសម្ព័ន្ធ និងមុខងារនៃប្រូតេអ៊ីន។ វិធីសាស្រ្តបំបែក និងបន្សុទ្ធប្រូតេអ៊ីន
គោលបំណងនៃការសិក្សា ដើម្បីអាច៖
1. ប្រើចំណេះដឹងអំពីលក្ខណៈពិសេសនៃរចនាសម្ព័ន្ធនិងមុខងារនៃប្រូតេអ៊ីន oligomeric ដើម្បីយល់ពីយន្តការបន្សាំនៃបទប្បញ្ញត្តិនៃមុខងាររបស់វា។
2. ពន្យល់ពីតួនាទីរបស់ chaperones ក្នុងការសំយោគ និងថែរក្សាការអនុលោមតាមប្រូតេអ៊ីននៅក្នុងកោសិកាមួយ។
3. ដើម្បីពន្យល់ពីភាពចម្រុះនៃការបង្ហាញនៃជីវិតដោយភាពចម្រុះនៃរចនាសម្ព័ន្ធនិងមុខងារនៃប្រូតេអ៊ីនដែលត្រូវបានសំយោគនៅក្នុងរាងកាយ។
4. វិភាគទំនាក់ទំនងរវាងរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីន និងមុខងាររបស់វាដោយប្រៀបធៀបអេម៉ូក្លូប៊ីនដែលទាក់ទង - myoglobin និង hemoglobin ក៏ដូចជាតំណាងនៃក្រុមប្រូតេអ៊ីនទាំងប្រាំនៃគ្រួសារ immunoglobulin ។
5. អនុវត្តចំណេះដឹងអំពីលក្ខណៈពិសេសនៃលក្ខណៈសម្បត្តិរូបវិទ្យានៃប្រូតេអ៊ីនដើម្បីជ្រើសរើសវិធីសាស្រ្តសម្រាប់ការបន្សុតរបស់ពួកគេពីប្រូតេអ៊ីននិងភាពមិនបរិសុទ្ធផ្សេងទៀត។
6. បកស្រាយលទ្ធផលនៃសមាសភាពបរិមាណនិងគុណភាពនៃប្រូតេអ៊ីនប្លាស្មាឈាមដើម្បីបញ្ជាក់ឬបញ្ជាក់ការធ្វើរោគវិនិច្ឆ័យគ្លីនិក។
ដឹង៖
1. លក្ខណៈពិសេសនៃរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីន oligomeric និងយន្តការសម្របខ្លួននៃបទប្បញ្ញត្តិនៃមុខងាររបស់ពួកគេនៅលើឧទាហរណ៍នៃអេម៉ូក្លូប៊ីន។
2. រចនាសម្ព័ននិងមុខងាររបស់ chaperones និងសារៈសំខាន់របស់ពួកគេសម្រាប់ការរក្សាការអនុលោមតាមប្រភពដើមនៃប្រូតេអ៊ីននៅក្នុងកោសិកាមួយ។
3. គោលការណ៍នៃការរៀបចំក្រុមប្រូតេអ៊ីនទៅជាក្រុមគ្រួសារដោយយោងទៅតាមភាពស្រដៀងគ្នានៃការអនុលោមតាមនិងមុខងាររបស់វានៅលើឧទាហរណ៍នៃ immunoglobulins ។
4. វិធីសាស្រ្តសម្រាប់ការបំបែកប្រូតេអ៊ីនដោយផ្អែកលើលក្ខណៈពិសេសនៃលក្ខណៈសម្បត្តិរូបវិទ្យារបស់ពួកគេ។
5. Electrophoresis នៃប្លាស្មាឈាមជាវិធីសាស្រ្តសម្រាប់វាយតម្លៃសមាសភាពគុណភាព និងបរិមាណនៃប្រូតេអ៊ីន។
ប្រធានបទ 1.4 ។ លក្ខណៈពិសេសនៃរចនាសម្ព័ន្ធនិងមុខងារនៃប្រូតេអ៊ីន OLIGOMERIC លើឧទាហរណ៍នៃអេម៉ូក្លូប៊ីន
1. ប្រូតេអ៊ីនជាច្រើនមានខ្សែសង្វាក់ polypeptide ជាច្រើន។ ប្រូតេអ៊ីនបែបនេះត្រូវបានគេហៅថា អូលីហ្គោមិកនិងសៀគ្វីបុគ្គល protomers ។ Protomers នៅក្នុងប្រូតេអ៊ីន oligomeric ត្រូវបានតភ្ជាប់ដោយចំណងដែលមិនមែនជាកូវ៉ាលេនខ្សោយជាច្រើន (hydrophobic, ionic, hydrogen) ។ អន្តរកម្ម
protomers ត្រូវបានអនុវត្តដោយអរគុណ ការបំពេញបន្ថែមផ្ទៃទំនាក់ទំនងរបស់ពួកគេ។
ចំនួន protomers នៅក្នុងប្រូតេអ៊ីន oligomeric អាចប្រែប្រួលយ៉ាងខ្លាំង៖ អេម៉ូក្លូប៊ីនមាន 4 protomers អង់ស៊ីម aspartate aminotransferase - 12 protomers និងប្រូតេអ៊ីនរបស់ថ្នាំជក់ mosaic virus រួមមាន protomers 2120 ដែលតភ្ជាប់ដោយចំណងមិនមែន covalent ។ ដូច្នេះ ប្រូតេអ៊ីន oligomeric អាចមានទម្ងន់ម៉ូលេគុលខ្ពស់ណាស់។
អន្តរកម្មរបស់ protomer មួយជាមួយអ្នកដទៃអាចត្រូវបានចាត់ទុកថាជាករណីពិសេសនៃអន្តរកម្មនៃប្រូតេអ៊ីនជាមួយ ligand ចាប់តាំងពី protomer នីមួយៗបម្រើជា ligand សម្រាប់ protomers ផ្សេងទៀត។ ចំនួននិងវិធីសាស្រ្តនៃការតភ្ជាប់ protomers នៅក្នុងប្រូតេអ៊ីនត្រូវបានគេហៅថា រចនាសម្ព័ន្ធប្រូតេអ៊ីន quaternary ។
ប្រូតេអ៊ីនអាចមាន protomers ដែលមានរចនាសម្ព័ន្ធដូចគ្នា ឬខុសគ្នា ឧទាហរណ៍ homodimers គឺជាប្រូតេអ៊ីនដែលមាន protomers ដូចគ្នាពីរ ហើយ heterodimers គឺជាប្រូតេអ៊ីនដែលមាន protomers ពីរផ្សេងគ្នា។
ប្រសិនបើប្រូតេអ៊ីនមាន protomers ផ្សេងគ្នា នោះមជ្ឈមណ្ឌលចងជាមួយ ligands ផ្សេងគ្នាដែលរចនាសម្ព័ន្ធខុសគ្នាអាចបង្កើតនៅលើពួកវា។ នៅពេលដែល ligand ភ្ជាប់ទៅនឹងមជ្ឈមណ្ឌលសកម្មមុខងារនៃប្រូតេអ៊ីននេះត្រូវបានបង្ហាញ។ មជ្ឈមណ្ឌលដែលមានទីតាំងនៅលើ protomer ផ្សេងគ្នាត្រូវបានគេហៅថា allosteric (ក្រៅពីសកម្ម) ។ ទំនាក់ទំនង allosteric ligand ឬ effector,វាអនុវត្តមុខងារនិយតកម្ម (រូបភាព 1.18) ។ អន្តរកម្មនៃមជ្ឈមណ្ឌល allosteric ជាមួយ effector បណ្តាលឱ្យមានការផ្លាស់ប្តូរទម្រង់នៅក្នុងរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីន oligomeric ទាំងមូលដោយសារតែ lability conformational របស់វា។ វាប៉ះពាល់ដល់ភាពស្និទ្ធស្នាលនៃគេហទំព័រសកម្មសម្រាប់ ligand ជាក់លាក់មួយ និងគ្រប់គ្រងមុខងារនៃប្រូតេអ៊ីននោះ។ ការផ្លាស់ប្តូរនៃការអនុលោមតាម និងមុខងាររបស់ protomers ទាំងអស់ក្នុងអំឡុងពេលអន្តរកម្មនៃប្រូតេអ៊ីន oligomeric ជាមួយ ligand យ៉ាងតិចមួយត្រូវបានគេហៅថា cooperative conformation change។ ឥទ្ធិពលដែលបង្កើនមុខងារប្រូតេអ៊ីនត្រូវបានគេហៅថា ភ្នាក់ងារសកម្មនិងឥទ្ធិពលដែលធ្វើឱ្យខូចមុខងាររបស់វា - ថ្នាំទប់ស្កាត់។
ដូច្នេះនៅក្នុងប្រូតេអ៊ីន oligomeric ក៏ដូចជាប្រូតេអ៊ីនដែលមានរចនាសម្ព័ន្ធដែន ទ្រព្យសម្បត្តិថ្មីលេចឡើងនៅក្នុងការប្រៀបធៀបជាមួយនឹងប្រូតេអ៊ីន monomeric - សមត្ថភាពក្នុងការគ្រប់គ្រងមុខងារ allosteric (បទប្បញ្ញត្តិដោយការភ្ជាប់ ligands ផ្សេងគ្នាទៅនឹងប្រូតេអ៊ីន) ។ នេះអាចត្រូវបានគេមើលឃើញដោយការប្រៀបធៀបរចនាសម្ព័ន្ធនិងមុខងារនៃប្រូតេអ៊ីនស្មុគស្មាញពីរដែលទាក់ទងគ្នាយ៉ាងជិតស្និទ្ធ myoglobin និង hemoglobin ។
 អង្ករ។ ១.១៨. ដ្យាក្រាមនៃរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីនឌីមឺរិច
អង្ករ។ ១.១៨. ដ្យាក្រាមនៃរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីនឌីមឺរិច
2. ការបង្កើតរចនាសម្ព័ន្ធលំហ និងដំណើរការនៃ myoglobin ។
Myoglobin (Mb) គឺជាប្រូតេអ៊ីនដែលមាននៅក្នុងសាច់ដុំក្រហម ដែលមុខងារសំខាន់គឺការបង្កើតទុនបម្រុង O 2 ដែលចាំបាច់សម្រាប់ការងារសាច់ដុំខ្លាំង។ MB គឺជាប្រូតេអ៊ីនស្មុគស្មាញដែលមានផ្នែកប្រូតេអ៊ីន - apoMB និងផ្នែកដែលមិនមានប្រូតេអ៊ីន - heme ។ រចនាសម្ព័ន្ធចម្បងនៃ apoMB កំណត់ការអនុលោមតាមរាងពងក្រពើតូចរបស់វា និងរចនាសម្ព័ន្ធនៃមជ្ឈមណ្ឌលសកម្ម ដែលផ្នែកដែលមិនមែនជាប្រូតេអ៊ីននៃ myoglobin, heme ត្រូវបានភ្ជាប់។ អុកស៊ីសែនពីឈាមទៅសាច់ដុំភ្ជាប់ទៅនឹង Fe + 2 heme នៅក្នុងសមាសភាពនៃ myoglobin ។ MB គឺជាប្រូតេអ៊ីន monomeric ដែលមានទំនាក់ទំនងខ្ពស់សម្រាប់ O 2 ដូច្នេះអុកស៊ីសែនត្រូវបានបញ្ចេញដោយ myoglobin តែក្នុងអំឡុងពេលការងារសាច់ដុំខ្លាំង នៅពេលដែលសម្ពាធផ្នែកនៃ O 2 ថយចុះយ៉ាងខ្លាំង។
ការបង្កើតអនុលោមតាម MB ។នៅក្នុងសាច់ដុំក្រហមនៅលើ ribosomes កំឡុងពេលបកប្រែការសំយោគនៃរចនាសម្ព័ន្ធចម្បងនៃ MB ដែលតំណាងដោយលំដាប់ជាក់លាក់នៃសំណល់អាស៊ីតអាមីណូចំនួន 153 កើតឡើង។ រចនាសម្ព័ន្ធបន្ទាប់បន្សំនៃ Mv មាន α-helices ចំនួនប្រាំបី ដែលហៅថាអក្សរឡាតាំងពី A ដល់ H ដែលនៅចន្លោះនោះមានផ្នែកដែលមិនមែនជាវង់។ រចនាសម្ព័ន្ធទីបីនៃ Mv មានទម្រង់នៃ globule បង្រួម នៅក្នុងការសម្រាកដែលរវាង F និង E α-helices មានមជ្ឈមណ្ឌលសកម្ម (រូបភាព 1.19) ។
 អង្ករ។ ១.១៩. រចនាសម្ព័ន្ធនៃ myoglobin
អង្ករ។ ១.១៩. រចនាសម្ព័ន្ធនៃ myoglobin
3. លក្ខណៈពិសេសនៃរចនាសម្ព័ន្ធនិងដំណើរការនៃមជ្ឈមណ្ឌលសកម្ម MV ។មជ្ឈមណ្ឌលសកម្មនៃ Mv ត្រូវបានបង្កើតឡើងជាចម្បងដោយរ៉ាឌីកាល់អាស៊ីតអាមីណូ hydrophobic ដែលនៅឆ្ងាយពីគ្នាទៅវិញទៅមកនៅក្នុងរចនាសម្ព័ន្ធបឋម (ឧទាហរណ៍ Tri 3 9 និង Phen 138) លីហ្គែនមិនរលាយក្នុងទឹក ហេម និងអូ 2 ត្រូវបានភ្ជាប់ទៅនឹងមជ្ឈមណ្ឌលសកម្ម។ Heme គឺជា apoMv ligand ជាក់លាក់ (Fig ។ 1.20) ដែលត្រូវបានផ្អែកលើចិញ្ចៀន pyrrole បួនតភ្ជាប់ដោយស្ពានមេទីល; នៅចំកណ្តាលមានអាតូម Fe + 2 ភ្ជាប់ទៅនឹងអាតូមអាសូតនៃចិញ្ចៀន pyrrole ដោយចំណងសំរបសំរួលចំនួនបួន។ បន្ថែមពីលើរ៉ាឌីកាល់ hydrophobic នៃអាស៊ីតអាមីណូមជ្ឈមណ្ឌលសកម្មនៃ Mv ក៏មានសំណល់នៃអាស៊ីតអាមីណូពីរដែលមានរ៉ាឌីកាល់ hydrophilic - Gis E ៧(ជីស ៦៤) និង Gis F ៨(៩៣ របស់ទ្រង់) (រូប ១.២១)។
 អង្ករ។ ១.២០. រចនាសម្ព័ន្ធនៃ heme - ផ្នែកដែលមិនមែនជាប្រូតេអ៊ីននៃ myoglobin និង hemoglobin
អង្ករ។ ១.២០. រចនាសម្ព័ន្ធនៃ heme - ផ្នែកដែលមិនមែនជាប្រូតេអ៊ីននៃ myoglobin និង hemoglobin
 អង្ករ។ ១.២១. ទីតាំងនៃ heme និង O 2 នៅក្នុងទីតាំងសកម្មនៃ apomyoglobin និង hemoglobin protomers
អង្ករ។ ១.២១. ទីតាំងនៃ heme និង O 2 នៅក្នុងទីតាំងសកម្មនៃ apomyoglobin និង hemoglobin protomers
Heme ត្រូវបានផ្សារភ្ជាប់យ៉ាងស្អិតរមួតជាមួយ F 8 របស់គាត់តាមរយៈអាតូមដែក។ O 2 ភ្ជាប់ទៅនឹងដែកនៅផ្នែកម្ខាងទៀតនៃយន្តហោះ heme ។ E 7 របស់គាត់គឺចាំបាច់សម្រាប់ការតំរង់ទិសត្រឹមត្រូវនៃ O 2 និងសម្របសម្រួលការបន្ថែមអុកស៊ីសែនទៅ Fe + 2 heme
Gis F ៨បង្កើតចំណងសំរបសំរួលជាមួយ Fe+ 2 ហើយជួសជុលយ៉ាងរឹងមាំនូវ heme នៅលើគេហទំព័រសកម្ម។ Gis E ៧គឺជាការចាំបាច់សម្រាប់ការតំរង់ទិសត្រឹមត្រូវនៅក្នុងមជ្ឈមណ្ឌលសកម្មនៃ ligand មួយផ្សេងទៀត - O 2 កំឡុងពេលអន្តរកម្មរបស់វាជាមួយ Fe + 2 heme ។ មីក្រូបរិស្ថាន heme បង្កើតលក្ខខណ្ឌសម្រាប់ការចងដ៏រឹងមាំ ប៉ុន្តែអាចបញ្ច្រាស់បាននៃ O 2 ជាមួយ Fe + 2 និងការពារទឹកពីការចូលទៅក្នុងមជ្ឈមណ្ឌលសកម្ម hydrophobic ដែលអាចនាំឱ្យអុកស៊ីតកម្មរបស់វាទៅ Fe + 3 ។
រចនាសម្ព័ន្ធ monomeric នៃ MB និងមជ្ឈមណ្ឌលសកម្មរបស់វាកំណត់ទំនាក់ទំនងខ្ពស់នៃប្រូតេអ៊ីនសម្រាប់ O 2 ។
4. រចនាសម្ព័ន្ធ Oligomeric នៃ Hb និងបទប្បញ្ញត្តិនៃទំនាក់ទំនង Hb សម្រាប់ O 2 ដោយ ligands ។ អេម៉ូក្លូប៊ីនរបស់មនុស្ស- ក្រុមគ្រួសារនៃប្រូតេអ៊ីនក៏ដូចជា myoglobin ដែលទាក់ទងទៅនឹងប្រូតេអ៊ីនស្មុគស្មាញ (hemoproteins) ។ ពួកវាមានរចនាសម្ព័ន្ធ tetrameric និងមានខ្សែសង្វាក់ α ពីរ ប៉ុន្តែមានភាពខុសប្លែកគ្នានៅក្នុងរចនាសម្ព័ន្ធនៃខ្សែសង្វាក់ polypeptide ពីរផ្សេងទៀត (2α-, 2x-chains) ។ រចនាសម្ព័ន្ធនៃខ្សែសង្វាក់ polypeptide ទីពីរកំណត់លក្ខណៈពិសេសនៃដំណើរការនៃទម្រង់ Hb ទាំងនេះ។ ប្រហែល 98% នៃអេម៉ូក្លូប៊ីននៅក្នុង erythrocytes មនុស្សពេញវ័យគឺ អេម៉ូក្លូប៊ីន A(2α-, 2p-chains) ។
អំឡុងពេលនៃការលូតលាស់គភ៌ មានអេម៉ូក្លូប៊ីនពីរប្រភេទសំខាន់ៗ៖ អំប្រ៊ីយ៉ុង HB(2α, 2ε) ដែលត្រូវបានរកឃើញនៅក្នុងដំណាក់កាលដំបូងនៃការអភិវឌ្ឍន៍គភ៌ និង អេម៉ូក្លូប៊ីន F (ទារក)- (2α, 2γ) ដែលជំនួសអេម៉ូក្លូប៊ីនរបស់គភ៌ដំបូងក្នុងខែទីប្រាំមួយនៃការអភិវឌ្ឍន៍គភ៌ ហើយត្រូវបានជំនួសដោយ Hb A ក្រោយពេលកើត។
Hv A គឺជាប្រូតេអ៊ីនដែលទាក់ទងទៅនឹង myoglobin (Mv) ដែលត្រូវបានរកឃើញនៅក្នុង erythrocytes មនុស្សពេញវ័យ។ រចនាសម្ព័ន្ធនៃ protomers បុគ្គលរបស់វាគឺស្រដៀងទៅនឹង myoglobin ។ រចនាសម្ព័ន្ធបន្ទាប់បន្សំ និងទីបីនៃ myoglobin និង hemoglobin protomers គឺស្រដៀងគ្នាខ្លាំងណាស់ ទោះបីជាមានសំណល់អាស៊ីតអាមីណូចំនួន 24 ដូចគ្នាដែរនៅក្នុងរចនាសម្ព័ន្ធចម្បងនៃខ្សែសង្វាក់ polypeptide របស់ពួកគេ (រចនាសម្ព័ន្ធបន្ទាប់បន្សំនៃ hemoglobin protomers ដូចជា myoglobin មាន α-helices ចំនួនប្រាំបី។ តំណាងដោយអក្សរឡាតាំងពី A ដល់ H ហើយរចនាសម្ព័ន្ធទីបីមានទម្រង់ជារាងពងក្រពើ) ។ ប៉ុន្តែមិនដូច myoglobin ទេ អេម៉ូក្លូប៊ីនមានរចនាសម្ព័ន្ធ oligomeric មានខ្សែសង្វាក់ polypeptide បួនដែលតភ្ជាប់ដោយចំណងដែលមិនមែនជាកូវ៉ាលេន (រូបភាព 1.22) ។
Hb protomer នីមួយៗត្រូវបានផ្សារភ្ជាប់ជាមួយនឹងផ្នែកដែលមិនមានប្រូតេអ៊ីន - heme និង protomers ជិតខាង។ ការតភ្ជាប់នៃផ្នែកប្រូតេអ៊ីននៃ Hb ជាមួយ heme គឺស្រដៀងគ្នាទៅនឹង myoglobin: នៅក្នុងមជ្ឈមណ្ឌលសកម្មនៃប្រូតេអ៊ីនផ្នែក hydrophobic នៃ heme ត្រូវបានហ៊ុំព័ទ្ធដោយរ៉ាឌីកាល់អាស៊ីតអាមីណូ hydrophobic លើកលែងតែ F 8 និង E 7 របស់គាត់ ដែលមានទីតាំងនៅសងខាងនៃយន្តហោះ heme និងដើរតួនាទីស្រដៀងគ្នាក្នុងដំណើរការនៃប្រូតេអ៊ីន និងការភ្ជាប់របស់វាជាមួយអុកស៊ីសែន (សូមមើលរចនាសម្ព័ន្ធនៃ myoglobin) ។
 អង្ករ។ ១.២២. រចនាសម្ព័ន្ធ oligomeric នៃអេម៉ូក្លូប៊ីន
អង្ករ។ ១.២២. រចនាសម្ព័ន្ធ oligomeric នៃអេម៉ូក្លូប៊ីន
ក្រៅពីនេះ Gis E ៧អនុវត្តសំខាន់ តួនាទីបន្ថែមនៅក្នុងដំណើរការរបស់ NV ។ heme ឥតគិតថ្លៃមានទំនាក់ទំនងខ្ពស់ជាង 25,000 ដងសម្រាប់ CO ជាង O 2 ។ CO ត្រូវបានបង្កើតឡើងក្នុងបរិមាណតិចតួចនៅក្នុងរាងកាយ ហើយដោយសារភាពស្និទ្ធស្នាលខ្ពស់របស់វាសម្រាប់ heme វាអាចរំខានដល់ការដឹកជញ្ជូន O 2 ដែលចាំបាច់សម្រាប់ជីវិតកោសិកា។ ទោះជាយ៉ាងណាក៏ដោយនៅក្នុងសមាសភាពនៃអេម៉ូក្លូប៊ីនភាពស្និទ្ធស្នាលនៃ heme សម្រាប់កាបូនម៉ូណូអុកស៊ីតលើសពីភាពស្និទ្ធស្នាលសម្រាប់ O 2 ត្រឹមតែ 200 ដងប៉ុណ្ណោះដោយសារតែវត្តមានរបស់ E 7 នៅក្នុងមជ្ឈមណ្ឌលសកម្មរបស់គាត់។ សំណល់នៃអាស៊ីតអាមីណូនេះបង្កើតលក្ខខណ្ឌល្អប្រសើរបំផុតសម្រាប់ការផ្សារភ្ជាប់នៃ heme ទៅ O2 និងធ្វើឱ្យអន្តរកម្មរបស់ heme ជាមួយ CO ចុះខ្សោយ។
5. មុខងារសំខាន់របស់ Hb គឺការដឹកជញ្ជូន O 2 ពីសួតទៅជាលិកា។មិនដូច myoglobin monomeric ដែលមានភាពស្និទ្ធស្នាលខ្លាំងសម្រាប់ O 2 និងអនុវត្តមុខងារនៃការរក្សាទុកអុកស៊ីសែននៅក្នុងសាច់ដុំក្រហមរចនាសម្ព័ន្ធ oligomeric នៃអេម៉ូក្លូប៊ីនផ្តល់នូវ:
1) តិត្ថិភាពរហ័សនៃ Hb ជាមួយនឹងអុកស៊ីសែននៅក្នុងសួត;
2) សមត្ថភាពរបស់ Hb ក្នុងការបញ្ចេញអុកស៊ីសែននៅក្នុងជាលិកានៅសម្ពាធផ្នែកខ្ពស់នៃ O 2 (20-40 mm Hg);
3) លទ្ធភាពនៃការគ្រប់គ្រងភាពស្និទ្ធស្នាលនៃ Hb ទៅ O 2 ។
6. ការផ្លាស់ប្តូរសហករណ៍ក្នុងការអនុលោមតាមអេម៉ូក្លូប៊ីន protomers ពន្លឿនការចង O 2 នៅក្នុងសួត និងការត្រលប់ទៅជាលិកាវិញ។ នៅក្នុងសួត សម្ពាធផ្នែកខ្ពស់នៃ O2 ជំរុញការភ្ជាប់របស់វាទៅនឹង Hb នៅកន្លែងសកម្មនៃ protomers បួន (2α និង 2β) ។ មជ្ឈមណ្ឌលសកម្មនៃ protomer នីមួយៗ ដូចជានៅក្នុង myoglobin មានទីតាំងនៅចន្លោះ α-helices (F និង E) នៅក្នុងហោប៉ៅ hydrophobic ។ វាមានផ្នែកដែលមិនមែនជាប្រូតេអ៊ីន - heme ដែលភ្ជាប់ទៅនឹងផ្នែកប្រូតេអ៊ីនដោយអន្តរកម្ម hydrophobic ខ្សោយជាច្រើន និងចំណងដ៏រឹងមាំមួយរវាង Fe 2 + heme និង F 8 របស់គាត់ (សូមមើលរូប 1.21) ។
នៅក្នុង deoxyhemoglobin ដោយសារតែការតភ្ជាប់នេះជាមួយ F 8 របស់គាត់ អាតូម Fe 2 + លាតសន្ធឹងពីយន្តហោះ heme ឆ្ពោះទៅរក histidine ។ ការផ្សារភ្ជាប់នៃ O 2 ទៅ Fe 2 + កើតឡើងនៅផ្នែកម្ខាងទៀតនៃ heme នៅក្នុងតំបន់ E 7 របស់គាត់ ដោយមានជំនួយពីចំណងសំរបសំរួលដោយឥតគិតថ្លៃតែមួយ។ អ៊ី 7 របស់គាត់ផ្តល់នូវលក្ខខណ្ឌដ៏ល្អប្រសើរសម្រាប់ការចង O 2 ជាមួយនឹងជាតិដែក heme ។
ការបន្ថែម O 2 ទៅអាតូម Fe +2 នៃ protomer មួយបណ្តាលឱ្យវាផ្លាស់ទីទៅក្នុងយន្តហោះ heme ហើយនៅពីក្រោយវា សំណល់ histidine ដែលជាប់ទាក់ទងនឹងវា
 អង្ករ។ ១.២៣. ការផ្លាស់ប្តូរការអនុលោមតាមអេម៉ូក្លូប៊ីនប្រូតូមឺរនៅពេលផ្សំជាមួយ O 2
អង្ករ។ ១.២៣. ការផ្លាស់ប្តូរការអនុលោមតាមអេម៉ូក្លូប៊ីនប្រូតូមឺរនៅពេលផ្សំជាមួយ O 2
នេះនាំឱ្យមានការផ្លាស់ប្តូរនៅក្នុងការអនុលោមតាមខ្សែសង្វាក់ polypeptide ទាំងអស់ដោយសារតែ lability អនុលោមតាមរបស់ពួកគេ។ ការផ្លាស់ប្តូរការអនុលោមតាមខ្សែសង្វាក់ផ្សេងទៀតសម្របសម្រួលអន្តរកម្មរបស់ពួកគេជាមួយម៉ូលេគុល O 2 បន្ទាប់។
ម៉ូលេគុល O 2 ទី 4 ភ្ជាប់ទៅនឹងអេម៉ូក្លូប៊ីនងាយស្រួលជាង 300 ដង (រូបភាព 1.24) ។
 អង្ករ។ ១.២៤. ការផ្លាស់ប្តូរសហករណ៍ក្នុងការអនុលោមតាមអេម៉ូក្លូប៊ីន protomers កំឡុងពេលអន្តរកម្មរបស់វាជាមួយ O 2
អង្ករ។ ១.២៤. ការផ្លាស់ប្តូរសហករណ៍ក្នុងការអនុលោមតាមអេម៉ូក្លូប៊ីន protomers កំឡុងពេលអន្តរកម្មរបស់វាជាមួយ O 2
នៅក្នុងជាលិកា ម៉ូលេគុល O 2 ជាបន្តបន្ទាប់នីមួយៗត្រូវបានកាត់ចេញយ៉ាងងាយស្រួលជាង ម៉ូលេគុលមុន ផងដែរ ដោយសារតែការផ្លាស់ប្តូរសហករណ៍ក្នុងការអនុលោមតាម protomer ។
7. CO 2 និង H + ដែលបង្កើតឡើងកំឡុងពេល catabolism នៃសារធាតុសរីរាង្គ កាត់បន្ថយភាពស្និទ្ធស្នាលនៃអេម៉ូក្លូប៊ីនសម្រាប់ O 2 តាមសមាមាត្រទៅនឹងកំហាប់របស់វា។ ថាមពលដែលចាំបាច់សម្រាប់ដំណើរការកោសិកាត្រូវបានផលិតជាចម្បងនៅក្នុង mitochondria កំឡុងពេលអុកស៊ីតកម្មនៃសារធាតុសរីរាង្គដោយប្រើ O 2 ដែលបញ្ជូនពីសួតដោយអេម៉ូក្លូប៊ីន។ ជាលទ្ធផលនៃការកត់សុីនៃសារធាតុសរីរាង្គផលិតផលចុងក្រោយនៃការពុកផុយរបស់ពួកគេត្រូវបានបង្កើតឡើង: CO 2 និង K 2 O ដែលជាបរិមាណសមាមាត្រទៅនឹងអាំងតង់ស៊ីតេនៃដំណើរការអុកស៊ីតកម្មដែលកំពុងដំណើរការ។
CO 2 សាយភាយចេញពីកោសិកាទៅក្នុងឈាម ហើយចូលទៅក្នុង erythrocytes ដែលនៅក្រោមសកម្មភាពនៃអង់ស៊ីម carbanhydrase វាប្រែទៅជាអាស៊ីតកាបូន។ អាស៊ីតខ្សោយនេះបំបែកទៅជាប្រូតុង និងអ៊ីយ៉ុង bicarbonate ។
H+ អាចចូលរួមជាមួយរ៉ាឌីកាល់ GIS 14 6 នៅក្នុង α- និង β-chains នៃ hemoglobin, i.e. នៅក្នុងតំបន់ឆ្ងាយពី heme ។ Protonation នៃអេម៉ូក្លូប៊ីនកាត់បន្ថយភាពស្និទ្ធស្នាលរបស់វាចំពោះ O 2 ជំរុញការលុបបំបាត់ O 2 ពី oxyHb ការបង្កើត deoxyHb និងបង្កើនការផ្គត់ផ្គង់អុកស៊ីសែនទៅជាលិកាក្នុងសមាមាត្រទៅនឹងចំនួនប្រូតុងដែលបានបង្កើតឡើង (រូបភាព 1.25) ។
ការកើនឡើងនៃបរិមាណអុកស៊ីសែនដែលបញ្ចេញដោយអាស្រ័យលើការកើនឡើងនៃកំហាប់ H + ក្នុង erythrocytes ត្រូវបានគេហៅថាឥទ្ធិពល Bohr (បន្ទាប់ពីអ្នកសរីរវិទ្យាជនជាតិដាណឺម៉ាក Christian Bohr ដែលបានរកឃើញឥទ្ធិពលនេះជាលើកដំបូង) ។
នៅក្នុងសួត សម្ពាធផ្នែកខ្ពស់នៃអុកស៊ីសែនជំរុញការភ្ជាប់របស់វាទៅនឹង deoxyHb ដែលកាត់បន្ថយភាពស្និទ្ធស្នាលរបស់ប្រូតេអ៊ីនសម្រាប់ H+ ។ ប្រូតុងដែលបញ្ចេញនៅក្រោមសកម្មភាពរបស់ carbanhydrase មានអន្តរកម្មជាមួយ bicarbonates ដើម្បីបង្កើត CO 2 និង H 2 O

 អង្ករ។ ១.២៥. ការពឹងផ្អែកនៃភាពស្និទ្ធស្នាលនៃ Hb ទៅ O 2 លើកំហាប់នៃ CO 2 និងប្រូតុង (ឥទ្ធិពល Bohr):
អង្ករ។ ១.២៥. ការពឹងផ្អែកនៃភាពស្និទ្ធស្នាលនៃ Hb ទៅ O 2 លើកំហាប់នៃ CO 2 និងប្រូតុង (ឥទ្ធិពល Bohr):
ប៉ុន្តែ- ឥទ្ធិពលនៃកំហាប់ CO 2 និង H + លើការបញ្ចេញ O 2 ពីស្មុគស្មាញជាមួយ Hb (ឥទ្ធិពល Bohr); ខ- អុកស៊ីសែននៃ deoxyhemoglobin នៅក្នុងសួត ការបង្កើត និងការបញ្ចេញ CO 2 ។
លទ្ធផល CO 2 ចូលទៅក្នុងលំហ alveolar ហើយត្រូវបានយកចេញដោយខ្យល់ដកដង្ហើមចេញ។ ដូច្នេះបរិមាណអុកស៊ីហ៊្សែនដែលបញ្ចេញដោយអេម៉ូក្លូប៊ីននៅក្នុងជាលិកាត្រូវបានគ្រប់គ្រងដោយផលិតផលនៃ catabolism នៃសារធាតុសរីរាង្គ: ការបំបែកសារធាតុកាន់តែខ្លាំងឧទាហរណ៍ក្នុងអំឡុងពេលហាត់ប្រាណការប្រមូលផ្តុំ CO 2 និង H + កាន់តែខ្ពស់និងច្រើនទៀត។ អុកស៊ីសែនដែលជាលិកាទទួលបានជាលទ្ធផលនៃការថយចុះនៃទំនាក់ទំនងនៃ H ទៅ O 2 ។
8. បទប្បញ្ញត្តិ Allosteric នៃ Hb affinity សម្រាប់ O 2 ដោយ ligand - 2,3-bisphosphoglycerate ។នៅក្នុង erythrocytes, allosteric ligand នៃ hemoglobin, 2,3-bisphosphoglycerate (2,3-BPG) ត្រូវបានសំយោគពីផលិតផលនៃការកត់សុីគ្លុយកូស - 1,3-bisphosphoglycerate ។ នៅក្រោមលក្ខខណ្ឌធម្មតាកំហាប់នៃ 2,3-BPG គឺខ្ពស់និងអាចប្រៀបធៀបទៅនឹង Hb ។ 2,3-BPG មានបន្ទុកអវិជ្ជមានខ្លាំងនៃ -5 ។
 Bisphosphoglycerate នៅក្នុងជាលិកា capillaries ដោយការភ្ជាប់ទៅនឹង deoxyhemoglobin បង្កើនទិន្នផលអុកស៊ីសែននៅក្នុងជាលិកាកាត់បន្ថយភាពស្និទ្ធស្នាលនៃ Hb ទៅ O 2 ។
Bisphosphoglycerate នៅក្នុងជាលិកា capillaries ដោយការភ្ជាប់ទៅនឹង deoxyhemoglobin បង្កើនទិន្នផលអុកស៊ីសែននៅក្នុងជាលិកាកាត់បន្ថយភាពស្និទ្ធស្នាលនៃ Hb ទៅ O 2 ។
មានប្រហោងមួយនៅចំកណ្តាលនៃម៉ូលេគុល tetrameric hemoglobin ។ វាត្រូវបានបង្កើតឡើងដោយសំណល់អាស៊ីតអាមីណូនៃ protomers ទាំងបួន (សូមមើលរូប 1.22) ។ នៅក្នុងជាលិកា capillaries ប្រូតុងនៃ Hb (ឥទ្ធិពល Bohr) បំបែកចំណងរវាងជាតិដែក heme និង O 2 ។ នៅក្នុងម៉ូលេគុលមួយ។
deoxyhemoglobin បើប្រៀបធៀបជាមួយ oxyhemoglobin ចំណងអ៊ីយ៉ុងបន្ថែមលេចឡើងដែលភ្ជាប់ protomers ដែលជាលទ្ធផលដែលទំហំនៃបែហោងធ្មែញកណ្តាលកើនឡើងបើប្រៀបធៀបទៅនឹង oxyhemoglobin ។ បែហោងធ្មែញកណ្តាលគឺជាកន្លែងភ្ជាប់នៃ 2,3-BPG ទៅនឹងអេម៉ូក្លូប៊ីន។ ដោយសារតែភាពខុសគ្នានៃទំហំនៃបែហោងធ្មែញកណ្តាល 2,3-BPG អាចភ្ជាប់ទៅនឹង deoxyhemoglobin ប៉ុណ្ណោះ។
2,3-BPG ធ្វើអន្តរកម្មជាមួយអេម៉ូក្លូប៊ីនក្នុងតំបន់ដាច់ស្រយាលពីមជ្ឈមណ្ឌលសកម្មនៃប្រូតេអ៊ីន និងជាកម្មសិទ្ធិរបស់ allosteric(និយតកម្ម) ligands និង បែហោងកណ្តាល Hb គឺ មជ្ឈមណ្ឌល allosteric ។ 2,3-BPG មានបន្ទុកអវិជ្ជមានខ្លាំង និងធ្វើអន្តរកម្មជាមួយក្រុមដែលមានបន្ទុកវិជ្ជមានចំនួន 5 នៃខ្សែសង្វាក់ Hb β-ពីរ៖ ក្រុម N-terminal α-amino ក្រុម Val និងរ៉ាឌីកាល់ Lys 82 Gis 143 (រូបភាព 1.26) ។
 អង្ករ។ ១.២៦. BPG នៅក្នុងបែហោងធ្មែញកណ្តាលនៃ deoxyhemoglobin
អង្ករ។ ១.២៦. BPG នៅក្នុងបែហោងធ្មែញកណ្តាលនៃ deoxyhemoglobin
BPG ភ្ជាប់ទៅក្រុមដែលមានបន្ទុកវិជ្ជមានចំនួនបីនៅក្នុង β-strand នីមួយៗ។
នៅក្នុងជាលិកា capillaries លទ្ធផល deoxyhemoglobin អន្តរកម្មជាមួយ 2,3-BPG ហើយចំណងអ៊ីយ៉ុងត្រូវបានបង្កើតឡើងរវាងរ៉ាឌីកាល់ដែលមានបន្ទុកវិជ្ជមាននៃ β-chains និង ligand ចោទប្រកាន់អវិជ្ជមាន ដែលផ្លាស់ប្តូរការអនុលោមតាមប្រូតេអ៊ីន និងកាត់បន្ថយភាពស្និទ្ធស្នាលរបស់ Hb សម្រាប់ O 2 ។ ការថយចុះនៃភាពស្និទ្ធស្នាលរបស់ Hb សម្រាប់ O 2 រួមចំណែកដល់ការបញ្ចេញ O 2 ទៅក្នុងជាលិកាកាន់តែមានប្រសិទ្ធភាព។
នៅក្នុងសួត, នៅសម្ពាធផ្នែកខ្ពស់, អុកស៊ីសែនធ្វើអន្តរកម្មជាមួយ Hb, ចូលរួមជាមួយជាតិដែក heme; ក្នុងករណីនេះការផ្លាស់ប្តូរការអនុលោមតាមប្រូតេអ៊ីន បែហោងធ្មែញកណ្តាលថយចុះ ហើយ 2,3-BPG ត្រូវបានផ្លាស់ទីលំនៅពីមជ្ឈមណ្ឌល allosteric
ដូច្នេះប្រូតេអ៊ីន oligomeric មានលក្ខណៈសម្បត្តិថ្មីបើប្រៀបធៀបទៅនឹងប្រូតេអ៊ីន monomeric ។ ការភ្ជាប់នៃ ligands នៅកន្លែង,
គម្លាតឆ្ងាយពីគ្នាទៅវិញទៅមក (allosteric) ដែលមានសមត្ថភាពធ្វើឱ្យមានការផ្លាស់ប្តូរទម្រង់នៅក្នុងម៉ូលេគុលប្រូតេអ៊ីនទាំងមូល។ ដោយសារតែអន្តរកម្មជាមួយ ligands និយតកម្មការផ្លាស់ប្តូរការអនុលោមភាពនិងមុខងារនៃម៉ូលេគុលប្រូតេអ៊ីនសម្របខ្លួនទៅនឹងការផ្លាស់ប្តូរបរិស្ថាន។
ប្រធានបទ 1.5 ។ ការថែរក្សាការអនុលោមតាមធម្មជាតិនៃប្រូតេអ៊ីនក្រោមលក្ខខណ្ឌកោសិកា
នៅក្នុងកោសិកា កំឡុងពេលសំយោគខ្សែសង្វាក់ polypeptide ការដឹកជញ្ជូនរបស់ពួកគេតាមរយៈភ្នាសទៅផ្នែកដែលត្រូវគ្នានៃកោសិកា ក្នុងដំណើរការនៃការបត់ (ការបង្កើតទម្រង់ដើម) និងកំឡុងពេលប្រមូលផ្តុំប្រូតេអ៊ីន oligomeric ក៏ដូចជាអំឡុងពេលដំណើរការរបស់វា កម្រិតមធ្យម។ , ងាយនឹងប្រមូលផ្តុំ, ការអនុលោមភាពមិនស្ថិតស្ថេរកើតឡើងនៅក្នុងរចនាសម្ព័ន្ធប្រូតេអ៊ីន។ រ៉ាឌីកាល់ Hydrophobic ដែលជាធម្មតាលាក់នៅខាងក្នុងម៉ូលេគុលប្រូតេអ៊ីននៅក្នុងការអនុលោមតាមដើមរបស់វា លេចឡើងនៅលើផ្ទៃក្នុងទម្រង់មិនស្ថិតស្ថេរ ហើយមានទំនោរទៅរួមផ្សំជាមួយនឹងក្រុមនៃប្រូតេអ៊ីនផ្សេងទៀតដែលស្រដៀងគ្នាមិនសូវរលាយក្នុងទឹក។ នៅក្នុងកោសិកានៃសារពាង្គកាយដែលគេស្គាល់ទាំងអស់ ប្រូតេអ៊ីនពិសេសត្រូវបានគេរកឃើញដែលផ្តល់នូវការផ្នត់ដ៏ល្អប្រសើរនៃប្រូតេអ៊ីនកោសិកា រក្សាលំនឹងការអនុលោមតាមដើមរបស់វាអំឡុងពេលដំណើរការ ហើយសំខាន់បំផុតគឺរក្សារចនាសម្ព័ន្ធ និងមុខងារនៃប្រូតេអ៊ីនក្នុងកោសិកាក្នុងករណីមានការរំខានដល់ homeostasis ។ ប្រូតេអ៊ីនទាំងនេះត្រូវបានគេហៅថា "អ្នកបួស"ដែលមានន័យថា "មេដោះ" ជាភាសាបារាំង។
1. មេអំបៅម៉ូលេគុល និងតួនាទីរបស់ពួកគេក្នុងការទប់ស្កាត់ការខូចទ្រង់ទ្រាយប្រូតេអ៊ីន។
Chaperones (III) ត្រូវបានចាត់ថ្នាក់តាមទំហំនៃអនុរង។ ទម្ងន់ម៉ូលេគុលខ្ពស់មានម៉ាសពី 60 ទៅ 110 kD ។ ក្នុងចំណោមពួកគេ ថ្នាក់បីត្រូវបានសិក្សាច្រើនបំផុតគឺ Sh-60, Sh-70 និង Sh-90 ។ ថ្នាក់នីមួយៗរួមមានក្រុមគ្រួសារនៃប្រូតេអ៊ីនដែលពាក់ព័ន្ធ។ ដូច្នេះ Sh-70 មានប្រូតេអ៊ីនដែលមានទម្ងន់ម៉ូលេគុលពី 66 ទៅ 78 kD ។ Chaperones ទម្ងន់ម៉ូលេគុលទាបមានទម្ងន់ម៉ូលេគុលពី 40 ទៅ 15 kD ។
ក្នុងចំណោមចៅក្រមមាន ធម្មនុញ្ញប្រូតេអ៊ីនដែលការសំយោគ basal ខ្ពស់មិនអាស្រ័យលើឥទ្ធិពលស្ត្រេសលើកោសិកានៃរាងកាយ និង មិនអាចទទួលយកបាន,ការសំយោគដែលនៅក្រោមលក្ខខណ្ឌធម្មតាគឺខ្សោយ ប៉ុន្តែកើនឡើងយ៉ាងខ្លាំងនៅក្រោមឥទ្ធិពលស្ត្រេស។ Chaperones Inducible ត្រូវបានគេហៅផងដែរថា "ប្រូតេអ៊ីនឆក់កំដៅ" ព្រោះវាត្រូវបានរកឃើញដំបូងនៅក្នុងកោសិកាដែលប៉ះពាល់នឹងសីតុណ្ហភាពខ្ពស់។ នៅក្នុងកោសិកា ដោយសារកំហាប់ប្រូតេអ៊ីនខ្ពស់ ការបង្កើតឡើងវិញដោយឯកឯងនៃប្រូតេអ៊ីនដែលខូចដោយផ្នែកគឺពិបាក។ Sh-70 អាចការពារដំណើរការនៃ denaturation ដែលបានចាប់ផ្តើម និងជួយស្ដារការអនុលោមតាមប្រភពដើមនៃប្រូតេអ៊ីន។ ម៉ូលេគុលអ្នកបួស-៧០- ថ្នាក់អភិរក្សខ្ពស់នៃប្រូតេអ៊ីនដែលរកឃើញនៅគ្រប់ផ្នែកទាំងអស់នៃកោសិកា៖ ស៊ីតូប្លាសម នុយក្លេស អេនដូប្លាសមិច រីទីគូល មីតូខនឌ្រី។ នៅចុង carboxyl នៃខ្សែសង្វាក់ polypeptide តែមួយគត់នៃ Sh-70 មានតំបន់មួយដែលជាចង្អូរដែលអាចធ្វើអន្តរកម្មជាមួយ peptides នៃប្រវែង
ពី 7 ទៅ 9 សំណល់អាស៊ីតអាមីណូដែលសំបូរទៅដោយរ៉ាឌីកាល់ hydrophobic ។ ទីតាំងបែបនេះនៅក្នុងប្រូតេអ៊ីន globular កើតឡើងប្រហែលរៀងរាល់ 16 អាមីណូអាស៊ីត។ Sh-70 អាចការពារប្រូតេអ៊ីនពីភាពអសកម្មនៃកម្ដៅ និងស្ដារឡើងវិញនូវទម្រង់ និងសកម្មភាពនៃប្រូតេអ៊ីនដែលមិនមានលក្ខណៈធម្មជាតិ។
2. តួនាទីរបស់ chaperones ក្នុងការបត់ប្រូតេអ៊ីន។ក្នុងអំឡុងពេលនៃការសំយោគប្រូតេអ៊ីននៅលើ ribosome តំបន់ N-terminal នៃ polypeptide ត្រូវបានសំយោគមុនតំបន់ C-terminal ។ លំដាប់អាស៊ីតអាមីណូពេញលេញនៃប្រូតេអ៊ីនគឺត្រូវបានទាមទារដើម្បីបង្កើតការអនុលោមតាមប្រភពដើម។ នៅក្នុងដំណើរការនៃការសំយោគប្រូតេអ៊ីន Chaperones-70 ដោយសារតែរចនាសម្ព័ន្ធនៃមជ្ឈមណ្ឌលសកម្មរបស់ពួកគេអាចបិទតំបន់ដែលងាយនឹងប្រមូលផ្តុំនៃ polypeptide ដែលសំបូរទៅដោយរ៉ាឌីកាល់អាស៊ីតអាមីណូ hydrophobic រហូតដល់ការសំយោគត្រូវបានបញ្ចប់ (រូបភាព 1.27, A) ។
 អង្ករ។ ១.២៧. ការចូលរួមរបស់ chaperones ក្នុងការបត់ប្រូតេអ៊ីន
អង្ករ។ ១.២៧. ការចូលរួមរបស់ chaperones ក្នុងការបត់ប្រូតេអ៊ីន
ក - ការចូលរួមរបស់ chaperones-70 ក្នុងការទប់ស្កាត់អន្តរកម្ម hydrophobic រវាងទីតាំងនៃ polypeptide សំយោគ; ខ - ការបង្កើតការអនុលោមតាមប្រូតេអ៊ីនដើមនៅក្នុងស្មុគស្មាញ chaperone
ប្រូតេអ៊ីនទម្ងន់ម៉ូលេគុលខ្ពស់ជាច្រើនដែលមានទម្រង់ស្មុគស្មាញដូចជារចនាសម្ព័ន្ធដែនបត់ក្នុងចន្លោះពិសេសដែលបង្កើតឡើងដោយ W-60។ Sh-60ដំណើរការជាស្មុគស្មាញ oligomeric ដែលមាន 14 អនុរង។ ពួកវាបង្កើតជារង្វង់ប្រហោងពីរ ដែលនីមួយៗមានផ្នែករងចំនួនប្រាំពីរ ចិញ្ចៀនទាំងនេះត្រូវបានតភ្ជាប់ទៅគ្នាទៅវិញទៅមក។ អនុផ្នែកនីមួយៗនៃ III-60 មានដែនចំនួនបី៖ apical (apical) សំបូរទៅដោយរ៉ាឌីកាល់ hydrophobic ប្រឈមមុខនឹងបែហោងធ្មែញនៃចិញ្ចៀន កម្រិតមធ្យម និងអេក្វាទ័រ (រូបភាព 1.28) ។
 អង្ករ។ ១.២៨. រចនាសម្ព័ន្ធនៃ chaperonin complex មាន 14 Sh-60
អង្ករ។ ១.២៨. រចនាសម្ព័ន្ធនៃ chaperonin complex មាន 14 Sh-60
ក - ទិដ្ឋភាពចំហៀង; ខ - ទិដ្ឋភាពកំពូល
ប្រូតេអ៊ីនសំយោគជាមួយនឹងធាតុផ្ទៃលក្ខណៈនៃម៉ូលេគុលដែលលាតត្រដាង ជាពិសេសរ៉ាឌីកាល់ hydrophobic ចូលទៅក្នុងបែហោងធ្មែញនៃចិញ្ចៀន chaperone ។ នៅក្នុងបរិយាកាសជាក់លាក់នៃបែហោងធ្មែញទាំងនេះ ការរាប់ចំនួននៃការអនុលោមតាមដែលអាចកើតមាន រហូតទាល់តែរកឃើញតែមួយគត់ដែលអំណោយផលបំផុតដែលមានថាមពលបំផុតត្រូវបានរកឃើញ (រូបភាព 1.27, ខ)។ ការបង្កើតនៃការអនុលោមតាមនិងការបញ្ចេញប្រូតេអ៊ីនត្រូវបានអមដោយ ATP hydrolysis នៅក្នុងតំបន់អេក្វាទ័រ។ ជាធម្មតា ផ្នត់ដែលពឹងផ្អែកលើ chaperone បែបនេះត្រូវការថាមពលយ៉ាងច្រើន។
បន្ថែមពីលើការចូលរួមក្នុងការបង្កើតរចនាសម្ព័ន្ធបីវិមាត្រនៃប្រូតេអ៊ីន និងការបង្កើតឡើងវិញនៃប្រូតេអ៊ីនដែលខូចដោយផ្នែកនោះ អ្នកដឹកនាំក៏ត្រូវបានទាមទារសម្រាប់ដំណើរការជាមូលដ្ឋានដូចជាការប្រមូលផ្តុំប្រូតេអ៊ីន oligomeric ការទទួលស្គាល់ និងការដឹកជញ្ជូនប្រូតេអ៊ីន denatured ចូលទៅក្នុង lysosomes ការដឹកជញ្ជូនប្រូតេអ៊ីន។ នៅទូទាំងភ្នាស និងការចូលរួមក្នុងបទប្បញ្ញត្តិនៃសកម្មភាពនៃស្មុគស្មាញប្រូតេអ៊ីន។
ប្រធានបទ 1.6 ។ ភាពចម្រុះនៃប្រូតេអ៊ីន។ គ្រួសារប្រូតេអ៊ីនលើឧទាហរណ៍នៃ Immunoglobulins
1. ប្រូតេអ៊ីនដើរតួនាទីយ៉ាងសំខាន់ក្នុងជីវិតរបស់កោសិកានីមួយៗ និងសារពាង្គកាយពហុកោសិកាទាំងមូល ហើយមុខងាររបស់វាមានភាពចម្រុះគួរឱ្យភ្ញាក់ផ្អើល។ នេះត្រូវបានកំណត់ដោយភាពបារម្ភនៃរចនាសម្ព័ន្ធបឋមនិងការអនុលោមតាមប្រូតេអ៊ីនរចនាសម្ព័ន្ធតែមួយគត់នៃមជ្ឈមណ្ឌលសកម្មនិងសមត្ថភាពក្នុងការចងលីហ្គែនជាក់លាក់។
មានតែផ្នែកតូចមួយនៃខ្សែសង្វាក់ peptide ដែលអាចធ្វើទៅបានទាំងអស់ដែលអាចទទួលយករចនាសម្ព័ន្ធលំហដែលមានស្ថេរភាព។ ភាគច្រើន
ទាំងនេះអាចទទួលយកការអនុលោមភាពជាច្រើនជាមួយនឹងថាមពល Gibbs ប្រហែលដូចគ្នា ប៉ុន្តែមានលក្ខណៈសម្បត្តិខុសៗគ្នា។ រចនាសម្ព័ន្ធចម្បងនៃប្រូតេអ៊ីនដែលគេស្គាល់ភាគច្រើន ដែលត្រូវបានជ្រើសរើសដោយការវិវត្តន៍ជីវសាស្រ្ត ផ្តល់នូវស្ថេរភាពពិសេសនៃការអនុលោមតាមប្រភេទណាមួយ ដែលកំណត់ពីលក្ខណៈពិសេសនៃដំណើរការនៃប្រូតេអ៊ីននេះ។
2. គ្រួសារប្រូតេអ៊ីន។នៅក្នុងប្រភេទជីវសាស្រ្តដូចគ្នា ការជំនួសសំណល់អាស៊ីតអាមីណូអាចនាំទៅដល់ការលេចចេញនូវប្រូតេអ៊ីនផ្សេងៗគ្នា ដែលបំពេញមុខងារពាក់ព័ន្ធ និងមានលំដាប់អាស៊ីតអាមីណូដូចគ្នា។ ប្រូតេអ៊ីនដែលពាក់ព័ន្ធបែបនេះមានការអនុលោមភាពស្រដៀងគ្នាខ្លាំង៖ ចំនួន និងការរៀបចំនៃ α-helices និង/ឬ β-structures ហើយភាគច្រើននៃវេន និងផ្នត់នៃខ្សែសង្វាក់ polypeptide គឺស្រដៀងគ្នា ឬដូចគ្នាបេះបិទ។ ប្រូតេអ៊ីនដែលមានតំបន់ដូចគ្នានៃខ្សែសង្វាក់ polypeptide ការអនុលោមភាពស្រដៀងគ្នា និងមុខងារដែលពាក់ព័ន្ធត្រូវបានបំបែកទៅជាក្រុមប្រូតេអ៊ីន។ ឧទាហរណ៍នៃគ្រួសារប្រូតេអ៊ីន៖ ប្រូតេអ៊ីន serine, គ្រួសារ immunoglobulin, គ្រួសារ myoglobin ។
ប្រូតេអ៊ីន Serine- ក្រុមគ្រួសារនៃប្រូតេអ៊ីនដែលបំពេញមុខងារនៃអង់ស៊ីម proteolytic ។ ទាំងនេះរួមបញ្ចូលអង់ស៊ីមរំលាយអាហារ - chymotrypsin, trypsin, elastase និងកត្តា coagulation ឈាមជាច្រើន។ ប្រូតេអ៊ីនទាំងនេះមានអាស៊ីតអាមីណូដូចគ្នា 40% និងការអនុលោមភាពស្រដៀងគ្នាខ្លាំង (រូបភាព 1.29) ។

អង្ករ។ ១.២៩. រចនាសម្ព័ន្ធលំហនៃ elastase (A) និង chymotrypsin (B)
ការជំនួសអាស៊ីតអាមីណូមួយចំនួនបាននាំឱ្យមានការផ្លាស់ប្តូរនៅក្នុងភាពជាក់លាក់នៃស្រទាប់ខាងក្រោមនៃប្រូតេអ៊ីនទាំងនេះ និងការលេចឡើងនៃភាពចម្រុះមុខងារនៅក្នុងគ្រួសារ។
3. គ្រួសារនៃ immunoglobulins ។ប្រូតេអ៊ីននៃគ្រួសារ immunoglobulin superfamily ដែលរួមមានគ្រួសារប្រូតេអ៊ីនចំនួនបីដើរតួនាទីយ៉ាងធំក្នុងដំណើរការនៃប្រព័ន្ធភាពស៊ាំ៖
អង្គបដិប្រាណ (immunoglobulins);
អ្នកទទួល T-lymphocyte;
ប្រូតេអ៊ីននៃស្មុគ្រស្មាញនៃភាពឆបគ្នាប្រវតិ្តសាស្រ្តសំខាន់ - ថ្នាក់ MHC ទី 1 និងទី 2 (ស្មុគស្មាញ Histocompatibility សំខាន់) ។
ប្រូតេអ៊ីនទាំងអស់នេះមានរចនាសម្ព័ន្ធដែន មានដែនស្រដៀងគ្នានៃប្រព័ន្ធភាពស៊ាំ និងអនុវត្តមុខងារស្រដៀងគ្នា៖ ពួកវាមានអន្តរកម្មជាមួយរចនាសម្ព័ន្ធបរទេស រំលាយនៅក្នុងឈាម ទឹករងៃ ឬសារធាតុរាវអន្តរកោសិកា (អង្គបដិប្រាណ) ឬមានទីតាំងនៅលើផ្ទៃនៃកោសិកា (ផ្ទាល់ខ្លួន ឬ បរទេស)។
4. អង្គបដិប្រាណ- ប្រូតេអ៊ីនជាក់លាក់ដែលផលិតដោយ B-lymphocytes ក្នុងការឆ្លើយតបទៅនឹងការបញ្ចូលរចនាសម្ព័ន្ធបរទេសហៅថា អង់ទីហ្សែន។
លក្ខណៈពិសេសនៃរចនាសម្ព័ន្ធនៃអង្គបដិប្រាណ
ម៉ូលេគុលអង្គបដិប្រាណសាមញ្ញបំផុតមានខ្សែសង្វាក់ polypeptide ចំនួនបួន៖ ខ្សែសង្វាក់ពន្លឺដូចគ្នាបេះបិទចំនួនពីរ - L ដែលមានអាស៊ីតអាមីណូប្រហែល 220 និងខ្សែសង្វាក់ធ្ងន់ដូចគ្នា - H ដែលមានអាស៊ីតអាមីណូ 440-700 ។ ខ្សែសង្វាក់ទាំងបួននៅក្នុងម៉ូលេគុលអង្គបដិបក្ខត្រូវបានតភ្ជាប់ដោយចំណងដែលមិនមែនជាកូវ៉ាឡង់ជាច្រើន និងចំណង disulfide បួន (រូបភាព 1.30) ។
ខ្សែសង្វាក់ពន្លឺនៃអង្គបដិប្រាណមានដែនពីរ៖ អថេរ (VL) ដែលមានទីតាំងនៅតំបន់ N នៃខ្សែសង្វាក់ polypeptide និងថេរ (CL) ដែលមានទីតាំងនៅ C-terminus ។ ខ្សែសង្វាក់ធ្ងន់ជាធម្មតាមានដែនចំនួនបួន៖ អថេរមួយ (VH) នៅ N-terminus និងថេរចំនួនបី (CH1, CH2, CH3) (សូមមើលរូបភាព 1.30) ។ ដែន immunoglobulin នីមួយៗមានរចនាសម្ព័ន្ធ β-pleated superstructure ដែលសំណល់ cysteine ពីរត្រូវបានភ្ជាប់ដោយចំណង disulfide ។
រវាងដែនថេរទាំងពីរ CH1 និង CH2 មានតំបន់មួយដែលមានសំណល់ប្រូលីនមួយចំនួនធំ ដែលការពារការបង្កើតរចនាសម្ព័ន្ធបន្ទាប់បន្សំ និងអន្តរកម្មនៃខ្សែសង្វាក់ H ជិតខាងនៅក្នុងផ្នែកនេះ។ តំបន់ hinge នេះផ្តល់នូវភាពបត់បែននៃម៉ូលេគុលអង្គបដិប្រាណ។ រវាងដែនអថេរនៃសង្វាក់ធ្ងន់ និងស្រាល គឺជាកន្លែងចងអង់ទីហ្សែនដូចគ្នាបេះបិទ (កន្លែងសកម្មសម្រាប់អង់ទីហ្សែនចង) ដូច្នេះអង្គបដិប្រាណបែបនេះច្រើនតែត្រូវបានគេហៅថា bivalents ។ការភ្ជាប់អង់ទីហ្សែនទៅនឹងអង្គបដិបក្ខមិនពាក់ព័ន្ធនឹងលំដាប់អាស៊ីតអាមីណូទាំងមូលនៃតំបន់អថេរនៃសង្វាក់ទាំងពីរនោះទេ ប៉ុន្តែមានតែអាស៊ីដអាមីណូ 20-30 ដែលស្ថិតនៅក្នុងតំបន់អថេរខ្ពស់នៃខ្សែសង្វាក់នីមួយៗ។ វាគឺជាតំបន់ទាំងនេះដែលកំណត់សមត្ថភាពពិសេសនៃប្រភេទអង់ទីករនីមួយៗដើម្បីធ្វើអន្តរកម្មជាមួយអង់ទីហ្សែនបំពេញបន្ថែមដែលត្រូវគ្នា។
អង្គបដិប្រាណគឺជាខ្សែការពារមួយរបស់រាងកាយប្រឆាំងនឹងការឈ្លានពានរបស់សារពាង្គកាយបរទេស។ មុខងាររបស់ពួកវាអាចបែងចែកជាពីរដំណាក់កាល៖ ដំណាក់កាលដំបូងគឺការទទួលស្គាល់ និងការចងអង់ទីហ្សែននៅលើផ្ទៃនៃសារពាង្គកាយបរទេស ដែលអាចធ្វើទៅបានដោយសារតែវត្តមាននៃកន្លែងភ្ជាប់អង់ទីហ្សែននៅក្នុងរចនាសម្ព័ន្ធនៃអង្គបដិប្រាណ។ ដំណាក់កាលទីពីរគឺការចាប់ផ្តើមនៃដំណើរការអសកម្ម និងការបំផ្លាញអង់ទីហ្សែន។ ភាពជាក់លាក់នៃដំណាក់កាលទីពីរគឺអាស្រ័យលើថ្នាក់នៃអង្គបដិប្រាណ។ មានខ្សែសង្វាក់ធ្ងន់ចំនួនប្រាំដែលខុសគ្នាពីគ្នាទៅវិញទៅមកនៅក្នុងរចនាសម្ព័ន្ធនៃដែនថេរ: α, δ, ε, γ និង μ យោងទៅតាមថ្នាក់នៃ immunoglobulins ប្រាំប្រភេទត្រូវបានសម្គាល់: A, D, E, G និង M ។
លក្ខណៈពិសេសនៃរចនាសម្ព័ន្ធនៃខ្សែសង្វាក់ធ្ងន់ផ្តល់ឱ្យតំបន់ hinge និងតំបន់ C-terminal នៃច្រវាក់ធ្ងន់នូវលក្ខណៈនៃការអនុលោមតាមថ្នាក់នីមួយៗ។ នៅពេលដែលអង់ទីហ្សែនភ្ជាប់ទៅនឹងអង្គបដិប្រាណ ការផ្លាស់ប្តូរទម្រង់នៅក្នុងដែនថេរកំណត់ផ្លូវសម្រាប់ការដកអង់ទីហ្សែនចេញ។
 អង្ករ។ 1. 30. រចនាសម្ព័ន្ធដែននៃ IgG
អង្ករ។ 1. 30. រចនាសម្ព័ន្ធដែននៃ IgG
Immunoglobulins M
Immunoglobulins M មានទម្រង់ពីរ។
ទម្រង់ Monomeric- អង្គបដិប្រាណថ្នាក់ទី 1 ផលិតដោយ B-lymphocyte ដែលកំពុងលូតលាស់។ ក្រោយមក កោសិកា B ជាច្រើនប្តូរទៅផលិតអង្គបដិប្រាណប្រភេទផ្សេងទៀត ប៉ុន្តែមានកន្លែងភ្ជាប់អង់ទីហ្សែនដូចគ្នា។ IgM ត្រូវបានបញ្ចូលទៅក្នុងភ្នាស ហើយដើរតួជាអ្នកទទួល antigen-recognizing ។ ការបញ្ចូល IgM ទៅក្នុងភ្នាសកោសិកាគឺអាចធ្វើទៅបានដោយសារតែវត្តមានរបស់សំណល់អាស៊ីតអាមីណូ hydrophobic 25 នៅក្នុងផ្នែកកន្ទុយនៃតំបន់។
ទម្រង់សម្ងាត់នៃ IgMមានអនុផ្នែក monomeric ចំនួនប្រាំដែលភ្ជាប់គ្នាទៅវិញទៅមកដោយចំណង disulfide និង polypeptide J-chain បន្ថែម (រូបភាព 1.31) ។ monomers ខ្សែសង្វាក់ធ្ងន់នៃទម្រង់នេះមិនមានកន្ទុយ hydrophobic ទេ។ Pentamer មានកន្លែងភ្ជាប់អង់ទីហ្សែនចំនួន 10 ហើយដូច្នេះវាមានប្រសិទ្ធភាពក្នុងការទទួលស្គាល់ និងដកចេញនូវអង់ទីហ្សែនដែលបានចូលទៅក្នុងខ្លួនជាលើកដំបូង។ ទម្រង់សំងាត់នៃ IgM គឺជាថ្នាក់ចម្បងនៃអង្គបដិបក្ខដែលសំងាត់ចូលទៅក្នុងឈាមកំឡុងពេលការឆ្លើយតបនៃប្រព័ន្ធភាពស៊ាំបឋម។ ការចង IgM ទៅនឹងអង់ទីហ្សែនផ្លាស់ប្តូរការអនុលោមតាម IgM និងជំរុញការភ្ជាប់របស់វាទៅនឹងសមាសធាតុប្រូតេអ៊ីនដំបូងនៃប្រព័ន្ធបំពេញបន្ថែម (ប្រព័ន្ធបំពេញបន្ថែមគឺជាសំណុំនៃប្រូតេអ៊ីនដែលពាក់ព័ន្ធនឹងការបំផ្លាញអង់ទីហ្សែន) និងការធ្វើឱ្យប្រព័ន្ធនេះសកម្ម។ ប្រសិនបើអង់ទីហ្សែនមានទីតាំងនៅលើផ្ទៃនៃអតិសុខុមប្រាណ ប្រព័ន្ធបំពេញបន្ថែមបណ្តាលឱ្យមានការរំលោភលើភាពសុចរិតនៃភ្នាសកោសិកា និងការស្លាប់នៃកោសិកាបាក់តេរី។
Immunoglobulins G
នៅក្នុងន័យបរិមាណ, ថ្នាក់នៃ immunoglobulins នេះគ្របដណ្តប់លើឈាម (75% នៃ Ig ទាំងអស់) ។ IgG - monomers ដែលជាថ្នាក់សំខាន់នៃអង្គបដិបក្ខដែលសម្ងាត់ចូលទៅក្នុងឈាមក្នុងអំឡុងពេលការឆ្លើយតបនៃប្រព័ន្ធភាពស៊ាំបន្ទាប់បន្សំ។ បន្ទាប់ពីអន្តរកម្មនៃ IgG ជាមួយអង់ទីហ្សែនផ្ទៃនៃអតិសុខុមប្រាណ ស្មុគស្មាញអង់ទីហ្សែន-អង្គបដិប្រាណអាចចង និងធ្វើឱ្យប្រូតេអ៊ីននៃប្រព័ន្ធបំពេញបន្ថែម ឬអាចធ្វើអន្តរកម្មជាមួយអ្នកទទួលជាក់លាក់នៅលើ macrophages និង neutrophils ។ អន្តរកម្មជាមួយ phagocytes
 អង្ករ។ ១.៣១. រចនាសម្ព័ន្ធនៃទម្រង់សម្ងាត់នៃ IgM
អង្ករ។ ១.៣១. រចនាសម្ព័ន្ធនៃទម្រង់សម្ងាត់នៃ IgM
ការស្រូបយកអង់ទីហ្សែន - អង់ទីករស្មុគស្មាញ និងការបំផ្លាញរបស់វានៅក្នុង phagosomes នៃកោសិកា។ IgG គឺជាប្រភេទអង្គបដិប្រាណតែមួយគត់ដែលអាចឆ្លងកាត់របាំងសុក និងការពារទារកពីការឆ្លងមេរោគក្នុងស្បូន។
Immunoglobulins A
អង្គបដិប្រាណសំខាន់ៗដែលមាននៅក្នុងសំងាត់ (ទឹកដោះគោ ទឹកមាត់ ផ្លូវដង្ហើម និងពោះវៀន)។ IgA ត្រូវបានសម្ងាត់ជាចម្បងនៅក្នុងទម្រង់ឌីមឺរិច ដែលម៉ូណូមឺរត្រូវបានភ្ជាប់ទៅគ្នាទៅវិញទៅមកតាមរយៈខ្សែសង្វាក់ J បន្ថែម (រូបភាព 1.32) ។
IgA មិនមានអន្តរកម្មជាមួយប្រព័ន្ធបំពេញបន្ថែម និងកោសិកា phagocytic ទេ ប៉ុន្តែដោយការភ្ជាប់ទៅនឹងអតិសុខុមប្រាណ អង្គបដិបក្ខរារាំងពួកគេពីការភ្ជាប់ទៅនឹងកោសិកា epithelial និងការជ្រៀតចូលទៅក្នុងខ្លួន។
Immunoglobulins E
Immunoglobulins E ត្រូវបានតំណាងដោយ monomers ដែលក្នុងនោះ ε-chains ធ្ងន់មាន ក៏ដូចជា μ-chains នៃ immunoglobulins M ដែលជាអថេរមួយ និងដែនថេរចំនួនបួន។ IgE បន្ទាប់ពីការសំងាត់ចងភ្ជាប់ជាមួយខ្លួនគេ
 អង្ករ។ ១.៣២. រចនាសម្ព័ន្ធ IgA
អង្ករ។ ១.៣២. រចនាសម្ព័ន្ធ IgA
តំបន់ C-terminal ដែលមានអ្នកទទួលដែលត្រូវគ្នានៅលើផ្ទៃនៃកោសិកា mast និង basophils ។ ជាលទ្ធផល ពួកវាក្លាយទៅជាអ្នកទទួលសម្រាប់អង់ទីហ្សែននៅលើផ្ទៃនៃកោសិកាទាំងនេះ (រូបភាព 1.33)។
 អង្ករ។ ១.៣៣. អន្តរកម្មនៃ IgE ជាមួយ antigen នៅលើផ្ទៃនៃកោសិកា mast
អង្ករ។ ១.៣៣. អន្តរកម្មនៃ IgE ជាមួយ antigen នៅលើផ្ទៃនៃកោសិកា mast
បន្ទាប់ពីអង់ទីហ្សែនត្រូវបានភ្ជាប់ទៅកន្លែង IgE ដែលភ្ជាប់អង់ទីហ្សែនដែលត្រូវគ្នា កោសិកាទទួលបានសញ្ញាមួយដើម្បីបញ្ចេញសារធាតុសកម្មជីវសាស្រ្ត (អ៊ីស្តាមីន សេរ៉ូតូនីន) ដែលទទួលខុសត្រូវយ៉ាងធំធេងចំពោះការវិវត្តនៃប្រតិកម្មរលាក និងសម្រាប់ការបង្ហាញនៃប្រតិកម្មអាលែហ្សីដូចជា ជំងឺហឺត urticaria គ្រុនក្តៅហៃ។
Immunoglobulins D
Immunoglobulins D ត្រូវបានរកឃើញនៅក្នុងសេរ៉ូមក្នុងបរិមាណតិចតួចបំផុត ពួកវាជា monomers ។ ខ្សែសង្វាក់ δ ធ្ងន់មានអថេរមួយ និងដែនថេរចំនួនបី។ IgD ដើរតួជាអ្នកទទួលសម្រាប់ B-lymphocytes មុខងារផ្សេងទៀតនៅតែមិនស្គាល់។ អន្តរកម្មនៃអង់ទីហ្សែនជាក់លាក់ជាមួយអ្នកទទួលនៅលើផ្ទៃនៃ B-lymphocytes (IgD) នាំទៅដល់ការបញ្ជូនសញ្ញាទាំងនេះទៅក្នុងកោសិកា និងការធ្វើឱ្យសកម្មនៃយន្តការដែលធានាដល់ការបន្តពូជនៃក្លូននៃ lymphocytes នេះ។
ប្រធានបទ ១.៧. លក្ខណៈសម្បត្តិរូបវិទ្យា-គីមីនៃប្រូតេអ៊ីន និងវិធីសាស្រ្តសម្រាប់ការបំបែករបស់ពួកគេ
1. ប្រូតេអ៊ីនបុគ្គលមានភាពខុសប្លែកគ្នានៅក្នុងលក្ខណៈសម្បត្តិរូបវិទ្យារបស់ពួកគេ៖
រូបរាងនៃម៉ូលេគុល;
ទម្ងន់ម៉ូលេគុល;
បន្ទុកសរុប, តម្លៃនៃការដែលអាស្រ័យលើសមាមាត្រនៃក្រុម anionic និង cationic នៃអាស៊ីតអាមីណូ;
សមាមាត្រនៃរ៉ាឌីកាល់អាស៊ីតអាមីណូប៉ូលនិងមិនប៉ូលនៅលើផ្ទៃនៃម៉ូលេគុល;
កម្រិតនៃភាពធន់ទ្រាំទៅនឹងភ្នាក់ងារ denaturing ផ្សេងៗ។
2. ភាពរលាយនៃប្រូតេអ៊ីនអាស្រ័យនៅលើលក្ខណៈសម្បត្តិនៃប្រូតេអ៊ីនដែលបានរាយបញ្ជីខាងលើ ក៏ដូចជាលើសមាសភាពនៃឧបករណ៍ផ្ទុកដែលប្រូតេអ៊ីនរលាយ (តម្លៃ pH សមាសភាពអំបិល សីតុណ្ហភាព វត្តមានសារធាតុសរីរាង្គផ្សេងទៀតដែលអាចធ្វើអន្តរកម្មជាមួយប្រូតេអ៊ីន)។ ទំហំនៃការចោទប្រកាន់នៃម៉ូលេគុលប្រូតេអ៊ីនគឺជាកត្តាមួយដែលប៉ះពាល់ដល់ការរលាយរបស់វា។ នៅពេលដែលការចោទប្រកាន់ត្រូវបានបាត់បង់នៅចំណុច isoelectric ប្រូតេអ៊ីនកាន់តែងាយស្រួលប្រមូលផ្តុំនិង precipitate ។ នេះជាការពិតជាពិសេសសម្រាប់ប្រូតេអ៊ីន denatured ដែលមានរ៉ាឌីកាល់អាស៊ីតអាមីណូ hydrophobic នៅលើផ្ទៃ។
នៅលើផ្ទៃនៃម៉ូលេគុលប្រូតេអ៊ីនមានរ៉ាឌីកាល់អាស៊ីតអាមីណូទាំងវិជ្ជមាន និងអវិជ្ជមាន។ ចំនួននៃក្រុមទាំងនេះ ហើយហេតុដូច្នេះហើយការចោទប្រកាន់សរុបនៃប្រូតេអ៊ីនគឺអាស្រ័យលើ pH នៃមធ្យម ពោលគឺឧ។ សមាមាត្រនៃការប្រមូលផ្តុំនៃក្រុម H + - និង OH - ។ នៅក្នុងបរិយាកាសអាសុីតការកើនឡើងនៃកំហាប់ H + នាំឱ្យមានការបង្ក្រាបការបំបែកក្រុម carboxyl -COO - + H + > -COOH និងការថយចុះនៃបន្ទុកអវិជ្ជមាននៃប្រូតេអ៊ីន។ នៅក្នុងបរិយាកាសអាល់កាឡាំងការចងនៃ OH លើស - ប្រូតុងបានបង្កើតឡើងក្នុងអំឡុងពេលការបំបែកនៃក្រុមអាមីណូ -NH 3 + + OH - - NH 2 + H 2 O ជាមួយនឹងការបង្កើតទឹកនាំទៅរកការថយចុះនៃបន្ទុកវិជ្ជមាននៃប្រូតេអ៊ីន។ តម្លៃ pH ដែលប្រូតេអ៊ីនមានបន្ទុកសុទ្ធសូន្យត្រូវបានគេហៅថា ចំណុច isoelectric (IEP) ។នៅក្នុង IET ចំនួនក្រុមគិតវិជ្ជមាន និងអវិជ្ជមានគឺដូចគ្នា ពោលគឺឧ។ ប្រូតេអ៊ីនស្ថិតនៅក្នុងស្ថានភាព isoelectric ។
3. ការបំបែកប្រូតេអ៊ីនបុគ្គល។លក្ខណៈពិសេសនៃរចនាសម្ព័ន្ធនិងដំណើរការនៃរាងកាយអាស្រ័យលើសំណុំនៃប្រូតេអ៊ីនដែលត្រូវបានសំយោគនៅក្នុងវា។ ការសិក្សាអំពីរចនាសម្ព័ន្ធ និងលក្ខណៈសម្បត្តិរបស់ប្រូតេអ៊ីនគឺមិនអាចទៅរួចទេបើគ្មានការញែកចេញពីកោសិកា និងការបន្សុតពីប្រូតេអ៊ីន និងម៉ូលេគុលសរីរាង្គផ្សេងទៀត។ ដំណាក់កាលនៃភាពឯកោ និងការបន្សុទ្ធប្រូតេអ៊ីនបុគ្គល៖
ការបំផ្លាញកោសិកានៃជាលិកាដែលបានសិក្សានិងទទួលបាន homogenate មួយ។
ការបំបែកភាពដូចគ្នាទៅជាប្រភាគ centrifugation ការទទួលបាននុយក្លេអ៊ែរ mitochondrial cytosolic ឬប្រភាគផ្សេងទៀតដែលមានប្រូតេអ៊ីនដែលចង់បាន។
ការប្រែពណ៌កំដៅជ្រើសរើស- កំដៅរយៈពេលខ្លីនៃដំណោះស្រាយប្រូតេអ៊ីន ដែលផ្នែកនៃប្រូតេអ៊ីនដែលមិនបរិសុទ្ធអាចត្រូវបានយកចេញ (ក្នុងករណីដែលប្រូតេអ៊ីនមានស្ថេរភាពកម្ដៅ)។
អំបិលចេញ។ប្រូតេអ៊ីនផ្សេងគ្នា precipitate នៅកំហាប់ផ្សេងគ្នានៃអំបិលនៅក្នុងដំណោះស្រាយ។ ដោយការបង្កើនកំហាប់អំបិលបន្តិចម្តងៗ វាអាចទៅរួចដើម្បីទទួលបានប្រភាគបុគ្គលមួយចំនួនជាមួយនឹងមាតិកាលេចធ្លោនៃប្រូតេអ៊ីនសម្ងាត់នៅក្នុងមួយក្នុងចំណោមពួកវា។ ប្រភាគប្រូតេអ៊ីនដែលប្រើជាទូទៅបំផុតគឺអាម៉ូញ៉ូមស៊ុលហ្វាត។ ប្រូតេអ៊ីនដែលមានកម្រិតរលាយទាបបំផុត precipitate នៅកំហាប់អំបិលទាប។
ការច្រោះជែល- វិធីសាស្រ្តនៃការបំបែកម៉ូលេគុលតាមរយៈគ្រាប់ Sephadex ហើម (ខ្សែសង្វាក់ dextran polysaccharide បីវិមាត្រជាមួយនឹងរន្ធញើស) ។ អត្រានៃការឆ្លងកាត់នៃប្រូតេអ៊ីនតាមរយៈជួរឈរដែលពោរពេញទៅដោយ Sephadex នឹងអាស្រ័យលើទម្ងន់ម៉ូលេគុលរបស់ពួកគេ៖ ម៉ាស់ម៉ូលេគុលប្រូតេអ៊ីនកាន់តែតូច ពួកវាកាន់តែងាយស្រួលជ្រាបចូលទៅក្នុង granules ហើយស្នាក់នៅទីនោះបានយូរ ម៉ាស់កាន់តែធំ ពួកវាកាន់តែលឿនជាងមុន។ ជួរឈរ។
Ultracentrifugation- វិធីសាស្រ្តដែលមាននៅក្នុងការពិតដែលថាប្រូតេអ៊ីននៅក្នុងបំពង់ centrifuge ត្រូវបានដាក់នៅក្នុង rotor នៃ ultracentrifuge មួយ។ នៅពេលដែល rotor បង្វិលអត្រា sedimentation នៃប្រូតេអ៊ីនគឺសមាមាត្រទៅនឹងទម្ងន់ម៉ូលេគុលរបស់ពួកគេ: ប្រភាគនៃប្រូតេអ៊ីនធ្ងន់ជាងមានទីតាំងនៅជិតបាតបំពង់ ស្រាលជាងនៅជិតផ្ទៃ។
electrophoresis- វិធីសាស្រ្តផ្អែកលើភាពខុសគ្នានៃល្បឿននៃចលនារបស់ប្រូតេអ៊ីននៅក្នុងវាលអគ្គិសនី។ តម្លៃនេះគឺសមាមាត្រទៅនឹងបន្ទុកប្រូតេអ៊ីន។ electrophoresis ប្រូតេអ៊ីនត្រូវបានអនុវត្តនៅលើក្រដាស (ក្នុងករណីនេះល្បឿននៃប្រូតេអ៊ីនគឺសមាមាត្រទៅនឹងបន្ទុករបស់វាប៉ុណ្ណោះ) ឬនៅក្នុងជែល polyacrylamide ដែលមានទំហំរន្ធញើសជាក់លាក់ (ល្បឿននៃប្រូតេអ៊ីនគឺសមាមាត្រទៅនឹងបន្ទុកនិងទម្ងន់ម៉ូលេគុលរបស់វា) ។
ការផ្លាស់ប្តូរអ៊ីយ៉ុងក្រូម៉ូសូម- វិធីសាស្រ្តប្រភាគផ្អែកលើការចងនៃក្រុមប្រូតេអ៊ីនដែលមានអ៊ីយ៉ុងជាមួយក្រុមដែលមានបន្ទុកផ្ទុយគ្នានៃជ័រផ្លាស់ប្តូរអ៊ីយ៉ុង (វត្ថុធាតុ polymeric មិនរលាយ) ។ កម្លាំងភ្ជាប់នៃប្រូតេអ៊ីនទៅនឹងជ័រគឺសមាមាត្រទៅនឹងបន្ទុកនៃប្រូតេអ៊ីន។ ប្រូតេអ៊ីនដែលត្រូវបានស្រូបយកនៅលើវត្ថុធាតុ polymer ផ្លាស់ប្តូរអ៊ីយ៉ុងអាចត្រូវបានទឹកនាំទៅជាមួយនឹងការបង្កើនការប្រមូលផ្តុំនៃដំណោះស្រាយ NaCl ។ ការចោទប្រកាន់ប្រូតេអ៊ីនកាន់តែទាប កំហាប់នៃ NaCl កាន់តែទាបនឹងត្រូវបានទាមទារដើម្បីលាងសម្អាតប្រូតេអ៊ីនដែលទាក់ទងនឹងក្រុមអ៊ីយ៉ុងនៃជ័រ។
ភាពស្និទ្ធស្នាល chromatography- វិធីសាស្រ្តជាក់លាក់បំផុតសម្រាប់ញែកប្រូតេអ៊ីនបុគ្គល។ លីហ្គែននៃប្រូតេអ៊ីនមួយត្រូវបានភ្ជាប់ជាមួយវត្ថុធាតុ polymer ដែលមិនដំណើរការ។ នៅពេលដែលដំណោះស្រាយប្រូតេអ៊ីនត្រូវបានឆ្លងកាត់ជួរឈរដែលមានវត្ថុធាតុ polymer ដោយសារតែការភ្ជាប់ប្រូតេអ៊ីនទៅនឹង ligand នោះមានតែប្រូតេអ៊ីនជាក់លាក់សម្រាប់ ligand នេះប៉ុណ្ណោះដែលត្រូវបានស្រូបយកនៅលើជួរឈរ។
ការលាងឈាម- វិធីសាស្រ្តប្រើដើម្បីយកសមាសធាតុទម្ងន់ម៉ូលេគុលទាបចេញពីដំណោះស្រាយនៃប្រូតេអ៊ីនដាច់ដោយឡែកមួយ។ វិធីសាស្រ្តនេះគឺផ្អែកលើអសមត្ថភាពនៃប្រូតេអ៊ីនដើម្បីឆ្លងកាត់ភ្នាស semipermeable មិនដូចសារធាតុទម្ងន់ម៉ូលេគុលទាប។ វាត្រូវបានគេប្រើដើម្បីបន្សុទ្ធប្រូតេអ៊ីនពីភាពមិនបរិសុទ្ធនៃទម្ងន់ម៉ូលេគុលទាប ឧទាហរណ៍ ពីអំបិលបន្ទាប់ពីអំបិលចេញ។
កិច្ចការសម្រាប់ការងារក្រៅម៉ោង
1. បំពេញតារាង។ ១.៤.
តារាង 1.4 ។ ការវិភាគប្រៀបធៀបនៃរចនាសម្ព័ន្ធនិងមុខងារនៃប្រូតេអ៊ីនដែលពាក់ព័ន្ធ - myoglobin និង hemoglobin
ក) ចងចាំរចនាសម្ព័ន្ធនៃមជ្ឈមណ្ឌលសកម្ម Mb និង Hb ។ តើរ៉ាឌីកាល់ hydrophobic នៃអាស៊ីតអាមីណូដើរតួនាទីអ្វីក្នុងការបង្កើតមជ្ឈមណ្ឌលសកម្មនៃប្រូតេអ៊ីនទាំងនេះ? ពិពណ៌នាអំពីរចនាសម្ព័ន្ធនៃមជ្ឈមណ្ឌលសកម្ម Mb និង Hb និងយន្តការនៃការភ្ជាប់ ligand ទៅវា។ តើសំណល់ F 8 និង E 7 របស់គាត់មានតួនាទីអ្វីក្នុងដំណើរការនៃគេហទំព័រសកម្ម Mv និង Hv?
ខ) តើលក្ខណៈសម្បត្តិថ្មីអ្វីខ្លះ បើប្រៀបធៀបទៅនឹង myoglobin monomeric តើប្រូតេអ៊ីន oligomeric, hemoglobin មានទំនាក់ទំនងយ៉ាងជិតស្និទ្ធិដែរឬទេ? ពន្យល់ពីតួនាទីនៃការផ្លាស់ប្តូរសហករណ៍ក្នុងការអនុលោមតាមប្រូតូមឺរនៅក្នុងម៉ូលេគុលអេម៉ូក្លូប៊ីន ឥទ្ធិពលនៃ CO 2 និងការប្រមូលផ្តុំប្រូតុងលើភាពស្និទ្ធស្នាលនៃអេម៉ូក្លូប៊ីនទៅនឹងអុកស៊ីសែន និងតួនាទីរបស់ 2,3-BPG ក្នុងបទប្បញ្ញត្តិ allosteric នៃមុខងារ Hb ។
2. ពិពណ៌នាអំពីលក្ខណៈរបស់មេម៉ូលេគុល ដោយយកចិត្តទុកដាក់លើទំនាក់ទំនងរវាងរចនាសម្ព័ន្ធ និងមុខងាររបស់វា។
3. តើប្រូតេអ៊ីនអ្វីខ្លះត្រូវបានដាក់ជាក្រុម? ដោយប្រើឧទាហរណ៍នៃគ្រួសារ immunoglobulin កំណត់លក្ខណៈរចនាសម្ព័ន្ធស្រដៀងគ្នានិងមុខងារពាក់ព័ន្ធនៃប្រូតេអ៊ីននៃគ្រួសារនេះ។
4. ជារឿយៗ ប្រូតេអ៊ីនបុគ្គលដែលបានបន្សុតគឺត្រូវបានទាមទារសម្រាប់គោលបំណងជីវគីមី និងផ្នែកវេជ្ជសាស្ត្រ។ ពន្យល់អំពីលក្ខណៈសម្បត្តិរូបវិទ្យានៃប្រូតេអ៊ីន វិធីសាស្ត្រដែលប្រើសម្រាប់ការបំបែក និងការបន្សុតរបស់ពួកវាគឺផ្អែកលើ។
កិច្ចការសម្រាប់ការគ្រប់គ្រងខ្លួនឯង
1. ជ្រើសរើសចម្លើយដែលត្រឹមត្រូវ។
មុខងាររបស់អេម៉ូក្លូប៊ីន៖
A. O 2 ដឹកជញ្ជូនពីសួតទៅជាលិកា B. H + ដឹកជញ្ជូនពីជាលិកាទៅសួត
B. រក្សា pH ឈាមថេរ D. ការដឹកជញ្ជូន CO2 ពីសួតទៅជាលិកា
ឃ. ការដឹកជញ្ជូន CO 2 ពីជាលិកាទៅសួត
2. ជ្រើសរើសចម្លើយដែលត្រឹមត្រូវ។ លីហ្គែនα - Hb protomer គឺ៖ A. ហេម
ខ.អុកស៊ីហ្សែន
B. CO D. 2,3-BPG
D. β-Protomer
3. ជ្រើសរើសចម្លើយដែលត្រឹមត្រូវ។
អេម៉ូក្លូប៊ីនខុសពី myoglobin៖
ក.មានរចនាសម្ព័ន្ធបួនជ្រុង
B. រចនាសម្ព័ន្ធបន្ទាប់បន្សំត្រូវបានតំណាងដោយ α-helices ប៉ុណ្ណោះ។
ខ.សំដៅលើប្រូតេអ៊ីនស្មុគស្មាញ
D. អន្តរកម្មជាមួយ ligand allosteric D. Covalently ចងទៅ heme
4. ជ្រើសរើសចម្លើយដែលត្រឹមត្រូវ។
ភាពស្និទ្ធស្នាលរបស់ Hb សម្រាប់ O 2 ថយចុះ៖
A. នៅពេលដែលម៉ូលេគុល O 2 មួយត្រូវបានភ្ជាប់ B. នៅពេលដែលម៉ូលេគុល O 2 មួយត្រូវបានលុបចោល
ខ.នៅពេលធ្វើអន្តរកម្មជាមួយ 2,3-BPG
D. នៅពេលដែលភ្ជាប់ទៅនឹង protomers H + D. នៅពេលដែលកំហាប់នៃ 2,3-BPG ថយចុះ
5. កំណត់ការប្រកួត។
សម្រាប់ប្រភេទ Hb វាជាលក្ខណៈ៖
A. បង្កើត fibrillar aggregates ក្នុងទម្រង់ deoxy B. មាន α- និង δ-chains ពីរ
B. ទម្រង់លេចធ្លោនៃ Hb នៅក្នុង erythrocytes មនុស្សពេញវ័យ D. វាមានផ្ទុក heme ជាមួយ Fe + 3 នៅក្នុងមជ្ឈមណ្ឌលសកម្ម
ឃ.មាន α- និងខ្សែសង្វាក់ γ ពីរ 1. HvA 2 ។
6. កំណត់ការប្រកួត។
Ligands Hb៖
A. ចងទៅ Hb នៅមជ្ឈមណ្ឌល allosteric
B. មានភាពស្និទ្ធស្នាលខ្ពស់សម្រាប់គេហទំព័រសកម្ម Hb
ខ. ចូលរួម បង្កើនភាពស្និទ្ធស្នាលរបស់ Hb ទៅ O 2 D. អុកស៊ីដ Fe + 2 ទៅ Fe + 3
D. បង្កើតជាចំណងកូវ៉ាឡេនជាមួយ hysF8
7. ជ្រើសរើសចម្លើយដែលត្រឹមត្រូវ។
អ្នកដឹកនាំ៖
ក. ប្រូតេអ៊ីនមានវត្តមាននៅគ្រប់ផ្នែកទាំងអស់នៃកោសិកា
ខ.ការសំយោគត្រូវបានពង្រឹងក្រោមឥទ្ធិពលស្ត្រេស
ខ. ចូលរួមក្នុង hydrolysis នៃប្រូតេអ៊ីន denatured
ឃ. ចូលរួមក្នុងការរក្សាការអនុលោមតាមប្រភពដើមនៃប្រូតេអ៊ីន
ឃ. បង្កើតសរីរាង្គដែលការអនុលោមតាមប្រូតេអ៊ីនត្រូវបានបង្កើតឡើង
8. ការប្រកួត។ Immunoglobulins៖
A. ទម្រង់សម្ងាត់គឺ pentameric
B. ថ្នាក់ Ig ដែលឆ្លងកាត់របាំងសុក
B. Ig - mast cell receptor
ឃ. ថ្នាក់សំខាន់នៃ Ig មានវត្តមាននៅក្នុងការសម្ងាត់នៃកោសិកា epithelial ។ D. B-lymphocyte receptor, ការធ្វើឱ្យសកម្មនៃការដែលធានាការបន្តពូជកោសិកា
9. ជ្រើសរើសចម្លើយដែលត្រឹមត្រូវ។
Immunoglobulins អ៊ី៖
A. ផលិតដោយ macrophages B. មាន ε-chains ធ្ងន់។
ខ.បានបង្កប់នៅក្នុងភ្នាសនៃ T-lymphocytes
D. ដើរតួជាអ្នកទទួលភ្នាសសម្រាប់អង់ទីហ្សែននៅលើកោសិកា mast និង basophils
D. ទទួលខុសត្រូវចំពោះការបង្ហាញពីប្រតិកម្មអាលែហ្សី
10. ជ្រើសរើសចម្លើយដែលត្រឹមត្រូវ។
វិធីសាស្រ្តបំបែកប្រូតេអ៊ីនគឺផ្អែកលើភាពខុសគ្នានៃទម្ងន់ម៉ូលេគុលរបស់ពួកគេ៖
A. ការច្រោះជែល
ខ. អ៊ុលត្រាហ្សេហ្វៀ
B. Polyacrylamide gel electrophoresis D. Ion exchange chromatography
D. Affinity chromatography
11. ជ្រើសរើសចម្លើយដែលត្រឹមត្រូវ។
វិធីសាស្រ្តបំបែកប្រូតេអ៊ីនគឺផ្អែកលើភាពខុសគ្នានៃភាពរលាយរបស់វានៅក្នុងទឹក៖
ក. ការច្រោះជែល ខ. ការបន្សាបអំបិល
ខ. ការផ្លាស់ប្តូរអ៊ីយ៉ុងក្រូម៉ាតូក្រាម ឃ
E. Polyacrylamide gel electrophoresis
ស្តង់ដារនៃចម្លើយចំពោះ "ភារកិច្ចសម្រាប់ការគ្រប់គ្រងខ្លួនឯង"
1. A, B, C, D
2. A, B, C, D
5. 1-B, 2-A, 3-D
6. 1-C, 2-B, 3-A
7. A, B, D, D
8. 1-G; 2-B, 3-C
លក្ខខណ្ឌមូលដ្ឋាន និងគោលគំនិត
1. ប្រូតេអ៊ីន Oligomeric, protomer, រចនាសម្ព័ន្ធ quaternary នៃប្រូតេអ៊ីន
2. ការផ្លាស់ប្តូរសហករណ៍នៅក្នុងការអនុលោមតាម protomer
3. ឥទ្ធិពល Bohr
4. បទប្បញ្ញត្តិ Allosteric នៃមុខងារប្រូតេអ៊ីន មជ្ឈមណ្ឌល allosteric និង allosteric effector
5. ម៉ូលេគុល chaperones ប្រូតេអ៊ីនឆក់កំដៅ
6. ក្រុមគ្រួសារប្រូតេអ៊ីន (ប្រូតេអ៊ីនសេរិន, immunoglobulins)
7. IgM-, G-, E-, A- ការតភ្ជាប់នៃរចនាសម្ព័ន្ធជាមួយនឹងមុខងារ
8. បន្ទុកសរុបនៃប្រូតេអ៊ីន ចំណុច isoelectric នៃប្រូតេអ៊ីន
9. Electrophoresis
10. អំបិលចេញ
11. ការច្រោះជែល
12. ការផ្លាស់ប្តូរ chromatography អ៊ីយ៉ុង
13. Ultracentrifugation
14. Affinity chromatography
15. electrophoresis ប្រូតេអ៊ីនប្លាស្មា
កិច្ចការសម្រាប់ការងារសវនកម្ម
1. ប្រៀបធៀបភាពអាស្រ័យនៃកម្រិតនៃការតិត្ថិភាពនៃអេម៉ូក្លូប៊ីន (Hb) និង myoglobin (Mb) ជាមួយនឹងអុកស៊ីសែននៅលើសម្ពាធផ្នែករបស់វានៅក្នុងជាលិកា។
 អង្ករ។ ១.៣៤. ភាពអាស្រ័យតិត្ថិភាពនៃ MV និងហបអុកស៊ីសែនពីសម្ពាធផ្នែករបស់វា។
អង្ករ។ ១.៣៤. ភាពអាស្រ័យតិត្ថិភាពនៃ MV និងហបអុកស៊ីសែនពីសម្ពាធផ្នែករបស់វា។
សូមចំណាំថារូបរាងនៃខ្សែកោងតិត្ថិភាពអុកស៊ីសែនប្រូតេអ៊ីនគឺខុសគ្នា: សម្រាប់ myoglobin - hyperbole សម្រាប់ hemoglobin - រាង sigmoid ។
1. ប្រៀបធៀបតម្លៃនៃសម្ពាធផ្នែកនៃអុកស៊ីសែនដែល Mb និង Hb ត្រូវបានឆ្អែតជាមួយ O 2 ដោយ 50% ។ តើប្រូតេអ៊ីនមួយណាក្នុងចំណោមប្រូតេអ៊ីនទាំងនេះមានទំនាក់ទំនងល្អជាងសម្រាប់ O 2 ?
2. តើលក្ខណៈរចនាសម្ព័ន្ធអ្វីខ្លះរបស់ MB កំណត់ភាពស្និទ្ធស្នាលខ្ពស់របស់វាសម្រាប់ O 2 ?
3. តើលក្ខណៈរចនាសម្ព័ន្ធអ្វីខ្លះនៃ Hb អនុញ្ញាតឱ្យវាបញ្ចេញ O 2 នៅក្នុង capillaries នៃជាលិកាសម្រាក (នៅសម្ពាធផ្នែកខ្លះខ្ពស់នៃ O 2) និងបង្កើនការត្រឡប់មកវិញនេះយ៉ាងខ្លាំងនៅក្នុងសាច់ដុំធ្វើការ? តើទ្រព្យសម្បត្តិអ្វីខ្លះនៃប្រូតេអ៊ីន oligomeric ផ្តល់ឥទ្ធិពលនេះ?
4. គណនាបរិមាណ O 2 (គិតជា%) ផ្តល់អេម៉ូក្លូប៊ីនអុកស៊ីហ្សែនដល់សាច់ដុំសម្រាក និងធ្វើការ?
5. ធ្វើការសន្និដ្ឋានអំពីទំនាក់ទំនងរវាងរចនាសម្ព័ន្ធប្រូតេអ៊ីន និងមុខងាររបស់វា។
2. បរិមាណអុកស៊ីសែនដែលបញ្ចេញដោយអេម៉ូក្លូប៊ីននៅក្នុងសរសៃឈាមគឺអាស្រ័យលើអាំងតង់ស៊ីតេនៃដំណើរការ catabolism នៅក្នុងជាលិកា (ឥទ្ធិពល Bohr) ។ តើការផ្លាស់ប្តូរនៃការរំលាយអាហារជាលិកាគ្រប់គ្រងភាពស្និទ្ធស្នាលរបស់ Hb សម្រាប់ O 2 យ៉ាងដូចម្តេច? ឥទ្ធិពលនៃ CO 2 និង H+ លើទំនាក់ទំនងនៃ Hb ទៅ O 2
 1. ពិពណ៌នាអំពីឥទ្ធិពល Bohr ។
1. ពិពណ៌នាអំពីឥទ្ធិពល Bohr ។
2. តើដំណើរការដែលបង្ហាញក្នុងលំហូរដ្យាក្រាមក្នុងទិសដៅអ្វី៖
ក) នៅក្នុង capillaries នៃសួត;
ខ) នៅក្នុងជាលិកា capillaries?
3. តើអ្វីទៅជាសារៈសំខាន់ខាងសរីរវិទ្យានៃឥទ្ធិពល Bohr?
4. ហេតុអ្វីបានជាអន្តរកម្មនៃ Hb ជាមួយ H+ នៅកន្លែងដាច់ស្រយាលពី heme ផ្លាស់ប្តូរភាពស្និទ្ធស្នាលនៃប្រូតេអ៊ីនសម្រាប់ O 2 ?
3. ភាពស្និទ្ធស្នាលនៃ Hb ទៅ O 2 អាស្រ័យលើកំហាប់នៃ ligand របស់វា 2,3-biphosphoglycerate ដែលជានិយតករ allosteric នៃភាពស្និទ្ធស្នាលនៃ Hb ទៅ O 2 ។ ហេតុអ្វីបានជាអន្តរកម្ម ligand នៅកន្លែងដាច់ស្រយាលពីគេហទំព័រសកម្មប៉ះពាល់ដល់មុខងារប្រូតេអ៊ីន? តើ 2,3-BPG គ្រប់គ្រងភាពស្និទ្ធស្នាលរបស់ Hb សម្រាប់ O 2 យ៉ាងដូចម្តេច? ដើម្បីដោះស្រាយបញ្ហា សូមឆ្លើយសំណួរខាងក្រោម៖
1. តើ 2,3-biphosphoglycerate (2,3-BPG) ត្រូវបានសំយោគមកពីណា? សរសេររូបមន្តរបស់វា បង្ហាញពីបន្ទុកនៃម៉ូលេគុលនេះ។
2. តើទម្រង់នៃអេម៉ូក្លូប៊ីន (អុកស៊ីដ ឬឌីអុកស៊ីត) BPG មានអន្តរកម្មជាមួយអ្វី ហើយហេតុអ្វី? តើអន្តរកម្មកើតឡើងនៅក្នុងផ្នែកណានៃម៉ូលេគុល Hb?
3. តើដំណើរការដែលបង្ហាញក្នុងដ្យាក្រាមដំណើរការក្នុងទិសដៅអ្វី?
ក) នៅក្នុង capillaries ជាលិកា;
ខ) នៅក្នុង capillaries នៃសួត?
4. កន្លែងដែលគួរតែប្រមូលផ្តុំខ្ពស់បំផុតនៃស្មុគស្មាញ
Nv-2,3-BFG៖
ក) នៅក្នុង capillaries នៃសាច់ដុំនៅពេលសម្រាក,
ខ) នៅក្នុង capillaries នៃសាច់ដុំធ្វើការ (សន្មត់ថាកំហាប់ដូចគ្នានៃ BPG នៅក្នុង erythrocytes)?
5. តើភាពស្និទ្ធស្នាលរបស់ Hb សម្រាប់អុកស៊ីហ្សែននឹងផ្លាស់ប្តូរយ៉ាងដូចម្តេច នៅពេលដែលមនុស្សម្នាក់សម្របខ្លួនទៅនឹងលក្ខខណ្ឌកម្ពស់ខ្ពស់ ប្រសិនបើកំហាប់ BPG នៅក្នុងអេរីត្រូស៊ីតកើនឡើង? តើអ្វីជាសារៈសំខាន់សរីរវិទ្យានៃបាតុភូតនេះ?
4. ការបំផ្លិចបំផ្លាញនៃ 2,3-BPG កំឡុងពេលផ្ទុកឈាមដែលបានបម្រុងទុកធ្វើឱ្យរំខានដល់មុខងាររបស់ Hb ។ តើភាពស្និទ្ធស្នាលរបស់ Hb ទៅ O 2 នៅក្នុងឈាមដែលបានរក្សាទុកនឹងផ្លាស់ប្តូរយ៉ាងដូចម្តេច ប្រសិនបើកំហាប់នៃ 2,3-BPG នៅក្នុង erythrocytes អាចថយចុះពី 8 ទៅ 0.5 mmol/l ។ តើវាអាចទៅរួចទេក្នុងការបញ្ជូនឈាមបែបនេះទៅអ្នកជំងឺធ្ងន់ធ្ងរ ប្រសិនបើកំហាប់ 2,3-BPG ត្រូវបានស្តារឡើងវិញមិនលឿនជាងបីថ្ងៃ? តើវាអាចទៅរួចទេក្នុងការស្តារមុខងាររបស់ erythrocytes ដោយបន្ថែម 2,3-BPG ទៅក្នុងឈាម?
5. រំលឹកឡើងវិញនូវរចនាសម្ព័ន្ធនៃម៉ូលេគុល immunoglobulin សាមញ្ញបំផុត។ តើ immunoglobulins មានតួនាទីអ្វីខ្លះនៅក្នុងប្រព័ន្ធភាពស៊ាំ? ហេតុអ្វីបានជា Igs ជារឿយៗត្រូវបានគេហៅថា bivalents? តើរចនាសម្ព័ន្ធរបស់ Igs ទាក់ទងនឹងមុខងាររបស់វាយ៉ាងដូចម្តេច? (ពិពណ៌នាដោយប្រើឧទាហរណ៍នៃថ្នាក់នៃ immunoglobulins ។ )
លក្ខណៈសម្បត្តិរូបវិទ្យា - គីមីនៃប្រូតេអ៊ីននិងវិធីសាស្រ្តសម្រាប់ការបំបែករបស់ពួកគេ។
6. តើបន្ទុកសុទ្ធនៃប្រូតេអ៊ីនប៉ះពាល់ដល់ការរលាយរបស់វាយ៉ាងដូចម្តេច?
ក) កំណត់បន្ទុកសរុបនៃ peptide នៅ pH 7
Ala-Glu-Tre-Pro-Asp-Liz-Cis
ខ) តើការចោទប្រកាន់នៃ peptide នេះនឹងផ្លាស់ប្តូរយ៉ាងដូចម្តេចនៅ pH > 7, pH<7, рН <<7?
គ) តើអ្វីជាចំណុចអ៊ីសូអេឡិចត្រិចនៃប្រូតេអ៊ីន (IEP) ហើយតើវាស្ថិតនៅក្នុងបរិយាកាសអ្វី
IET នៃ peptide នេះ?
ឃ) នៅតម្លៃ pH ណាដែលការរលាយតិចបំផុតនៃ peptide នេះនឹងត្រូវបានអង្កេត។
7. ហេតុអ្វីបានជាទឹកដោះគោជូរមិនដូចទឹកដោះគោស្រស់ "កក" នៅពេលស្ងោរ (ឧទាហរណ៍ប្រូតេអ៊ីនទឹកដោះគោ casein precipitates)? ម៉ូលេគុល Casein នៅក្នុងទឹកដោះគោស្រស់មានបន្ទុកអវិជ្ជមាន។
8. ការច្រោះជែលត្រូវបានប្រើដើម្បីបំបែកប្រូតេអ៊ីនបុគ្គល។ ល្បាយដែលមានប្រូតេអ៊ីន A, B, C ដែលមានម៉ាស់ម៉ូលេគុលស្មើនឹង 160,000, 80,000 និង 60,000 រៀងគ្នា ត្រូវបានវិភាគដោយការច្រោះជែល (រូបភាព 1.35)។ គ្រាប់ជែលដែលហើមអាចជ្រាបចូលទៅក្នុងប្រូតេអ៊ីនដែលមានទម្ងន់ម៉ូលេគុលតិចជាង 70,000។ តើគោលការណ៍អ្វីខ្លះដែលបញ្ជាក់ពីវិធីសាស្ត្របំបែកនេះ? តើក្រាហ្វណាមួយតំណាងឱ្យលទ្ធផលនៃប្រភាគបានត្រឹមត្រូវ? បញ្ជាក់លំដាប់នៃការបញ្ចេញប្រូតេអ៊ីន A, B និង C ពីជួរឈរ។
 អង្ករ។ ១.៣៥. ដោយប្រើវិធីសាស្ត្រចម្រោះជែលដើម្បីបំបែកប្រូតេអ៊ីន
អង្ករ។ ១.៣៥. ដោយប្រើវិធីសាស្ត្រចម្រោះជែលដើម្បីបំបែកប្រូតេអ៊ីន
9. នៅលើរូបភព។ 1.36, A បង្ហាញដ្យាក្រាមនៃ electrophoresis នៅលើក្រដាសនៃប្រូតេអ៊ីននៅក្នុងសេរ៉ូមឈាមរបស់មនុស្សដែលមានសុខភាពល្អ។ បរិមាណដែលទាក់ទងនៃប្រភាគប្រូតេអ៊ីនដែលទទួលបានដោយប្រើវិធីសាស្ត្រនេះគឺ៖ អាល់ប៊ុយមីន 54-58%, α 1 -globulins 6-7%, α 2 -globulins 8-9%, β-globulins 13%, γ-globulins 11-12% ។
 អង្ករ។ 1.36 Electrophoresis នៅលើក្រដាសនៃប្រូតេអ៊ីនប្លាស្មាឈាមរបស់មនុស្សដែលមានសុខភាពល្អ (A) និងអ្នកជំងឺ (B)
អង្ករ។ 1.36 Electrophoresis នៅលើក្រដាសនៃប្រូតេអ៊ីនប្លាស្មាឈាមរបស់មនុស្សដែលមានសុខភាពល្អ (A) និងអ្នកជំងឺ (B)
ខ្ញុំ - γ-globulins; II - β-globulins; III -α 2 - globulin; IV-α 2 - globulin; វី - អាល់ប៊ុមប៊ីន
ជំងឺជាច្រើនត្រូវបានអមដោយការផ្លាស់ប្តូរបរិមាណនៅក្នុងសមាសភាពនៃប្រូតេអ៊ីន whey (dysproteinemia) ។ ធម្មជាតិនៃការផ្លាស់ប្តូរទាំងនេះត្រូវបានយកមកពិចារណានៅពេលធ្វើការធ្វើរោគវិនិច្ឆ័យ និងវាយតម្លៃពីភាពធ្ងន់ធ្ងរ និងដំណាក់កាលនៃជំងឺ។
ដូចដែលអ្នកបានដឹងហើយថាប្រូតេអ៊ីនគឺជាមូលដ្ឋានសម្រាប់ប្រភពដើមនៃជីវិតនៅលើភពផែនដីរបស់យើង។ ប៉ុន្តែវាគឺជាការធ្លាក់ចុះ coacervate ដែលមានម៉ូលេគុល peptide ដែលបានក្លាយជាមូលដ្ឋានសម្រាប់កំណើតនៃភាវៈរស់។ នេះគឺហួសពីការសង្ស័យព្រោះការវិភាគនៃសមាសភាពខាងក្នុងនៃអ្នកតំណាងនៃជីវម៉ាសណាមួយបង្ហាញថាសារធាតុទាំងនេះត្រូវបានរកឃើញនៅក្នុងអ្វីគ្រប់យ៉ាង: រុក្ខជាតិសត្វ microorganisms ផ្សិតមេរោគ។ លើសពីនេះទៅទៀត ពួកវាមានភាពចម្រុះ និងម៉ាក្រូម៉ូលេគុលនៅក្នុងធម្មជាតិ។
រចនាសម្ព័នទាំងនេះមានឈ្មោះបួន ដែលពួកវាទាំងអស់គឺមានន័យដូច៖
- ប្រូតេអ៊ីន;
- ប្រូតេអ៊ីន;
- polypeptides;
- peptides ។
ម៉ូលេគុលប្រូតេអ៊ីន
លេខរបស់ពួកគេពិតជាមិនអាចគណនាបាន។ ក្នុងករណីនេះ ម៉ូលេគុលប្រូតេអ៊ីនទាំងអស់អាចបែងចែកជាពីរក្រុមធំ៖
- សាមញ្ញ - មានតែលំដាប់អាស៊ីតអាមីណូដែលតភ្ជាប់ដោយចំណង peptide;
- ស្មុគ្រស្មាញ - រចនាសម្ព័ន្ធនិងរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីនត្រូវបានកំណត់ដោយក្រុម protolytic (សិប្បនិម្មិត) បន្ថែមដែលត្រូវបានគេហៅថា cofactors ។
ជាងនេះទៅទៀត ម៉ូលេគុលស្មុគស្មាញក៏មានការបែងចែកប្រភេទរបស់ពួកគេផងដែរ។
ការចាត់ថ្នាក់នៃ peptides ស្មុគស្មាញ
- Glycoproteins គឺជាសមាសធាតុដែលទាក់ទងយ៉ាងជិតស្និទ្ធនៃប្រូតេអ៊ីន និងកាបូអ៊ីដ្រាត។ ក្រុមសិប្បនិម្មិតនៃ mucopolysaccharides ត្រូវបានត្បាញចូលទៅក្នុងរចនាសម្ព័ន្ធនៃម៉ូលេគុល។
- Lipoproteins គឺជាសមាសធាតុស្មុគស្មាញនៃប្រូតេអ៊ីននិង lipid ។
- Metalloproteins - អ៊ីយ៉ុងដែក (ជាតិដែកម៉ង់ហ្គាណែសទង់ដែងនិងផ្សេងទៀត) ដើរតួជាក្រុមសិប្បនិម្មិត។
- Nucleoproteins - ការតភ្ជាប់នៃប្រូតេអ៊ីននិងអាស៊ីត nucleic (DNA, RNA) ។
- Phosphoproteins - ការអនុលោមតាមប្រូតេអ៊ីននិងសំណល់អាស៊ីត orthophosphoric ។
- Chromoproteins គឺស្រដៀងទៅនឹង metalloproteins ទោះជាយ៉ាងណាក៏ដោយ ធាតុដែលជាផ្នែកមួយនៃក្រុមសិប្បនិម្មិតគឺជាស្មុគស្មាញពណ៌ទាំងមូល (ក្រហម - អេម៉ូក្លូប៊ីន បៃតង - ក្លរ៉ូហ្វីល ហើយដូច្នេះនៅលើ) ។
ក្រុមនីមួយៗដែលត្រូវបានពិចារណាមានរចនាសម្ព័ន្ធ និងលក្ខណៈសម្បត្តិរបស់ប្រូតេអ៊ីនខុសៗគ្នា។ មុខងារដែលពួកគេអនុវត្តក៏ប្រែប្រួលអាស្រ័យលើប្រភេទនៃម៉ូលេគុល។

រចនាសម្ព័ន្ធគីមីនៃប្រូតេអ៊ីន
តាមទស្សនៈនេះ ប្រូតេអ៊ីនគឺជាខ្សែសង្វាក់ដ៏ធំនៃសំណល់អាស៊ីតអាមីណូដែលទាក់ទងគ្នាទៅវិញទៅមកដោយចំណងជាក់លាក់ដែលហៅថាចំណង peptide ។ ពីរចនាសម្ព័ន្ធចំហៀងនៃអាស៊ីតចេញពីសាខា - រ៉ាឌីកាល់។ រចនាសម្ព័ន្ធនៃម៉ូលេគុលនេះត្រូវបានរកឃើញដោយ E. Fischer នៅដើមសតវត្សទី 21 ។
ក្រោយមកទៀត ប្រូតេអ៊ីន រចនាសម្ព័ន្ធ និងមុខងាររបស់ប្រូតេអ៊ីនត្រូវបានសិក្សាលម្អិតបន្ថែមទៀត។ វាច្បាស់ណាស់ថាមានអាស៊ីដអាមីណូតែ 20 ប៉ុណ្ណោះដែលបង្កើតជារចនាសម្ព័ន្ធនៃ peptide ប៉ុន្តែពួកវាអាចបញ្ចូលគ្នាបានតាមវិធីផ្សេងៗគ្នា។ ដូច្នេះភាពចម្រុះនៃរចនាសម្ព័ន្ធ polypeptide ។ លើសពីនេះទៀតនៅក្នុងដំណើរការនៃជីវិតនិងការអនុវត្តមុខងាររបស់ពួកគេប្រូតេអ៊ីនអាចឆ្លងកាត់ការផ្លាស់ប្តូរគីមីមួយចំនួន។ ជាលទ្ធផលពួកគេផ្លាស់ប្តូររចនាសម្ព័ន្ធហើយប្រភេទនៃការតភ្ជាប់ថ្មីទាំងស្រុងលេចឡើង។
ដើម្បីបំបែកចំណង peptide នោះគឺដើម្បីបំបែកប្រូតេអ៊ីនរចនាសម្ព័ន្ធនៃច្រវាក់អ្នកត្រូវជ្រើសរើសលក្ខខណ្ឌដ៏អាក្រក់ (សកម្មភាពនៃសីតុណ្ហភាពខ្ពស់អាស៊ីតឬអាល់កាឡាំងដែលជាកាតាលីករ) ។ នេះគឺដោយសារតែកម្លាំងខ្ពស់នៅក្នុងម៉ូលេគុលគឺនៅក្នុងក្រុម peptide ។

ការរកឃើញរចនាសម្ព័ន្ធប្រូតេអ៊ីននៅក្នុងមន្ទីរពិសោធន៍ត្រូវបានអនុវត្តដោយប្រើប្រតិកម្ម biuret - ការប៉ះពាល់ទៅនឹង polypeptide ដែល precipitated ស្រស់ (II) ។ ស្មុគស្មាញនៃក្រុម peptide និងអ៊ីយ៉ុងទង់ដែងផ្តល់នូវពណ៌ violet ភ្លឺ។
មានអង្គការរចនាសម្ព័ន្ធសំខាន់ៗចំនួនបួនដែលនីមួយៗមានលក្ខណៈរចនាសម្ព័ន្ធផ្ទាល់ខ្លួននៃប្រូតេអ៊ីន។
កម្រិតអង្គការ៖ រចនាសម្ព័ន្ធបឋម
ដូចដែលបានរៀបរាប់ខាងលើ peptide គឺជាលំដាប់នៃសំណល់អាស៊ីតអាមីណូដែលមានឬគ្មានការរួមបញ្ចូល coenzymes ។ ដូច្នេះឈ្មោះចម្បងគឺដូចជារចនាសម្ព័ន្ធនៃម៉ូលេគុលដែលជាធម្មជាតិធម្មជាតិគឺពិតជាអាស៊ីតអាមីណូដែលតភ្ជាប់ដោយចំណង peptide ហើយគ្មានអ្វីទៀតទេ។ នោះគឺ polypeptide នៃរចនាសម្ព័ន្ធលីនេអ៊ែរ។ ក្នុងពេលជាមួយគ្នានេះ លក្ខណៈរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីននៃផែនការបែបនេះគឺថា ការរួមបញ្ចូលគ្នានៃអាស៊ីតបែបនេះគឺជាការសម្រេចចិត្តសម្រាប់ការអនុវត្តមុខងារនៃម៉ូលេគុលប្រូតេអ៊ីនមួយ។ ដោយសារតែវត្តមាននៃលក្ខណៈពិសេសទាំងនេះវាមិនត្រឹមតែអាចកំណត់អត្តសញ្ញាណ peptide ប៉ុណ្ណោះទេប៉ុន្តែថែមទាំងអាចទស្សន៍ទាយពីលក្ខណៈសម្បត្តិនិងតួនាទីរបស់ថ្មីទាំងស្រុងដែលមិនទាន់ត្រូវបានរកឃើញ។ ឧទាហរណ៏នៃ peptides ដែលមានរចនាសម្ព័ន្ធចម្បងធម្មជាតិគឺអាំងស៊ុយលីន pepsin chymotrypsin និងផ្សេងទៀត។

ការអនុលោមតាមអនុវិទ្យាល័យ
រចនាសម្ព័ននិងលក្ខណៈសម្បត្តិនៃប្រូតេអ៊ីននៅក្នុងប្រភេទនេះផ្លាស់ប្តូរខ្លះ។ រចនាសម្ព័ន្ធបែបនេះអាចត្រូវបានបង្កើតឡើងដំបូងពីធម្មជាតិ ឬនៅពេលដែលរចនាសម្ព័ន្ធបឋមត្រូវបានប៉ះពាល់នឹងអ៊ីដ្រូលីស៊ីតធ្ងន់ធ្ងរ សីតុណ្ហភាព ឬលក្ខខណ្ឌផ្សេងទៀត។
ទម្រង់នេះមានបីប្រភេទ៖
- ខ្សែស្តេរ៉េអូធម្មតា រលោង ធម្មតា បង្កើតឡើងពីសំណល់អាស៊ីតអាមីណូ ដែលបង្វិលជុំវិញអ័ក្សសំខាន់នៃការតភ្ជាប់។ ពួកវាត្រូវបានប្រមូលផ្តុំគ្នាដោយសារធាតុដែលកើតឡើងរវាងអុកស៊ីសែននៃក្រុម peptide មួយ និងអ៊ីដ្រូសែននៃក្រុមមួយទៀត។ ជាងនេះទៅទៀត រចនាសម្ព័នត្រូវបានចាត់ទុកថាត្រឹមត្រូវ ដោយសារការបង្វិលត្រូវបានធ្វើម្តងទៀតស្មើៗគ្នារៀងរាល់ 4 តំណភ្ជាប់។ រចនាសម្ព័ន្ធបែបនេះអាចជាដៃឆ្វេងឬដៃស្តាំ។ ប៉ុន្តែនៅក្នុងប្រូតេអ៊ីនដែលគេស្គាល់ភាគច្រើន isomer dextrorotatory នាំមុខ។ ការអនុលោមភាពបែបនេះត្រូវបានគេហៅថារចនាសម្ព័ន្ធអាល់ហ្វា។
- សមាសភាព និងរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីននៃប្រភេទខាងក្រោមខុសពីប្រភេទមុន ដែលចំណងអ៊ីដ្រូសែនត្រូវបានបង្កើតឡើងមិនមែនរវាងសំណល់ដែលនៅជាប់នឹងផ្នែកម្ខាងនៃម៉ូលេគុលនោះទេ ប៉ុន្តែនៅចន្លោះឆ្ងាយ និងចម្ងាយដ៏ច្រើនគ្រប់គ្រាន់។ សម្រាប់ហេតុផលនេះ រចនាសម្ព័ន្ធទាំងមូលបង្កើតជាខ្សែសង្វាក់ serpentine polypeptide ជាច្រើនរលក។ មានលក្ខណៈពិសេសមួយដែលប្រូតេអ៊ីនត្រូវតែបង្ហាញ។ រចនាសម្ព័ន្ធនៃអាស៊ីតអាមីណូនៅលើមែកឈើគួរតែខ្លីតាមដែលអាចធ្វើទៅបាន ដូចជា glycine ឬ alanine ជាឧទាហរណ៍។ ប្រភេទនៃការអនុលោមតាមអនុវិទ្យាល័យនេះត្រូវបានគេហៅថាសន្លឹកបេតាសម្រាប់សមត្ថភាពហាក់ដូចជានៅជាប់គ្នានៅពេលបង្កើតរចនាសម្ព័ន្ធរួម។
- ជីវវិទ្យាសំដៅលើរចនាសម្ព័ន្ធប្រូតេអ៊ីនប្រភេទទី 3 ថាជាបំណែកស្មុគ្រស្មាញ ខ្ចាត់ខ្ចាយ គ្មានសណ្តាប់ធ្នាប់ ដែលមិនមានភាពទៀងទាត់ និងមានសមត្ថភាពផ្លាស់ប្តូររចនាសម្ព័ន្ធក្រោមឥទ្ធិពលនៃលក្ខខណ្ឌខាងក្រៅ។
គ្មានឧទាហរណ៍នៃប្រូតេអ៊ីនដែលមានរចនាសម្ព័ន្ធបន្ទាប់បន្សំដោយធម្មជាតិត្រូវបានគេកំណត់អត្តសញ្ញាណនោះទេ។

ការអប់រំថ្នាក់ឧត្តមសិក្សា
នេះជាទម្រង់ស្មុគ្រស្មាញគួរសមដែលគេហៅថា "globule"។ តើប្រូតេអ៊ីនបែបនេះជាអ្វី? រចនាសម្ព័ន្ធរបស់វាត្រូវបានផ្អែកលើរចនាសម្ព័ន្ធបន្ទាប់បន្សំ ទោះជាយ៉ាងណាក៏ដោយ អន្តរកម្មប្រភេទថ្មីរវាងអាតូមនៃក្រុមត្រូវបានបន្ថែម ហើយម៉ូលេគុលទាំងមូលហាក់ដូចជារួញឡើង ដូច្នេះផ្តោតលើការពិតដែលថាក្រុម hydrophilic ត្រូវបានដឹកនាំនៅខាងក្នុង globule និង hydrophobic គឺនៅខាងក្រៅ។
នេះពន្យល់ពីការចោទប្រកាន់នៃម៉ូលេគុលប្រូតេអ៊ីននៅក្នុងដំណោះស្រាយ colloidal ទឹក។ តើអន្តរកម្មប្រភេទណាខ្លះដែលមានវត្តមាននៅទីនេះ?
- ចំណងអ៊ីដ្រូសែន - នៅតែមិនផ្លាស់ប្តូររវាងផ្នែកដូចគ្នាដូចនៅក្នុងរចនាសម្ព័ន្ធបន្ទាប់បន្សំ។
- អន្តរកម្ម - កើតឡើងនៅពេលដែល polypeptide ត្រូវបានរំលាយនៅក្នុងទឹក។
- ការទាក់ទាញអ៊ីយ៉ុង - បង្កើតឡើងរវាងក្រុមផ្សេងគ្នានៃសំណល់អាស៊ីតអាមីណូ (រ៉ាឌីកាល់) ។
- អន្តរកម្ម covalent - អាចបង្កើតរវាងកន្លែងអាស៊ីតជាក់លាក់ - ម៉ូលេគុល cysteine ឬផ្ទុយទៅវិញកន្ទុយរបស់វា។
ដូច្នេះសមាសភាពនិងរចនាសម្ព័ន្ធនៃប្រូតេអ៊ីនដែលមានរចនាសម្ព័ន្ធទីបីអាចត្រូវបានពិពណ៌នាថាជាខ្សែសង្វាក់ polypeptide បត់ចូលទៅក្នុង globules ដែលរក្សានិងស្ថេរភាពការអនុលោមភាពរបស់ពួកគេដោយសារតែប្រភេទផ្សេងៗនៃអន្តរកម្មគីមី។ ឧទាហរណ៏នៃ peptides បែបនេះ៖ phosphoglycerate kenase, tRNA, alpha-keratin, silk fibroin និងផ្សេងទៀត។
រចនាសម្ព័ន្ធបួនជ្រុង
នេះគឺជា globules ស្មុគស្មាញបំផុតមួយដែលប្រូតេអ៊ីនបង្កើត។ រចនាសម្ព័ននិងមុខងារនៃប្រូតេអ៊ីននៃប្រភេទនេះគឺមានភាពចម្រុះនិងជាក់លាក់។
តើអ្វីទៅជាការអនុលោមតាមបែបនេះ? ទាំងនេះគឺជាខ្សែសង្វាក់ polypeptide ធំ និងតូចជាច្រើន (ក្នុងករណីខ្លះរាប់សិប) ដែលត្រូវបានបង្កើតឡើងដោយឯករាជ្យពីគ្នាទៅវិញទៅមក។ ប៉ុន្តែបន្ទាប់មក ដោយសារតែអន្តរកម្មដូចគ្នាដែលយើងបានពិចារណាសម្រាប់រចនាសម្ព័ន្ធទីបី សារធាតុ peptides ទាំងអស់នេះរមួល និងទាក់ទងគ្នាទៅវិញទៅមក។ តាមវិធីនេះ កោសិកាដែលមានរាងស្មុគ្រស្មាញត្រូវបានទទួល ដែលអាចផ្ទុកអាតូមដែក ក្រុម lipid និងក្រុមកាបូអ៊ីដ្រាត។ ឧទាហរណ៍នៃប្រូតេអ៊ីនបែបនេះគឺ DNA polymerase ស្រោមសំបុត្រមេរោគថ្នាំជក់ អេម៉ូក្លូប៊ីន និងផ្សេងទៀត។

រចនាសម្ព័ន្ធ peptide ទាំងអស់ដែលយើងបានពិចារណាមានវិធីសាស្រ្តកំណត់អត្តសញ្ញាណផ្ទាល់របស់ពួកគេនៅក្នុងមន្ទីរពិសោធន៍ ដោយផ្អែកលើលទ្ធភាពទំនើបនៃការប្រើប្រាស់ chromatography, centrifugation, អេឡិចត្រុង និងមីក្រូទស្សន៍អុបទិក និងបច្ចេកវិទ្យាកុំព្យូទ័រខ្ពស់។
មុខងារត្រូវបានអនុវត្ត
រចនាសម្ព័ន្ធ និងមុខងាររបស់ប្រូតេអ៊ីនមានទំនាក់ទំនងគ្នាយ៉ាងជិតស្និទ្ធ។ នោះគឺ peptide នីមួយៗដើរតួនាទីជាក់លាក់ ពិសេស និងជាក់លាក់។ វាក៏មានអ្នកដែលអាចធ្វើប្រតិបត្តិការសំខាន់ៗជាច្រើននៅក្នុងកោសិការស់មួយក្នុងពេលតែមួយ។ ទោះយ៉ាងណាក៏ដោយ វាអាចបង្ហាញជាទម្រង់ទូទៅនៃមុខងារសំខាន់នៃម៉ូលេគុលប្រូតេអ៊ីននៅក្នុងសារពាង្គកាយរបស់សត្វមានជីវិត៖
- ធានាចលនា។ សារពាង្គកាយ Unicellular ឬ organelles ឬប្រភេទកោសិកាមួយចំនួនមានសមត្ថភាពធ្វើចលនា កន្ត្រាក់ ចលនា។ នេះត្រូវបានផ្តល់ដោយប្រូតេអ៊ីនដែលជាផ្នែកមួយនៃរចនាសម្ព័ន្ធនៃបរិធានម៉ូទ័ររបស់ពួកគេ: cilia, flagella, ភ្នាស cytoplasmic ។ ប្រសិនបើយើងនិយាយអំពីកោសិកាដែលមិនអាចផ្លាស់ទីបាន នោះប្រូតេអ៊ីនអាចរួមចំណែកដល់ការកន្ត្រាក់របស់វា (សាច់ដុំ myosin)។
- អាហារូបត្ថម្ភឬមុខងារបម្រុង។ វាគឺជាការប្រមូលផ្តុំនៃម៉ូលេគុលប្រូតេអ៊ីននៅក្នុងស៊ុត អំប្រ៊ីយ៉ុង និងគ្រាប់ពូជនៃរុក្ខជាតិ ដើម្បីបំពេញបន្ថែមសារធាតុចិញ្ចឹមដែលបាត់។ នៅពេលកាត់ចេញ សារធាតុ peptides ផ្តល់អាស៊ីតអាមីណូ និងសារធាតុសកម្មជីវសាស្រ្ត ដែលចាំបាច់សម្រាប់ការអភិវឌ្ឍធម្មតានៃសារពាង្គកាយមានជីវិត។
- មុខងារថាមពល។ បន្ថែមពីលើកាបូអ៊ីដ្រាតប្រូតេអ៊ីនក៏អាចផ្តល់កម្លាំងដល់រាងកាយផងដែរ។ ជាមួយនឹងការបំបែក 1 ក្រាមនៃ peptide ថាមពលដែលមានប្រយោជន៍ 17.6 kJ ត្រូវបានបញ្ចេញក្នុងទម្រង់ជាអាស៊ីត adenosine triphosphoric (ATP) ដែលត្រូវបានចំណាយលើដំណើរការសំខាន់ៗ។
- សញ្ញា និងវាមាននៅក្នុងការអនុវត្តការត្រួតពិនិត្យយ៉ាងប្រុងប្រយ័ត្ននៃដំណើរការដែលកំពុងដំណើរការ និងការបញ្ជូនសញ្ញាពីកោសិកាទៅជាលិកា ពីពួកវាទៅសរីរាង្គ ពីក្រោយទៅប្រព័ន្ធ។ល។ ឧទាហរណ៍ធម្មតាគឺអាំងស៊ុយលីនដែលជួសជុលយ៉ាងតឹងរ៉ឹងនូវបរិមាណគ្លុយកូសក្នុងឈាម។
- មុខងារទទួល។ វាត្រូវបានអនុវត្តដោយការផ្លាស់ប្តូរការអនុលោមតាម peptide នៅផ្នែកម្ខាងនៃភ្នាសនិងពាក់ព័ន្ធនឹងចុងម្ខាងទៀតនៅក្នុងការរៀបចំរចនាសម្ព័ន្ធឡើងវិញ។ ក្នុងពេលជាមួយគ្នានេះសញ្ញានិងព័ត៌មានចាំបាច់ត្រូវបានបញ្ជូន។ ភាគច្រើនជាញឹកញាប់ ប្រូតេអ៊ីនបែបនេះត្រូវបានបង្កើតឡើងនៅក្នុងភ្នាស cytoplasmic នៃកោសិកា ហើយអនុវត្តការគ្រប់គ្រងយ៉ាងតឹងរ៉ឹងលើសារធាតុទាំងអស់ដែលឆ្លងកាត់វា។ ពួកគេក៏ដាស់តឿនអ្នកអំពីការផ្លាស់ប្តូរគីមី និងរូបវន្តនៅក្នុងបរិស្ថានផងដែរ។
- មុខងារដឹកជញ្ជូន peptides ។ វាត្រូវបានអនុវត្តដោយប្រូតេអ៊ីនឆានែលនិងប្រូតេអ៊ីនដឹកជញ្ជូន។ តួនាទីរបស់ពួកគេគឺជាក់ស្តែង - ការដឹកជញ្ជូនម៉ូលេគុលចាំបាច់ទៅកន្លែងដែលមានកំហាប់ទាបពីផ្នែកដែលមានកម្រិតខ្ពស់។ ឧទាហរណ៍ធម្មតាគឺការដឹកជញ្ជូនអុកស៊ីសែន និងកាបូនឌីអុកស៊ីតតាមរយៈសរីរាង្គ និងជាលិកាដោយប្រូតេអ៊ីនអេម៉ូក្លូប៊ីន។ ពួកគេក៏អនុវត្តការចែកចាយសមាសធាតុជាមួយនឹងទម្ងន់ម៉ូលេគុលទាបតាមរយៈភ្នាសកោសិកានៅខាងក្នុង។
- មុខងាររចនាសម្ព័ន្ធ។ មួយនៃសំខាន់បំផុតដែលប្រូតេអ៊ីនអនុវត្ត។ រចនាសម្ព័ន្ធនៃកោសិកាទាំងអស់ organelles របស់វាត្រូវបានផ្តល់យ៉ាងជាក់លាក់ដោយ peptides ។ ពួកគេដូចជាស៊ុមមួយកំណត់រូបរាងនិងរចនាសម្ព័ន្ធ។ លើសពីនេះទៀតពួកគេគាំទ្រវាហើយកែប្រែវាប្រសិនបើចាំបាច់។ ដូច្នេះដើម្បីការលូតលាស់ និងការអភិវឌ្ឍន៍ គ្រប់សារពាង្គកាយមានជីវិតត្រូវការប្រូតេអ៊ីននៅក្នុងរបបអាហារ។ peptides ទាំងនេះរួមមាន elastin, tubulin, collagen, actin, keratin និងផ្សេងៗទៀត។
- មុខងារកាតាលីករ។ អង់ស៊ីមធ្វើវា។ ជាច្រើន និងផ្លាស់ប្តូរ ពួកគេបង្កើនល្បឿនប្រតិកម្មគីមី និងជីវគីមីទាំងអស់នៅក្នុងរាងកាយ។ ដោយគ្មានការចូលរួមរបស់ពួកគេ ផ្លែប៉ោមធម្មតាមួយនៅក្នុងក្រពះអាចរំលាយបានក្នុងរយៈពេលត្រឹមតែពីរថ្ងៃប៉ុណ្ណោះ ជាមួយនឹងប្រូបាបខ្ពស់នៃការរលួយ។ នៅក្រោមសកម្មភាពរបស់ catalase, peroxidase និងអង់ស៊ីមផ្សេងទៀតដំណើរការនេះត្រូវចំណាយពេលពីរម៉ោង។ ជាទូទៅវាគឺជាអរគុណចំពោះតួនាទីនៃប្រូតេអ៊ីននេះដែល anabolism និង catabolism ត្រូវបានអនុវត្ត ពោលគឺប្លាស្ទិក និង

តួនាទីការពារ
មានប្រភេទនៃការគំរាមកំហែងជាច្រើនដែលប្រូតេអ៊ីនត្រូវបានរចនាឡើងដើម្បីការពាររាងកាយពី។
ទីមួយ សារធាតុរបួស ឧស្ម័ន ម៉ូលេគុល សារធាតុនៃវិសាលគមផ្សេងៗនៃសកម្មភាព។ Peptides អាចចូលទៅក្នុងអន្តរកម្មគីមីជាមួយពួកវា បំប្លែងពួកវាទៅជាទម្រង់គ្មានការបង្កគ្រោះថ្នាក់ ឬគ្រាន់តែបន្សាបពួកវា។
ទីពីរមានការគំរាមកំហែងខាងរាងកាយពីរបួស - ប្រសិនបើប្រូតេអ៊ីន fibrinogen មិនត្រូវបានផ្លាស់ប្តូរទៅជា fibrin ទាន់ពេលវេលានៅកន្លែងរងរបួសនោះឈាមនឹងមិនកកទេដែលមានន័យថាការស្ទះនឹងមិនកើតឡើងទេ។ បន្ទាប់មក ផ្ទុយទៅវិញ អ្នកនឹងត្រូវការ plasmin peptide ដែលមានសមត្ថភាពដោះស្រាយកំណកឈាម និងស្ដារឡើងវិញនូវភាពធន់នៃនាវា។
ទីបីការគំរាមកំហែងដល់អភ័យឯកសិទ្ធិ។ រចនាសម្ព័ននិងសារៈសំខាន់នៃប្រូតេអ៊ីនដែលបង្កើតការការពារប្រព័ន្ធភាពស៊ាំមានសារៈសំខាន់ខ្លាំងណាស់។ អង្គបដិប្រាណ, immunoglobulins, interferons គឺជាធាតុសំខាន់និងសំខាន់នៃប្រព័ន្ធឡាំហ្វាទិចនិងប្រព័ន្ធភាពស៊ាំរបស់មនុស្ស។ ភាគល្អិតបរទេសណាមួយ ម៉ូលេគុលដែលបង្កគ្រោះថ្នាក់ ផ្នែកដែលស្លាប់នៃកោសិកា ឬរចនាសម្ព័ន្ធទាំងមូលត្រូវទទួលរងការស៊ើបអង្កេតភ្លាមៗដោយសមាសធាតុ peptide ។ នោះហើយជាមូលហេតុដែលមនុស្សម្នាក់អាចឯករាជ្យដោយគ្មានជំនួយពីឱសថប្រចាំថ្ងៃការពារខ្លួនពីការឆ្លងមេរោគនិងមេរោគសាមញ្ញ។
លក្ខណៈសម្បត្តិរូបវន្ត
រចនាសម្ព័ន្ធនៃប្រូតេអ៊ីនកោសិកាគឺជាក់លាក់ណាស់ ហើយអាស្រ័យលើមុខងារដែលបានអនុវត្ត។ ប៉ុន្តែលក្ខណៈសម្បត្តិរូបវន្តនៃ peptides ទាំងអស់គឺស្រដៀងគ្នា និងឆ្អិនទៅនឹងលក្ខណៈដូចខាងក្រោម។
- ទំងន់នៃម៉ូលេគុលគឺរហូតដល់ 1,000,000 Daltons ។
- ប្រព័ន្ធ Colloidal ត្រូវបានបង្កើតឡើងនៅក្នុងដំណោះស្រាយ aqueous ។ នៅទីនោះ រចនាសម្ព័ន្ធទទួលបានបន្ទុកដែលអាចប្រែប្រួលអាស្រ័យលើទឹកអាស៊ីតរបស់ឧបករណ៍ផ្ទុក។
- នៅពេលដែលប៉ះពាល់នឹងលក្ខខណ្ឌដ៏អាក្រក់ (ការ irradiation, អាស៊ីត ឬ alkali, សីតុណ្ហភាព និងដូច្នេះនៅលើ), ពួកគេអាចផ្លាស់ទីទៅកម្រិតផ្សេងទៀតនៃការអនុលោមភាព, នោះគឺ, denature ។ ដំណើរការនេះគឺមិនអាចត្រឡប់វិញបានក្នុង 90% នៃករណី។ ទោះយ៉ាងណាក៏ដោយក៏មានការផ្លាស់ប្តូរបញ្ច្រាសផងដែរ - ការផ្លាស់ប្តូរ។
ទាំងនេះគឺជាលក្ខណៈសម្បត្តិសំខាន់នៃលក្ខណៈរូបវន្តនៃ peptides ។
