Na primeira metade do século XIX muitos químicos, e entre eles principalmente J. von Liebig, gradualmente chegaram à conclusão de que as proteínas são uma classe especial de compostos nitrogenados. O nome "proteínas" (do grego.
proto- o primeiro) foi proposto em 1840 pelo químico holandês G. Mulder. PROPRIEDADES FÍSICAS As proteínas são brancas no estado sólido, mas incolores em solução, a menos que carreguem algum grupo cromóforo (colorido), como a hemoglobina. A solubilidade em água de diferentes proteínas varia muito. Também varia com o pH e com a concentração de sais na solução, de modo que se pode escolher as condições sob as quais uma proteína irá precipitar seletivamente na presença de outras proteínas. Este método de "salting out" é amplamente utilizado para isolar e purificar proteínas. A proteína purificada muitas vezes precipita da solução como cristais.Em comparação com outros compostos, o peso molecular das proteínas é muito grande - de vários milhares a muitos milhões de daltons. Portanto, durante a ultracentrifugação, as proteínas são precipitadas e, além disso, em taxas diferentes. Devido à presença de grupos carregados positivamente e negativamente nas moléculas de proteínas, elas se movem em velocidades diferentes em um campo elétrico. Esta é a base da eletroforese, um método usado para isolar proteínas individuais de misturas complexas. A purificação de proteínas também é realizada por cromatografia.
PROPRIEDADES QUIMICAS Estrutura. As proteínas são polímeros, ou seja, moléculas construídas como cadeias de unidades monoméricas repetidas, ou subunidades, cujo papel elas desempenham uma -aminoácidos. Fórmula geral dos aminoácidos onde R - um átomo de hidrogênio ou algum grupo orgânico.Uma molécula de proteína (cadeia polipeptídica) pode consistir em apenas um número relativamente pequeno de aminoácidos ou vários milhares de unidades monoméricas. A ligação dos aminoácidos na cadeia é possível porque cada um deles possui dois grupos químicos diferentes: um grupo amino com propriedades básicas,
NH2 , e um grupo carboxila acídico, COOH. Ambos os grupos são afiliados a uma - um átomo de carbono. O grupo carboxila de um aminoácido pode formar uma ligação amida (peptídeo) com o grupo amino de outro aminoácido: Depois que dois aminoácidos foram conectados dessa maneira, a cadeia pode ser estendida adicionando um terceiro ao segundo aminoácido e assim por diante. Como pode ser visto na equação acima, quando uma ligação peptídica é formada, uma molécula de água é liberada. Na presença de ácidos, álcalis ou enzimas proteolíticas, a reação prossegue na direção oposta: a cadeia polipeptídica é clivada em aminoácidos com a adição de água. Essa reação é chamada de hidrólise. A hidrólise ocorre espontaneamente e é necessária energia para combinar aminoácidos em uma cadeia polipeptídica.
Depois que dois aminoácidos foram conectados dessa maneira, a cadeia pode ser estendida adicionando um terceiro ao segundo aminoácido e assim por diante. Como pode ser visto na equação acima, quando uma ligação peptídica é formada, uma molécula de água é liberada. Na presença de ácidos, álcalis ou enzimas proteolíticas, a reação prossegue na direção oposta: a cadeia polipeptídica é clivada em aminoácidos com a adição de água. Essa reação é chamada de hidrólise. A hidrólise ocorre espontaneamente e é necessária energia para combinar aminoácidos em uma cadeia polipeptídica. Um grupo carboxila e um grupo amida (ou um grupo imida semelhante a ele - no caso do aminoácido prolina) estão presentes em todos os aminoácidos, enquanto as diferenças entre os aminoácidos são determinadas pela natureza desse grupo, ou "lado chain", que é indicado acima pela letra
R . O papel da cadeia lateral pode ser desempenhado por um átomo de hidrogênio, como no aminoácido glicina, ou por algum grupo volumoso, como na histidina e no triptofano. Algumas cadeias laterais são quimicamente inertes, enquanto outras são altamente reativas.Muitos milhares de aminoácidos diferentes podem ser sintetizados, e muitos aminoácidos diferentes ocorrem na natureza, mas apenas 20 tipos de aminoácidos são usados para a síntese de proteínas: alanina, arginina, asparagina, ácido aspártico, valina, histidina, glicina, glutamina, glutâmico. ácido, isoleucina, leucina, lisina, metionina, prolina, serina, tirosina, treonina, triptofano, fenilalanina e cisteína (nas proteínas, a cisteína pode estar presente como um dímero
cistina). É verdade que existem outros aminoácidos em algumas proteínas, além dos vinte que ocorrem regularmente, mas eles são formados como resultado da modificação de qualquer um dos vinte listados após ter sido incluído na proteína.atividade óptica. Todos os aminoácidos, com exceção da glicina, uma O átomo de carbono tem quatro grupos diferentes ligados. Em termos de geometria, quatro grupos diferentes podem ser anexados de duas maneiras e, portanto, existem duas configurações possíveis, ou dois isômeros, relacionados entre si como um objeto à sua imagem especular, ou seja, como a mão esquerda para a direita. Uma configuração é chamada de canhoto ou canhoto ( eu ), e o outro - direito, ou dextrógiro ( D ), uma vez que dois desses isômeros diferem na direção de rotação do plano da luz polarizada. Encontrado apenas em proteínas eu -aminoácidos (a exceção é a glicina; ela só pode ser representada em uma forma, pois dois de seus quatro grupos são iguais) e todos têm atividade óptica (já que há apenas um isômero). D -aminoácidos são raros na natureza; eles são encontrados em alguns antibióticos e na parede celular de bactérias.A sequência de aminoácidos. Os aminoácidos na cadeia polipeptídica não estão dispostos aleatoriamente, mas em uma certa ordem fixa, e é essa ordem que determina as funções e propriedades da proteína. Variando a ordem dos 20 tipos de aminoácidos, você pode obter um grande número de proteínas diferentes, assim como você pode criar muitos textos diferentes com as letras do alfabeto.No passado, determinar a sequência de aminoácidos de uma proteína geralmente levava vários anos. A determinação direta ainda é uma tarefa bastante trabalhosa, embora tenham sido criados dispositivos que permitem que ela seja realizada automaticamente. Geralmente é mais fácil determinar a sequência de nucleotídeos do gene correspondente e derivar a sequência de aminoácidos da proteína a partir dele. Até o momento, as sequências de aminoácidos de muitas centenas de proteínas já foram determinadas. As funções das proteínas decodificadas geralmente são conhecidas, e isso ajuda a imaginar as possíveis funções de proteínas semelhantes formadas, por exemplo, em neoplasias malignas.
Proteínas complexas. As proteínas que consistem apenas em aminoácidos são chamadas de simples. Muitas vezes, no entanto, um átomo de metal ou algum composto químico que não é um aminoácido está ligado à cadeia polipeptídica. Tais proteínas são chamadas de complexas. Um exemplo é a hemoglobina: ela contém porfirina de ferro, que lhe confere a cor vermelha e permite que ela atue como carreadora de oxigênio.Os nomes das proteínas mais complexas contêm uma indicação da natureza dos grupos anexados: os açúcares estão presentes nas glicoproteínas, as gorduras nas lipoproteínas. Se a atividade catalítica da enzima depende do grupo ligado, então é chamado de grupo prostético. Muitas vezes, alguma vitamina desempenha o papel de um grupo protético ou faz parte dele. A vitamina A, por exemplo, ligada a uma das proteínas da retina, determina sua sensibilidade à luz.
Estrutura terciária. O importante não é tanto a sequência de aminoácidos da proteína (estrutura primária), mas a forma como ela é colocada no espaço. Ao longo de todo o comprimento da cadeia polipeptídica, os íons de hidrogênio formam ligações de hidrogênio regulares, que lhe conferem a forma de uma espiral ou camada (estrutura secundária). Da combinação de tais hélices e camadas, surge uma forma compacta da próxima ordem - a estrutura terciária da proteína. Em torno das ligações que prendem os elos monoméricos da cadeia, são possíveis rotações em pequenos ângulos. Portanto, de um ponto de vista puramente geométrico, o número de configurações possíveis para qualquer cadeia polipeptídica é infinitamente grande. Na realidade, cada proteína normalmente existe em apenas uma configuração, determinada por sua sequência de aminoácidos. Esta estrutura não é rígida, é, por assim dizer, « respira” - oscila em torno de uma certa configuração média. A corrente é dobrada em uma configuração na qual a energia livre (a capacidade de realizar trabalho) é mínima, assim como uma mola liberada é comprimida apenas para um estado correspondente a um mínimo de energia livre. Muitas vezes, uma parte da cadeia está rigidamente ligada a outro dissulfeto (- S–S–) ligações entre dois resíduos de cisteína. É em parte por isso que a cisteína entre os aminoácidos desempenha um papel particularmente importante.A complexidade da estrutura das proteínas é tão grande que ainda não é possível calcular a estrutura terciária de uma proteína, mesmo que sua sequência de aminoácidos seja conhecida. Mas se for possível obter cristais de proteína, sua estrutura terciária pode ser determinada por difração de raios X.
Em proteínas estruturais, contráteis e em algumas outras, as cadeias são alongadas e várias cadeias levemente dobradas que se encontram lado a lado formam fibrilas; as fibrilas, por sua vez, dobram-se em formações maiores - fibras. No entanto, a maioria das proteínas em solução são globulares: as cadeias são enroladas em um glóbulo, como fios em uma bola. A energia livre nesta configuração é mínima, uma vez que os aminoácidos hidrofóbicos (“repelem a água”) estão escondidos dentro do glóbulo, enquanto os aminoácidos hidrofílicos (“atraem a água”) estão em sua superfície.
Muitas proteínas são complexos de várias cadeias polipeptídicas. Essa estrutura é chamada de estrutura quaternária da proteína. A molécula de hemoglobina, por exemplo, é composta de quatro subunidades, cada uma das quais é uma proteína globular.
As proteínas estruturais, devido à sua configuração linear, formam fibras nas quais a resistência à tração é muito alta, enquanto a configuração globular permite que as proteínas entrem em interações específicas com outros compostos. Na superfície do glóbulo, com a colocação correta de cadeias, aparecem cavidades de uma determinada forma, nas quais estão localizados grupos químicos reativos. Se essa proteína é uma enzima, então outra molécula, geralmente menor, de alguma substância entra em tal cavidade, assim como uma chave entra em uma fechadura; neste caso, a configuração da nuvem eletrônica da molécula muda sob a influência de grupos químicos localizados na cavidade, e isso a força a reagir de uma determinada maneira. Desta forma, a enzima catalisa a reação. As moléculas de anticorpos também têm cavidades nas quais várias substâncias estranhas se ligam e, portanto, tornam-se inofensivas. O modelo "chave e fechadura", que explica a interação das proteínas com outros compostos, permite entender a especificidade de enzimas e anticorpos, ou seja, sua capacidade de reagir apenas com certos compostos.
Proteínas em diferentes tipos de organismos. Proteínas que desempenham a mesma função em diferentes espécies de plantas e animais e, portanto, têm o mesmo nome também têm uma configuração semelhante. Eles, no entanto, diferem um pouco em sua sequência de aminoácidos. À medida que as espécies divergem de um ancestral comum, alguns aminoácidos em certas posições são substituídos por mutações com outras. Mutações prejudiciais que causam doenças hereditárias são descartadas pela seleção natural, mas as benéficas ou pelo menos neutras podem ser preservadas. Quanto mais próximas duas espécies biológicas estiverem uma da outra, menos diferenças serão encontradas em suas proteínas.Algumas proteínas mudam de forma relativamente rápida, outras são bastante conservadoras. Estes últimos incluem, por exemplo, citocromo com- uma enzima respiratória encontrada na maioria dos organismos vivos. Em humanos e chimpanzés, suas sequências de aminoácidos são idênticas, e no citocromo com trigo, apenas 38% dos aminoácidos se mostraram diferentes. Mesmo comparando humanos e bactérias, a semelhança dos citocromos com(as diferenças afetam 65% dos aminoácidos aqui) ainda podem ser vistas, embora o ancestral comum de bactérias e humanos tenha vivido na Terra cerca de dois bilhões de anos atrás. Hoje em dia, a comparação de sequências de aminoácidos é frequentemente usada para construir uma árvore filogenética (genealógica) que reflete as relações evolutivas entre diferentes organismos.
Desnaturação. A molécula de proteína sintetizada, dobrada, adquire configuração própria. Essa configuração, no entanto, pode ser destruída pelo aquecimento, pela alteração do pH, pela ação de solventes orgânicos e até mesmo pela simples agitação da solução até que apareçam bolhas em sua superfície. Uma proteína alterada dessa maneira é chamada desnaturada; perde sua atividade biológica e geralmente se torna insolúvel. Exemplos bem conhecidos de proteína desnaturada são ovos cozidos ou chantilly. Pequenas proteínas, contendo apenas cerca de cem aminoácidos, são capazes de renaturar, ou seja, readquirir a configuração original. Mas a maioria das proteínas são simplesmente transformadas em uma massa de cadeias polipeptídicas emaranhadas e não restauram sua configuração anterior.Uma das principais dificuldades no isolamento de proteínas ativas é sua extrema sensibilidade à desnaturação. Esta propriedade das proteínas encontra aplicação útil na conservação de produtos alimentares: a alta temperatura desnatura irreversivelmente as enzimas dos microrganismos, e os microrganismos morrem.
SÍNTESE PROTEÍCA Para a síntese de proteínas, um organismo vivo deve ter um sistema de enzimas capaz de ligar um aminoácido a outro. Também é necessária uma fonte de informação que determine quais aminoácidos devem ser conectados. Como existem milhares de tipos de proteínas no corpo, e cada uma delas consiste em uma média de várias centenas de aminoácidos, a informação necessária deve ser realmente enorme. Ele é armazenado (semelhante a como um registro é armazenado em uma fita magnética) nas moléculas de ácido nucleico que compõem os genes. Cm . também HEREDITÁRIA; ÁCIDOS NUCLEICOS.Ativação enzimática. Uma cadeia polipeptídica sintetizada a partir de aminoácidos nem sempre é uma proteína em sua forma final. Muitas enzimas são primeiramente sintetizadas como precursores inativos e tornam-se ativas somente depois que outra enzima remove alguns aminoácidos de uma extremidade da cadeia. Algumas das enzimas digestivas, como a tripsina, são sintetizadas nessa forma inativa; essas enzimas são ativadas no trato digestivo como resultado da remoção do fragmento terminal da cadeia. O hormônio insulina, cuja molécula em sua forma ativa consiste em duas cadeias curtas, é sintetizada na forma de uma única cadeia, a chamada cadeia. pró-insulina. Em seguida, a parte do meio dessa cadeia é removida e os fragmentos restantes se unem, formando a molécula do hormônio ativo. As proteínas complexas são formadas somente depois que um determinado grupo químico é ligado à proteína, e essa ligação muitas vezes também requer uma enzima.Circulação metabólica. Depois de alimentar um animal com aminoácidos marcados com isótopos radioativos de carbono, nitrogênio ou hidrogênio, o rótulo é rapidamente incorporado às suas proteínas. Se os aminoácidos marcados deixarem de entrar no corpo, a quantidade de marcadores nas proteínas começará a diminuir. Esses experimentos mostram que as proteínas resultantes não são armazenadas no corpo até o final da vida. Todos eles, com algumas exceções, estão em um estado dinâmico, constantemente se decompondo em aminoácidos e depois ressintetizados.Algumas proteínas se decompõem quando as células morrem e são destruídas. Isso acontece o tempo todo, por exemplo, com glóbulos vermelhos e células epiteliais que revestem a superfície interna do intestino. Além disso, a quebra e a ressíntese de proteínas também ocorrem em células vivas. Curiosamente, sabe-se menos sobre a quebra de proteínas do que sobre sua síntese. O que está claro, no entanto, é que enzimas proteolíticas estão envolvidas na quebra, semelhantes àquelas que quebram proteínas em aminoácidos no trato digestivo.
A meia-vida de diferentes proteínas é diferente - de várias horas a muitos meses. A única exceção são as moléculas de colágeno. Uma vez formados, eles permanecem estáveis e não são renovados ou substituídos. Com o tempo, no entanto, algumas de suas propriedades, em particular a elasticidade, mudam e, como não são renovadas, certas alterações relacionadas à idade, como o aparecimento de rugas na pele, são resultado disso.
proteínas sintéticas. Os químicos há muito aprenderam a polimerizar aminoácidos, mas os aminoácidos são combinados aleatoriamente, de modo que os produtos dessa polimerização têm pouca semelhança com os naturais. É verdade que é possível combinar aminoácidos em uma determinada ordem, o que permite obter algumas proteínas biologicamente ativas, em particular a insulina. O processo é bastante complicado, e desta forma é possível obter apenas aquelas proteínas cujas moléculas contêm cerca de cem aminoácidos. É preferível sintetizar ou isolar a sequência de nucleótidos de um gene correspondente à sequência de aminoácidos desejada e depois introduzir este gene numa bactéria, que produzirá por replicação uma grande quantidade do produto desejado. Este método, no entanto, também tem suas desvantagens. Cm . Veja também ENGENHARIA GENÉTICA. PROTEÍNAS E NUTRIÇÃO Quando as proteínas do corpo são decompostas em aminoácidos, esses aminoácidos podem ser reutilizados para a síntese de proteínas. Ao mesmo tempo, os próprios aminoácidos estão sujeitos à decomposição, de modo que não são totalmente utilizados. Também está claro que durante o crescimento, gravidez e cicatrização de feridas, a síntese de proteínas deve exceder a degradação. O corpo perde continuamente algumas proteínas; estas são as proteínas do cabelo, unhas e a camada superficial da pele. Portanto, para a síntese de proteínas, cada organismo deve receber aminoácidos dos alimentos. As plantas verdes são sintetizadas a partir do CO 2 , água e amônia ou nitratos são todos os 20 aminoácidos encontrados nas proteínas. Muitas bactérias também são capazes de sintetizar aminoácidos na presença de açúcar (ou algum equivalente) e nitrogênio fixado, mas o açúcar é, em última análise, fornecido pelas plantas verdes. Nos animais, a capacidade de sintetizar aminoácidos é limitada; eles obtêm aminoácidos comendo plantas verdes ou outros animais. No trato digestivo, as proteínas absorvidas são decompostas em aminoácidos, os últimos são absorvidos e as proteínas características de um determinado organismo são construídas a partir deles. Nenhuma das proteínas absorvidas é incorporada nas estruturas do corpo como tal. A única exceção é que, em muitos mamíferos, parte dos anticorpos maternos pode passar intacta pela placenta para a circulação fetal, e através do leite materno (especialmente em ruminantes) ser transferida para o recém-nascido imediatamente após o nascimento.Necessidade de proteínas. É claro que, para manter a vida, o corpo deve receber uma certa quantidade de proteína dos alimentos. No entanto, o tamanho dessa necessidade depende de uma série de fatores. O corpo precisa de alimentos tanto como fonte de energia (calorias) quanto como material para construir suas estruturas. Em primeiro lugar está a necessidade de energia. Isso significa que quando há poucos carboidratos e gorduras na dieta, as proteínas da dieta são usadas não para a síntese de suas próprias proteínas, mas como fonte de calorias. Com o jejum prolongado, até mesmo suas próprias proteínas são gastas para suprir as necessidades energéticas. Se houver carboidratos suficientes na dieta, a ingestão de proteínas pode ser reduzida.balanço de nitrogênio. Em média aprox. 16% da massa total de proteína é nitrogênio. Quando os aminoácidos que compõem as proteínas são decompostos, o nitrogênio contido neles é excretado do corpo na urina e (em menor grau) nas fezes na forma de vários compostos nitrogenados. Portanto, é conveniente usar um indicador como o balanço de nitrogênio para avaliar a qualidade da nutrição proteica, ou seja, a diferença (em gramas) entre a quantidade de nitrogênio ingerida pelo corpo e a quantidade de nitrogênio excretada por dia. Com nutrição normal em um adulto, essas quantidades são iguais. Em um organismo em crescimento, a quantidade de nitrogênio excretado é menor que a quantidade de entrada, ou seja, o saldo é positivo. Com a falta de proteína na dieta, o saldo é negativo. Se houver calorias suficientes na dieta, mas as proteínas estiverem completamente ausentes, o corpo economizará proteínas. Ao mesmo tempo, o metabolismo das proteínas diminui e a reutilização de aminoácidos na síntese de proteínas ocorre da maneira mais eficiente possível. No entanto, as perdas são inevitáveis e os compostos nitrogenados ainda são excretados na urina e parcialmente nas fezes. A quantidade de nitrogênio excretada do corpo por dia durante a falta de proteína pode servir como uma medida da falta diária de proteína. É natural supor que, introduzindo na dieta uma quantidade de proteína equivalente a essa deficiência, seja possível restabelecer o equilíbrio de nitrogênio. No entanto, não é. Tendo recebido essa quantidade de proteína, o corpo começa a usar aminoácidos com menos eficiência, portanto, é necessária alguma proteína adicional para restaurar o equilíbrio de nitrogênio.Se a quantidade de proteína na dieta exceder o necessário para manter o equilíbrio de nitrogênio, parece não haver nenhum dano com isso. O excesso de aminoácidos é simplesmente usado como fonte de energia. Um exemplo particularmente notável é o esquimó, que consome pouco carboidrato e cerca de dez vezes mais proteína do que o necessário para manter o equilíbrio de nitrogênio. Na maioria dos casos, no entanto, usar proteína como fonte de energia não é benéfico, pois você pode obter muito mais calorias de uma determinada quantidade de carboidratos do que da mesma quantidade de proteína. Nos países pobres, a população recebe as calorias necessárias dos carboidratos e consome uma quantidade mínima de proteína.
Se o corpo recebe o número necessário de calorias na forma de alimentos não proteicos, a quantidade mínima de proteína que mantém o equilíbrio de nitrogênio é de aprox. 30g por dia. Aproximadamente tanta proteína está contida em quatro fatias de pão ou 0,5 litros de leite. Uma quantidade um pouco maior é geralmente considerada ideal; recomendado de 50 a 70 g.
Aminoácidos essenciais. Até agora, a proteína foi considerada como um todo. Enquanto isso, para que a síntese de proteínas ocorra, todos os aminoácidos necessários devem estar presentes no corpo. Alguns dos aminoácidos que o próprio corpo do animal é capaz de sintetizar. Eles são chamados de intercambiáveis, pois não precisam estar presentes na dieta - é importante apenas que, em geral, a ingestão de proteína como fonte de nitrogênio seja suficiente; então, com a falta de aminoácidos não essenciais, o corpo pode sintetizá-los às custas daqueles que estão presentes em excesso. Os aminoácidos "essenciais" restantes não podem ser sintetizados e devem ser ingeridos com alimentos. Essenciais para os seres humanos são valina, leucina, isoleucina, treonina, metionina, fenilalanina, triptofano, histidina, lisina e arginina. (Embora a arginina possa ser sintetizada no corpo, ela é considerada um aminoácido essencial porque recém-nascidos e crianças em crescimento produzem quantidades insuficientes dela. Por outro lado, para uma pessoa madura, a ingestão de alguns desses aminoácidos dos alimentos pode se tornar opcional.)Esta lista de aminoácidos essenciais é aproximadamente a mesma em outros vertebrados e até mesmo em insetos. O valor nutricional das proteínas geralmente é determinado alimentando-as com ratos em crescimento e monitorando o ganho de peso dos animais.
O valor nutricional das proteínas. O valor nutricional de uma proteína é determinado pelo aminoácido essencial mais deficiente. Vamos ilustrar isso com um exemplo. As proteínas do nosso corpo contêm uma média de aprox. 2% de triptofano (em peso). Digamos que a dieta inclua 10 g de proteína contendo 1% de triptofano e que haja outros aminoácidos essenciais suficientes. No nosso caso, 10 g dessa proteína defeituosa equivale essencialmente a 5 g de uma proteína completa; os 5 g restantes servem apenas como fonte de energia. Observe que, como os aminoácidos praticamente não são armazenados no organismo e, para que a síntese de proteínas ocorra, todos os aminoácidos devem estar presentes simultaneamente, o efeito da ingestão de aminoácidos essenciais só pode ser detectado se todos entrarem no organismo. corpo ao mesmo tempo.. A composição média da maioria das proteínas animais está próxima da composição média das proteínas no corpo humano, portanto, é improvável que enfrentemos deficiência de aminoácidos se nossa dieta for rica em alimentos como carne, ovos, leite e queijo. No entanto, existem proteínas, como a gelatina (um produto da desnaturação do colágeno), que contém muito poucos aminoácidos essenciais. As proteínas vegetais, embora sejam melhores que a gelatina nesse sentido, também são pobres em aminoácidos essenciais; especialmente pouco neles lisina e triptofano. No entanto, uma dieta puramente vegetariana não é nada saudável, a menos que consuma uma quantidade um pouco maior de proteínas vegetais, suficientes para fornecer ao corpo aminoácidos essenciais. A maior parte da proteína é encontrada nas plantas nas sementes, especialmente nas sementes de trigo e várias leguminosas. Brotos jovens, como aspargos, também são ricos em proteínas.Proteínas sintéticas na dieta. Ao adicionar pequenas quantidades de aminoácidos essenciais sintéticos ou proteínas ricas neles a proteínas incompletas, como proteínas de milho, pode-se aumentar significativamente o valor nutricional deste último, ou seja, aumentando assim a quantidade de proteína consumida. Outra possibilidade é cultivar bactérias ou leveduras em hidrocarbonetos de petróleo com a adição de nitratos ou amônia como fonte de nitrogênio. A proteína microbiana obtida desta forma pode servir como ração para aves ou gado, ou pode ser consumida diretamente por humanos. O terceiro método, amplamente utilizado, utiliza a fisiologia dos ruminantes. Em ruminantes, na seção inicial do estômago, o chamado. No rúmen, existem formas especiais de bactérias e protozoários que convertem proteínas vegetais defeituosas em proteínas microbianas mais completas, e estas, por sua vez, após digestão e absorção, transformam-se em proteínas animais. A ureia, um composto sintético barato contendo nitrogênio, pode ser adicionada à alimentação do gado. Microrganismos que vivem no rúmen usam nitrogênio ureico para converter carboidratos (dos quais há muito mais na ração) em proteína. Cerca de um terço de todo o nitrogênio na alimentação do gado pode vir na forma de uréia, o que em essência significa, até certo ponto, síntese química de proteínas. Nos EUA, este método desempenha um papel importante como uma das formas de obtenção de proteína.LITERATURA Murray R, Grenner D, Meyes P, Rodwell W. bioquímica humana, t. 1–2. M., 1993Alberts B., Bray D., Lewis J. et ai. Biologia molecular da célula, t. 1–3. M., 1994
Bilhete 2. 1. Fatores nutricionais essenciais de natureza lipídica. Alguns lipídios não são sintetizados no corpo humano e, portanto, são fatores nutricionais indispensáveis. Estes incluem ácidos graxos com duas ou mais ligações duplas (polieno) - ácidos graxos essenciais. Alguns desses ácidos são substratos para a síntese de hormônios locais - eicosanóides (tópico 8.10).
Vitaminas lipossolúveis executar várias funções: vitamina A participa do processo de visão, bem como do crescimento e diferenciação das células; sua capacidade de inibir o crescimento de certos tipos de tumores foi comprovada; vitamina K participa da coagulação do sangue; vitamina D participa na regulação do metabolismo do cálcio; vitamina E- antioxidante, inibe a formação de radicais livres e assim neutraliza os danos celulares resultantes da peroxidação lipídica.
Documento
2. Estrutura e níveis de organização estrutural das proteínas
Existem quatro níveis de organização estrutural das proteínas: primário, secundário, terciário e quaternário. Cada nível tem suas próprias características.
Estrutura primária de uma proteína
A estrutura primária das proteínas é uma cadeia polipeptídica linear de aminoácidos ligados por ligações peptídicas. A estrutura primária é o nível mais simples de organização estrutural de uma molécula de proteína. A alta estabilidade é dada a ele por ligações peptídicas covalentes entre o grupo α-amino de um aminoácido e o grupo α-carboxil de outro aminoácido. [exposição].
Se o grupo imino de prolina ou hidroxiprolina está envolvido na formação de uma ligação peptídica, então ele tem uma forma diferente [exposição].
Quando as ligações peptídicas são formadas nas células, o grupo carboxila de um aminoácido é ativado primeiro e depois se combina com o grupo amino de outro. Aproximadamente o mesmo se executa a síntese de laboratório de polipeptídeos.
Uma ligação peptídica é um fragmento repetido de uma cadeia polipeptídica. Possui várias características que afetam não apenas a forma da estrutura primária, mas também os mais altos níveis de organização da cadeia polipeptídica:

coplanaridade - todos os átomos do grupo peptídico estão no mesmo plano;
a capacidade de existir em duas formas ressonantes (forma ceto ou enol);
a posição trans dos substituintes em relação à ligação C-N;
a capacidade de formar ligações de hidrogênio, e cada um dos grupos peptídicos pode formar duas ligações de hidrogênio com outros grupos, incluindo os peptídicos.
A exceção são os grupos peptídicos com a participação do grupo amino da prolina ou hidroxiprolina. Eles são capazes de formar apenas uma ligação de hidrogênio (veja acima). Isso afeta a formação da estrutura secundária da proteína. A cadeia polipeptídica no local onde a prolina ou hidroxiprolina está localizada é facilmente dobrada, pois não é mantida, como de costume, por uma segunda ligação de hidrogênio.
Nomenclatura de peptídeos e polipeptídeos. O nome dos peptídeos é formado a partir dos nomes de seus aminoácidos constituintes. Dois aminoácidos formam um dipeptídeo, três um tripeptídeo, quatro um tetrapeptídeo, etc. Cada peptídeo ou cadeia polipeptídica de qualquer comprimento tem um aminoácido N-terminal contendo um grupo amino livre e um aminoácido C-terminal contendo um grupo carboxila livre. Ao nomear polipeptídeos, todos os aminoácidos são listados sequencialmente, começando pelo N-terminal, substituindo em seus nomes, exceto para o C-terminal, o sufixo -in a -il (uma vez que os aminoácidos nos peptídeos não têm mais um grupo carboxil, mas uma carbonila). Por exemplo, o nome mostrado na Fig. 1 tripeptídeo - leuco lodo fenilalano lodo treon dentro.
Características da estrutura primária da proteína. Na espinha dorsal da cadeia polipeptídica, estruturas rígidas (grupos peptídicos planos) alternam-se com regiões relativamente móveis (-CHR) que são capazes de girar em torno das ligações. Tais características da estrutura da cadeia polipeptídica afetam seu empacotamento no espaço.
Estrutura secundária de uma proteína
A estrutura secundária é uma maneira de colocar a cadeia polipeptídica em uma estrutura ordenada devido à formação de ligações de hidrogênio entre os grupos peptídicos de uma cadeia ou cadeias polipeptídicas adjacentes. Por configuração, as estruturas secundárias são divididas em helicoidais (α-hélice) e dobradas em camadas (estrutura β e forma β cruzada).


α-Hélice. Este é um tipo de estrutura secundária de proteína que tem a forma de uma hélice regular formada devido a ligações de hidrogênio interpeptídicas dentro de uma única cadeia polipeptídica. O modelo de estrutura α-hélice (Fig. 2), que leva em conta todas as propriedades da ligação peptídica, foi proposto por Pauling e Corey. As principais características da α-hélice:
configuração helicoidal da cadeia polipeptídica com simetria helicoidal;
a formação de ligações de hidrogênio entre os grupos peptídicos de cada um dos primeiro e quarto resíduos de aminoácidos;
a regularidade das voltas da espiral;
a equivalência de todos os resíduos de aminoácidos na α-hélice, independentemente da estrutura de seus radicais laterais;
radicais laterais de aminoácidos não participam da formação da α-hélice.
Externamente, a α-hélice parece uma hélice ligeiramente esticada de um fogão elétrico. A regularidade das ligações de hidrogênio entre o primeiro e o quarto grupo peptídico também determina a regularidade das voltas da cadeia polipeptídica. A altura de uma volta, ou o passo da α-hélice, é 0,54 nm; inclui 3,6 resíduos de aminoácidos, ou seja, cada resíduo de aminoácido se move ao longo do eixo (a altura de um resíduo de aminoácido) em 0,15 nm (0,54:3,6 = 0,15 nm), o que nos permite falar sobre a equivalência de todos os aminoácidos resíduos na α-hélice. O período de regularidade da α-hélice é de 5 voltas ou 18 resíduos de aminoácidos; o comprimento de um período é de 2,7 nm. Arroz. 3. Modelo de α-hélice de Pauling-Corey
β-Estrutura. Este é um tipo de estrutura secundária que tem uma configuração ligeiramente curva da cadeia polipeptídica e é formada usando ligações de hidrogênio interpeptídicas dentro de seções individuais de uma cadeia polipeptídica ou cadeias polipeptídicas adjacentes. Também é chamada de estrutura dobrada em camadas. Existem variedades de estruturas β. As regiões em camadas limitadas formadas por uma cadeia polipeptídica de uma proteína são chamadas de forma β cruzada (estrutura β curta). As ligações de hidrogênio na forma β cruzada são formadas entre os grupos peptídicos das alças da cadeia polipeptídica. Outro tipo, a estrutura β completa, é característica de toda a cadeia polipeptídica, que tem uma forma alongada e é mantida por pontes de hidrogênio interpeptídicas entre cadeias polipeptídicas paralelas adjacentes (Fig. 3). Essa estrutura lembra o fole sanfonado. Além disso, são possíveis variantes de estruturas β: elas podem ser formadas por cadeias paralelas (os N-terminais das cadeias polipeptídicas são direcionados na mesma direção) e antiparalelos (os N-terminais são direcionados em direções diferentes). Os radicais laterais de uma camada são colocados entre os radicais laterais de outra camada.
Nas proteínas, as transições de estruturas α para estruturas β e vice-versa são possíveis devido ao rearranjo das ligações de hidrogênio. Em vez de ligações de hidrogênio interpeptídicas regulares ao longo da cadeia (devido a elas, a cadeia polipeptídica é torcida em espiral), as seções espiraladas são destorcidas e as ligações de hidrogênio são fechadas entre os fragmentos alongados das cadeias polipeptídicas. Essa transição é encontrada na queratina, uma proteína do cabelo. Ao lavar o cabelo com detergentes alcalinos, a estrutura helicoidal da β-queratina é facilmente destruída e passa para a α-queratina (alisamento de cabelos cacheados).
A destruição das estruturas secundárias regulares das proteínas (α-hélices e estruturas β), por analogia com a fusão de um cristal, é chamada de "fusão" de polipeptídeos. Nesse caso, as ligações de hidrogênio são quebradas e as cadeias polipeptídicas assumem a forma de uma bobina aleatória. Portanto, a estabilidade das estruturas secundárias é determinada por ligações de hidrogênio interpeptídicas. Outros tipos de ligações quase não participam disso, com exceção das ligações dissulfeto ao longo da cadeia polipeptídica nos locais dos resíduos de cisteína. Peptídeos curtos devido a ligações dissulfeto são fechados em ciclos. Muitas proteínas têm simultaneamente regiões α-helicoidais e estruturas β. Quase não há proteínas naturais consistindo em 100% de α-hélice (a exceção é a paramiosina, uma proteína muscular que é 96-100% de α-hélice), enquanto os polipeptídeos sintéticos têm 100% de hélice.
Outras proteínas têm um grau desigual de helicidade. Uma alta frequência de estruturas α-helicoidal é observada na paramiosina, mioglobina e hemoglobina. Pelo contrário, na tripsina, ribonuclease, uma parte significativa da cadeia polipeptídica se encaixa em estruturas β em camadas. Proteínas dos tecidos de suporte: queratina (proteína do cabelo, lã), colágeno (proteína do tendão, pele), fibroína (proteína da seda natural) têm uma configuração β de cadeias polipeptídicas. O diferente grau de helicização das cadeias polipeptídicas das proteínas indica que, obviamente, existem forças que interrompem parcialmente a helixização ou “quebram” o enovelamento regular da cadeia polipeptídica. A razão para isso é o empacotamento mais compacto da cadeia polipeptídica da proteína em um determinado volume, ou seja, na estrutura terciária.
Estrutura terciária de uma proteína
A estrutura terciária de uma proteína é a maneira pela qual uma cadeia polipeptídica é dobrada no espaço. De acordo com a forma da estrutura terciária, as proteínas são divididas principalmente em globulares e fibrilares. As proteínas globulares geralmente têm uma forma elíptica, e as proteínas fibrilares (filamentosas) são alongadas (a forma de uma haste, fuso).
No entanto, a configuração da estrutura terciária das proteínas ainda não permite pensar que as proteínas fibrilares tenham apenas uma estrutura β, e as globulares α-helicoidais. Existem proteínas fibrilares que têm uma estrutura secundária helicoidal em vez de dobrada em camadas. Por exemplo, α-queratina e paramiosina (proteína do músculo obturador do molusco), tropomiosinas (proteínas do músculo esquelético) são proteínas fibrilares (têm uma forma em forma de bastonete) e sua estrutura secundária é uma α-hélice; pelo contrário, as proteínas globulares podem conter um grande número de estruturas β.
A espiralização de uma cadeia polipeptídica linear reduz seu tamanho em cerca de 4 vezes; e o empacotamento em uma estrutura terciária a torna dezenas de vezes mais compacta que a cadeia original.
Ligações que estabilizam a estrutura terciária de uma proteína. Na estabilização da estrutura terciária, as ligações entre os radicais laterais dos aminoácidos desempenham um papel. Essas conexões podem ser divididas em:
forte (covalente) [exposição].
fraco (polar e van der Waals) [exposição].
Numerosas ligações entre os radicais laterais dos aminoácidos determinam a configuração espacial da molécula de proteína.
Características da organização da estrutura terciária da proteína. A conformação da estrutura terciária da cadeia polipeptídica é determinada pelas propriedades dos radicais laterais de seus aminoácidos constituintes (que não têm um efeito perceptível na formação de estruturas primárias e secundárias) e o microambiente, ou seja, o ambiente. Quando dobrada, a cadeia polipeptídica de uma proteína tende a assumir uma forma energeticamente favorável, caracterizada por um mínimo de energia livre. Portanto, os grupos R não polares, "evitando" a água, formam, por assim dizer, a parte interna da estrutura terciária da proteína, onde está localizada a parte principal dos resíduos hidrofóbicos da cadeia polipeptídica. Quase não há moléculas de água no centro do glóbulo de proteína. Os grupos R polares (hidrofílicos) do aminoácido estão localizados fora desse núcleo hidrofóbico e são cercados por moléculas de água. A cadeia polipeptídica se curva bizarramente no espaço tridimensional. Quando é dobrado, a conformação helicoidal secundária é quebrada. A cadeia "quebra" nos pontos fracos onde se localizam a prolina ou a hidroxiprolina, pois esses aminoácidos são mais móveis na cadeia, formando apenas uma ligação de hidrogênio com outros grupos peptídicos. Outro lugar da curva é a glicina, cujo grupo R é pequeno (hidrogênio). Portanto, os grupos R de outros aminoácidos, quando empilhados, tendem a ocupar o espaço livre no local da glicina. Uma série de aminoácidos - alanina, leucina, glutamato, histidina - contribuem para a preservação de estruturas helicoidais estáveis na proteína e, como metionina, valina, isoleucina, ácido aspártico, favorecem a formação de estruturas β. Em uma molécula de proteína com configuração terciária, existem seções na forma de α-hélices (espiralizadas), estruturas β (em camadas) e uma bobina aleatória. Somente o dobramento espacial correto de uma proteína a torna ativa; a violação leva a uma mudança nas propriedades da proteína e à perda de atividade biológica.
Estrutura da proteína quaternária
As proteínas que consistem em uma única cadeia polipeptídica têm apenas uma estrutura terciária. Estes incluem a mioglobina, uma proteína do tecido muscular envolvida na ligação do oxigênio, uma série de enzimas (lisozima, pepsina, tripsina, etc.). No entanto, algumas proteínas são construídas a partir de várias cadeias polipeptídicas, cada uma com uma estrutura terciária. Para essas proteínas, foi introduzido o conceito de estrutura quaternária, que é a organização de várias cadeias polipeptídicas com estrutura terciária em uma única molécula de proteína funcional. Essa proteína com estrutura quaternária é chamada de oligômero, e suas cadeias polipeptídicas com estrutura terciária são chamadas de protômeros ou subunidades (Fig. 4).

No nível quaternário de organização, as proteínas retêm a configuração básica da estrutura terciária (globular ou fibrilar). Por exemplo, a hemoglobina é uma proteína que tem uma estrutura quaternária e consiste em quatro subunidades. Cada uma das subunidades é uma proteína globular e, em geral, a hemoglobina também tem uma configuração globular. Proteínas de cabelo e lã - queratinas, relacionadas em estrutura terciária às proteínas fibrilares, possuem uma conformação fibrilar e uma estrutura quaternária.
Estabilização da estrutura quaternária de proteínas. Todas as proteínas com estrutura quaternária foram isoladas como macromoléculas individuais que não se decompõem em subunidades. Os contatos entre as superfícies das subunidades só são possíveis devido aos grupos polares dos resíduos de aminoácidos, uma vez que durante a formação da estrutura terciária de cada uma das cadeias polipeptídicas, os radicais laterais dos aminoácidos apolares (que constituem a maioria de todos os aminoácidos proteinogênicos aminoácidos) estão escondidos dentro da subunidade. Numerosas ligações iônicas (sal), hidrogênio e, em alguns casos, dissulfeto são formadas entre seus grupos polares, que mantêm firmemente as subunidades na forma de um complexo organizado. O uso de substâncias que quebram ligações de hidrogênio, ou substâncias que restauram pontes dissulfeto, provoca desagregação de protômeros e destruição da estrutura quaternária da proteína. Na tabela. 1 resume dados sobre ligações que estabilizam diferentes níveis de organização de uma molécula de proteína [exposição].
Características da organização estrutural de algumas proteínas fibrilares
A organização estrutural das proteínas fibrilares tem várias características em comparação com as proteínas globulares. Essas características podem ser rastreadas no exemplo da queratina, fibroína e colágeno. As queratinas existem nas conformações α e β. As α-queratinas e a fibroína têm uma estrutura secundária dobrada em camadas, no entanto, na queratina, as cadeias são paralelas e na fibroína são antiparalelas (ver Fig. 3); além disso, as ligações dissulfeto intercadeias estão presentes na queratina, enquanto estão ausentes na fibroína. A quebra das ligações dissulfeto leva à separação das cadeias polipeptídicas nas queratinas. Pelo contrário, a formação do número máximo de ligações dissulfeto nas queratinas pela ação de agentes oxidantes cria uma forte estrutura espacial. Em geral, em proteínas fibrilares, em contraste com proteínas globulares, às vezes é difícil distinguir estritamente entre diferentes níveis de organização. Se aceitarmos (como para uma proteína globular) que a estrutura terciária deve ser formada empilhando uma cadeia polipeptídica no espaço, e a estrutura quaternária deve ser formada por várias cadeias, então em proteínas fibrilares várias cadeias polipeptídicas já estão envolvidas na formação de a estrutura secundária. Um exemplo típico de proteína fibrilar é o colágeno, que é uma das proteínas mais abundantes no corpo humano (cerca de 1/3 da massa de todas as proteínas). É encontrado em tecidos de alta resistência e baixa extensibilidade (ossos, tendões, pele, dentes, etc.). No colágeno, um terço dos resíduos de aminoácidos são glicina e cerca de um quarto ou um pouco mais são prolina ou hidroxiprolina.

Uma cadeia polipeptídica de colágeno isolada (estrutura primária) parece uma linha quebrada. Contém cerca de 1000 aminoácidos e tem um peso molecular de cerca de 105 (Fig. 5, a, b). A cadeia polipeptídica é construída a partir de uma trinca repetida de aminoácidos (tripla) da seguinte composição: gly-A-B, onde A e B são quaisquer aminoácidos exceto glicina (mais frequentemente prolina e hidroxiprolina). Cadeias polipeptídicas de colágeno (ou cadeias α) durante a formação de estruturas secundárias e terciárias (Fig. 5, ced) não podem formar α-hélices típicas com simetria helicoidal. Isso é evitado pela prolina, hidroxiprolina e glicina (aminoácidos anti-helicoidal). Portanto, três cadeias α formam, por assim dizer, espirais torcidas, como três fios enrolados em torno de um cilindro. Três cadeias α helicoidais formam uma estrutura de colágeno repetida chamada tropocolágeno (Fig. 5d). O tropocolágeno em sua organização é a estrutura terciária do colágeno. Anéis planos de prolina e hidroxiprolina, alternando-se regularmente ao longo da cadeia, conferem rigidez, assim como as ligações intercadeias entre as cadeias α do tropocolágeno (portanto, o colágeno é resistente ao estiramento). O tropocolágeno é essencialmente uma subunidade das fibrilas de colágeno. As subunidades de tropocolágeno são empilhadas na estrutura quaternária do colágeno de forma gradual (Fig. 5e).
A estabilização das estruturas de colágeno ocorre devido ao hidrogênio intercadeias, ligações iônicas e van der Waals e uma pequena quantidade de ligações covalentes.
As cadeias α do colágeno têm diferentes estruturas químicas. Existem cadeias α 1 de diferentes tipos (I, II, III, IV) e cadeias α 2 . Dependendo de quais cadeias α 1 - e α 2 - estão envolvidas na formação da hélice de três fitas do tropocolágeno, quatro tipos de colágeno são distinguidos:
o primeiro tipo - duas cadeias α 1 (I) e uma α 2;
o segundo tipo - três cadeias α 1 (II);
o terceiro tipo - três cadeias α1(III);
o quarto tipo - três cadeias α 1 (IV).
O colágeno mais comum do primeiro tipo: é encontrado no tecido ósseo, pele, tendões; o colágeno tipo 2 é encontrado na cartilagem, e assim por diante, podendo haver diferentes tipos de colágeno no mesmo tipo de tecido.
A agregação ordenada de estruturas de colágeno, sua rigidez e inércia proporcionam alta resistência às fibras de colágeno. As proteínas de colágeno também contêm componentes de carboidratos, ou seja, são complexos proteína-carboidratos.
O colágeno é uma proteína extracelular que é formada pelas células do tecido conjuntivo que faz parte de todos os órgãos. Portanto, com danos ao colágeno (ou violação de sua formação), ocorrem várias violações das funções de suporte do tecido conjuntivo dos órgãos.
A cadeia polipeptídica alfa termina com a combinação de aminoácidos valina-leucina, e a cadeia polipeptídica beta termina com a combinação valina-histidina-leucina. As cadeias de polipeptídeos alfa e beta na molécula de hemoglobina não são colocadas linearmente, esta é a estrutura primária. Devido à existência de forças intramoleculares, as cadeias polipeptídicas torcem-se na forma de uma hélice alfa-hélice típica das proteínas (estrutura secundária). A própria hélice alfa-hélice para cada cadeia de polipeptídeos alfa e beta envolve-se espacialmente, formando plexos em forma de ovoide (estrutura terciária). As partes individuais das hélices alfa-hélice das cadeias polipeptídicas são marcadas em letras latinas de A a H. Todas as quatro cadeias polipeptídicas alfa e beta dobradas terciárias estão localizadas espacialmente em uma certa proporção - uma estrutura quaternária. Eles estão conectados uns aos outros não por ligações químicas reais, mas por forças intermoleculares.
Descobriu-se que uma pessoa tem três tipos principais de hemoglobina normal: embrionária - U, fetal - F e hemoglobina adulta - A. HbU (nomeado após a letra inicial da palavra útero) ocorre no embrião entre 7 e 12 semanas de vida , então desaparece e aparece a hemoglobina fetal, que após o terceiro mês é a principal hemoglobina fetal. Isto é seguido por hemoglobina adulta normal gradual, chamada HbA, após a letra inicial da palavra inglesa "adulto". A quantidade de hemoglobina fetal diminui gradualmente de modo que no momento do nascimento 80% da hemoglobina é HbA e apenas 20% é HbF. Após o nascimento, a hemoglobina fetal continua a diminuir e aos 2-3 anos é de apenas 1-2%. A mesma quantidade de hemoglobina fetal em um adulto. A quantidade de HbF superior a 2% é considerada patológica para um adulto e para crianças com mais de 3 anos.
Além dos tipos normais de hemoglobina, mais de 50 de suas variantes patológicas são atualmente conhecidas. Eles foram nomeados pela primeira vez em letras latinas. A letra B está ausente nas designações dos tipos de hemoglobina, uma vez que originalmente designava HbS.
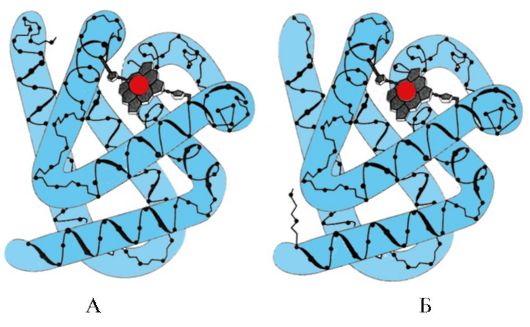
Hemoglobina (Hb)- uma cromoproteína presente nos eritrócitos e envolvida no transporte de oxigênio para os tecidos. A hemoglobina adulta é chamada de hemoglobina A (HbA). Seu peso molecular é de cerca de 65.000 Da. A molécula de Hb A tem uma estrutura quaternária e inclui quatro subunidades - cadeias polipeptídicas (denotadas α1, α2, β1 e β2), cada uma das quais está associada a um heme.
Lembre-se que a hemoglobina é uma proteína alostérica, suas moléculas podem mudar reversivelmente de uma conformação para outra. Isso altera a afinidade da proteína por ligantes. A conformação com a menor afinidade para o ligante é chamada de conformação tensa ou T. A conformação com maior afinidade pelo ligante é chamada de conformação relaxada ou R.
As conformações R e T da molécula de hemoglobina estão em um estado de equilíbrio dinâmico:
Vários fatores ambientais podem mudar esse equilíbrio em uma direção ou outra. Os reguladores alostéricos que afetam a afinidade da Hb pelo O2 são: 1) oxigênio; 2) concentração de H+ (pH do meio); 3) dióxido de carbono (CO2); 4) 2,3-difosfoglicerato (DPG). A ligação de uma molécula de oxigênio a uma das subunidades de hemoglobina promove a transição de uma conformação tensa para uma relaxada e aumenta a afinidade pelo oxigênio de outras subunidades da mesma molécula de hemoglobina. Esse fenômeno é chamado de efeito cooperativo. A natureza complexa da ligação da hemoglobina ao oxigênio é refletida na curva de saturação da hemoglobina O2, que tem a forma de S (Figura 3.1).

Figura 3.1. Curvas de saturação de mioglobina (1) e hemoglobina (2) com oxigênio.
Formas moleculares hemoglobina diferem entre si na estrutura das cadeias polipeptídicas. Um exemplo de tal variedade de hemoglobina que existe sob condições fisiológicas é hemoglobina fetal (HbF), presente no sangue na fase embrionária do desenvolvimento humano. Ao contrário da HbA, sua molécula contém 2 cadeias α e 2 γ (ou seja, as cadeias β são substituídas por cadeias γ). Essa hemoglobina tem uma afinidade maior pelo oxigênio. É isso que permite que o embrião receba oxigênio do sangue da mãe através da placenta. Logo após o nascimento, a HbF no sangue do bebê é substituída pela HbA.
Como exemplo de hemoglobina anormal ou patológica, podemos citar a já mencionada (ver 2.4.) hemoglobina S, encontrada em pacientes com anemia falciforme. Como você já sabe, difere da hemoglobina A por substituir o glutamato por valina nas cadeias β. Essa substituição de aminoácidos causa uma diminuição na solubilidade da HbS em água e uma diminuição na sua afinidade pelo O2.
1. Por que as proteínas são consideradas polímeros?
Responda. Proteínas são polímeros, ou seja, moléculas construídas como cadeias a partir de unidades monómeras repetidas, ou subunidades, consistindo de aminoácidos conectados em uma determinada sequência por uma ligação peptídica. Eles são os componentes básicos e necessários de todos os organismos.
Existem proteínas simples (proteínas) e proteínas complexas (proteínas). Proteínas são proteínas cujas moléculas contêm apenas componentes proteicos. Com sua hidrólise completa, os aminoácidos são formados.
As proteínas são chamadas de proteínas complexas, cujas moléculas diferem significativamente das moléculas de proteína, pois, além do próprio componente proteico, contêm um componente de baixo peso molecular de natureza não proteica.
2. Que funções das proteínas você conhece?
Responda. As proteínas desempenham as seguintes funções: construtora, energética, catalítica, protetora, transportadora, contrátil, sinalizadora, entre outras.
Perguntas após § 11
1. Quais substâncias são chamadas de proteínas?
Responda. Proteínas, ou proteínas, são polímeros biológicos cujos monômeros são aminoácidos. Todos os aminoácidos têm um grupo amino (-NH2) e um grupo carboxila (-COOH) e diferem na estrutura e propriedades dos radicais. Os aminoácidos estão ligados entre si por ligações peptídicas, de modo que as proteínas também são chamadas de polipeptídeos.
Responda. As moléculas de proteína podem assumir várias formas espaciais - conformações, que representam quatro níveis de sua organização. A sequência linear de aminoácidos na composição da cadeia polipeptídica representa a estrutura primária da proteína. É único para qualquer proteína e determina sua forma, propriedades e funções.
3. Como são formadas as estruturas proteicas secundárias, terciárias e quaternárias?
Responda. A estrutura secundária de uma proteína é formada pela formação de ligações de hidrogênio entre os grupos -CO- e -NH-. Neste caso, a cadeia polipeptídica é torcida em espiral. A hélice pode adquirir a configuração de um glóbulo, uma vez que surgem várias ligações entre os radicais de aminoácidos na hélice. Glóbulo é a estrutura terciária de uma proteína. Se vários glóbulos são combinados em um único complexo complexo, surge uma estrutura quaternária. Por exemplo, a hemoglobina do sangue humano é formada por quatro glóbulos.
4. O que é desnaturação de proteínas?
Responda. A violação da estrutura natural da proteína é chamada de desnaturação. Sob a influência de vários fatores (químicos, radioativos, temperatura, etc.), as estruturas quaternárias, terciárias e secundárias da proteína podem ser destruídas. Se a ação do fator parar, a proteína pode restaurar sua estrutura. Se a ação do fator aumenta, a estrutura primária da proteína, a cadeia polipeptídica, também é destruída. Este já é um processo irreversível - a proteína não pode restaurar a estrutura
5. Com base em que as proteínas são divididas em simples e complexas?
Responda. As proteínas simples são compostas exclusivamente de aminoácidos. As proteínas complexas podem incluir outras substâncias orgânicas: carboidratos (então são chamados de glicoproteínas), gorduras (lipoproteínas), ácidos nucléicos (nucleoproteínas).
6. Que funções das proteínas você conhece?
Responda. Função de construção (plástico). As proteínas são um componente estrutural das membranas biológicas e organelas celulares, e também fazem parte das estruturas de suporte do corpo, cabelos, unhas, vasos sanguíneos. função enzimática. As proteínas servem como enzimas, ou seja, catalisadores biológicos que aceleram a taxa de reações bioquímicas em dezenas e centenas de milhões de vezes. Um exemplo é a amilase, que decompõe o amido em monossacarídeos. Função contrátil (motora). É realizado por proteínas contráteis especiais que garantem o movimento das células e estruturas intracelulares. Graças a eles, os cromossomos se movem durante a divisão celular, e os flagelos e os cílios colocam as células dos protozoários em movimento. As propriedades contráteis das proteínas actina e miosina são a base da função muscular. função de transporte. As proteínas estão envolvidas no transporte de moléculas e íons dentro do corpo (a hemoglobina transporta oxigênio dos pulmões para os órgãos e tecidos, a albumina sérica está envolvida no transporte de ácidos graxos). função protetora. Consiste em proteger o corpo de danos e invasão de proteínas e bactérias estranhas. As proteínas de anticorpos produzidas pelos linfócitos criam a defesa do corpo contra infecções estranhas, a trombina e a fibrina estão envolvidas na formação de um coágulo sanguíneo, ajudando assim o corpo a evitar grandes perdas de sangue. função reguladora. É realizado por proteínas hormonais. Eles estão envolvidos na regulação da atividade celular e todos os processos vitais do corpo. Assim, a insulina regula o açúcar no sangue e o mantém em um determinado nível. Função de sinal. As proteínas embutidas na membrana celular são capazes de alterar sua estrutura em resposta à irritação. Assim, os sinais são transmitidos do ambiente externo para a célula. Função de energia. É extremamente raro em proteínas. Com a quebra completa de 1 g de proteína, 17,6 kJ de energia podem ser liberados. No entanto, as proteínas são um composto muito valioso para o corpo. Portanto, a clivagem de proteínas geralmente ocorre em aminoácidos, a partir dos quais novas cadeias polipeptídicas são construídas. Os hormônios proteicos regulam a atividade da célula e todos os processos vitais do corpo. Assim, no corpo humano, a somatotropina está envolvida na regulação do crescimento corporal, a insulina mantém um nível constante de glicose no sangue.
7. Qual é o papel das proteínas hormonais?
Responda. A função reguladora é inerente às proteínas hormonais (reguladores). Eles regulam vários processos fisiológicos. Por exemplo, o hormônio mais conhecido é a insulina, que regula os níveis de glicose no sangue. Com a falta de insulina no organismo, ocorre uma doença conhecida como diabetes mellitus.
8. Qual é a função das proteínas enzimáticas?
Responda. As enzimas são catalisadores biológicos, ou seja, aceleradores de reações químicas centenas de milhões de vezes. As enzimas têm especificidade estrita em relação à substância que reage. Cada reação é catalisada por sua própria enzima.
9. Por que as proteínas raramente são usadas como fonte de energia?
Responda. Os monômeros de proteínas de aminoácidos são uma matéria-prima valiosa para a construção de novas moléculas de proteínas. Portanto, a clivagem completa de polipeptídeos em substâncias inorgânicas é rara. Consequentemente, a função de energia, que consiste na liberação de energia durante a divisão completa, é realizada por proteínas muito raramente.
A clara de ovo é uma proteína típica. Descubra o que acontecerá com ele se for exposto a água, álcool, acetona, ácido, álcali, óleo vegetal, alta temperatura, etc.
Responda. Como resultado da ação da alta temperatura sobre a proteína do ovo, ocorrerá a desnaturação da proteína. Sob a ação de álcool, acetona, ácidos ou álcalis, acontece aproximadamente a mesma coisa: a proteína se dobra. Este é um processo em que há uma violação da estrutura terciária e quaternária da proteína devido à quebra de ligações de hidrogênio e iônicas.
Na água e no óleo vegetal, a proteína mantém sua estrutura.
Moa um tubérculo de batata crua para uma polpa. Pegue três tubos de ensaio e coloque uma pequena quantidade de batatas picadas em cada um.
Coloque o primeiro tubo de ensaio no freezer da geladeira, o segundo - na prateleira inferior da geladeira e o terceiro - em uma jarra de água morna (t = 40 °C). Após 30 minutos, retire os tubos de ensaio e coloque uma pequena quantidade de peróxido de hidrogênio em cada um. Observe o que acontecerá em cada tubo de ensaio. Explique seus resultados
Responda. Este experimento ilustra a atividade da enzima catalase de células vivas no peróxido de hidrogênio. Como resultado da reação, o oxigênio é liberado. A dinâmica da secreção da vesícula pode ser usada para avaliar a atividade da enzima.
A experiência permitiu-nos corrigir os seguintes resultados:
A atividade da catalase depende da temperatura:
1. Tubo de ensaio 1: não há bolhas - isso ocorre porque as células da batata foram destruídas em baixa temperatura.
2. Tubo 2: uma pequena quantidade de bolhas - porque a atividade da enzima em baixa temperatura é baixa.
3. Tubo 3: muitas bolhas, a temperatura é ótima, a catalase é muito ativa.
Coloque algumas gotas de água no primeiro tubo de ensaio com batatas, algumas gotas de ácido (vinagre de mesa) no segundo e alcalino no terceiro.
Observe o que acontecerá em cada tubo de ensaio. Explique seus resultados. Tire suas próprias conclusões.
Responda. Ao adicionar água, nada acontece, ao adicionar ácido, ocorre algum escurecimento, ao adicionar álcali, "espuma" - hidrólise alcalina.
Pequena descrição:
Um fragmento do livro didático: Química biológica com exercícios e tarefas: livro didático / ed. membro correspondente RAMN S.E. Severino. M.: GEOTAR-Media, 2011. - 624 p.: il. MÓDULO 1: ESTRUTURA, PROPRIEDADES E FUNÇÕES DAS PROTEÍNAS
MÓDULO 1: ESTRUTURA, PROPRIEDADES E FUNÇÕES DAS PROTEÍNAS
Estrutura do módulo | Temas |
Unidade modular 1 | 1.1. Organização estrutural das proteínas. Estágios de formação da conformação nativa de proteínas 1.2. Fundamentos do funcionamento das proteínas. Drogas como ligantes que afetam a função da proteína 1.3. Desnaturação de Proteínas e a Possibilidade de Sua Reativação Espontânea |
Unidade modular 2 | 1.4. Características da estrutura e funcionamento das proteínas oligoméricas no exemplo da hemoglobina 1.5. Mantendo a conformação nativa das proteínas em uma célula 1.6. Variedade de proteínas. Famílias de proteínas no exemplo das imunoglobulinas 1.7. Propriedades físico-químicas de proteínas e métodos para sua separação |
Unidade modular 1 ORGANIZAÇÃO ESTRUTURAL DAS PROTEÍNAS MONOMÉRICAS E A BASE DO SEU FUNCIONAMENTO
Objetivos de aprendizagem Ser capaz de:
1. Utilizar os conhecimentos sobre as características estruturais das proteínas e a dependência das funções das proteínas na sua estrutura para compreender os mecanismos de desenvolvimento das proteinopatias hereditárias e adquiridas.
2. Explicar os mecanismos de ação terapêutica de certos fármacos como ligantes que interagem com proteínas e alteram sua atividade.
3. Utilizar o conhecimento sobre a estrutura e labilidade conformacional das proteínas para compreender a sua instabilidade estrutural e funcional e a sua tendência à desnaturação em condições variáveis.
4. Explicar o uso de agentes desnaturantes como meio de esterilização de material e instrumentos médicos, bem como antissépticos.
Conhecer:
1. Níveis de organização estrutural das proteínas.
2. A importância da estrutura primária das proteínas, que determina a sua diversidade estrutural e funcional.
3. O mecanismo de formação do centro ativo nas proteínas e sua interação específica com o ligante, subjacente ao funcionamento das proteínas.
4. Exemplos da influência de ligantes exógenos (drogas, toxinas, venenos) na conformação e atividade funcional das proteínas.
5. Causas e efeitos da desnaturação de proteínas, fatores que causam a desnaturação.
6. Exemplos de uso de fatores desnaturantes na medicina como antissépticos e meios de esterilização de instrumentos médicos.
TÓPICO 1.1. ORGANIZAÇÃO ESTRUTURAL DE PROTEÍNAS. ESTÁGIOS FORMANDO UM NATIVO
CONFORMAÇÕES DE PROTEÍNAS
Esquilos são heteropolímeros. moléculas (ou seja, consistindo em uma variedade de monômeros). Os monômeros de proteínas são 20 tipos de α-aminoácidos, interligados por ligações peptídicas.
O conjunto e a ordem de conexão dos aminoácidos em uma proteína são determinados pela estrutura dos genes correspondentes no DNA dos indivíduos. Cada proteína, de acordo com sua estrutura específica, desempenha sua própria função. O conjunto de proteínas de um determinado organismo ( proteoma) determina suas características fenotípicas, bem como a presença de doenças hereditárias ou predisposição ao seu desenvolvimento.
1. Aminoácidos que compõem as proteínas. ligação peptídica.
As proteínas são heteropolímeros construídos a partir de monômeros - 20 α-aminoácidos.
A fórmula geral dos aminoácidos é mostrada abaixo.

Os aminoácidos diferem em estrutura, tamanho, propriedades físico-químicas dos radicais ligados ao átomo de carbono α. Os grupos funcionais dos aminoácidos determinam as características das propriedades de diferentes α-aminoácidos. Os radicais encontrados nos α-aminoácidos podem ser divididos em vários grupos:
prolina, Ao contrário dos outros 19 monômeros de proteína, não um aminoácido, mas um iminoácido, o radical na prolina está associado tanto ao átomo de carbono α quanto ao grupo imino.

Os aminoácidos diferem em sua solubilidade em água. Isso se deve à capacidade dos radicais de interagir com a água (para serem hidratados).
Para hidrofílico incluem radicais contendo grupos funcionais não carregados aniônicos, catiônicos e polares.
Para hidrofóbico incluem radicais contendo grupos metilo, cadeias ou ciclos alifáticos.
2. As ligações peptídicas ligam aminoácidos em peptídeos. Durante a síntese de um peptídeo, o grupo α-carboxila de um aminoácido interage com o grupo α-amino de outro aminoácido para formar ligação peptídica:
As proteínas são polipéptidos, i.e. polímeros lineares de α-aminoácidos conectados por uma ligação peptídica (Fig. 1.1.)
 Arroz. 1.1. Termos usados para descrever a estrutura de peptídeos
Arroz. 1.1. Termos usados para descrever a estrutura de peptídeos
Os monômeros de aminoácidos que compõem os polipeptídeos são chamados de resíduos de aminoácidos. Cadeia de grupos de repetição - NH-CH-CO- formulários espinha dorsal peptídica. Um resíduo de aminoácido com um grupo α-amino livre é chamado de N-terminal, e um com um grupo α-carboxil livre é chamado de C-terminal. Os peptídeos são escritos e lidos do terminal N para o terminal C.
A ligação peptídica formada pelo grupo imino da prolina difere de outras ligações peptídicas: o átomo de nitrogênio do grupo peptídico não possui hidrogênio,
em vez disso, há uma ligação com o radical, como resultado, um lado do ciclo é incluído no esqueleto peptídico:

Os peptídeos diferem na composição de aminoácidos, no número de aminoácidos e na ordem dos aminoácidos, por exemplo, Ser-Ala-Glu-Gis e His-Glu-Ala-Ser são dois peptídeos diferentes.
As ligações peptídicas são muito fortes e sua hidrólise química não enzimática requer condições severas: a proteína a ser analisada é hidrolisada em ácido clorídrico concentrado a uma temperatura de cerca de 110°C por 24 horas. Em uma célula viva, as ligações peptídicas podem ser quebradas por enzimas proteolíticas, chamado proteases ou hidrolases peptídicas.
3. Estrutura primária das proteínas. Os resíduos de aminoácidos nas cadeias peptídicas de diferentes proteínas não se alternam aleatoriamente, mas são organizados em uma determinada ordem. A sequência linear ou sequência de resíduos de aminoácidos em uma cadeia polipeptídica é chamada a estrutura primária de uma proteína.
A estrutura primária de cada proteína individual é codificada em uma molécula de DNA (em uma região chamada gene) e é implementada durante a transcrição (reescrevendo a informação no mRNA) e a tradução (síntese da estrutura primária da proteína). Consequentemente, a estrutura primária das proteínas de uma pessoa individual é a informação herdada dos pais para os filhos que determina as características estruturais das proteínas de um determinado organismo, das quais depende a função das proteínas existentes (Fig. 1.2).
 Arroz. 1.2. A relação entre o genótipo e a conformação de proteínas sintetizadas no corpo de um indivíduo
Arroz. 1.2. A relação entre o genótipo e a conformação de proteínas sintetizadas no corpo de um indivíduo
Cada uma das cerca de 100.000 proteínas individuais do corpo humano tem exclusivo estrutura primária. Moléculas de um tipo de proteína (por exemplo, albumina) têm a mesma alternância de resíduos de aminoácidos, o que distingue a albumina de qualquer outra proteína individual.
A sequência de resíduos de aminoácidos na cadeia peptídica pode ser considerada como uma forma de registro de informações. Esta informação determina o dobramento espacial de uma cadeia peptídica linear em uma estrutura tridimensional mais compacta chamada conformação esquilo. O processo de formação de uma conformação proteica funcionalmente ativa é chamado de dobrando.
4. Conformação de proteínas. A rotação livre no esqueleto peptídico é possível entre o átomo de nitrogênio do grupo peptídico e o átomo de carbono α vizinho, bem como entre o átomo de carbono α e o carbono do grupo carbonila. Devido à interação de grupos funcionais de resíduos de aminoácidos, a estrutura primária das proteínas pode adquirir estruturas espaciais mais complexas. Nas proteínas globulares, distinguem-se dois níveis principais de dobramento da conformação das cadeias peptídicas: secundário e Estrutura terciária.
Estrutura secundária de proteínas- esta é uma estrutura espacial formada como resultado da formação de ligações de hidrogênio entre os grupos funcionais -C=O e -NH- do esqueleto peptídico. Neste caso, a cadeia peptídica pode adquirir estruturas regulares de dois tipos: α-hélices e estruturas β.
NO α-hélices ligações de hidrogênio são formadas entre o átomo de oxigênio do grupo carbonila e o hidrogênio do nitrogênio amida do 4º aminoácido a partir dele; cadeias laterais de resíduos de aminoácidos
localizada ao longo da periferia da hélice, não participando da formação da estrutura secundária (Fig. 1.3.).
Radicais volumosos ou radicais carregando as mesmas cargas impedem a formação de uma α-hélice. O resíduo de prolina, que possui estrutura em anel, interrompe a α-hélice, pois devido à falta de hidrogênio no átomo de nitrogênio da cadeia peptídica, é impossível formar uma ligação de hidrogênio. A ligação entre o nitrogênio e o átomo de carbono α faz parte do ciclo da prolina, de modo que o esqueleto peptídico adquire uma curvatura neste local.
β-Estruturaé formado entre as regiões lineares do esqueleto peptídico de uma cadeia polipeptídica, formando assim estruturas dobradas. As cadeias polipeptídicas ou suas partes podem formar paralelo ou estruturas β antiparalelas. No primeiro caso, os terminais N e C das cadeias peptídicas que interagem coincidem e, no segundo caso, eles têm a direção oposta (Fig. 1.4).
Arroz. 1.3. Estrutura secundária da proteína - α-hélice
 Arroz. 1.4. Estruturas β-pregueadas paralelas e antiparalelas
Arroz. 1.4. Estruturas β-pregueadas paralelas e antiparalelas
As estruturas β estão indicadas por setas largas: A - Estrutura β antiparalela. B - Estruturas β-pregas paralelas
Em algumas proteínas, as estruturas β podem ser formadas devido à formação de ligações de hidrogênio entre os átomos do esqueleto peptídico de diferentes cadeias polipeptídicas.
Também encontrado em proteínas áreas com secundário irregular estrutura, que inclui curvas, voltas, voltas do esqueleto polipeptídico. Eles estão frequentemente localizados em locais onde a direção da cadeia peptídica muda, por exemplo, durante a formação de uma estrutura de folha β paralela.
Pela presença de α-hélices e estruturas β, as proteínas globulares podem ser divididas em quatro categorias.
Arroz. 1.5. Estrutura secundária da mioglobina (A) e da cadeia β da hemoglobina (B), contendo oito α-hélices
 Arroz. 1.6. Estrutura secundária da triose fosfato isomerase e domínio piruvato quinase
Arroz. 1.6. Estrutura secundária da triose fosfato isomerase e domínio piruvato quinase
 Arroz. 1.7. Estrutura secundária do domínio constante de imunoglobulina (A) e enzima superóxido dismutase (B)
Arroz. 1.7. Estrutura secundária do domínio constante de imunoglobulina (A) e enzima superóxido dismutase (B)
NO quarta categoria incluíram proteínas que possuem em sua composição uma pequena quantidade de estruturas secundárias regulares. Essas proteínas incluem pequenas proteínas ricas em cisteína ou metaloproteínas.
Estrutura terciária de uma proteína- um tipo de conformação formada devido a interações entre radicais de aminoácidos, que podem estar localizados a uma distância considerável um do outro na cadeia peptídica. Neste caso, a maioria das proteínas forma uma estrutura espacial semelhante a um glóbulo (proteínas globulares).
Como os radicais hidrofóbicos dos aminoácidos tendem a se combinar com a ajuda dos chamados interações hidrofóbicas e forças intermoleculares de van der Waals, um núcleo hidrofóbico denso é formado dentro do glóbulo de proteína. Os radicais hidrofílicos ionizados e não ionizados estão localizados principalmente na superfície da proteína e determinam sua solubilidade em água.
 Arroz. 1.8. Tipos de ligações que surgem entre os radicais de aminoácidos durante a formação da estrutura terciária de uma proteína
Arroz. 1.8. Tipos de ligações que surgem entre os radicais de aminoácidos durante a formação da estrutura terciária de uma proteína
1 - ligação iônica- ocorre entre grupos funcionais carregados positivamente e negativamente;
2 - ligação de hidrogênio- ocorre entre o grupo hidrofílico não carregado e qualquer outro grupo hidrofílico;
3 - interações hidrofóbicas- ocorrem entre radicais hidrofóbicos;
4 - ligação dissulfeto- é formado devido à oxidação de grupos SH de resíduos de cisteína e sua interação entre si
Resíduos de aminoácidos hidrofílicos que estão dentro do núcleo hidrofóbico podem interagir uns com os outros usando iônico e ligações de hidrogênio(Fig. 1.8).
As ligações iônicas e de hidrogênio, bem como as interações hidrofóbicas, estão entre as mais fracas: sua energia excede ligeiramente a energia do movimento térmico das moléculas à temperatura ambiente. A conformação da proteína é mantida pela ocorrência de muitas dessas ligações fracas. Como os átomos que compõem a proteína estão em constante movimento, é possível quebrar algumas ligações fracas e formar outras, o que leva a pequenos movimentos de seções individuais da cadeia polipeptídica. Essa propriedade das proteínas de mudar de conformação como resultado da quebra de algumas e da formação de outras ligações fracas é chamada de labilidade conformacional.
O corpo humano possui sistemas que homeostase- a constância do ambiente interno dentro de certos limites aceitáveis para um organismo saudável. Sob condições de homeostase, pequenas mudanças na conformação não perturbam a estrutura geral e a função das proteínas. A conformação funcionalmente ativa de uma proteína é chamada de conformação nativa. Uma mudança no ambiente interno (por exemplo, a concentração de glicose, íons Ca, prótons, etc.) leva a uma mudança na conformação e ruptura das funções das proteínas.
A estrutura terciária de algumas proteínas é estabilizada Ligações dissulfureto, formado pela interação de grupos -SH de dois resíduos
 Arroz. 1.9. A formação de uma ligação dissulfeto em uma molécula de proteína
Arroz. 1.9. A formação de uma ligação dissulfeto em uma molécula de proteína
cisteína (Fig. 1.9). A maioria das proteínas intracelulares não possui ligações dissulfeto covalentes em sua estrutura terciária. Sua presença é característica de proteínas secretadas pela célula, o que garante sua maior estabilidade em condições extracelulares. Assim, as ligações dissulfeto estão presentes nas moléculas de insulina e imunoglobulinas.
Insulina- um hormônio proteico sintetizado nas células β do pâncreas e secretado no sangue em resposta a um aumento na concentração de glicose no sangue. Na estrutura da insulina, existem duas ligações dissulfeto conectando as cadeias A e B do polipeptídeo e uma ligação dissulfeto dentro da cadeia A (Fig. 1.10).
 Arroz. 1.10. Ligações dissulfeto na estrutura da insulina
Arroz. 1.10. Ligações dissulfeto na estrutura da insulina
5. Estrutura super secundária de proteínas. Em proteínas diferentes em estrutura e funções primárias, às vezes combinações semelhantes e interposição de estruturas secundárias, que são chamadas de estrutura supersecundária. Ocupa uma posição intermediária entre as estruturas secundárias e terciárias, pois é uma combinação específica de elementos da estrutura secundária durante a formação da estrutura terciária de uma proteína. As estruturas supersecundárias têm nomes específicos como "α-hélice-vira-a-hélice", "zíper de leucina", "dedos de zinco", etc. Essas estruturas supersecundárias são características de proteínas de ligação ao DNA.
"Zíper de leucina". Esse tipo de estrutura super secundária é usada para conectar duas proteínas. Na superfície das proteínas que interagem existem regiões α-helicoidais contendo pelo menos quatro resíduos de leucina. Os resíduos de leucina na α-hélice estão localizados a seis aminoácidos separados um do outro. Como cada volta da α-hélice contém 3,6 resíduos de aminoácidos, os radicais de leucina são encontrados na superfície de cada outra volta. Os resíduos de leucina da α-hélice de uma proteína podem interagir com os resíduos de leucina de outra proteína (interações hidrofóbicas), conectando-os (Fig. 1.11.). Muitas proteínas de ligação ao DNA funcionam como parte de complexos oligoméricos, onde as subunidades individuais estão ligadas umas às outras por "zíperes de leucina".
 Arroz. 1.11. "Zíper de leucina" entre regiões α-helicoidal de duas proteínas
Arroz. 1.11. "Zíper de leucina" entre regiões α-helicoidal de duas proteínas
As histonas são um exemplo dessas proteínas. Histonas- proteínas nucleares, que incluem um grande número de aminoácidos carregados positivamente - arginina e lisina (até 80%). As moléculas de histonas são combinadas em complexos oligoméricos contendo oito monômeros com a ajuda de "fixadores de leucina", apesar da significativa carga homônima dessas moléculas.
"Dedo de Zinco"- uma variante da estrutura supersecundária, característica das proteínas de ligação ao DNA, tem a forma de um fragmento alongado na superfície da proteína e contém cerca de 20 resíduos de aminoácidos (Fig. 1.12). A forma do "dedo esticado" é sustentada por um átomo de zinco associado a quatro radicais de aminoácidos - dois resíduos de cisteína e dois resíduos de histidina. Em alguns casos, em vez de resíduos de histidina, há resíduos de cisteína. Os dois resíduos de cisteína espaçados são separados dos outros dois resíduos de Gisili por uma sequência Cys de aproximadamente 12 resíduos de aminoácidos. Essa região da proteína forma uma α-hélice, cujos radicais podem se ligar especificamente às regiões reguladoras do sulco principal do DNA. A especificidade da ligação de um indivíduo
 Arroz. 1.12. A estrutura primária de uma seção de proteínas de ligação ao DNA que formam a estrutura “dedo de zinco” (as letras indicam os aminoácidos que compõem essa estrutura)
Arroz. 1.12. A estrutura primária de uma seção de proteínas de ligação ao DNA que formam a estrutura “dedo de zinco” (as letras indicam os aminoácidos que compõem essa estrutura)
proteína reguladora de ligação ao DNA depende da sequência de resíduos de aminoácidos localizados no "dedo de zinco". Tais estruturas contêm, em particular, receptores para hormônios esteróides envolvidos na regulação da transcrição (leitura de informações do DNA para o RNA).
TÓPICO 1.2. BASES DE FUNCIONAMENTO DE PROTEÍNAS. DROGAS COMO LIGANTES QUE AFETAM A FUNÇÃO DA PROTEÍNA
1. O centro ativo da proteína e sua interação com o ligante. Durante a formação da estrutura terciária, na superfície de uma proteína funcionalmente ativa, geralmente em recesso, forma-se um sítio formado por radicais de aminoácidos que estão distantes na estrutura primária. Este sítio, que possui uma estrutura única para uma determinada proteína e é capaz de interagir especificamente com determinada molécula ou grupo de moléculas semelhantes, é chamado de sítio de ligação da proteína com um ligante ou sítio ativo. Ligantes são moléculas que interagem com proteínas.
Alta especificidade A interação da proteína com o ligante é assegurada pela complementaridade da estrutura do centro ativo com a estrutura do ligante.
complementaridadeé a correspondência espacial e química das superfícies que interagem. O centro ativo não deve apenas corresponder espacialmente ao ligante incluído nele, mas ligações (interações iônicas, hidrogênio e hidrofóbicas) também devem se formar entre os grupos funcionais dos radicais incluídos no centro ativo e o ligante, que mantêm o ligante em o centro ativo (Fig. 1.13).
 Arroz. 1.13. Interação complementar de uma proteína com um ligante
Arroz. 1.13. Interação complementar de uma proteína com um ligante
Alguns ligantes, quando ligados ao centro ativo de uma proteína, desempenham um papel auxiliar no funcionamento das proteínas. Esses ligantes são chamados de cofatores, e as proteínas que possuem uma parte não proteica em sua composição são chamadas de cofatores. proteínas complexas(em contraste com proteínas simples, consistindo apenas na parte proteica). A parte não proteica que está firmemente ligada à proteína é chamada de grupo protético. Por exemplo, a composição de mioglobina, hemoglobina e citocromos contém um grupo protético firmemente ligado ao centro ativo - um heme contendo um íon de ferro. Proteínas complexas contendo heme são chamadas de hemoproteínas.
Quando ligantes específicos são ligados a proteínas, a função dessas proteínas é manifestada. Assim, a albumina, a proteína mais importante no plasma sanguíneo, exibe sua função de transporte ligando ligantes hidrofóbicos ao centro ativo, como ácidos graxos, bilirrubina, algumas drogas, etc. (Fig. 1.14)
Os ligantes que interagem com a estrutura tridimensional da cadeia peptídica podem ser não apenas moléculas orgânicas e inorgânicas de baixo peso molecular, mas também macromoléculas:
DNA (exemplos discutidos acima com proteínas de ligação ao DNA);
Polissacarídeos;
 Arroz. 1.14. Relação entre genótipo e fenótipo
Arroz. 1.14. Relação entre genótipo e fenótipo
A estrutura primária única das proteínas humanas, codificada na molécula de DNA, é realizada nas células na forma de uma conformação única, estrutura do sítio ativo e funções da proteína.
Nesses casos, a proteína reconhece uma região específica do ligante que é proporcional e complementar ao sítio de ligação. Assim, na superfície dos hepatócitos existem proteínas receptoras para o hormônio insulina, que também possui uma estrutura proteica. A interação da insulina com o receptor provoca uma alteração na sua conformação e ativação dos sistemas de sinalização, levando ao acúmulo de nutrientes nos hepatócitos após a alimentação.
Por isso, O funcionamento das proteínas é baseado na interação específica do centro ativo da proteína com o ligante.
2. Estrutura do domínio e seu papel no funcionamento das proteínas. Longas cadeias polipeptídicas de proteínas globulares muitas vezes se dobram em várias regiões compactas e relativamente independentes. Possuem uma estrutura terciária independente, semelhante à das proteínas globulares, e são chamadas de domínios. Devido à estrutura de domínio das proteínas, sua estrutura terciária é mais fácil de formar.
Em proteínas de domínio, os sítios de ligação do ligante estão frequentemente localizados entre os domínios. Assim, a tripsina é uma enzima proteolítica que é produzida pela parte exócrina do pâncreas e é necessária para a digestão das proteínas dos alimentos. Possui uma estrutura de dois domínios, e o sítio de ligação da tripsina com seu ligante - proteína alimentar - está localizado no sulco entre os dois domínios. No centro ativo, são criadas as condições necessárias para a ligação efetiva de um sítio específico da proteína alimentar e a hidrólise de suas ligações peptídicas.
Diferentes domínios em uma proteína podem se mover em relação uns aos outros quando o centro ativo interage com o ligante (Fig. 1.15).
Hexoquinase- uma enzima que catalisa a fosforilação da glicose com a ajuda do ATP. O sítio ativo da enzima está localizado na fenda entre os dois domínios. Quando a hexoquinase se liga à glicose, os domínios circundantes se fecham e o substrato fica preso, onde ocorre a fosforilação (veja a Fig. 1.15).
 Arroz. 1.15. Ligação de domínios de hexoquinase à glicose
Arroz. 1.15. Ligação de domínios de hexoquinase à glicose
Em algumas proteínas, os domínios desempenham funções independentes ligando-se a vários ligantes. Tais proteínas são chamadas de multifuncionais.
3. Drogas - ligantes que afetam a função das proteínas. A interação de proteínas com ligantes é específica. No entanto, devido à labilidade conformacional da proteína e de seu sítio ativo, é possível escolher outra substância que também possa interagir com a proteína no sítio ativo ou em outra parte da molécula.
Uma substância que é semelhante em estrutura a um ligante natural é chamada de análogo estrutural do ligante ou um ligando não natural. Ele também interage com uma proteína no sítio ativo. Um análogo estrutural de um ligante pode melhorar a função da proteína (agonista) e reduzi-lo (antagonista). O ligante e seus análogos estruturais competem entre si pela ligação proteica no mesmo sítio. Tais substâncias são chamadas moduladores competitivos(reguladores) das funções das proteínas. Muitos medicamentos atuam como inibidores de proteínas. Alguns deles são obtidos por modificação química de ligantes naturais. Os inibidores da função das proteínas podem ser drogas e venenos.
A atropina é um inibidor competitivo dos receptores M-colinérgicos. A acetilcolina é um neurotransmissor para a transmissão de impulsos nervosos através de sinapses colinérgicas. Para conduzir a excitação, a acetilcolina liberada na fenda sináptica deve interagir com a proteína - o receptor da membrana pós-sináptica. Dois tipos encontrados receptores colinérgicos:
M-receptor além da acetilcolina, interage seletivamente com a muscarina (toxina agárica da mosca). M - os receptores colinérgicos estão presentes na musculatura lisa e, ao interagir com a acetilcolina, causam sua contração;
receptor H liga-se especificamente à nicotina. Os receptores N-colinérgicos são encontrados nas sinapses dos músculos estriados esqueléticos.
inibidor específico Receptores M-colinérgicosé atropina. É encontrado em plantas de beladona e meimendro.
 A atropina possui grupos funcionais e seu arranjo espacial semelhante à acetilcolina em sua estrutura, portanto, pertence aos inibidores competitivos dos receptores M-colinérgicos. Dado que a ligação da acetilcolina aos receptores M-colinérgicos causa a contração da musculatura lisa, a atropina é utilizada como medicamento que alivia o espasmo. (antiespasmódico). Assim, é conhecido o uso da atropina para relaxar os músculos oculares na visualização do fundo de olho, bem como para aliviar espasmos em cólicas gastrointestinais. Os receptores M-colinérgicos também estão presentes no sistema nervoso central (SNC), de modo que grandes doses de atropina podem causar uma reação indesejável do sistema nervoso central: agitação motora e mental, alucinações, convulsões.
A atropina possui grupos funcionais e seu arranjo espacial semelhante à acetilcolina em sua estrutura, portanto, pertence aos inibidores competitivos dos receptores M-colinérgicos. Dado que a ligação da acetilcolina aos receptores M-colinérgicos causa a contração da musculatura lisa, a atropina é utilizada como medicamento que alivia o espasmo. (antiespasmódico). Assim, é conhecido o uso da atropina para relaxar os músculos oculares na visualização do fundo de olho, bem como para aliviar espasmos em cólicas gastrointestinais. Os receptores M-colinérgicos também estão presentes no sistema nervoso central (SNC), de modo que grandes doses de atropina podem causar uma reação indesejável do sistema nervoso central: agitação motora e mental, alucinações, convulsões.
A ditilina é um agonista competitivo dos receptores H-colinérgicos que inibe a função das sinapses neuromusculares.
 As sinapses neuromusculares dos músculos esqueléticos contêm receptores H-colinérgicos. Sua interação com a acetilcolina leva a contrações musculares. Em algumas operações cirúrgicas, bem como em estudos endoscópicos, são utilizados medicamentos que causam relaxamento dos músculos esqueléticos. (relaxantes musculares). Estes incluem ditilina, que é um análogo estrutural da acetilcolina. Ele se liga aos receptores H-colinérgicos, mas, ao contrário da acetilcolina, é destruído muito lentamente pela enzima acetilcolinesterase. Como resultado da abertura prolongada dos canais iônicos e da despolarização persistente da membrana, a condução do impulso nervoso é interrompida e ocorre o relaxamento muscular. Inicialmente, essas propriedades foram encontradas no veneno curare, por isso tais medicamentos são chamados de curariforme.
As sinapses neuromusculares dos músculos esqueléticos contêm receptores H-colinérgicos. Sua interação com a acetilcolina leva a contrações musculares. Em algumas operações cirúrgicas, bem como em estudos endoscópicos, são utilizados medicamentos que causam relaxamento dos músculos esqueléticos. (relaxantes musculares). Estes incluem ditilina, que é um análogo estrutural da acetilcolina. Ele se liga aos receptores H-colinérgicos, mas, ao contrário da acetilcolina, é destruído muito lentamente pela enzima acetilcolinesterase. Como resultado da abertura prolongada dos canais iônicos e da despolarização persistente da membrana, a condução do impulso nervoso é interrompida e ocorre o relaxamento muscular. Inicialmente, essas propriedades foram encontradas no veneno curare, por isso tais medicamentos são chamados de curariforme.
TÓPICO 1.3. DENATURAÇÃO DE PROTEÍNAS E A POSSIBILIDADE DE SUA RENATIVAÇÃO ESPONTÂNEA
1. Uma vez que a conformação nativa das proteínas é mantida devido a interações fracas, mudanças na composição e propriedades do ambiente ao redor da proteína, o impacto de reagentes químicos e fatores físicos causam uma mudança em sua conformação (propriedade de labilidade conformacional). A ruptura de um grande número de ligações leva à destruição da conformação nativa e à desnaturação da proteína.
Desnaturação de proteínas- trata-se da destruição de sua conformação nativa sob a ação de agentes desnaturantes, causada pela quebra de ligações fracas que estabilizam a estrutura espacial da proteína. A desnaturação é acompanhada pela destruição da estrutura tridimensional única e do centro ativo da proteína e pela perda de sua atividade biológica (Fig. 1.16).
Todas as moléculas desnaturadas de uma proteína adquirem uma conformação aleatória que difere de outras moléculas da mesma proteína. Os radicais de aminoácidos que formam o centro ativo acabam sendo espacialmente distantes um do outro, ou seja, o sítio de ligação específico da proteína com o ligante é destruído. Durante a desnaturação, a estrutura primária das proteínas permanece inalterada.
O uso de agentes desnaturantes em pesquisa biológica e medicina. Em estudos bioquímicos, antes da determinação de compostos de baixo peso molecular em um material biológico, as proteínas são geralmente removidas da solução primeiro. Para este fim, o ácido tricloroacético (TCA) é mais frequentemente usado. Após a adição de TCA à solução, as proteínas desnaturadas precipitam e são facilmente removidas por filtração (Tabela 1.1.)
Na medicina, os agentes desnaturantes são frequentemente usados para esterilizar instrumentos e materiais médicos em autoclaves (agente desnaturante - alta temperatura) e como antissépticos (álcool, fenol, cloramina) para tratar superfícies contaminadas contendo microflora patogênica.
2. Regeneração espontânea de proteínas- prova do determinismo da estrutura primária, conformação e função das proteínas. Proteínas individuais são produtos de um gene que possuem uma sequência de aminoácidos idêntica e adquirem a mesma conformação na célula. A conclusão fundamental de que a estrutura primária de uma proteína já contém informações sobre sua conformação e função foi feita com base na capacidade de algumas proteínas (em particular, ribonuclease e mioglobina) de reativação espontânea - a restauração de sua conformação nativa após a desnaturação.
A formação das estruturas espaciais da proteína é realizada pelo método de automontagem - processo espontâneo em que a cadeia polipeptídica, que possui uma estrutura primária única, tende a adotar uma conformação com a menor energia livre em solução. A capacidade de regenerar proteínas que retêm sua estrutura primária após a desnaturação foi descrita em um experimento com a enzima ribonuclease.
A ribonuclease é uma enzima que quebra ligações entre nucleotídeos individuais em uma molécula de RNA. Esta proteína globular tem uma cadeia polipeptídica, cuja estrutura terciária é estabilizada por muitas ligações dissulfeto fracas e quatro.
O tratamento da ribonuclease com uréia, que quebra as ligações de hidrogênio na molécula, e um agente redutor, que quebra as ligações dissulfeto, leva à desnaturação da enzima e perda de sua atividade.
A remoção de agentes desnaturantes por diálise leva à restauração da conformação e função da proteína, i.e. à reanimação. (Fig. 1.17).
 Arroz. 1.17. Desnaturação e reativação da ribonuclease
Arroz. 1.17. Desnaturação e reativação da ribonuclease
A - conformação nativa da ribonuclease, na estrutura terciária da qual existem quatro ligações dissulfeto; B - molécula de ribonuclease desnaturada;
B - molécula de ribonuclease reativa com estrutura e função restauradas
1. Tabela completa 1.2.
Tabela 1.2. Classificação dos aminoácidos de acordo com a polaridade dos radicais
2. Escreva a fórmula de um tetrapeptídeo:
Asp - Pro - Fen - Liz
a) isolar os grupos de repetição no peptídeo que formam o esqueleto peptídico e os grupos variáveis representados pelos radicais de aminoácidos;
b) designar os terminais N e C;
c) sublinhar as ligações peptídicas;
d) escrever outro peptídeo consistindo nos mesmos aminoácidos;
e) contar o número de variantes tetrapeptídicas possíveis com composição de aminoácidos semelhante.
3. Explique o papel da estrutura primária das proteínas no exemplo de uma análise comparativa de dois hormônios peptídicos estruturalmente semelhantes e evolutivamente próximos da neurohipófise de mamíferos - oxitocina e vasopressina (Tabela 1.3).
Tabela 1.3. Estrutura e função da ocitocina e vasopressina
 Por esta:
Por esta:
a) comparar a composição e a sequência de aminoácidos dos dois peptídeos;
b) encontrar a semelhança da estrutura primária dos dois peptídeos e a semelhança de sua ação biológica;
c) encontrar as diferenças na estrutura dos dois peptídeos e a diferença em suas funções;
d) tirar uma conclusão sobre a influência da estrutura primária dos peptídeos em suas funções.
4. Descrever as principais etapas na formação da conformação das proteínas globulares (estruturas secundárias, terciárias, o conceito de estrutura supersecundária). Especifique os tipos de ligações envolvidas na formação de estruturas de proteínas. Quais radicais de aminoácidos podem participar na formação de interações hidrofóbicas, iônicas, ligações de hidrogênio.
Dar exemplos.
5. Definir o conceito de "labilidade conformacional das proteínas", indicar as razões da sua existência e significado.
6. Explique o significado da seguinte frase: “As proteínas funcionam com base em sua interação específica com um ligante”, usando termos e explicando seu significado: conformação da proteína, sítio ativo, ligante, complementaridade, função da proteína.
7. Usando um dos exemplos, explique o que são domínios e qual é o seu papel no funcionamento das proteínas.
TAREFAS PARA AUTO-CONTROLE
1. Defina uma partida.
Grupo funcional no radical aminoácido:
A. Grupo carboxila B. Grupo hidroxila C Grupo Guanidina D. Grupo tiol E. Grupo amino
2. Escolha as respostas corretas.
Os aminoácidos com radicais polares não carregados são:
A. Tsis B. Asn
B. Glu G. Três
3. Escolha as respostas corretas.
Radicais de aminoácidos:
A. Fornecer especificidade da estrutura primária B. Participar da formação da estrutura terciária
B. Estando localizados na superfície da proteína, eles afetam sua solubilidade D. Formam um centro ativo
D. Participar na formação de ligações peptídicas
4. Escolha as respostas corretas.
Interações hidrofóbicas podem se formar entre radicais de aminoácidos:
A. Tre Lay B. Pro Três
B. Met Ile G. Tir Ala D. Val Fen
5. Escolha as respostas corretas.
As ligações iônicas podem se formar entre os radicais de aminoácidos:
A. Gln Asp B. Abr Liz
B. Liz Glu G. Gansos Asp D. Asn Abr
6. Escolha as respostas corretas.
As ligações de hidrogênio podem se formar entre os radicais de aminoácidos:
A. Ser Gln B. Cis Tre
B. Asp Liz G. Glu Asp D. Asn Tre
7. Defina uma partida.
O tipo de ligação envolvida na formação da estrutura da proteína:
A. Estrutura primária B. Estrutura secundária
B. Estrutura terciária
D. Estrutura supersecundária E. Conformação.
1. Ligações de hidrogênio entre os átomos do esqueleto peptídico
2. Ligações fracas entre grupos funcionais de radicais de aminoácidos
3. Ligações entre grupos α-amino e α-carboxil de aminoácidos
8. Escolha as respostas corretas. Tripsina:
A. Enzima proteolítica B. Contém dois domínios
B. Hidrolisa o amido
D. O centro ativo está localizado entre domínios. D. Consiste em duas cadeias polipeptídicas.
9. Escolha as respostas corretas. Atropina:
A. Neurotransmissor
B. Análogo estrutural da acetilcolina
B. Interage com receptores H-colinérgicos
G. Melhora a condução de um impulso nervoso através de sinapses colinérgicas
D. Inibidor competitivo de receptores M-colinérgicos
10. Escolha as afirmações corretas. Em proteínas:
A. A estrutura primária contém informações sobre a estrutura de seu sítio ativo
B. O centro ativo é formado no nível da estrutura primária
B. A conformação é rigidamente fixada por ligações covalentes
D. O sítio ativo pode interagir com um grupo de ligantes semelhantes
devido à labilidade conformacional das proteínas D. A alteração do ambiente pode afetar a afinidade do ativo
centro para ligante
1. 1-C, 2-D, 3-B.
3. A, B, C, D.
7. 1-B, 2-D, 3-A.
8. A, B, C, D.
TERMOS E CONCEITOS BÁSICOS
1. Proteína, polipeptídeo, aminoácidos
2. Estruturas proteicas primárias, secundárias e terciárias
3. Conformação, conformação de proteína nativa
4. Ligações covalentes e fracas em uma proteína
5. Labilidade conformacional
6. Sítio ativo da proteína
7. Ligantes
8. Dobramento de proteínas
9. Análogos estruturais de ligantes
10. Proteínas de domínio
11. Proteínas simples e complexas
12. Desnaturação de proteínas, agentes desnaturantes
13. Regeneração de proteínas
Resolver problemas
"Organização estrutural das proteínas e a base do seu funcionamento"
1. A principal função da proteína - hemoglobina A (HbA) - é o transporte de oxigênio para os tecidos. Na população humana, são conhecidas múltiplas formas desta proteína com propriedades e funções alteradas – as chamadas hemoglobinas anormais. Por exemplo, a hemoglobina S encontrada nos eritrócitos de pacientes com anemia falciforme (HbS) tem baixa solubilidade sob condições de baixa pressão parcial de oxigênio (como ocorre no sangue venoso). Isso leva à formação de agregados desta proteína. A proteína perde sua função, precipita-se e as hemácias tornam-se irregulares (algumas delas em formato de foice) e são destruídas mais rapidamente que o normal no baço. Como resultado, a anemia falciforme se desenvolve.
A única diferença na estrutura primária de HvA foi encontrada na região N-terminal da cadeia β da hemoglobina. Compare as regiões N-terminais da cadeia β e mostre como as mudanças na estrutura primária de uma proteína afetam suas propriedades e funções.
 Por esta:
Por esta:
a) escreva as fórmulas de aminoácidos pelas quais HvA difere e compare as propriedades desses aminoácidos (polaridade, carga).
b) tirar uma conclusão sobre o motivo da diminuição da solubilidade e da violação do transporte de oxigênio no tecido.
2. A figura mostra um diagrama da estrutura de uma proteína que possui um centro de ligação ao ligante (centro ativo). Explique por que uma proteína é seletiva na escolha de um ligante. Por esta:
a) lembrar qual é o centro ativo da proteína e considerar a estrutura do centro ativo da proteína mostrada na figura;
b) escreva as fórmulas dos radicais de aminoácidos que compõem o centro ativo;
c) desenhar um ligante que possa interagir especificamente com o sítio ativo da proteína. Indique nele os grupos funcionais capazes de formar ligações com os radicais de aminoácidos que compõem o centro ativo;
d) indicar os tipos de ligações que surgem entre o ligante e os radicais aminoácidos do centro ativo;
e) Explique a base para a especificidade da interação de uma proteína com um ligante.
 3.
A figura mostra o sítio ativo da proteína e vários ligantes.
3.
A figura mostra o sítio ativo da proteína e vários ligantes.
Determine qual dos ligantes tem maior probabilidade de interagir com o sítio ativo da proteína e por quê.
 Que tipos de ligações surgem durante a formação do complexo proteína-ligante?
Que tipos de ligações surgem durante a formação do complexo proteína-ligante?
4. Análogos estruturais de ligantes de proteínas naturais podem ser usados como drogas para alterar a atividade de proteínas.
A acetilcolina é um mediador da transmissão de excitação nas sinapses neuromusculares. Quando a acetilcolina interage com proteínas - receptores da membrana pós-sináptica dos músculos esqueléticos, os canais iônicos se abrem e ocorre a contração muscular. A ditilina é uma droga usada em algumas operações para relaxar os músculos, pois interrompe a transmissão dos impulsos nervosos através das sinapses neuromusculares. Explique o mecanismo de ação da ditilina como relaxante muscular. Por esta:
a) escreva as fórmulas da acetilcolina e da ditilina e compare suas estruturas;
b) descrever o mecanismo de ação relaxante da ditilina.
5. Em algumas doenças, a temperatura corporal do paciente aumenta, o que é considerado uma reação protetora do corpo. No entanto, altas temperaturas são prejudiciais às proteínas do corpo. Explique por que em temperaturas acima de 40°C a função das proteínas é interrompida e surge uma ameaça à vida humana. Para fazer isso, lembre-se:
1) A estrutura das proteínas e as ligações que mantêm sua estrutura na conformação nativa;
2) Como a estrutura e a função das proteínas mudam com o aumento da temperatura?;
3) O que é homeostase e por que é importante manter a saúde humana.
Unidade modular 2 PROTEÍNAS OLIGOMÉRICAS COMO OBJETIVOS DE INFLUÊNCIA REGULATÓRIA. VARIEDADE ESTRUTURAL E FUNCIONAL DE PROTEÍNAS. MÉTODOS DE SEPARAÇÃO E PURIFICAÇÃO DE PROTEÍNAS
Objetivos de aprendizagem Ser capaz de:
1. Utilizar o conhecimento sobre as características da estrutura e funções das proteínas oligoméricas para compreender os mecanismos adaptativos de regulação das suas funções.
2. Explicar o papel das chaperonas na síntese e manutenção da conformação proteica de uma célula.
3. Explicar a diversidade de manifestações da vida pela diversidade de estruturas e funções das proteínas sintetizadas no organismo.
4. Analisar a relação entre a estrutura das proteínas e sua função comparando hemoproteínas relacionadas - mioglobina e hemoglobina, bem como representantes de cinco classes de proteínas da família das imunoglobulinas.
5. Aplicar conhecimentos sobre as características das propriedades físico-químicas das proteínas para selecionar métodos para a sua purificação de outras proteínas e impurezas.
6. Interpretar os resultados da composição quantitativa e qualitativa das proteínas do plasma sanguíneo para confirmar ou esclarecer o diagnóstico clínico.
Conhecer:
1. Características da estrutura de proteínas oligoméricas e mecanismos adaptativos de regulação de suas funções no exemplo da hemoglobina.
2. A estrutura e funções das chaperonas e sua importância para a manutenção da conformação nativa das proteínas em uma célula.
3. Princípios de agrupamento de proteínas em famílias de acordo com a semelhança de sua conformação e funções no exemplo das imunoglobulinas.
4. Métodos de separação de proteínas com base nas características das suas propriedades físico-químicas.
5. Eletroforese de plasma sanguíneo como método de avaliação da composição qualitativa e quantitativa de proteínas.
TÓPICO 1.4. CARACTERÍSTICAS DA ESTRUTURA E FUNCIONAMENTO DAS PROTEÍNAS OLIGOMÉRICAS NO EXEMPLO DE HEMOGLOBINA
1. Muitas proteínas contêm várias cadeias polipeptídicas. Tais proteínas são chamadas de oligomérico, e circuitos individuais protômeros. Protômeros em proteínas oligoméricas são conectados por muitas ligações não covalentes fracas (hidrofóbicas, iônicas, hidrogênio). Interação
protômeros é realizado graças a complementaridade suas superfícies de contato.
O número de protômeros nas proteínas oligoméricas pode variar muito: a hemoglobina contém 4 protômeros, a enzima aspartato aminotransferase - 12 protômeros, e a proteína do vírus do mosaico do tabaco inclui 2.120 protômeros conectados por ligações não covalentes. Portanto, as proteínas oligoméricas podem ter pesos moleculares muito altos.
A interação de um protômero com outros pode ser considerada como um caso especial da interação de uma proteína com um ligante, pois cada protômero serve como ligante para outros protômeros. O número e o método de conexão dos protômeros em uma proteína são chamados de estrutura proteica quaternária.
As proteínas podem conter protômeros de estrutura igual ou diferente, por exemplo, homodímeros são proteínas contendo dois protômeros idênticos e heterodímeros são proteínas contendo dois protômeros diferentes.
Se as proteínas contêm diferentes protômeros, então centros de ligação com diferentes ligantes que diferem na estrutura podem se formar nelas. Quando o ligante se liga ao centro ativo, a função dessa proteína se manifesta. Um centro localizado em um protômero diferente é chamado de alostérico (diferente de ativo). Entrando em contato ligante ou efetor alostérico, ele desempenha uma função reguladora (Fig. 1.18). A interação do centro alostérico com o efetor causa mudanças conformacionais na estrutura de toda a proteína oligomérica devido à sua labilidade conformacional. Isso afeta a afinidade do sítio ativo por um ligante específico e regula a função dessa proteína. Uma mudança na conformação e função de todos os protômeros durante a interação de uma proteína oligomérica com pelo menos um ligante é chamada de mudanças conformacionais cooperativas. Os efetores que melhoram a função das proteínas são chamados ativadores e efetores que deprimem sua função - inibidores.
Assim, nas proteínas oligoméricas, assim como nas proteínas com estrutura de domínio, surge uma nova propriedade em comparação com as proteínas monoméricas - a capacidade de regular funções alostericamente (regulação pela ligação de diferentes ligantes à proteína). Isso pode ser visto comparando as estruturas e funções das duas proteínas complexas intimamente relacionadas mioglobina e hemoglobina.
 Arroz. 1.18. Diagrama da estrutura de uma proteína dimérica
Arroz. 1.18. Diagrama da estrutura de uma proteína dimérica
2. Formação de estruturas espaciais e funcionamento da mioglobina.
A mioglobina (Mv) é uma proteína encontrada nos músculos vermelhos, cuja principal função é a criação de reservas de O 2 necessárias ao trabalho muscular intenso. MB é uma proteína complexa contendo uma parte proteica - apoMB e uma parte não proteica - heme. A estrutura primária da apoMB determina sua conformação globular compacta e a estrutura do centro ativo, ao qual está ligada a parte não proteica da mioglobina, a heme. O oxigênio do sangue para os músculos se liga ao Fe + 2 heme na composição da mioglobina. A MB é uma proteína monomérica com afinidade muito alta pelo O 2, portanto, o oxigênio é liberado pela mioglobina apenas durante o trabalho muscular intenso, quando a pressão parcial do O 2 diminui acentuadamente.
Formação da conformação MB. Nos músculos vermelhos, nos ribossomos durante a tradução, ocorre a síntese da estrutura primária do MB, representada por uma sequência específica de 153 resíduos de aminoácidos. A estrutura secundária de Mv contém oito α-hélices, chamadas letras latinas de A a H, entre as quais existem seções não espiraladas. A estrutura terciária de Mv tem a forma de um glóbulo compacto, no recesso do qual está localizado um centro ativo entre as α-hélices F e E (Fig. 1.19).
 Arroz. 1.19. Estrutura da mioglobina
Arroz. 1.19. Estrutura da mioglobina
3. Características da estrutura e funcionamento do centro ativo de MT. O centro ativo de Mv é formado principalmente por radicais de aminoácidos hidrofóbicos que estão distantes uns dos outros na estrutura primária (por exemplo, Tri 3 9 e Phen 138) Os ligantes pouco solúveis em água, heme e O 2, estão ligados ao centro ativo. Heme é um ligante específico de apoMv (Fig. 1.20), que é baseado em quatro anéis pirrólicos conectados por pontes metenil; no centro, há um átomo de Fe+ 2 ligado aos átomos de nitrogênio dos anéis pirrólicos por quatro ligações de coordenação. Além dos radicais hidrofóbicos de aminoácidos, o centro ativo de Mv também contém resíduos de dois aminoácidos com radicais hidrofílicos - Gis E 7(Gis 64) e Gis F 8(His 93) (Fig. 1.21).
 Arroz. 1,20. A estrutura do heme - a parte não proteica da mioglobina e da hemoglobina
Arroz. 1,20. A estrutura do heme - a parte não proteica da mioglobina e da hemoglobina
 Arroz. 1.21. Localização do heme e do O 2 no sítio ativo dos protômeros da apomioglobina e da hemoglobina
Arroz. 1.21. Localização do heme e do O 2 no sítio ativo dos protômeros da apomioglobina e da hemoglobina
O heme está ligado covalentemente a His F 8 por meio de um átomo de ferro. O 2 liga-se ao ferro do outro lado do plano heme. Seu E 7 é necessário para a correta orientação do O 2 e facilita a adição de oxigênio ao Fe + 2 heme
Gis F 8 forma uma ligação de coordenação com Fe+ 2 e fixa firmemente o heme no sítio ativo. Gis E 7é necessário para a orientação correta no centro ativo de outro ligante - O 2 durante sua interação com Fe + 2 heme. O microambiente heme cria condições para a ligação forte, mas reversível de O 2 com Fe + 2 e impede a entrada de água no centro ativo hidrofóbico, o que pode levar à sua oxidação a Fe + 3 .
A estrutura monomérica do MB e seu centro ativo determinam a alta afinidade da proteína pelo O 2 .
4. Estrutura oligomérica da Hb e regulação da afinidade da Hb pelo O 2 por ligantes. Hemoglobinas humanas- uma família de proteínas, bem como a mioglobina relacionada a proteínas complexas (hemoproteínas). Eles têm uma estrutura tetramérica e contêm duas cadeias α, mas diferem na estrutura das outras duas cadeias polipeptídicas (cadeias 2α, 2x). A estrutura da segunda cadeia polipeptídica determina as características do funcionamento dessas formas de Hb. Cerca de 98% da hemoglobina nos eritrócitos adultos é hemoglobina A(cadeias 2α-, 2p).
Durante o desenvolvimento fetal, existem dois tipos principais de hemoglobinas: HB embrionário(2α, 2ε), que é encontrado nos estágios iniciais do desenvolvimento fetal, e hemoglobina F (fetal)- (2α, 2γ), que substitui a hemoglobina fetal precoce no sexto mês de desenvolvimento fetal e é substituída pela Hb A somente após o nascimento.
Hv A é uma proteína relacionada à mioglobina (Mv) encontrada em eritrócitos adultos. A estrutura de seus protômeros individuais é semelhante à da mioglobina. As estruturas secundárias e terciárias dos protômeros da mioglobina e da hemoglobina são muito semelhantes, apesar de apenas 24 resíduos de aminoácidos serem idênticos na estrutura primária de suas cadeias polipeptídicas (a estrutura secundária dos protômeros da hemoglobina, como a mioglobina, contém oito α-hélices, denotado por letras latinas de A a H, e a estrutura terciária tem a forma de um glóbulo compacto). Mas ao contrário da mioglobina, a hemoglobina tem uma estrutura oligomérica, composta por quatro cadeias polipeptídicas ligadas por ligações não covalentes (Figura 1.22).
Cada protômero de Hb está associado a uma parte não proteica - heme e protômeros vizinhos. A ligação da parte proteica da Hb com o heme é semelhante à da mioglobina: no centro ativo da proteína, as partes hidrofóbicas do heme são cercadas por radicais de aminoácidos hidrofóbicos, com exceção de His F 8 e His E 7 , que estão localizados em ambos os lados do plano heme e desempenham um papel semelhante no funcionamento da proteína e sua ligação com o oxigênio (veja a estrutura da mioglobina).
 Arroz. 1.22. Estrutura oligomérica da hemoglobina
Arroz. 1.22. Estrutura oligomérica da hemoglobina
Além do mais, Gis E 7 desempenha um importante papel adicional no funcionamento do NV. O heme livre tem uma afinidade 25.000 vezes maior pelo CO do que pelo O 2 . O CO é formado em pequenas quantidades no organismo e, devido à sua alta afinidade pelo heme, pode interromper o transporte de O 2 necessário à vida celular. Entretanto, na composição da hemoglobina, a afinidade do heme pelo monóxido de carbono supera a afinidade pelo O 2 em apenas 200 vezes devido à presença do E 7 no centro ativo da His. O resíduo desse aminoácido cria condições ideais para a ligação do heme ao O2 e enfraquece a interação do heme com o CO.
5. A principal função da Hb é o transporte de O 2 dos pulmões para os tecidos. Ao contrário da mioglobina monomérica, que tem uma afinidade muito alta pelo O 2 e desempenha a função de armazenar oxigênio nos músculos vermelhos, a estrutura oligomérica da hemoglobina fornece:
1) rápida saturação da Hb com oxigênio nos pulmões;
2) a capacidade da Hb de liberar oxigênio nos tecidos a uma pressão parcial de O 2 relativamente alta (20-40 mmHg);
3) a possibilidade de regular a afinidade da Hb ao O 2 .
6. Mudanças cooperativas na conformação dos protômeros da hemoglobina aceleram a ligação do O 2 nos pulmões e seu retorno aos tecidos. Nos pulmões, uma alta pressão parcial de O2 promove sua ligação à Hb no sítio ativo de quatro protômeros (2α e 2β). O centro ativo de cada protômero, como na mioglobina, está localizado entre duas α-hélices (F e E) em uma bolsa hidrofóbica. Ele contém uma parte não proteica - heme, ligada à parte proteica por muitas interações hidrofóbicas fracas e uma forte ligação entre Fe 2 + heme e His F 8 (veja a Fig. 1.21).
Na desoxiemoglobina, devido a esta conexão com His F 8 , o átomo de Fe 2 + se projeta do plano heme em direção à histidina. A ligação de O 2 a Fe 2 + ocorre no outro lado do heme na região His E 7 com a ajuda de uma única ligação de coordenação livre. Seu E 7 fornece condições ótimas para a ligação de O 2 com ferro heme.
A adição de O 2 ao átomo de Fe + 2 de um protômero faz com que ele se mova para o plano heme, seguido pelo resíduo de histidina associado a ele
 Arroz. 1.23. Mudança na conformação do protômero da hemoglobina quando combinado com O 2
Arroz. 1.23. Mudança na conformação do protômero da hemoglobina quando combinado com O 2
Isso leva a uma mudança na conformação de todas as cadeias polipeptídicas devido à sua labilidade conformacional. A alteração da conformação de outras cadeias facilita sua interação com as seguintes moléculas de O 2 .
A quarta molécula de O 2 liga-se à hemoglobina 300 vezes mais facilmente do que a primeira (Fig. 1.24).
 Arroz. 1,24. Mudanças cooperativas na conformação dos protômeros da hemoglobina durante sua interação com O 2
Arroz. 1,24. Mudanças cooperativas na conformação dos protômeros da hemoglobina durante sua interação com O 2
Nos tecidos, cada molécula de O2 subsequente é mais facilmente clivada do que a anterior, também devido a mudanças cooperativas na conformação do protômero.
7. CO 2 e H +, formados durante o catabolismo de substâncias orgânicas, reduzem a afinidade da hemoglobina pelo O 2 na proporção de sua concentração. A energia necessária para o funcionamento celular é produzida principalmente nas mitocôndrias durante a oxidação de substâncias orgânicas usando O 2 liberado dos pulmões pela hemoglobina. Como resultado da oxidação de substâncias orgânicas, os produtos finais de sua decomposição são formados: CO 2 e K 2 O, cuja quantidade é proporcional à intensidade dos processos de oxidação em andamento.
O CO 2 difunde-se das células para o sangue e penetra nos eritrócitos, onde, sob a ação da enzima carbanidrase, transforma-se em ácido carbônico. Este ácido fraco dissocia-se em um próton e um íon bicarbonato.
H+ são capazes de se juntar aos radicais GIS 14 6 nas cadeias α e β da hemoglobina, i.e. em áreas distantes do heme. A protonação da hemoglobina reduz sua afinidade pelo O 2 , promove a eliminação do O 2 da oxiHb, a formação da desoxiHb e aumenta o fornecimento de oxigênio aos tecidos na proporção do número de prótons formados (Fig. 1.25).
O aumento na quantidade de oxigênio liberado dependendo do aumento da concentração de H + nos eritrócitos é chamado de efeito Bohr (em homenagem ao fisiologista dinamarquês Christian Bohr, que descobriu esse efeito pela primeira vez).
Nos pulmões, uma alta pressão parcial de oxigênio promove sua ligação à desoxiHb, o que reduz a afinidade da proteína pelo H+. Os prótons liberados sob a ação da carbanidrase interagem com bicarbonatos para formar CO 2 e H 2 O

 Arroz. 1,25. A dependência da afinidade de Hb para O 2 na concentração de CO 2 e prótons (efeito Bohr):
Arroz. 1,25. A dependência da afinidade de Hb para O 2 na concentração de CO 2 e prótons (efeito Bohr):
MAS- influência da concentração de CO 2 e H+ na liberação de O 2 do complexo com Hb (efeito Bohr); B- oxigenação da desoxiemoglobina nos pulmões, formação e liberação de CO 2 .
O CO 2 resultante entra no espaço alveolar e é removido com o ar exalado. Assim, a quantidade de oxigênio liberada pela hemoglobina nos tecidos é regulada pelos produtos do catabolismo de substâncias orgânicas: quanto mais intensa a quebra de substâncias, por exemplo, durante o esforço físico, maior a concentração de CO 2 e H + e mais oxigênio que os tecidos recebem como resultado de uma diminuição na afinidade de H para O 2.
8. Regulação alostérica da afinidade da Hb pelo O 2 por um ligante - 2,3-bisfosfoglicerato. Nos eritrócitos, o ligante alostérico da hemoglobina, 2,3-bisfosfoglicerato (2,3-BPG), é sintetizado a partir do produto da oxidação da glicose - 1,3-bisfosfoglicerato. Em condições normais, a concentração de 2,3-BPG é alta e comparável à de Hb. 2,3-BPG tem uma forte carga negativa de -5.
 O bifosfoglicerato nos capilares teciduais, ao se ligar à desoxiemoglobina, aumenta a produção de oxigênio nos tecidos, reduzindo a afinidade da Hb pelo O 2 .
O bifosfoglicerato nos capilares teciduais, ao se ligar à desoxiemoglobina, aumenta a produção de oxigênio nos tecidos, reduzindo a afinidade da Hb pelo O 2 .
Há uma cavidade no centro da molécula de hemoglobina tetramérica. Ele é formado pelos resíduos de aminoácidos de todos os quatro protômeros (veja a Fig. 1.22). Nos capilares teciduais, a protonação da Hb (efeito Bohr) quebra a ligação entre o ferro heme e o O 2 . Em uma molécula
desoxiemoglobina, em comparação com a oxiemoglobina, aparecem ligações iônicas adicionais que conectam os protômeros, como resultado do aumento do tamanho da cavidade central em comparação com a oxiemoglobina. A cavidade central é o local de fixação do 2,3-BPG à hemoglobina. Devido à diferença no tamanho da cavidade central, o 2,3-BPG só pode se ligar à desoxiemoglobina.
O 2,3-BPG interage com a hemoglobina em uma região distante dos sítios ativos da proteína e pertence a alostérico(reguladores) ligantes, e a cavidade central Hb é centro alostérico. O 2,3-BPG tem uma forte carga negativa e interage com cinco grupos carregados positivamente de duas cadeias de Hb β: o grupo α-amino do terminal N Val e os radicais Lys 82 Gis 143 (Fig. 1.26).
 Arroz. 1,26. BPG na cavidade central da desoxiemoglobina
Arroz. 1,26. BPG na cavidade central da desoxiemoglobina
BPG liga-se a três grupos carregados positivamente em cada fita β.
Nos capilares teciduais, a desoxiemoglobina resultante interage com o 2,3-BPG, e são formadas ligações iônicas entre os radicais carregados positivamente das cadeias β e o ligante carregado negativamente, que alteram a conformação da proteína e reduzem a afinidade da Hb pelo O 2 . A diminuição da afinidade da Hb pelo O 2 contribui para uma liberação mais eficiente de O 2 no tecido.
Nos pulmões, em alta pressão parcial, o oxigênio interage com a Hb, juntando-se ao ferro heme; neste caso, a conformação da proteína muda, a cavidade central diminui e o 2,3-BPG é deslocado do centro alostérico
Assim, as proteínas oligoméricas têm novas propriedades em comparação com as proteínas monoméricas. Fixação de ligantes em sítios,
espacialmente distantes uns dos outros (alostéricos), capazes de causar mudanças conformacionais em toda a molécula de proteína. Devido à interação com ligantes reguladores, a conformação muda e a função da molécula de proteína se adapta às mudanças ambientais.
TÓPICO 1.5. MANUTENÇÃO DA CONFORMAÇÃO NATIVA DE PROTEÍNAS EM CONDIÇÕES CELULARES
Nas células, durante a síntese de cadeias polipeptídicas, seu transporte através de membranas para as seções correspondentes da célula, no processo de dobramento (formação de uma conformação nativa) e durante a montagem de proteínas oligoméricas, bem como durante seu funcionamento, intermediário , conformações instáveis e propensas à agregação surgem na estrutura da proteína. Radicais hidrofóbicos, geralmente escondidos dentro da molécula de proteína em sua conformação nativa, aparecem na superfície em uma conformação instável e tendem a se combinar com grupos de outras proteínas que são igualmente pouco solúveis em água. Nas células de todos os organismos conhecidos, foram encontradas proteínas especiais que proporcionam o dobramento ideal das proteínas celulares, estabilizam sua conformação nativa durante o funcionamento e, mais importante, mantêm a estrutura e as funções das proteínas intracelulares em caso de distúrbio da homeostase. Essas proteínas são chamadas de "acompanhantes" que significa "babá" em francês.
1. Chaperonas moleculares e seu papel na prevenção da desnaturação de proteínas.
As chaperonas (III) são classificadas de acordo com a massa das subunidades. As chaperonas de alto peso molecular têm uma massa de 60 a 110 kD. Dentre elas, três classes foram as mais estudadas: Sh-60, Sh-70 e Sh-90. Cada classe inclui uma família de proteínas relacionadas. Assim, Sh-70 contém proteínas com peso molecular de 66 a 78 kD. As chaperonas de baixo peso molecular têm um peso molecular de 40 a 15 kD.
Entre os acompanhantes estão constitutivo proteínas cuja alta síntese basal não depende de efeitos estressantes sobre as células do corpo, e induzível, cuja síntese em condições normais é fraca, mas aumenta acentuadamente sob influências estressantes. As chaperonas induzíveis também são chamadas de "proteínas de choque térmico" porque foram descobertas pela primeira vez em células expostas a altas temperaturas. Nas células, devido à alta concentração de proteínas, a regeneração espontânea de proteínas parcialmente desnaturadas é difícil. Sh-70 pode prevenir o processo de desnaturação que começou e ajudar a restaurar a conformação nativa das proteínas. Chaperones moleculares-70- uma classe altamente conservada de proteínas encontradas em todas as partes da célula: citoplasma, núcleo, retículo endoplasmático, mitocôndrias. Na extremidade carboxila da única cadeia polipeptídica de Sh-70, existe uma região que é um sulco que pode interagir com peptídeos de comprimento
de 7 a 9 resíduos de aminoácidos enriquecidos com radicais hidrofóbicos. Tais sítios em proteínas globulares ocorrem aproximadamente a cada 16 aminoácidos. Sh-70 são capazes de proteger proteínas da inativação térmica e restaurar a conformação e atividade de proteínas parcialmente desnaturadas.
2. Papel das chaperonas no enovelamento de proteínas. Durante a síntese de proteínas no ribossomo, a região N-terminal do polipeptídeo é sintetizada antes da região C-terminal. A sequência completa de aminoácidos da proteína é necessária para formar a conformação nativa. No processo de síntese proteica, as chaperonas-70, devido à estrutura de seu centro ativo, são capazes de fechar áreas propensas à agregação do polipeptídeo enriquecido em radicais de aminoácidos hidrofóbicos até que a síntese seja completada (Figura 1.27, A).
 Arroz. 1,27. Envolvimento de chaperones no dobramento de proteínas
Arroz. 1,27. Envolvimento de chaperones no dobramento de proteínas
A - participação das chaperonas-70 na prevenção de interações hidrofóbicas entre os sítios do polipeptídeo sintetizado; B - formação de uma conformação de proteína nativa no complexo chaperone
Muitas proteínas de alto peso molecular com uma conformação complexa, como uma estrutura de domínio, dobram-se em um espaço especial formado por W-60. Sh-60 funcionam como um complexo oligomérico constituído por 14 subunidades. Eles formam dois anéis ocos, cada um dos quais consiste em sete subunidades, esses anéis estão conectados entre si. Cada subunidade de III-60 consiste em três domínios: apical (apical), enriquecido com radicais hidrofóbicos voltados para a cavidade do anel, intermediário e equatorial (Fig. 1.28).
 Arroz. 1,28. Estrutura do complexo de chaperonina que consiste em 14 Sh-60
Arroz. 1,28. Estrutura do complexo de chaperonina que consiste em 14 Sh-60
A - vista lateral; B - vista superior
Proteínas sintetizadas com elementos de superfície característicos de moléculas desdobradas, em particular, radicais hidrofóbicos, entram na cavidade dos anéis de chaperona. No ambiente específico dessas cavidades, ocorre uma enumeração de possíveis conformações até encontrar a única, energeticamente mais favorável (Fig. 1.27, B). A formação de conformações e liberação da proteína é acompanhada pela hidrólise de ATP na região equatorial. Tipicamente, tal dobramento dependente de chaperona requer uma quantidade significativa de energia.
Além de participar na formação da estrutura tridimensional das proteínas e na reativação de proteínas parcialmente desnaturadas, as chaperonas também são necessárias para processos fundamentais como a montagem de proteínas oligoméricas, reconhecimento e transporte de proteínas desnaturadas em lisossomos, transporte de proteínas através das membranas, e participação na regulação da atividade de complexos proteicos.
TÓPICO 1.6. VARIEDADE DE PROTEÍNAS. FAMÍLIAS DE PROTEÍNAS NO EXEMPLO DE IMUNOGLOBULINAS
1. As proteínas desempenham um papel decisivo na vida das células individuais e de todo o organismo multicelular, e suas funções são surpreendentemente diversas. Isso é determinado pelas peculiaridades da estrutura primária e conformações das proteínas, a estrutura única do centro ativo e a capacidade de ligar ligantes específicos.
Apenas uma parte muito pequena de todas as variantes possíveis de cadeias peptídicas pode adotar uma estrutura espacial estável; maioria
deles podem assumir muitas conformações com aproximadamente a mesma energia de Gibbs, mas com propriedades diferentes. A estrutura primária da maioria das proteínas conhecidas, selecionadas pela evolução biológica, proporciona excepcional estabilidade de uma das conformações, o que determina as características do funcionamento dessa proteína.
2. Famílias de proteínas. Dentro de uma mesma espécie biológica, substituições de resíduos de aminoácidos podem levar ao surgimento de diferentes proteínas que desempenham funções relacionadas e possuem sequências de aminoácidos homólogas. Essas proteínas relacionadas têm conformações notavelmente semelhantes: o número e o arranjo das α-hélices e/ou estruturas β, e a maioria das voltas e dobras das cadeias polipeptídicas são semelhantes ou idênticas. Proteínas com regiões homólogas da cadeia polipeptídica, conformação semelhante e funções relacionadas são isoladas em famílias de proteínas. Exemplos de famílias de proteínas: serina proteinases, família de imunoglobulinas, família de mioglobinas.
serina proteinases- uma família de proteínas que desempenham a função de enzimas proteolíticas. Estes incluem enzimas digestivas - quimotripsina, tripsina, elastase e muitos fatores de coagulação do sangue. Essas proteínas têm aminoácidos 40% idênticos e uma conformação muito semelhante (Fig. 1.29).

Arroz. 1.29. Estruturas espaciais de elastase (A) e quimotripsina (B)
Algumas substituições de aminoácidos levaram a uma mudança na especificidade do substrato dessas proteínas e ao surgimento de diversidade funcional dentro da família.
3. Família de imunoglobulinas. As proteínas da superfamília das imunoglobulinas, que inclui três famílias de proteínas, desempenham um papel importante no funcionamento do sistema imunológico:
Anticorpos (imunoglobulinas);
receptores de linfócitos T;
Proteínas do complexo principal de histocompatibilidade - MHC 1ª e 2ª classes (Complexo Principal de Histocompatibilidade).
Todas estas proteínas têm uma estrutura de domínio, consistem em domínios homólogos do tipo imune e desempenham funções semelhantes: interagem com estruturas estranhas, quer dissolvidas no sangue, linfa ou fluido intercelular (anticorpos), quer localizadas na superfície das células (próprias ou esqueceram).
4. Anticorpos- proteínas específicas produzidas por linfócitos B em resposta à ingestão de uma estrutura estranha chamada antígeno.
Características da estrutura dos anticorpos
As moléculas de anticorpos mais simples consistem em quatro cadeias polipeptídicas: duas cadeias leves idênticas - L, contendo cerca de 220 aminoácidos, e duas cadeias pesadas idênticas - H, compostas por 440-700 aminoácidos. Todas as quatro cadeias em uma molécula de anticorpo estão conectadas por muitas ligações não covalentes e quatro ligações dissulfeto (Fig. 1.30).
As cadeias leves de anticorpos consistem em dois domínios: variável (VL), localizada na região N-terminal da cadeia polipeptídica, e constante (CL), localizada na região C-terminal. Cadeias pesadas normalmente têm quatro domínios: uma variável (VH) no terminal N e três constantes (CH1, CH2, CH3) (veja a Figura 1.30). Cada domínio de imunoglobulina tem uma superestrutura β-pregueada na qual dois resíduos de cisteína estão ligados por uma ligação dissulfeto.
Entre os dois domínios constantes CH1 e CH2 existe uma região contendo um grande número de resíduos de prolina, que impedem a formação da estrutura secundária e a interação de cadeias H vizinhas neste segmento. Esta região de dobradiça dá flexibilidade à molécula do anticorpo. Entre os domínios variáveis das cadeias pesada e leve estão dois sítios idênticos de ligação a antígenos (sítios ativos para antígenos de ligação), de modo que tais anticorpos são freqüentemente chamados de bivalentes. A ligação de um antígeno a um anticorpo não envolve toda a sequência de aminoácidos das regiões variáveis de ambas as cadeias, mas apenas 20-30 aminoácidos localizados nas regiões hipervariáveis de cada cadeia. São essas áreas que determinam a capacidade única de cada tipo de anticorpo de interagir com o antígeno complementar correspondente.
Os anticorpos são uma das linhas de defesa do corpo contra a invasão de organismos estranhos. Seu funcionamento pode ser dividido em duas etapas: a primeira é o reconhecimento e a ligação de um antígeno na superfície de organismos estranhos, o que é possível devido à presença de sítios de ligação ao antígeno na estrutura do anticorpo; a segunda etapa é o início do processo de inativação e destruição do antígeno. A especificidade do segundo estágio depende da classe de anticorpos. Existem cinco classes de cadeias pesadas que diferem umas das outras na estrutura dos domínios constantes: α, δ, ε, γ e μ, segundo as quais se distinguem cinco classes de imunoglobulinas: A, D, E, G e M.
As características estruturais das cadeias pesadas dão às regiões de dobradiça e às regiões C-terminais das cadeias pesadas uma conformação característica de cada classe. Uma vez que um antígeno se liga a um anticorpo, mudanças conformacionais nos domínios constantes determinam a via para a remoção do antígeno.
 Arroz. 1. 30. Estrutura de domínio de IgG
Arroz. 1. 30. Estrutura de domínio de IgG
Imunoglobulinas M
As imunoglobulinas M têm duas formas.
Forma monomérica- 1ª classe de anticorpos produzidos pelo linfócito B em desenvolvimento. Subsequentemente, muitas células B passam a produzir outras classes de anticorpos, mas com o mesmo sítio de ligação ao antígeno. A IgM é incorporada na membrana e atua como um receptor de reconhecimento de antígeno. A incorporação de IgM na membrana celular é possível devido à presença de 25 resíduos de aminoácidos hidrofóbicos na porção caudal da região.
Forma secretora de IgM contém cinco subunidades monoméricas ligadas entre si por pontes dissulfeto e uma cadeia J de polipeptídeo adicional (Fig. 1.31). Monômeros de cadeia pesada desta forma não contêm uma cauda hidrofóbica. O pentâmero possui 10 sítios de ligação ao antígeno e, portanto, é eficaz em reconhecer e remover o antígeno que entrou no corpo pela primeira vez. A forma secretora de IgM é a principal classe de anticorpos secretados no sangue durante a resposta imune primária. A ligação de IgM a um antígeno altera a conformação da IgM e induz sua ligação ao primeiro componente proteico do sistema complemento (o sistema complemento é um conjunto de proteínas envolvidas na destruição do antígeno) e ativação desse sistema. Se o antígeno estiver localizado na superfície do microrganismo, o sistema complemento causa uma violação da integridade da membrana celular e a morte da célula bacteriana.
Imunoglobulinas G
Em termos quantitativos, esta classe de imunoglobulinas predomina no sangue (75% de todas as Ig). IgG - monômeros, a principal classe de anticorpos secretados no sangue durante a resposta imune secundária. Após a interação da IgG com os antígenos de superfície dos microrganismos, o complexo antígeno-anticorpo é capaz de se ligar e ativar proteínas do sistema complemento ou pode interagir com receptores específicos em macrófagos e neutrófilos. interação com fagócitos
 Arroz. 1.31. A estrutura da forma secretora de IgM
Arroz. 1.31. A estrutura da forma secretora de IgM
à absorção de complexos antígeno-anticorpo e sua destruição nos fagossomos das células. A IgG é a única classe de anticorpos que pode atravessar a barreira placentária e proteger o feto de infecções no útero.
Imunoglobulinas A
Principal classe de anticorpos presentes nas secreções (leite, saliva, secreções respiratórias e intestinais). A IgA é secretada principalmente na forma dimérica, onde os monômeros estão ligados uns aos outros por meio de uma cadeia J adicional (Fig. 1.32).
A IgA não interage com o sistema complemento e células fagocitárias, mas ao se ligar aos microrganismos, os anticorpos impedem que eles se liguem às células epiteliais e penetrem no corpo.
Imunoglobulinas E
As imunoglobulinas E são representadas por monômeros nos quais as cadeias ε pesadas contêm, assim como as cadeias μ das imunoglobulinas M, uma variável e quatro domínios constantes. A IgE após a secreção se liga às suas próprias
 Arroz. 1,32. Estrutura de IgA
Arroz. 1,32. Estrutura de IgA
Regiões C-terminais com receptores correspondentes na superfície de mastócitos e basófilos. Como resultado, eles se tornam receptores para antígenos na superfície dessas células (Fig. 1.33).
 Arroz. 1,33. Interação de IgE com antígeno na superfície do mastócitos
Arroz. 1,33. Interação de IgE com antígeno na superfície do mastócitos
Depois que o antígeno é ligado aos sítios de IgE de ligação ao antígeno correspondentes, as células recebem um sinal para secretar substâncias biologicamente ativas (histamina, serotonina), que são em grande parte responsáveis pelo desenvolvimento da reação inflamatória e pela manifestação de reações alérgicas como asma, urticária, febre do feno.
Imunoglobulinas D
As imunoglobulinas D são encontradas no soro em quantidades muito pequenas, são monômeros. As cadeias δ pesadas têm uma variável e três domínios constantes. As IgD atuam como receptores para linfócitos B, outras funções ainda são desconhecidas. A interação de antígenos específicos com receptores na superfície dos linfócitos B (IgD) leva à transmissão desses sinais para a célula e à ativação de mecanismos que garantem a reprodução desse clone de linfócitos.
TÓPICO 1.7. PROPRIEDADES FÍSICO-QUÍMICAS DAS PROTEÍNAS E MÉTODOS PARA SUA SEPARAÇÃO
1. As proteínas individuais diferem em suas propriedades físico-químicas:
A forma das moléculas;
Peso molecular;
A carga total, cujo valor depende da proporção de grupos aniônicos e catiônicos de aminoácidos;
A proporção de radicais de aminoácidos polares e não polares na superfície das moléculas;
Graus de resistência a vários agentes desnaturantes.
2. A solubilidade das proteínas depende nas propriedades das proteínas listadas acima, bem como na composição do meio em que a proteína se dissolve (valores de pH, composição de sais, temperatura, presença de outras substâncias orgânicas que podem interagir com a proteína). A magnitude da carga das moléculas de proteína é um dos fatores que afetam sua solubilidade. Quando a carga é perdida no ponto isoelétrico, as proteínas se agregam e precipitam mais facilmente. Isso é especialmente verdadeiro para proteínas desnaturadas, que possuem radicais de aminoácidos hidrofóbicos na superfície.
Na superfície da molécula de proteína, existem radicais de aminoácidos carregados positivamente e negativamente. O número desses grupos e, portanto, a carga total de proteínas, depende do pH do meio, ou seja, a razão da concentração de grupos H + - e OH -. Em um ambiente ácido um aumento na concentração de H+ leva à supressão da dissociação dos grupos carboxila -COO - + H+ > -COOH e uma diminuição na carga negativa das proteínas. Em um ambiente alcalino, a ligação do excesso de OH - prótons formados durante a dissociação dos grupos amino -NH 3 + + OH - - NH 2 + H 2 O com a formação de água, leva a uma diminuição da carga positiva das proteínas. O valor de pH no qual uma proteína tem uma carga líquida igual a zero é chamado ponto isoelétrico (PEI). No IET, o número de grupos carregados positivamente e negativamente é o mesmo, ou seja, a proteína está em um estado isoelétrico.
3. Separação de proteínas individuais. As características da estrutura e funcionamento do corpo dependem do conjunto de proteínas sintetizadas nele. O estudo da estrutura e propriedades das proteínas é impossível sem seu isolamento da célula e purificação de outras proteínas e moléculas orgânicas. As etapas de isolamento e purificação de proteínas individuais:
destruição celular do tecido estudado e obtenção de um homogenato.
Separação do homogenato em frações centrifugação, obtendo-se uma fração nuclear, mitocondrial, citosólica ou outra que contenha a proteína desejada.
Desnaturação seletiva de calor- aquecimento de curta duração da solução de proteína, no qual parte das impurezas da proteína desnaturada pode ser removida (no caso de a proteína ser relativamente estável termicamente).
Salgando fora. Diferentes proteínas precipitam em diferentes concentrações de sal em solução. Aumentando gradualmente a concentração de sal, é possível obter várias frações individuais com um teor predominante da proteína secretada em uma delas. O fracionamento de proteínas mais comumente usado é o sulfato de amônio. Proteínas com a menor solubilidade precipitam em baixas concentrações de sal.
Filtração em gel- um método de peneirar moléculas através de grânulos de Sephadex inchados (cadeias tridimensionais de polissacarídeo dextrano com poros). A taxa de passagem das proteínas através de uma coluna preenchida com Sephadex dependerá de seu peso molecular: quanto menor a massa das moléculas de proteína, mais facilmente elas penetram nos grânulos e permanecem lá por mais tempo, quanto maior a massa, mais rápido elas eluem do coluna.
Ultracentrifugação- um método que consiste no fato de que as proteínas em um tubo de centrífuga são colocadas no rotor de uma ultracentrífuga. Quando o rotor gira, a velocidade de sedimentação da proteína é proporcional ao seu peso molecular: as frações de proteína mais pesadas estão localizadas mais próximas do fundo do tubo, as mais leves estão mais próximas da superfície.
eletroforese- um método baseado em diferenças na velocidade de movimento de proteínas em um campo elétrico. Este valor é proporcional à carga das proteínas. A eletroforese de proteínas é realizada em papel (neste caso, a velocidade das proteínas é proporcional apenas à sua carga) ou em um gel de poliacrilamida com um determinado tamanho de poro (a velocidade das proteínas é proporcional à sua carga e peso molecular).
Cromatografia de troca iônica- um método de fracionamento baseado na ligação de grupos ionizados de proteínas com grupos de cargas opostas de resinas de troca iônica (materiais poliméricos insolúveis). A força de ligação de uma proteína a uma resina é proporcional à carga da proteína. As proteínas adsorvidas no polímero de troca iônica podem ser lavadas com concentrações crescentes de soluções de NaCl; quanto menor a carga da proteína, menor será a concentração de NaCl necessária para lavar a proteína associada aos grupos iônicos da resina.
Cromatografia de afinidade- o método mais específico para isolar proteínas individuais.Um ligante de uma proteína é covalentemente ligado a um polímero inerte. Quando uma solução de proteína passa por uma coluna com um polímero, devido à ligação complementar da proteína ao ligante, apenas a proteína específica para este ligante é adsorvida na coluna.
Diálise- um método usado para remover compostos de baixo peso molecular de uma solução de uma proteína isolada. O método baseia-se na incapacidade das proteínas de passar por uma membrana semipermeável, ao contrário das substâncias de baixo peso molecular. É usado para purificar proteínas de impurezas de baixo peso molecular, por exemplo, de sais após a salga.
ATRIBUIÇÕES PARA TRABALHO EXTRACURRÍCULO
1. Preencha a tabela. 1.4.
Tabela 1.4. Análise comparativa da estrutura e funções de proteínas relacionadas - mioglobina e hemoglobina
a) lembre-se da estrutura do centro ativo Mb e Hb. Qual o papel dos radicais hidrofóbicos dos aminoácidos na formação dos centros ativos dessas proteínas? Descreva a estrutura do centro ativo de Mb e Hb e os mecanismos de ligação do ligante a ele. Qual o papel dos resíduos His F 8 e His E 7 no funcionamento do sítio ativo Mv e Hv?
b) que novas propriedades em comparação com a mioglobina monomérica tem uma proteína oligomérica intimamente relacionada, a hemoglobina? Explique o papel das mudanças cooperativas na conformação dos protômeros na molécula de hemoglobina, o efeito das concentrações de CO 2 e prótons na afinidade da hemoglobina pelo oxigênio e o papel do 2,3-BPG na regulação alostérica da função da Hb.
2. Descrever as características das chaperonas moleculares, prestando atenção à relação entre a sua estrutura e função.
3. Quais proteínas são agrupadas em famílias? Usando o exemplo da família de imunoglobulinas, determine as características estruturais semelhantes e funções relacionadas das proteínas desta família.
4. Muitas vezes, proteínas individuais purificadas são necessárias para aplicações bioquímicas e médicas. Explique em que propriedades físico-químicas das proteínas se baseiam os métodos utilizados para a sua separação e purificação.
TAREFAS PARA AUTO-CONTROLE
1. Escolha as respostas corretas.
Funções da hemoglobina:
A. Transporte de O 2 dos pulmões para os tecidos B. Transporte de H + dos tecidos para os pulmões
B. Mantendo um pH sanguíneo constante D. Transporte de CO2 dos pulmões para os tecidos
D. Transporte de CO 2 dos tecidos para os pulmões
2. Escolha as respostas corretas. ligandoα -Hb protômero é: A. Heme
B. Oxigênio
B. CO D. 2,3-BPG
D. β-Protômero
3. Escolha as respostas corretas.
A hemoglobina é diferente da mioglobina:
A. Tem uma estrutura quaternária
B. A estrutura secundária é representada apenas por α-hélices
B. Refere-se a proteínas complexas
D. Interage com um ligante alostérico D. Ligado covalentemente ao heme
4. Escolha as respostas corretas.
A afinidade da Hb pelo O 2 diminui:
A. Quando uma molécula de O 2 é ligada B. Quando uma molécula de O 2 é eliminada
B. Ao interagir com 2,3-BPG
D. Quando ligado a protômeros H + D. Quando a concentração de 2,3-BPG diminui
5. Defina uma partida.
Para os tipos Hb é característico:
A. Forma agregados fibrilares na forma desoxi B. Contém duas cadeias α e duas δ
B. A forma predominante de Hb em eritrócitos adultos D. Contém heme com Fe + 3 no centro ativo
D. Contém duas cadeias α e duas γ 1. HvA 2.
6. Defina uma partida.
Ligandos Hb:
A. Liga-se à Hb no centro alostérico
B. Tem uma afinidade muito alta para o sítio ativo Hb
B. Juntando, aumenta a afinidade de Hb para O 2 D. Oxida Fe + 2 para Fe + 3
D. Forma uma ligação covalente com hysF8
7. Escolha as respostas corretas.
Acompanhantes:
A. Proteínas presentes em todas as partes da célula
B. A síntese é aprimorada sob influências estressantes
B. Participar da hidrólise de proteínas desnaturadas
D. Participar na manutenção da conformação nativa das proteínas
D. Criar organelas nas quais a conformação da proteína é formada
8. Combinar. Imunoglobulinas:
A. A forma secretora é pentamérica
B. Classe de Ig que atravessa a barreira placentária
B. Ig - receptor de mastócitos
D. A principal classe de Ig presente nas secreções das células epiteliais. D. Receptor de linfócitos B, cuja ativação garante a reprodução celular
9. Escolha as respostas corretas.
Imunoglobulinas E:
A. Produzido por macrófagos B. Possui cadeias ε pesadas.
B. Incorporado na membrana dos linfócitos T
D. Atuam como receptores de membrana para antígenos em mastócitos e basófilos
D. Responsável pela manifestação de reações alérgicas
10. Escolha as respostas corretas.
O método para separar proteínas é baseado em diferenças em seu peso molecular:
A. Filtração em gel
B. Ultracentrifugação
B. Eletroforese em gel de poliacrilamida D. Cromatografia de troca iônica
D. Cromatografia de afinidade
11. Escolha a resposta correta.
O método para separar proteínas é baseado em diferenças em sua solubilidade em água:
A. Filtração em gel B. Salga
B. Cromatografia de troca iônica D. Cromatografia de afinidade
E. Eletroforese em gel de poliacrilamida
PADRÕES DE RESPOSTAS PARA "TAREFAS DE AUTOCONTROLE"
1. A, B, C, D
2. A, B, C, D
5. 1-B, 2-A, 3-G
6. 1-C, 2-B, 3-A
7. A, B, D, D
8. 1-G; 2-B, 3-C
TERMOS E CONCEITOS BÁSICOS
1. Proteínas oligoméricas, protômero, estrutura quaternária de proteínas
2. Mudanças cooperativas na conformação do protômero
3. Efeito Bohr
4. Regulação alostérica das funções das proteínas, centro alostérico e efetor alostérico
5. Chaperonas moleculares, proteínas de choque térmico
6. Famílias de proteínas (proteases de serina, imunoglobulinas)
7. IgM-, G-, E-, A-conexão de estrutura com função
8. Carga total das proteínas, ponto isoelétrico das proteínas
9. Eletroforese
10. Salgando
11. Filtração em gel
12. Cromatografia de troca iônica
13. Ultracentrifugação
14. Cromatografia de afinidade
15. Eletroforese de proteínas plasmáticas
TAREFAS PARA O TRABALHO AUDITIVO
1. Compare as dependências dos graus de saturação da hemoglobina (Hb) e mioglobina (Mb) com o oxigênio em sua pressão parcial nos tecidos
 Arroz. 1,34. Dependência de saturação de MV eHboxigênio de sua pressão parcial
Arroz. 1,34. Dependência de saturação de MV eHboxigênio de sua pressão parcial
Observe que a forma das curvas de saturação de oxigênio da proteína é diferente: para mioglobina - hipérbole, para hemoglobina - forma sigmóide.
1. Compare os valores da pressão parcial de oxigênio em que Mb e Hb estão saturados com O 2 em 50%. Qual dessas proteínas tem maior afinidade pelo O 2 ?
2. Quais características estruturais do MB determinam sua alta afinidade pelo O 2 ?
3. Que características estruturais da Hb permitem que ela libere O 2 nos capilares dos tecidos em repouso (a uma pressão parcial de O 2 relativamente alta) e aumente drasticamente esse retorno nos músculos em atividade? Que propriedade das proteínas oligoméricas proporciona esse efeito?
4. Calcule que quantidade de O 2 (em%) fornece hemoglobina oxigenada ao músculo em repouso e em trabalho?
5. tirar conclusões sobre a relação entre a estrutura da proteína e sua função.
2. A quantidade de oxigênio liberada pela hemoglobina nos capilares depende da intensidade dos processos de catabolismo nos tecidos (efeito Bohr). Como as mudanças no metabolismo tecidual regulam a afinidade da Hb pelo O 2 ? Efeito de CO 2 e H+ na afinidade de Hb para O 2
 1. Descreva o efeito Bohr.
1. Descreva o efeito Bohr.
2. em que direção o processo mostrado no diagrama flui:
a) nos capilares dos pulmões;
b) nos capilares teciduais?
3. Qual é o significado fisiológico do efeito Bohr?
4. Por que a interação de Hb com H+ em sítios distantes do heme altera a afinidade da proteína pelo O 2 ?
3. A afinidade da Hb pelo O 2 depende da concentração de seu ligante, o 2,3-bifosfoglicerato, que é um regulador alostérico da afinidade da Hb pelo O 2 . Por que a interação do ligante em um sítio distante do sítio ativo afeta a função da proteína? Como o 2,3-BPG regula a afinidade da Hb pelo O 2 ? Para resolver o problema, responda às seguintes perguntas:
1. Onde e de que é sintetizado o 2,3-bifosfoglicerato (2,3-BPG)? Escreva sua fórmula, indique a carga dessa molécula.
2. Com que forma de hemoglobina (oxi ou desoxi) o BPG interage e por quê? Em qual região da molécula de Hb ocorre a interação?
3. em que direção o processo mostrado no diagrama prossegue?
a) nos capilares teciduais;
b) nos capilares dos pulmões?
4. onde deve ser a maior concentração do complexo
Nv-2,3-BFG:
a) nos capilares dos músculos em repouso,
b) nos capilares dos músculos em atividade (assumindo a mesma concentração de BPG nos eritrócitos)?
5. Como a afinidade da Hb pelo oxigênio mudará quando uma pessoa se adaptar a condições de altitude elevada, se a concentração de BPG nos eritrócitos aumentar? Qual é o significado fisiológico desse fenômeno?
4. A destruição de 2,3-BPG durante o armazenamento de sangue preservado interrompe as funções da Hb. Como a afinidade da Hb para O 2 no sangue preservado mudará se a concentração de 2,3-BPG nos eritrócitos puder diminuir de 8 para 0,5 mmol/l. É possível transfundir esse sangue para pacientes gravemente doentes se a concentração de 2,3-BPG for restaurada não antes de três dias? É possível restaurar as funções dos eritrócitos adicionando 2,3-BPG ao sangue?
5. Lembre-se da estrutura das moléculas de imunoglobulina mais simples. Qual o papel das imunoglobulinas no sistema imunológico? Por que as Igs são frequentemente chamadas de bivalentes? Como a estrutura das Igs está relacionada à sua função? (Descreva usando um exemplo de uma classe de imunoglobulinas.)
Propriedades físico-químicas das proteínas e métodos para a sua separação.
6. Como a carga líquida de uma proteína afeta sua solubilidade?
a) determinar a carga total do peptídeo em pH 7
Ala-Glu-Tre-Pro-Asp-Liz-Cis
b) como a carga desse peptídeo mudará em pH > 7, pH<7, рН <<7?
c) qual é o ponto isoelétrico de uma proteína (IEP) e em que ambiente ela se encontra
IET deste peptídeo?
d) em que valor de pH será observada a menor solubilidade deste peptídeo.
7. Por que o leite azedo, ao contrário do leite fresco, “coagula” quando fervido (ou seja, a proteína do leite caseína precipita)? As moléculas de caseína no leite fresco têm uma carga negativa.
8. A filtração em gel é usada para separar proteínas individuais. Uma mistura contendo proteínas A, B, C com massas moleculares iguais a 160.000, 80.000 e 60.000, respectivamente, foi analisada por filtração em gel (Fig. 1.35). Os grânulos de gel inchados são permeáveis a proteínas com peso molecular inferior a 70.000. Qual é o princípio subjacente a este método de separação? Qual dos gráficos representa corretamente os resultados do fracionamento? Especifique a ordem de liberação das proteínas A, B e C da coluna.
 Arroz. 1,35. Usando o Método de Filtração em Gel para Separar Proteínas
Arroz. 1,35. Usando o Método de Filtração em Gel para Separar Proteínas
9. Na fig. 1.36, A mostra um diagrama de eletroforese em papel de proteínas no soro sanguíneo de uma pessoa saudável. As quantidades relativas de frações de proteína obtidas usando este método são: albuminas 54-58%, α1-globulinas 6-7%, α2-globulinas 8-9%, β-globulinas 13%, γ-globulinas 11-12%.
 Arroz. 1.36 Eletroforese em papel de proteínas do plasma sanguíneo de uma pessoa saudável (A) e de um paciente (B)
Arroz. 1.36 Eletroforese em papel de proteínas do plasma sanguíneo de uma pessoa saudável (A) e de um paciente (B)
I - γ-globulinas; II - β-globulinas; III-α 2 - globulina; 4-α 2 - globulina; V - albuminas
Muitas doenças são acompanhadas por mudanças quantitativas na composição das proteínas do soro (disproteinemia). A natureza dessas alterações é levada em consideração ao fazer um diagnóstico e avaliar a gravidade e o estágio da doença.
Como você sabe, as proteínas são a base para a origem da vida em nosso planeta. Mas foi a gota de coacervado, constituída por moléculas peptídicas, que se tornou a base para o nascimento dos seres vivos. Isso é inquestionável, pois a análise da composição interna de qualquer representante da biomassa mostra que essas substâncias são encontradas em tudo: plantas, animais, microorganismos, fungos, vírus. Além disso, eles são muito diversos e de natureza macromolecular.
Essas estruturas têm quatro nomes, todos eles são sinônimos:
- proteínas;
- proteínas;
- polipeptídeos;
- peptídeos.
moléculas de proteína
Seu número é verdadeiramente incalculável. Neste caso, todas as moléculas de proteína podem ser divididas em dois grandes grupos:
- simples - consistem apenas em sequências de aminoácidos conectadas por ligações peptídicas;
- complexo - a estrutura e a estrutura da proteína são caracterizadas por grupos protolíticos (prostéticos) adicionais, também chamados de cofatores.
Além disso, moléculas complexas também têm sua própria classificação.
Gradação de peptídeos complexos
- As glicoproteínas são compostos intimamente relacionados de proteínas e carboidratos. Grupos prostéticos de mucopolissacarídeos são tecidos na estrutura da molécula.
- As lipoproteínas são um composto complexo de proteínas e lipídios.
- Metaloproteínas - íons metálicos (ferro, manganês, cobre e outros) atuam como um grupo prostético.
- Nucleoproteínas - a conexão de proteínas e ácidos nucleicos (DNA, RNA).
- Fosfoproteínas - a conformação de uma proteína e um resíduo de ácido ortofosfórico.
- As cromoproteínas são muito parecidas com as metaloproteínas, porém, o elemento que faz parte do grupo prostético é um complexo todo colorido (vermelho - hemoglobina, verde - clorofila e assim por diante).
Cada grupo considerado tem uma estrutura e propriedades de proteínas diferentes. As funções que desempenham também variam dependendo do tipo de molécula.

Estrutura química das proteínas
Deste ponto de vista, as proteínas são uma longa e maciça cadeia de resíduos de aminoácidos interligados por ligações específicas chamadas ligações peptídicas. Das estruturas laterais dos ácidos partem ramos - radicais. Esta estrutura da molécula foi descoberta por E. Fischer no início do século XXI.
Mais tarde, as proteínas, a estrutura e as funções das proteínas foram estudadas com mais detalhes. Ficou claro que existem apenas 20 aminoácidos que formam a estrutura do peptídeo, mas eles podem ser combinados de várias maneiras. Daí a diversidade de estruturas polipeptídicas. Além disso, no processo de vida e no desempenho de suas funções, as proteínas são capazes de sofrer uma série de transformações químicas. Como resultado, eles alteram a estrutura e um tipo de conexão completamente novo aparece.
Para quebrar a ligação peptídica, ou seja, quebrar a proteína, a estrutura das cadeias, você precisa escolher condições muito adversas (a ação de altas temperaturas, ácidos ou álcalis, um catalisador). Isto deve-se à elevada força da molécula, nomeadamente no grupo peptídico.

A detecção da estrutura da proteína em laboratório é realizada usando a reação do biureto - exposição ao polipeptídeo recém-precipitado (II). O complexo do grupo peptídico e o íon cobre dá uma cor violeta brilhante.
Existem quatro organizações estruturais principais, cada uma com suas próprias características estruturais de proteínas.
Níveis de organização: estrutura primária
Como mencionado acima, um peptídeo é uma sequência de resíduos de aminoácidos com ou sem inclusões, coenzimas. Assim, o nome principal é tal estrutura da molécula, que é natural, natural, é verdadeiramente aminoácidos conectados por ligações peptídicas e nada mais. Ou seja, um polipeptídeo de estrutura linear. Ao mesmo tempo, as características estruturais das proteínas de tal plano são que essa combinação de ácidos é decisiva para o desempenho das funções de uma molécula de proteína. Devido à presença dessas características, é possível não só identificar o peptídeo, mas também prever as propriedades e o papel de um completamente novo, ainda não descoberto. Exemplos de peptídeos com estrutura primária natural são insulina, pepsina, quimotripsina e outros.

Conformação secundária
A estrutura e as propriedades das proteínas nesta categoria mudam um pouco. Tal estrutura pode ser formada inicialmente a partir da natureza ou quando a estrutura primária é exposta a hidrólise severa, temperatura ou outras condições.
Esta conformação tem três variedades:
- Bobinas lisas, regulares e estereoregulares construídas a partir de resíduos de aminoácidos que giram em torno do eixo principal da conexão. Eles são mantidos juntos apenas por aqueles que surgem entre o oxigênio de um grupo peptídico e o hidrogênio de outro. Além disso, a estrutura é considerada correta devido ao fato de que as voltas são repetidas uniformemente a cada 4 links. Essa estrutura pode ser destro ou canhoto. Mas na maioria das proteínas conhecidas, o isômero dextrorotatório predomina. Tais conformações são chamadas de estruturas alfa.
- A composição e estrutura das proteínas do tipo seguinte difere da anterior, pois as ligações de hidrogênio são formadas não entre resíduos adjacentes a um lado da molécula, mas entre significativamente distantes e a uma distância suficientemente grande. Por esta razão, toda a estrutura assume a forma de várias cadeias polipeptídicas onduladas e serpentinas. Há uma característica que uma proteína deve apresentar. A estrutura dos aminoácidos nos ramos deve ser a mais curta possível, como glicina ou alanina, por exemplo. Esse tipo de conformação secundária é chamado de folhas beta pela capacidade de parecerem grudadas ao formar uma estrutura comum.
- A biologia refere-se ao terceiro tipo de estrutura proteica como fragmentos complexos, dispersos, desordenados, que não possuem estereorregularidade e são capazes de alterar a estrutura sob a influência de condições externas.
Não foram identificados exemplos de proteínas possuindo uma estrutura secundária por natureza.

Educação terciária
Esta é uma conformação bastante complexa chamada "glóbulo". O que é tal proteína? Sua estrutura é baseada na estrutura secundária, porém, novos tipos de interações entre os átomos dos grupos são adicionados, e toda a molécula parece se enrolar, focando assim no fato de que os grupos hidrofílicos são direcionados para dentro do glóbulo, e o os hidrofóbicos são para fora.
Isso explica a carga da molécula de proteína em soluções coloidais de água. Que tipos de interações estão presentes aqui?
- Ligações de hidrogênio - permanecem inalteradas entre as mesmas partes que na estrutura secundária.
- interações - ocorrem quando o polipeptídeo é dissolvido em água.
- Atração iônica - formada entre grupos de resíduos de aminoácidos (radicais) de cargas diferentes.
- Interações covalentes - são capazes de se formar entre sítios ácidos específicos - moléculas de cisteína, ou melhor, suas caudas.
Assim, a composição e estrutura de proteínas com estrutura terciária podem ser descritas como cadeias polipeptídicas dobradas em glóbulos que retêm e estabilizam sua conformação devido a vários tipos de interações químicas. Exemplos de tais peptídeos: fosfoglicerato kenase, tRNA, alfa-queratina, fibroína de seda e outros.
Estrutura quaternária
Este é um dos glóbulos mais complexos que as proteínas formam. A estrutura e as funções das proteínas deste tipo são muito versáteis e específicas.
O que é tal conformação? Estas são várias (em alguns casos dezenas) cadeias polipeptídicas grandes e pequenas que são formadas independentemente umas das outras. Mas então, devido às mesmas interações que consideramos para a estrutura terciária, todos esses peptídeos se torcem e se entrelaçam. Dessa forma, são obtidos glóbulos conformacionais complexos, que podem conter átomos de metal, grupos lipídicos e grupos de carboidratos. Exemplos de tais proteínas são DNA polimerase, envelope de vírus do tabaco, hemoglobina e outros.

Todas as estruturas peptídicas que consideramos têm seus próprios métodos de identificação em laboratório, baseados em modernas possibilidades de uso de cromatografia, centrifugação, microscopia eletrônica e óptica e altas tecnologias de computador.
Funções desempenhadas
A estrutura e a função das proteínas estão intimamente relacionadas entre si. Ou seja, cada peptídeo desempenha um determinado papel, único e específico. Há também aqueles que são capazes de realizar várias operações significativas em uma célula viva de uma só vez. No entanto, é possível expressar de forma generalizada as principais funções das moléculas de proteínas nos organismos dos seres vivos:
- Garantindo o movimento. Organismos unicelulares, ou organelas, ou alguns tipos de células são capazes de locomoção, contração e movimento. Isso é fornecido por proteínas que fazem parte da estrutura de seu aparelho motor: cílios, flagelos, membrana citoplasmática. Se falamos de células incapazes de se mover, as proteínas podem contribuir para sua contração (miosina muscular).
- Função nutricional ou de reserva. É o acúmulo de moléculas de proteína nos ovos, embriões e sementes de plantas para repor ainda mais os nutrientes que faltam. Quando clivados, os peptídeos fornecem aminoácidos e substâncias biologicamente ativas que são necessárias para o desenvolvimento normal dos organismos vivos.
- Função de energia. Além dos carboidratos, as proteínas também podem dar força ao corpo. Com a quebra de 1 g do peptídeo, 17,6 kJ de energia útil são liberados na forma de ácido adenosina trifosfórico (ATP), que é gasto em processos vitais.
- Sinal e Consiste na implementação de um acompanhamento cuidadoso dos processos em curso e na transmissão de sinais das células para os tecidos, destes para os órgãos, destes para os sistemas e assim sucessivamente. Um exemplo típico é a insulina, que fixa estritamente a quantidade de glicose no sangue.
- função do receptor. É realizado alterando a conformação do peptídeo em um lado da membrana e envolvendo a outra extremidade na reestruturação. Ao mesmo tempo, o sinal e as informações necessárias são transmitidos. Na maioria das vezes, essas proteínas são construídas nas membranas citoplasmáticas das células e exercem controle estrito sobre todas as substâncias que passam por elas. Eles também alertam sobre mudanças químicas e físicas no ambiente.
- Função de transporte de peptídeos. É realizado por proteínas de canal e proteínas transportadoras. Seu papel é óbvio - transportar as moléculas necessárias para locais com baixa concentração de partes com alta. Um exemplo típico é o transporte de oxigênio e dióxido de carbono através de órgãos e tecidos pela proteína hemoglobina. Eles também realizam a entrega de compostos com baixo peso molecular através da membrana celular no interior.
- função estrutural. Uma das mais importantes daquelas que a proteína realiza. A estrutura de todas as células, suas organelas são fornecidas precisamente por peptídeos. Eles, como uma moldura, definem a forma e a estrutura. Além disso, eles o suportam e o modificam, se necessário. Portanto, para crescimento e desenvolvimento, todos os organismos vivos precisam de proteínas na dieta. Esses peptídeos incluem elastina, tubulina, colágeno, actina, queratina e outros.
- função catalítica. As enzimas fazem isso. Numerosos e variados, eles aceleram todas as reações químicas e bioquímicas do corpo. Sem a participação deles, uma maçã comum no estômago poderia ser digerida em apenas dois dias, com alta probabilidade de apodrecer. Sob a ação da catalase, peroxidase e outras enzimas, esse processo leva duas horas. Em geral, é graças a esse papel das proteínas que se realiza o anabolismo e o catabolismo, ou seja, plástico e

Papel protetor
Existem vários tipos de ameaças que as proteínas são projetadas para proteger o corpo.
Primeiro, reagentes traumáticos, gases, moléculas, substâncias de vários espectros de ação. Peptídeos são capazes de entrar em interação química com eles, convertendo-os em uma forma inofensiva ou simplesmente neutralizando-os.
Em segundo lugar, há uma ameaça física de feridas - se a proteína fibrinogênio não for transformada em fibrina a tempo no local da lesão, o sangue não coagulará, o que significa que o bloqueio não ocorrerá. Então, pelo contrário, você precisará do peptídeo de plasmina, que é capaz de resolver o coágulo e restaurar a permeabilidade do vaso.
Em terceiro lugar, a ameaça à imunidade. A estrutura e o significado das proteínas que formam as defesas imunológicas são extremamente importantes. Anticorpos, imunoglobulinas, interferons são todos elementos importantes e significativos do sistema linfático e imunológico humano. Qualquer partícula estranha, molécula nociva, parte morta da célula ou toda a estrutura é submetida a investigação imediata pelo composto peptídico. É por isso que uma pessoa pode independentemente, sem a ajuda de medicamentos, proteger-se diariamente de infecções e vírus simples.
Propriedades físicas
A estrutura de uma proteína celular é muito específica e depende da função desempenhada. Mas as propriedades físicas de todos os peptídeos são semelhantes e se resumem às seguintes características.
- O peso da molécula é de até 1.000.000 Daltons.
- Sistemas coloidais são formados em uma solução aquosa. Lá, a estrutura adquire uma carga que pode variar dependendo da acidez do meio.
- Quando expostos a condições adversas (irradiação, ácido ou alcalino, temperatura e assim por diante), eles são capazes de passar para outros níveis de conformações, ou seja, desnaturar. Este processo é irreversível em 90% dos casos. No entanto, há também uma mudança inversa - renaturação.
Estas são as principais propriedades das características físicas dos peptídeos.
