730. कुछ तंत्रों को ठंडा करने के लिए पानी का उपयोग क्यों किया जाता है?
पानी में उच्च विशिष्ट ताप क्षमता होती है, जो तंत्र से अच्छी गर्मी हटाने में योगदान करती है।
731. किस मामले में अधिक ऊर्जा खर्च की जानी चाहिए: एक लीटर पानी को 1 डिग्री सेल्सियस गर्म करने के लिए या एक सौ ग्राम पानी को 1 डिग्री सेल्सियस गर्म करने के लिए?
एक लीटर पानी गर्म करने के लिए, चूंकि द्रव्यमान जितना बड़ा होता है, उतनी ही अधिक ऊर्जा खर्च करने की आवश्यकता होती है।
732. समान द्रव्यमान के क्यूप्रोनिकेल और चांदी के कांटे गर्म पानी में डूबे हुए थे। क्या उन्हें पानी से उतनी ही मात्रा में ऊष्मा प्राप्त होती है?
एक कप्रोनिकेल कांटा अधिक गर्मी प्राप्त करेगा, क्योंकि कप्रोनिकेल की विशिष्ट गर्मी चांदी की तुलना में अधिक होती है।
733. सीसे का एक टुकड़ा और एक ही द्रव्यमान का कच्चा लोहा का एक टुकड़ा एक हथौड़े से तीन बार मारा गया। कौन सा हिस्सा गर्म हो गया?
सीसा अधिक गर्म होगा क्योंकि इसकी विशिष्ट ऊष्मा क्षमता कच्चा लोहा से कम है, और सीसा को गर्म करने के लिए कम ऊर्जा की आवश्यकता होती है।
734. एक फ्लास्क में पानी है, दूसरे में समान द्रव्यमान और तापमान का मिट्टी का तेल है। समान रूप से गर्म किए गए लोहे के घन को प्रत्येक फ्लास्क में फेंका गया। उच्च तापमान तक क्या गर्म होगा - पानी या मिट्टी का तेल?
मिटटी तेल।
735. समुद्र के किनारे के शहरों में अंतर्देशीय शहरों की तुलना में सर्दियों और गर्मियों में तापमान में उतार-चढ़ाव कम तेज क्यों होता है?
पानी गर्म होता है और हवा की तुलना में धीमी गति से ठंडा होता है। सर्दियों में, यह ठंडा हो जाता है और गर्म हवा को जमीन पर ले जाता है, जिससे तट पर जलवायु गर्म हो जाती है।
736. एल्युमिनियम की विशिष्ट ऊष्मा क्षमता 920 J/kg °C है। इसका क्या मतलब है?
इसका मतलब है कि 1 किलो एल्युमिनियम को 1 डिग्री सेल्सियस गर्म करने में 920 J लगता है।
737. 1 किलो के समान द्रव्यमान के एल्यूमीनियम और तांबे की सलाखों को 1 डिग्री सेल्सियस तक ठंडा किया जाता है। प्रत्येक ब्लॉक की आंतरिक ऊर्जा में कितना परिवर्तन होगा? कौन सा बार ज्यादा बदलेगा और कितना बदलेगा?
738. एक किलोग्राम लोहे के बिलेट को 45 डिग्री सेल्सियस तक गर्म करने के लिए कितनी मात्रा में ऊष्मा की आवश्यकता होती है?

739. 0.25 किग्रा जल को 30°C से 50°C तक गर्म करने के लिए कितनी ऊष्मा की आवश्यकता होती है?

740. 5 डिग्री सेल्सियस गर्म करने पर दो लीटर पानी की आंतरिक ऊर्जा कैसे बदलेगी?

741. 5 ग्राम पानी को 20 डिग्री सेल्सियस से 30 डिग्री सेल्सियस तक गर्म करने के लिए कितनी गर्मी की आवश्यकता होती है?
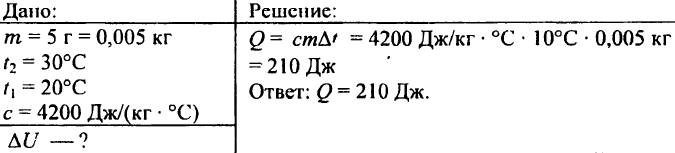
742. 0.03 किग्रा भार वाली एक एल्युमिनियम की गेंद को 72 °C तक गर्म करने के लिए कितनी ऊष्मा की आवश्यकता होती है?

743. 15 किलो तांबे को 80 डिग्री सेल्सियस गर्म करने के लिए आवश्यक गर्मी की मात्रा की गणना करें।
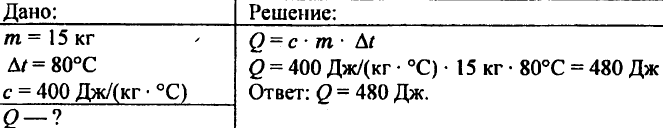
744. 5 किलो तांबे को 10 डिग्री सेल्सियस से 200 डिग्री सेल्सियस तक गर्म करने के लिए आवश्यक गर्मी की मात्रा की गणना करें।

745. 0.2 किग्रा जल को 15°C से 20°C तक गर्म करने के लिए कितनी ऊष्मा की आवश्यकता होती है?

746. 0.3 किलो वजन का पानी 20 डिग्री सेल्सियस तक ठंडा हो गया है। पानी की आंतरिक ऊर्जा कितनी कम हो जाती है?

747. 0.4 किलो पानी को 20 डिग्री सेल्सियस के तापमान पर 30 डिग्री सेल्सियस के तापमान पर गर्म करने के लिए कितनी गर्मी की आवश्यकता होती है?

748. 2.5 किग्रा जल को 20°C तक गर्म करने पर कितनी ऊष्मा खर्च होती है?
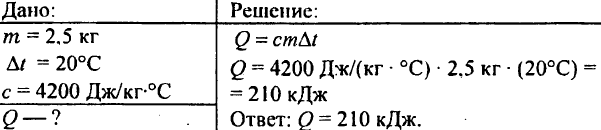
749. 250 ग्राम पानी को 90 डिग्री सेल्सियस से 40 डिग्री सेल्सियस तक ठंडा करने पर कितनी गर्मी निकलती है?
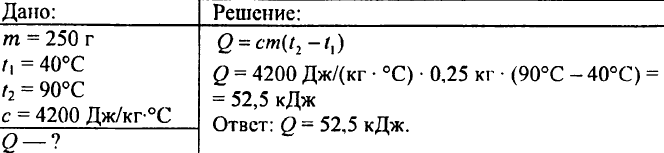
750. 0.015 लीटर पानी को 1 °C गर्म करने के लिए कितनी ऊष्मा की आवश्यकता होती है?

751. 300 m3 के आयतन वाले तालाब को 10 °C गर्म करने के लिए आवश्यक ऊष्मा की मात्रा की गणना करें?
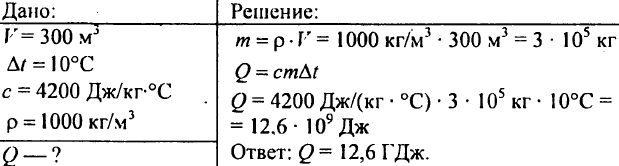
752. 1 किलो पानी का तापमान 30°C से 40°C तक बढ़ाने के लिए उसे कितनी ऊष्मा देनी चाहिए?

753. 10 लीटर की मात्रा वाला पानी 100 डिग्री सेल्सियस के तापमान से 40 डिग्री सेल्सियस के तापमान तक ठंडा हो गया है। इस मामले में कितनी गर्मी निकलती है?

754. 1 m3 रेत को 60 °C गर्म करने के लिए आवश्यक ऊष्मा की मात्रा की गणना करें।

755. वायु मात्रा 60 एम 3, विशिष्ट ताप क्षमता 1000 जे / किग्रा डिग्री सेल्सियस, वायु घनत्व 1.29 किग्रा / एम 3। इसे 22°C तक बढ़ाने के लिए कितनी ऊष्मा की आवश्यकता है?

756. पानी को 10 ° C गर्म किया गया, जिससे 4.20 103 J ऊष्मा खर्च हुई। पानी की मात्रा निर्धारित करें।
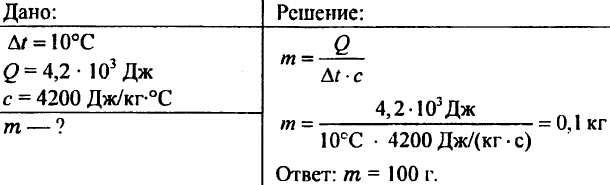
757. 0.5 किलो वजन वाले पानी में 20.95 kJ गर्मी बताई गई। पानी का तापमान क्या था यदि पानी का प्रारंभिक तापमान 20 डिग्री सेल्सियस था?

758. 10 डिग्री सेल्सियस पर 8 किलो पानी 2.5 किलो वजन वाले तांबे के बर्तन में डाला जाता है। एक बर्तन में पानी को उबालने के लिए कितनी गर्मी चाहिए?

759. 15 डिग्री सेल्सियस के तापमान पर एक लीटर पानी 300 ग्राम वजन की तांबे की करछुल में डाला जाता है। करछुल में पानी को 85 डिग्री सेल्सियस तक गर्म करने के लिए कितनी गर्मी की आवश्यकता होती है?

760. 3 किलो वजन के गर्म ग्रेनाइट का एक टुकड़ा पानी में रखा जाता है। ग्रेनाइट 12.6 kJ गर्मी को पानी में स्थानांतरित करता है, 10 डिग्री सेल्सियस तक ठंडा करता है। पत्थर की विशिष्ट ऊष्मा क्षमता क्या है?

761. 50 डिग्री सेल्सियस पर गर्म पानी 12 डिग्री सेल्सियस पर 5 किलो पानी में मिलाया गया, जिससे 30 डिग्री सेल्सियस के तापमान के साथ मिश्रण प्राप्त हुआ। कितना पानी डाला?

762. 40°C पर पानी प्राप्त करने के लिए 60°C पर 3 लीटर पानी में 20°C पर पानी मिलाया गया। कितना पानी डाला?

763. मिश्रण का तापमान क्या होगा यदि 80 डिग्री सेल्सियस पर 600 ग्राम पानी को 20 डिग्री सेल्सियस पर 200 ग्राम पानी के साथ मिलाया जाए?

764. 90°C पर एक लीटर पानी 10°C पर पानी में डाला गया, और पानी का तापमान 60°C हो गया। कितना ठंडा पानी था?

765. निर्धारित करें कि एक बर्तन में 60 डिग्री सेल्सियस तक गर्म किया गया कितना गर्म पानी डाला जाना चाहिए यदि बर्तन में पहले से ही 15 डिग्री सेल्सियस के तापमान पर 20 लीटर ठंडा पानी है; मिश्रण का तापमान 40 डिग्री सेल्सियस होना चाहिए।

766. निर्धारित करें कि 425 ग्राम पानी को 20 डिग्री सेल्सियस गर्म करने के लिए कितनी गर्मी की आवश्यकता है।

767. अगर पानी 167.2 kJ प्राप्त करता है तो 5 किलो पानी कितने डिग्री गर्म होगा?

768. तापमान t1 से तापमान t2 पर m ग्राम पानी को गर्म करने के लिए कितनी गर्मी की आवश्यकता होती है?
769. एक कैलोरीमीटर में 15°C ताप पर 2 kg जल डाला जाता है। कैलोरीमीटर का पानी किस तापमान तक गर्म होगा यदि 500 ग्राम का पीतल का वजन 100 डिग्री सेल्सियस तक गर्म किया जाता है? पीतल की विशिष्ट ऊष्मा क्षमता 0.37 kJ/(kg °C) है।
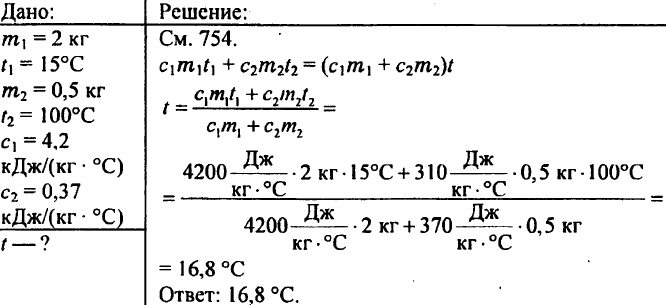
770. तांबे, टिन और एल्यूमीनियम के समान आयतन के टुकड़े हैं। इनमें से किस टुकड़े में सबसे बड़ी और सबसे छोटी ताप क्षमता है?

771. 450 ग्राम पानी, जिसका तापमान 20 डिग्री सेल्सियस है, कैलोरीमीटर में डाला गया था। जब 200 ग्राम लोहे के बुरादे को 100°C तक गर्म करके इस पानी में डुबोया गया, तो पानी का तापमान 24°C हो गया। चूरा की विशिष्ट ताप क्षमता निर्धारित करें।

772. 100 ग्राम वजन वाले तांबे के कैलोरीमीटर में 738 ग्राम पानी होता है, जिसका तापमान 15 डिग्री सेल्सियस होता है। इस कैलोरीमीटर में 200 ग्राम तांबे को 100 डिग्री सेल्सियस के तापमान पर उतारा गया, जिसके बाद कैलोरीमीटर का तापमान बढ़कर 17 डिग्री सेल्सियस हो गया। तांबे की विशिष्ट ऊष्मा क्षमता क्या है?

773. 10 ग्राम वजन वाली स्टील की गेंद को भट्ठी से बाहर निकाला जाता है और 10 डिग्री सेल्सियस के तापमान पर पानी में उतारा जाता है। पानी का तापमान 25 डिग्री सेल्सियस तक बढ़ गया। यदि पानी का द्रव्यमान 50 ग्राम है तो ओवन में गेंद का तापमान क्या था? स्टील की विशिष्ट ऊष्मा क्षमता 0.5 kJ/(kg °C) है।

777. 19 डिग्री सेल्सियस पर 50 ग्राम पानी 35 डिग्री सेल्सियस के तापमान पर 150 ग्राम वजन वाले पानी में डाला जाता है। मिश्रण का तापमान क्या है?

778. 90 डिग्री सेल्सियस पर 5 किलो वजन वाले पानी को 10 डिग्री सेल्सियस के तापमान पर 2 किलो वजन वाले कच्चे लोहे की केतली में डाला गया। पानी का तापमान क्या था?

779. 2 किलो वजन वाली स्टील की छेनी को 800 डिग्री सेल्सियस के तापमान पर गर्म किया गया और फिर 10 डिग्री सेल्सियस के तापमान पर 15 लीटर पानी वाले बर्तन में उतारा गया। बर्तन में पानी किस तापमान पर गर्म किया जाएगा?

(संकेत। इस समस्या को हल करने के लिए, एक समीकरण बनाना आवश्यक है जिसमें कटर को कम करने के बाद बर्तन में पानी का वांछित तापमान अज्ञात के रूप में लिया जाता है।)
780. यदि आप 0.02 किलो पानी 15 डिग्री सेल्सियस, 0.03 किलो पानी 25 डिग्री सेल्सियस और 0.01 किलो पानी 60 डिग्री सेल्सियस पर मिलाते हैं तो पानी कितना तापमान प्राप्त करेगा?
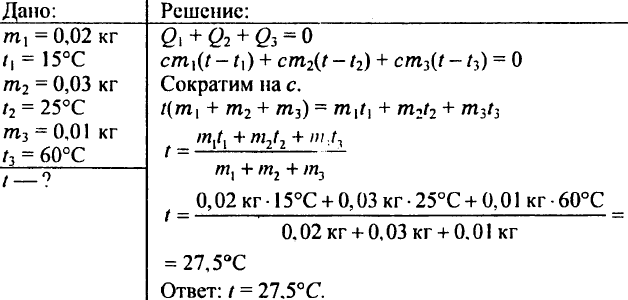
781. एक अच्छी तरह हवादार वर्ग को गर्म करने के लिए प्रति घंटे 4.19 एमजे की गर्मी की आवश्यकता होती है। पानी हीटिंग रेडिएटर्स में 80 डिग्री सेल्सियस पर प्रवेश करता है और 72 डिग्री सेल्सियस पर बाहर निकलता है। प्रत्येक घंटे रेडिएटर्स को कितना पानी दिया जाना चाहिए?

782. 100 डिग्री सेल्सियस के तापमान पर 0.1 किलोग्राम वजन वाले लेड को 0.04 किलोग्राम वजन वाले एल्यूमीनियम कैलोरीमीटर में 0.24 किलोग्राम पानी में 15 डिग्री सेल्सियस के तापमान पर डुबोया गया। उसके बाद, कैलोरीमीटर में 16 डिग्री सेल्सियस का तापमान स्थापित किया गया था। लेड की विशिष्ट ऊष्मा धारिता क्या है?

चूल्हे पर क्या तेजी से गर्म होता है - केतली या पानी की बाल्टी? उत्तर स्पष्ट है - एक केतली। फिर दूसरा सवाल यह है कि क्यों?
उत्तर कम स्पष्ट नहीं है - क्योंकि केतली में पानी का द्रव्यमान कम होता है। बढ़िया। और अब आप सबसे वास्तविक शारीरिक अनुभव घर पर स्वयं कर सकते हैं। ऐसा करने के लिए, आपको दो समान छोटे सॉस पैन, समान मात्रा में पानी और वनस्पति तेल की आवश्यकता होगी, उदाहरण के लिए, आधा लीटर प्रत्येक और एक स्टोव। एक ही आग पर तेल और पानी के बर्तन रखें। और अब बस देखें कि क्या तेजी से गर्म होगा। यदि तरल पदार्थों के लिए थर्मामीटर है, तो आप इसका उपयोग कर सकते हैं, यदि नहीं, तो आप समय-समय पर अपनी उंगली से तापमान की जांच कर सकते हैं, बस सावधान रहें कि आप खुद को जलाएं नहीं। किसी भी मामले में, आप जल्द ही देखेंगे कि तेल पानी की तुलना में काफी तेजी से गर्म होता है। और एक और सवाल, जिसे अनुभव के रूप में भी लागू किया जा सकता है। कौन तेजी से उबलता है - गर्म पानी या ठंडा? सब कुछ फिर से स्पष्ट है - गर्म सबसे पहले खत्म होगा। ये सब अजीब सवाल और प्रयोग क्यों? "ऊष्मा की मात्रा" नामक भौतिक मात्रा निर्धारित करने के लिए।
गर्मी की मात्रा
गर्मी की मात्रा वह ऊर्जा है जो शरीर गर्मी हस्तांतरण के दौरान खो देता है या प्राप्त करता है। यह नाम से स्पष्ट है। ठंडा होने पर, शरीर एक निश्चित मात्रा में गर्मी खो देगा, और गर्म होने पर यह अवशोषित हो जाएगा। और हमारे सवालों के जवाब ने हमें दिखाया ऊष्मा की मात्रा किस पर निर्भर करती है?सबसे पहले, शरीर का द्रव्यमान जितना अधिक होता है, उतनी ही अधिक ऊष्मा की मात्रा को उसके तापमान को एक डिग्री बदलने के लिए खर्च करना पड़ता है। दूसरे, किसी पिंड को गर्म करने के लिए आवश्यक ऊष्मा की मात्रा उस पदार्थ पर निर्भर करती है जिससे वह बना है, अर्थात पदार्थ के प्रकार पर। और तीसरा, गर्मी हस्तांतरण से पहले और बाद में शरीर के तापमान में अंतर भी हमारी गणना के लिए महत्वपूर्ण है। पूर्वगामी के आधार पर, हम कर सकते हैं ऊष्मा की मात्रा सूत्र द्वारा ज्ञात कीजिए :
क्यू=सेमी(t_2-t_1) ,
जहां क्यू गर्मी की मात्रा है,
एम - शरीर का वजन,
(t_2-t_1) - प्रारंभिक और अंतिम शरीर के तापमान के बीच का अंतर,
सी - पदार्थ की विशिष्ट ताप क्षमता, संबंधित तालिकाओं से पाई जाती है।
इस सूत्र का उपयोग करके, आप किसी भी पिंड को गर्म करने के लिए आवश्यक ऊष्मा की मात्रा की गणना कर सकते हैं या यह कि यह शरीर ठंडा होने पर छोड़ेगा।
ऊष्मा की मात्रा को किसी अन्य प्रकार की ऊर्जा की तरह जूल (1 J) में मापा जाता है। हालांकि, यह मान बहुत पहले नहीं पेश किया गया था, और लोगों ने गर्मी की मात्रा को बहुत पहले ही मापना शुरू कर दिया था। और उन्होंने एक ऐसी इकाई का उपयोग किया जो हमारे समय में व्यापक रूप से उपयोग की जाती है - एक कैलोरी (1 कैलोरी)। 1 कैलोरी 1 ग्राम पानी के तापमान को 1 डिग्री सेल्सियस बढ़ाने के लिए आवश्यक ऊष्मा की मात्रा है। इन आंकड़ों के आधार पर, अपने द्वारा खाए जाने वाले भोजन में कैलोरी गिनने के प्रेमी, रुचि के लिए, गणना कर सकते हैं कि दिन के दौरान वे भोजन के साथ कितनी ऊर्जा का उपभोग करते हैं, कितने लीटर पानी उबाला जा सकता है।
कार्य करने से आंतरिक ऊर्जा में परिवर्तन कार्य की मात्रा की विशेषता है, अर्थात। कार्य किसी दी गई प्रक्रिया में आंतरिक ऊर्जा में परिवर्तन का एक उपाय है। ऊष्मा स्थानांतरण के दौरान किसी पिंड की आंतरिक ऊर्जा में परिवर्तन की विशेषता ऊष्मा की मात्रा कहलाने वाली मात्रा से होती है।
बिना काम किए ही गर्मी हस्तांतरण की प्रक्रिया में शरीर की आंतरिक ऊर्जा में परिवर्तन होता है। ऊष्मा की मात्रा को अक्षर द्वारा निरूपित किया जाता है क्यू .
कार्य, आंतरिक ऊर्जा और ऊष्मा की मात्रा को एक ही इकाई में मापा जाता है - जूल ( जे), ऊर्जा के किसी अन्य रूप की तरह।
थर्मल माप में, ऊर्जा की एक विशेष इकाई, कैलोरी ( मल), के बराबर 1 ग्राम पानी के तापमान को 1 डिग्री सेल्सियस बढ़ाने के लिए आवश्यक ऊष्मा की मात्रा (अधिक सटीक रूप से, 19.5 से 20.5 डिग्री सेल्सियस तक)। यह इकाई, विशेष रूप से, वर्तमान में अपार्टमेंट इमारतों में गर्मी (तापीय ऊर्जा) की खपत की गणना में उपयोग की जाती है। अनुभवजन्य रूप से, ऊष्मा के यांत्रिक समतुल्य को स्थापित किया गया है - कैलोरी और जूल के बीच का अनुपात: 1 कैल = 4.2 जे.

जब कोई पिंड बिना काम किए ही एक निश्चित मात्रा में ऊष्मा स्थानांतरित करता है, तो उसकी आंतरिक ऊर्जा बढ़ जाती है, यदि कोई शरीर एक निश्चित मात्रा में ऊष्मा छोड़ता है, तो उसकी आंतरिक ऊर्जा कम हो जाती है।
यदि आप दो समान बर्तनों में 100 ग्राम पानी और दूसरे में 400 ग्राम पानी समान तापमान पर डालकर उसी बर्नर पर डालते हैं, तो पहले बर्तन में पानी पहले उबल जाएगा। इस प्रकार, शरीर का द्रव्यमान जितना अधिक होता है, उतनी ही अधिक ऊष्मा की मात्रा को गर्म करने की आवश्यकता होती है। वही शीतलन के लिए जाता है।

किसी पिंड को गर्म करने के लिए आवश्यक ऊष्मा की मात्रा इस बात पर भी निर्भर करती है कि यह शरीर किस प्रकार के पदार्थ से बना है। पदार्थ के प्रकार पर शरीर को गर्म करने के लिए आवश्यक ऊष्मा की मात्रा की यह निर्भरता एक भौतिक मात्रा की विशेषता है जिसे कहा जाता है विशिष्ट गर्मी की क्षमता पदार्थ।
- यह एक भौतिक मात्रा है जो ऊष्मा की मात्रा के बराबर होती है जिसे किसी पदार्थ को 1 ° C (या 1 K) गर्म करने के लिए 1 किलो पदार्थ को सूचित किया जाना चाहिए। 1 डिग्री सेल्सियस तक ठंडा करने पर पदार्थ के 1 किलो द्वारा उतनी ही मात्रा में ऊष्मा निकलती है।
विशिष्ट ताप क्षमता को अक्षर द्वारा दर्शाया जाता है साथ. विशिष्ट ऊष्मा धारिता की इकाई है 1 जे/किलो डिग्री सेल्सियसया 1 जे/किलो डिग्री के।
पदार्थों की विशिष्ट ऊष्मा धारिता के मान प्रयोगात्मक रूप से निर्धारित किए जाते हैं। तरल पदार्थों में धातुओं की तुलना में उच्च विशिष्ट ताप क्षमता होती है; पानी की विशिष्ट ऊष्मा क्षमता सबसे अधिक होती है, सोने की विशिष्ट ऊष्मा क्षमता बहुत कम होती है।
चूँकि ऊष्मा की मात्रा शरीर की आंतरिक ऊर्जा में परिवर्तन के बराबर होती है, इसलिए हम कह सकते हैं कि विशिष्ट ऊष्मा क्षमता यह दर्शाती है कि आंतरिक ऊर्जा में कितना परिवर्तन होता है। 1 किलोग्रामपदार्थ जब उसका तापमान बदलता है 1 डिग्री सेल्सियस. विशेष रूप से, 1 किलो लेड की आंतरिक ऊर्जा, जब इसे 1 °C गर्म किया जाता है, तो 140 J बढ़ जाती है, और जब इसे ठंडा किया जाता है, तो यह 140 J कम हो जाती है।
क्यूशरीर द्रव्यमान को गर्म करने के लिए आवश्यक एमतापमान टी 1 डिग्रीСतापमान तक टी 2 डिग्रीС, पदार्थ की विशिष्ट गर्मी क्षमता, शरीर द्रव्यमान और अंतिम और प्रारंभिक तापमान के बीच के अंतर के उत्पाद के बराबर है, अर्थात।क्यू \u003d सी एम (टी 2 - टी 1)
उसी सूत्र के अनुसार, ठंडा होने पर शरीर जितनी गर्मी देता है, उसकी गणना भी की जाती है। केवल इस मामले में अंतिम तापमान को प्रारंभिक तापमान से घटाया जाना चाहिए, अर्थात। छोटे तापमान को बड़े तापमान से घटाएं।

यह इस विषय पर एक सारांश है। "गर्मी की मात्रा। विशिष्ट ताप". अगले चरण चुनें:
- अगले सार पर जाएँ:
« भौतिकी - ग्रेड 10 "
पदार्थ का समग्र परिवर्तन किन प्रक्रियाओं में होता है?
पदार्थ की अवस्था को कैसे बदला जा सकता है?
आप किसी भी पिंड की आंतरिक ऊर्जा को काम करके, गर्म करके या, इसके विपरीत, ठंडा करके बदल सकते हैं।
इस प्रकार, धातु की फोर्जिंग करते समय, काम किया जाता है और इसे गर्म किया जाता है, जबकि साथ ही धातु को जलती हुई लौ पर गर्म किया जा सकता है।
साथ ही, यदि पिस्टन स्थिर है (चित्र 13.5), तो गर्म करने पर गैस का आयतन नहीं बदलता है और कोई कार्य नहीं होता है। लेकिन गैस का तापमान और इसलिए इसकी आंतरिक ऊर्जा बढ़ जाती है।
आंतरिक ऊर्जा बढ़ और घट सकती है, इसलिए गर्मी की मात्रा सकारात्मक या नकारात्मक हो सकती है।
बिना कार्य किये एक पिंड से दूसरे पिंड में ऊर्जा के स्थानान्तरण की प्रक्रिया कहलाती है गर्मी विनिमय.
गर्मी हस्तांतरण के दौरान आंतरिक ऊर्जा में परिवर्तन की मात्रात्मक माप को कहा जाता है गर्मी की मात्रा.
गर्मी हस्तांतरण की आणविक तस्वीर।
पिंडों के बीच की सीमा पर गर्मी के आदान-प्रदान के दौरान, ठंडे शरीर के धीरे-धीरे चलने वाले अणु गर्म शरीर के तेजी से गतिमान अणुओं के साथ बातचीत करते हैं। नतीजतन, अणुओं की गतिज ऊर्जा बराबर हो जाती है और ठंडे शरीर के अणुओं की गति बढ़ जाती है, जबकि गर्म शरीर के अणुओं की गति कम हो जाती है।
हीट एक्सचेंज के दौरान, ऊर्जा का एक रूप से दूसरे रूप में रूपांतरण नहीं होता है, एक गर्म शरीर की आंतरिक ऊर्जा का हिस्सा कम गर्म शरीर में स्थानांतरित हो जाता है।
गर्मी और गर्मी क्षमता की मात्रा।
आप पहले से ही जानते हैं कि तापमान t 1 से तापमान t 2 तक द्रव्यमान m वाले किसी पिंड को गर्म करने के लिए, उसमें ऊष्मा की मात्रा को स्थानांतरित करना आवश्यक है:
क्यू \u003d सेमी (टी 2 - टी 1) \u003d सेमी t। (13.5)
जब शरीर ठंडा होता है, तो उसका अंतिम तापमान t2 प्रारंभिक तापमान t1 से कम हो जाता है और शरीर द्वारा छोड़ी गई गर्मी की मात्रा नकारात्मक होती है।
गुणांक c को सूत्र (13.5) में कहा जाता है विशिष्ट गर्मी की क्षमतापदार्थ।
विशिष्ट ताप- यह संख्यात्मक रूप से गर्मी की मात्रा के बराबर एक मान है जो 1 किलो के द्रव्यमान वाला पदार्थ प्राप्त करता है या छोड़ देता है जब उसका तापमान 1 के बदलता है।
गैसों की विशिष्ट ऊष्मा क्षमता उस प्रक्रिया पर निर्भर करती है जिसके द्वारा ऊष्मा का स्थानांतरण होता है। यदि आप किसी गैस को स्थिर दाब पर गर्म करते हैं, तो वह फैल जाएगी और कार्य करेगी। स्थिर दाब पर किसी गैस को 1 °C तक गर्म करने के लिए, उसे स्थिर आयतन पर गर्म करने की अपेक्षा अधिक ऊष्मा स्थानांतरित करने की आवश्यकता होती है, जब गैस केवल गर्म होगी।
तरल पदार्थ और ठोस गर्म करने पर थोड़ा फैलते हैं। स्थिर आयतन और स्थिर दबाव पर उनकी विशिष्ट ऊष्मा क्षमताएँ बहुत कम होती हैं।
वाष्पीकरण की विशिष्ट ऊष्मा।
उबलने की प्रक्रिया के दौरान एक तरल को वाष्प में बदलने के लिए, इसमें एक निश्चित मात्रा में ऊष्मा को स्थानांतरित करना आवश्यक है। किसी द्रव को उबालने पर उसका तापमान नहीं बदलता है। एक स्थिर तापमान पर तरल के वाष्प में परिवर्तन से अणुओं की गतिज ऊर्जा में वृद्धि नहीं होती है, बल्कि उनकी बातचीत की संभावित ऊर्जा में वृद्धि होती है। आखिरकार, गैस के अणुओं के बीच की औसत दूरी तरल अणुओं के बीच की तुलना में बहुत अधिक है।
संख्यात्मक रूप से एक स्थिर तापमान पर 1 किलो तरल को भाप में बदलने के लिए आवश्यक ऊष्मा की मात्रा के बराबर मान कहलाता है वाष्पीकरण की विशिष्ट ऊष्मा.
तरल वाष्पीकरण की प्रक्रिया किसी भी तापमान पर होती है, जबकि सबसे तेज़ अणु तरल छोड़ देते हैं, और वाष्पीकरण के दौरान यह ठंडा हो जाता है। वाष्पीकरण की विशिष्ट ऊष्मा वाष्पीकरण की विशिष्ट ऊष्मा के बराबर होती है।
यह मान अक्षर r द्वारा निरूपित किया जाता है और जूल प्रति किलोग्राम (J / kg) में व्यक्त किया जाता है।
पानी के वाष्पीकरण की विशिष्ट ऊष्मा बहुत अधिक होती है: r H20 = 2.256 10 6 J/kg 100 °C के तापमान पर। अन्य तरल पदार्थों में, जैसे अल्कोहल, ईथर, पारा, मिट्टी के तेल में, वाष्पीकरण की विशिष्ट गर्मी पानी की तुलना में 3-10 गुना कम होती है।
द्रव्यमान m के एक द्रव को भाप में बदलने के लिए, ऊष्मा की मात्रा के बराबर की आवश्यकता होती है:
क्यू पी \u003d आरएम। (13.6)
जब भाप संघनित होती है, तो उतनी ही मात्रा में ऊष्मा निकलती है:
क्यू के \u003d -आरएम। (13.7)
संलयन की विशिष्ट ऊष्मा।
जब एक क्रिस्टलीय पिंड पिघलता है, तो उसे आपूर्ति की जाने वाली सारी गर्मी अणुओं की बातचीत की संभावित ऊर्जा को बढ़ाने के लिए जाती है। अणुओं की गतिज ऊर्जा में परिवर्तन नहीं होता है, क्योंकि गलनांक स्थिर तापमान पर होता है।
संख्यात्मक रूप से 1 किलो वजन वाले क्रिस्टलीय पदार्थ को गलनांक पर द्रव में बदलने के लिए आवश्यक ऊष्मा की मात्रा के बराबर मान कहलाता है संलयन की विशिष्ट ऊष्माऔर अक्षर द्वारा निरूपित किए जाते हैं।
1 किलो द्रव्यमान वाले पदार्थ के क्रिस्टलीकरण के दौरान, उतनी ही मात्रा में ऊष्मा निकलती है जितनी पिघलने के दौरान अवशोषित होती है।
बर्फ के पिघलने की विशिष्ट ऊष्मा अपेक्षाकृत अधिक होती है: 3.34 10 5 J/kg।
"यदि बर्फ में संलयन की उच्च गर्मी नहीं होती, तो वसंत ऋतु में बर्फ के पूरे द्रव्यमान को कुछ मिनटों या सेकंड में पिघलना पड़ता, क्योंकि गर्मी लगातार हवा से बर्फ में स्थानांतरित हो जाती है। इसके परिणाम भयानक होंगे; क्योंकि वर्तमान स्थिति में भी बड़ी बाढ़ और पानी की बड़ी धाराएँ बर्फ या बर्फ के बड़े समूह के पिघलने से उत्पन्न होती हैं।” आर. ब्लैक, 18वीं सदी
द्रव्यमान m के क्रिस्टलीय पिंड को पिघलाने के लिए, ऊष्मा की मात्रा की आवश्यकता होती है:
क्यूपीएल \u003d m। (13.8)
शरीर के क्रिस्टलीकरण के दौरान निकलने वाली ऊष्मा की मात्रा बराबर होती है:
क्यू करोड़ = -λm (13.9)
गर्मी संतुलन समीकरण।
एक प्रणाली के भीतर गर्मी विनिमय पर विचार करें जिसमें शुरू में अलग-अलग तापमान वाले कई निकाय होते हैं, उदाहरण के लिए, एक बर्तन में पानी के बीच गर्मी का आदान-प्रदान और एक गर्म लोहे की गेंद को पानी में उतारा जाता है। ऊर्जा संरक्षण के नियम के अनुसार, एक पिंड द्वारा दी गई ऊष्मा की मात्रा संख्यात्मक रूप से दूसरे द्वारा प्राप्त ऊष्मा की मात्रा के बराबर होती है।
दी गई ऊष्मा की मात्रा को ऋणात्मक माना जाता है, प्राप्त ऊष्मा की मात्रा को धनात्मक माना जाता है। अत: ऊष्मा की कुल मात्रा Q1 + Q2 = 0।
यदि एक पृथक प्रणाली में कई निकायों के बीच गर्मी का आदान-प्रदान होता है, तो
क्यू 1 + क्यू 2 + क्यू 3 + ... = 0. (13.10)
समीकरण (13.10) कहलाता है गर्मी संतुलन समीकरण.
यहाँ Q 1 Q 2, Q 3 - पिंडों द्वारा प्राप्त या दी गई ऊष्मा की मात्रा। ऊष्मा की इन मात्राओं को सूत्र (13.5) या सूत्रों (13.6) - (13.9) द्वारा व्यक्त किया जाता है, यदि पदार्थ के विभिन्न चरण परिवर्तन गर्मी हस्तांतरण (पिघलने, क्रिस्टलीकरण, वाष्पीकरण, संघनन) की प्रक्रिया में होते हैं।
आप न केवल काम करके, बल्कि गैस को गर्म करके भी सिलेंडर में गैस की आंतरिक ऊर्जा को बदल सकते हैं (चित्र 43)। यदि पिस्टन स्थिर हो जाता है, तो गैस का आयतन नहीं बदलेगा, लेकिन तापमान और इसलिए आंतरिक ऊर्जा में वृद्धि होगी।
बिना कार्य किए ऊर्जा को एक पिंड से दूसरे पिंड में स्थानांतरित करने की प्रक्रिया को ऊष्मा अंतरण या ऊष्मा अंतरण कहा जाता है।
गर्मी हस्तांतरण के परिणामस्वरूप शरीर में स्थानांतरित होने वाली ऊर्जा को गर्मी की मात्रा कहा जाता है। गर्मी की मात्रा को वह ऊर्जा भी कहा जाता है जो शरीर गर्मी हस्तांतरण की प्रक्रिया में देता है।
गर्मी हस्तांतरण की आणविक तस्वीर।पिंडों के बीच की सीमा पर गर्मी के आदान-प्रदान के दौरान, ठंडे शरीर के धीरे-धीरे चलने वाले अणु गर्म शरीर के तेज गति वाले अणुओं के साथ बातचीत करते हैं। नतीजतन, गतिज ऊर्जा
अणु संरेखित होते हैं और ठंडे शरीर के अणुओं की गति बढ़ जाती है, और गर्म की घट जाती है।
ऊष्मा विनिमय के दौरान, ऊर्जा का एक रूप से दूसरे रूप में रूपांतरण नहीं होता है: एक गर्म शरीर की आंतरिक ऊर्जा का कुछ हिस्सा ठंडे शरीर में स्थानांतरित हो जाता है।
गर्मी और गर्मी क्षमता की मात्रा।कक्षा VII के भौतिकी पाठ्यक्रम से यह ज्ञात होता है कि तापमान से तापमान तक किसी पिंड को द्रव्यमान के साथ गर्म करने के लिए, उसे ऊष्मा की मात्रा के बारे में सूचित करना आवश्यक है।
![]()
जब शरीर ठंडा होता है, तो उसका अंतिम तापमान प्रारंभिक तापमान से कम होता है और शरीर द्वारा छोड़ी गई गर्मी की मात्रा नकारात्मक होती है।
सूत्र (4.5) में गुणांक c को विशिष्ट ऊष्मा धारिता कहा जाता है। विशिष्ट ऊष्मा धारिता ऊष्मा की वह मात्रा है जो किसी पदार्थ के 1 किलो के तापमान में परिवर्तन होने पर 1 किलो पदार्थ प्राप्त करता है या देता है -
विशिष्ट ऊष्मा क्षमता जूल प्रति किलोग्राम केल्विन गुणा में व्यक्त की जाती है। विभिन्न निकायों को I K द्वारा तापमान बढ़ाने के लिए असमान मात्रा में ऊर्जा की आवश्यकता होती है। इस प्रकार, पानी और तांबे की विशिष्ट ऊष्मा क्षमता
विशिष्ट ताप क्षमता न केवल पदार्थ के गुणों पर निर्भर करती है, बल्कि उस प्रक्रिया पर भी निर्भर करती है जिसके द्वारा गर्मी हस्तांतरण होता है। यदि आप निरंतर दबाव में गैस को गर्म करते हैं, तो यह फैल जाएगी और काम करेगी। स्थिर दाब पर किसी गैस को 1°C तक गर्म करने के लिए, उसे स्थिर आयतन पर गर्म करने की अपेक्षा अधिक ऊष्मा स्थानांतरित करने की आवश्यकता होगी।
तरल पदार्थ और ठोस गर्म होने पर थोड़ा फैलते हैं, और स्थिर आयतन और स्थिर दबाव पर उनकी विशिष्ट ऊष्मा क्षमताएँ बहुत कम होती हैं।
वाष्पीकरण की विशिष्ट ऊष्मा। किसी द्रव को वाष्प में बदलने के लिए उसमें एक निश्चित मात्रा में ऊष्मा का स्थानान्तरण होना चाहिए। इस परिवर्तन के दौरान तरल का तापमान नहीं बदलता है। एक स्थिर तापमान पर एक तरल के वाष्प में परिवर्तन से अणुओं की गतिज ऊर्जा में वृद्धि नहीं होती है, बल्कि उनकी संभावित ऊर्जा में वृद्धि होती है। आखिरकार, गैस के अणुओं के बीच की औसत दूरी तरल अणुओं की तुलना में कई गुना अधिक होती है। इसके अलावा, तरल से गैसीय अवस्था में किसी पदार्थ के संक्रमण के दौरान मात्रा में वृद्धि के लिए बाहरी दबाव की ताकतों के खिलाफ काम करने की आवश्यकता होती है।
स्थिर ताप पर 1 किग्रा द्रव को वाष्प में बदलने के लिए आवश्यक ऊष्मा की मात्रा कहलाती है
वाष्पीकरण की विशिष्ट ऊष्मा। यह मान एक अक्षर द्वारा निरूपित किया जाता है और जूल प्रति किलोग्राम में व्यक्त किया जाता है।
पानी के वाष्पीकरण की विशिष्ट ऊष्मा बहुत अधिक होती है: 100°C के तापमान पर। अन्य तरल पदार्थों (शराब, ईथर, पारा, मिट्टी के तेल, आदि) के लिए, वाष्पीकरण की विशिष्ट गर्मी 3-10 गुना कम होती है।
एक तरल द्रव्यमान को वाष्प में बदलने के लिए बराबर ऊष्मा की आवश्यकता होती है:
जब भाप संघनित होती है, तो उतनी ही मात्रा में ऊष्मा निकलती है:
संलयन की विशिष्ट ऊष्मा।जब कोई क्रिस्टलीय पिंड पिघलता है, तो उसे दी गई सारी ऊष्मा अणुओं की स्थितिज ऊर्जा को बढ़ाने में चली जाती है। अणुओं की गतिज ऊर्जा में परिवर्तन नहीं होता है, क्योंकि गलनांक स्थिर तापमान पर होता है।
गलनांक पर 1 किलोग्राम क्रिस्टलीय पदार्थ को उसी तापमान के तरल में बदलने के लिए आवश्यक ऊष्मा A की मात्रा को संलयन की विशिष्ट ऊष्मा कहा जाता है।
किसी पदार्थ के 1 किग्रा के क्रिस्टलीकरण के दौरान ठीक उतनी ही मात्रा में ऊष्मा निकलती है। बर्फ के पिघलने की विशिष्ट ऊष्मा काफी अधिक होती है:
एक द्रव्यमान के साथ एक क्रिस्टलीय शरीर को पिघलाने के लिए, ऊष्मा की मात्रा की आवश्यकता होती है:
शरीर के क्रिस्टलीकरण के दौरान निकलने वाली ऊष्मा की मात्रा बराबर होती है:
1. ऊष्मा की मात्रा को क्या कहते हैं? 2. पदार्थों की विशिष्ट ऊष्मा क्षमता क्या निर्धारित करती है? 3. वाष्पीकरण की विशिष्ट ऊष्मा को क्या कहते हैं? 4. संलयन की विशिष्ट ऊष्मा को क्या कहते हैं? 5. किन मामलों में स्थानांतरित ऊष्मा की मात्रा ऋणात्मक होती है?
